α-环糊精葡萄糖基转移酶催化合成α-熊果苷
2015-10-25赵如奎吴剑荣詹晓北
赵如奎,吴剑荣,詹晓北,朱 莉
(1.江南大学 生物工程学院糖 化学与生物技术教育部重点实验室,江苏 无锡 214122;2.无锡格莱克斯生物科技有限公司,江苏 无锡 214125)
熊果苷(arbutin)属氢醌苷化合物,化学名为4-羟基苯基-D-吡喃葡萄糖苷,存在于熊果、越橘等植物中,是一种新兴的无刺激、无过敏、配伍性强的天然美白活性物质[1-2]。熊果苷具有显著的抑制酪氨酸酶活性,可减少酪氨酸酶在皮肤中的沉积,对皮肤有美白、防色变和祛斑的功效[3]。另外,熊果苷具有两种同分异构体,分别是 α-熊果苷和 β-熊果苷。相关应用研究表明,α-熊果苷的美白效果是β-熊果苷的10 倍以上[4-7]。α-熊果苷的美白机制是直接抑制酪氨酸酶活性,从而减少黑色素的生成,而不是通过抑制细胞生长或酪氨酸酶基因表达的方式来达到减少黑色素生成的目的。由于α-熊果苷是一种更高效、更安全的美白活性物质,国内外许多家化妆品公司已采用α-熊果苷代替β-熊果苷作为美白添加剂[8-9]。
与β-熊果苷可通过植物提取、植物细胞培养和化学合成等方法来获得的方式不同,α-熊果苷一般只能通过微生物细胞或者酶进行催化葡萄糖基糖转移到氢醌上形成单一的α-熊果苷[10-12]。已报道用于合成α-熊果苷的酶包括从酿酒酵母中分离的α-葡萄糖苷酶[13],从肠膜明串珠菌分离的葡聚糖蔗糖酶[14]以及淀粉蔗糖酶等[15];葡萄糖基供体包括蔗糖、麦芽糖、滤纸粉、葡萄糖和对硝基葡萄糖苷等,α-熊果苷最高产量仅为 2.3 g/L[16-19]。另外,野油菜黄单胞菌由于含有转葡萄糖苷酶,其冻干细胞或者细胞破碎悬液也可以用于催化α-熊果苷合成,产量分别为0.42 g/L和6.58 g/L,但是细胞质量浓度达到80 g/L,底物糖浓度比较高,糖转化率低,给后续提取造成困难[4,20]。为了提高转葡萄糖苷酶作用效率,Wu等[21]将野油菜黄单胞菌的转葡萄糖苷酶基因表达并锚定在大肠杆菌表面,全细胞催化后,α-熊果苷产量可达21 g/L,氢醌转化率为76%。另外,刘春巧课题组以嗜麦芽黄单胞菌为催化剂,尝试采用发酵法和游离细胞进行催化反应,α-熊果苷可达12~16 g/L;进一步采用固定氢醌在树脂方后进行全细胞催化,最终产量可达到65.9 g/L,氢醌转化率为95.2%[22-25]。虽然发酵法或全细胞催化能够得到较高浓度产物,但是发酵液复杂的成分给后续提取造成困难,且培养细胞和催化反应都需要较长时间。
环糊精葡萄糖基转移酶(cyclodextrin glycosyltransfer,CGT酶,EC2.4.1.19)是一种胞外酶,可以分成 α-、β-和 γ-3 种类型,多用于制备α-、β-和 γ-环糊精[26]。CGT酶是一种多功能型酶,它能催化4种不同的反应:3种转糖基反应(歧化反应、环化反应和偶合反应)和水解反应[27]。研究发现α-CGT酶还可以通过转糖基反应催化转苷,生成如维生素C葡萄糖苷、α-熊果苷等产物[28-31]。相比其他用于催化合成α-熊果苷的酶,α-CGT酶底物专一性较广,转葡萄糖基过程不需要耗能。
本文中,笔者尝试利用国产安琪酵母公司的α-CGT酶为催化剂,以廉价麦芽糊精为葡萄糖基供体进行合成,再通过淀粉葡萄糖苷酶水解获得α-熊果苷,为以商品化α-CGT酶生产制备α-熊果苷提供理论基础。
1 材料与方法
1.1 主要材料
α-CGT酶,安琪酵母公司;淀粉葡萄糖苷酶,无锡杰能科生物工程公司;对苯二酚(HQ)、麦芽糖、CaCl2、Na2HPO4·12H2O、柠檬酸,国药集团化学试剂有限公司;麦芽糊精为市售产品(dextrose equivalent值(DE)分别4% ~6%、8% ~10%、10% ~15%);α-熊果苷标准品,Sigma-Aldrich公司。
1.2 α-熊果苷的合成
转葡萄糖糖基反应:在20 mmol/L pH 6.0的柠檬酸-磷酸盐缓冲液体系中加入CaCl2(5 mmol/L),对苯二酚(150 mmol/L),麦芽糊精60 g/L和0.025 mg/mL α-环糊精葡萄糖基转移酶,于40℃、100 r/min水浴摇床中反应24 h,样品沸水浴5 min灭活。
水解反应:高温灭活后的样品中加入淀粉葡萄糖苷酶,于40℃、100 r/min水浴摇床中反应4 h后,再次沸水浴5 min灭活,离心后经高效液相色谱(HPLC)分析。
1.3 α-熊果苷的分析
取0.8 mL样品,加入0.2 mL甲醇,在8000 r/min条件下离心10 min,上清液用LC-2010A型高效液相色谱检测(日本岛津)。色谱条件:色谱柱为岛津 C18柱(4.6 mm ×25 cm,5 μm);柱温为 30 ℃;流动相为H2O-CH3OH溶液,其体积比为80∶20;流速为0.6 mL/min;检测器为紫外检测器;检测波长为 280 nm;进样量为 10 μL。
1.4 对苯二酚转化率计算
对苯二酚的转化率计算见式(1)。
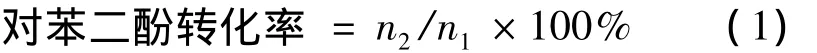
式中:n1为加入到发酵液中对苯二酚物质的量,n2为反应后发酵液中转化为α-熊果苷的对苯二酚物质的量。
1.5 α-熊果苷的纯化
样品经8000 r/min离心10 min,取上清液加入2倍体积乙酸乙酯,收集水相,再加入2倍体积正丁醇,收集水相,分别萃取3次,通过旋转蒸发仪蒸干后收集样品,即得初步纯化的α-熊果苷。
1.6 α-熊果苷的结构测定
通过高效液相色谱-电喷雾串联质谱技术(LCESI-MS/MS,TSQ Quantum Ultra EMR,Thermo Fisher Scientific)对产物进行鉴定。
色谱条件:色谱柱为Hypersil Gold C18(100 mm×2.1 mm,1.9 μm),柱温为 30 ℃;流动相为水(A)-甲醇(B)溶液。梯度洗脱(0~2 min 10%B、2~10 min 20%B、10 ~13 min 80%B、13 ~15 min 10%B);流速为 0.2 mL/min,进样量为 1 μL。质谱条件:ESI离子源,正离子监测模式检测;喷雾电压为3.2 kV;雾化器压力为0.208 MPa;辅助气压力为0.208 MPa;离子传输毛细管温度为350℃;数据采集扫描时间为0.50 s;分辨率Q1和Q3均为0.7 amu(FWHM);碰撞能量为15 eV。
2 结果与讨论
2.1 对苯二酚的转糖基反应
考察安琪酵母的α-CGT酶催化对苯二酚与麦芽糊精的转糖基反应,结果如图1所示。由图1可知:α-CGT酶能够使对苯二酚糖基化,形成具有不同葡萄糖基的糖苷混合物(HQGn),其葡萄糖基的数量不等,保留时间均小于对苯二酚。首先,麦芽糊精作为供体与α-CGT酶的活性位点结合形成中间酶,通过水解不同的糖苷键,释放出单糖、双糖或低聚糖。然后,中间酶又与对苯二酚结合,对苯二酚的羟基与单糖、双糖或低聚糖结合生成HQGn。同样,HQGn也可以作为供体底物。当HQGn作为供体底物,对苯二酚(HQ)作为受体底物时,α-CGT酶切断不同的糖苷键,从而也可生成HQG1~HQG4[31]。

图1 α-CGT酶催化对苯二酚转糖基反应的产物液相色谱Fig.1 Transglycosylation of hydroquinone with α-CGT by HPLC
2.2 糖苷的水解反应
淀粉葡萄糖苷酶(糖化酶)可以切断α-糖苷键,将该酶加入上述转糖基反应混合液中,可以将长链的葡萄糖切除,使得HQGn生成HQG1(α-熊果苷)。液相色谱分析结果如图2所示。由图2可知,图中的峰分别为HQG1和未反应的对苯二酚HQ。因此,通过α-CGT酶和淀粉葡萄糖苷酶的两步酶法反应体系,可以用于合成α-熊果苷。
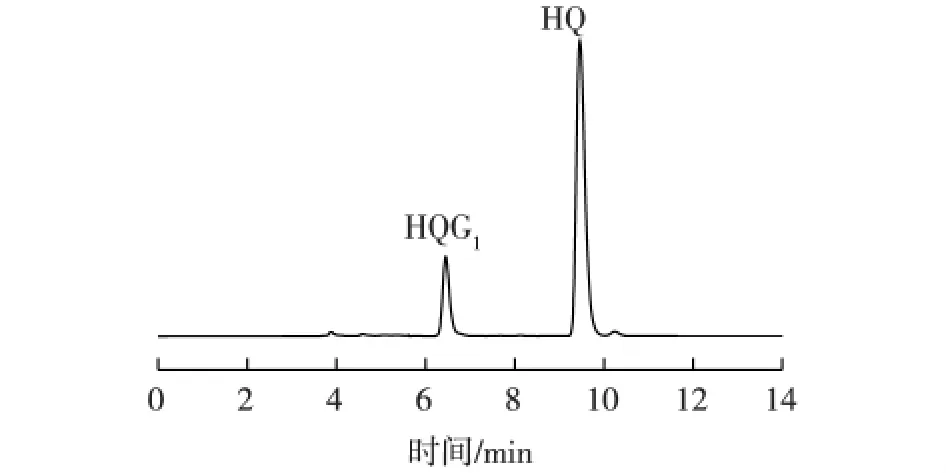
图2 糖化酶催化糖苷水解反应的产物液相色谱Fig.2 Hydrolysis of glycoside with glucoamylase by HPLC
2.3 催化反应条件的优化
2.3.1 不同供体底物对反应的影响
分别考察葡萄糖、麦芽糖、麦芽糊精(DE值4% ~6%、8% ~10%、10% ~15%)作为 α-熊果苷的供体底物对反应的影响,结果见表1。由表1可知:所选底物中除葡萄糖外,麦芽糖、麦芽糊精均可作为供体底物生成α-熊果苷,其中采用DE值8% ~10%麦芽糊精的α-熊果苷产量最高,达到2.61 g/L。DE值4% ~6%麦芽糊精水溶性较差,水溶液黏度高,溶于水易形成凝胶。采用DE值10% ~15%麦芽糊精时,低分子葡萄糖较多,高分子葡萄糖较少,α-熊果苷产量要低于DE值8% ~10%麦芽糊精;麦芽糖仅由2个葡萄糖基组成,α-CGT也能催化糖基转移反应形成少量α-熊果苷,表明该α-CGT的底物专一性不强,底物选择范围较大。作为参照,葡萄糖做为单糖无法被α-CGT识别[4],未能检测到α-熊果苷。相比多数研究以蔗糖、麦芽糖为葡萄糖基供体的酶催化反应[16-19],本研究使用的麦芽糊精价格更低廉,并且α-熊果苷产量较高,但对苯二酚的转化率要低很多。
2.3.2 麦芽糊精浓度对反应的影响
考察不同质量浓度的DE值为8%~10%麦芽糊精为底物对催化反应的影响,结果如图3所示。由图3可知:在一定麦芽糊精浓度范围内,α-熊果苷的产量随着麦芽糊精浓度的升高而增加,当麦芽糊精达到60 g/L时,α-熊果苷的产量达到最大值2.58 g/L,对苯二酚转化率为6.34%,生产速率为0.11 g/(L·h),继续增加麦芽糊精用量,由于底物抑制作用,α-熊果苷产量基本不变,所以较适的麦芽糊精为60 g/L。该底物浓度与Shimoda等[30]所用的5%的滤纸粉用量相差不大。
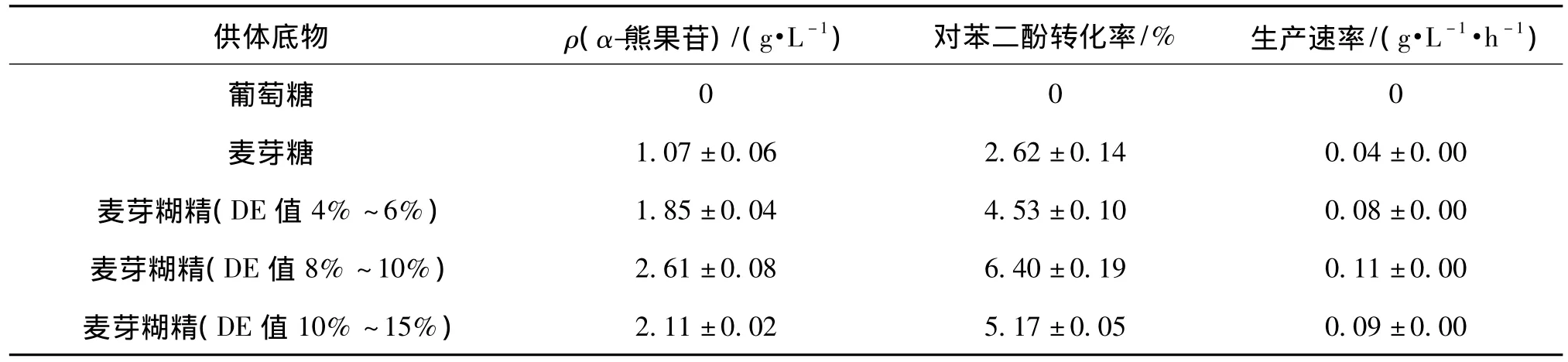
表1 不同供体底物对α-CGT酶催化反应的影响Table 1 Effects of different substrates on the reaction catalyzed by α-CGT
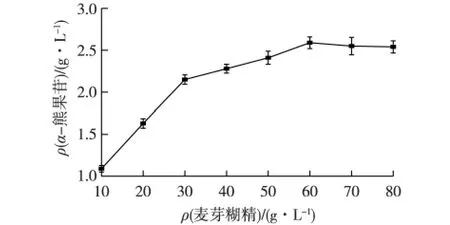
图3 麦芽糊精浓度对催化合成α-熊果苷的影响Fig.3 Effect of maltodextrin concentration on the synthesis of α-arbutin
2.3.3 对苯二酚浓度对反应的影响
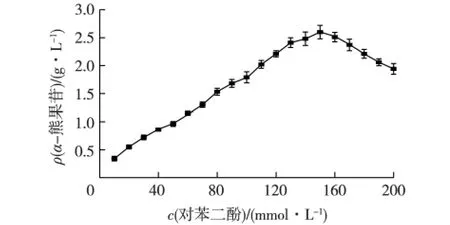
图4 对苯二酚浓度对催化合成α-熊果苷的影响Fig.4 Effect of hydroquinone concentration on the synthesis of α-arbutin
由于对苯二酚对酶具有抑制作用,当缓冲液中对苯二酚浓度超过一定量时,酶活性会下降。图4为对苯二酚浓度对催化合成α-熊果苷的影响结果。由图4可知:在一定对苯二酚浓度范围内,α-熊果苷的产量随着对苯二酚浓度的增加而增加,最高产量为2.67 g/L,此时对苯二酚转化率为6.54%,生产速率为0.11 g/(L·h)。但当对苯二酚浓度超过150 mmol/L时,α-熊果苷的产量开始下降。这可能是由于对苯二酚的羟基比较活泼,对酶的活性中心和结构会产生影响,浓度过高会导致部分α-CGT酶活性下降甚至失活,最终导致α-熊果苷产量下降。与全细胞催化、细胞破碎悬液和发酵法制备α-熊果苷相比而言,商品化的α-CGT酶对对苯二酚的耐受性大大提高[19-20,22-23]。
2.3.4 温度对反应的影响
考察反应温度对催化反应的影响,结果如图5所示。由图5可知:α-熊果苷的最适反应温度为40℃,此时产量达 2.59 g/L,对苯二酚转化率为6.35%,生产速率为0.11 g/(L·h)。在一定温度范围内,提高温度有利于提高酶的活性,当反应温度过高时,会导致酶的催化能力下降。同时,随着温度的升高,对苯二酚氧化速度加快,反应体系中对苯二酚浓度下降,最终导致α-熊果苷产量下降。
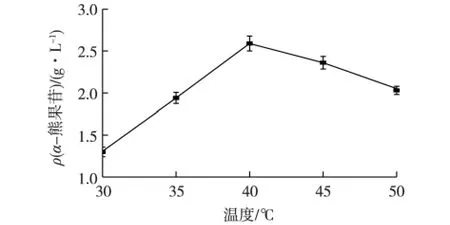
图5 温度对催化合成α-熊果苷的影响Fig.5 Effect of temperature on the synthesis of α-arbutin
2.3.5 缓冲溶液pH对反应的影响
其他条件不变,考察不同pH的柠檬酸-磷酸盐缓冲溶液反应体系对酶催化反应的影响,结果如图6所示。由图6可知:当柠檬酸-磷酸盐缓冲溶液的pH在6.0时,α-熊果苷的产量最高为2.62 g/L,对苯二酚转化率为6.42%,生产速率为0.11 g/(L·h),这说明α-CGT酶在pH为6.0的缓冲溶液体系中活性达到最大。

图6 缓冲液pH对催化合成α-熊果苷的影响Fig.6 Effect of buffer solution pH value on the synthesis of α-arbutin
2.3.6 反应时间对反应的影响
图7为反应时间对催化反应的影响结果。由图7可知:α-熊果苷产量随着反应时间的延长先升高后降低,当反应时间为24 h时,α-熊果苷产量达到最高2.65 g/L,对苯二酚转化率6.50%,生产速率为0.11 g/(L·h)。随着反应时间的延长,α-熊果苷产量有所下降,这是因为α-熊果苷存在一个缓慢的水解过程。所以最佳反应时间为24 h。相比以往酶催化反应所需时间(48~96 h)和生产速率(8.33×10-4~1.53 ×10-2g/(L·h)),本研究的反应时间大大缩短,而生产速率提高一个数量级[22-25]。
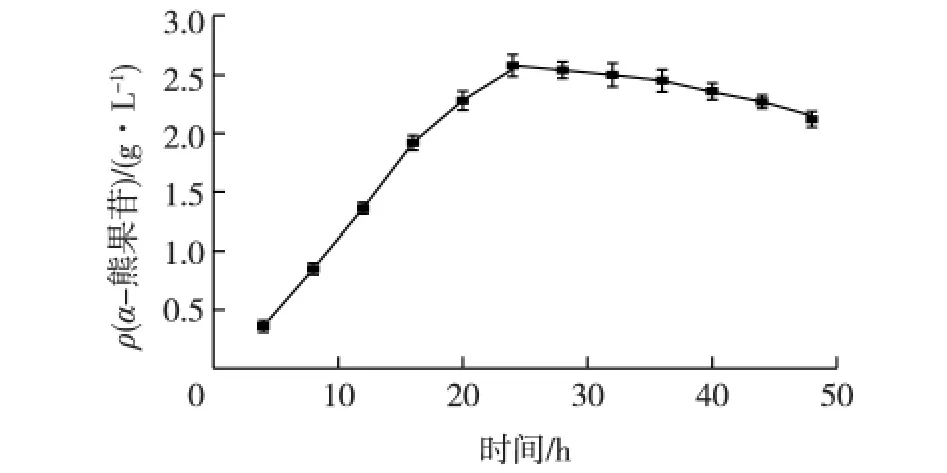
图7 反应时间对催化合成α-熊果苷的影响Fig.7 Effect of reaction time on the synthesis of α-arbutin
2.4 α-熊果苷的纯化与鉴定
把反应所得到的样品首先经乙酸乙酯萃取,再经正丁醇萃取,通过旋转蒸发仪蒸干收集,得到的样品再经过离心,上清液用HPLC进行分析,并与α-熊果苷标准品的HPLC色谱图进行比较,发现样品与α-熊果苷有相同的保留时间,所以初步推断样品中含有α-熊果苷。再把萃取纯化后的产物通过LC-ESI-MS/MS的正离子模式进行鉴定,结果如图8所示。由图8可知:α-熊果苷实际相对分子质量为272,产物相对分子质量与α-熊果苷标准品相对分子质量均为295,这是由于形成阳离子加合物[M+Na]+的结果。所以,可以确定产物为 α-熊果苷。
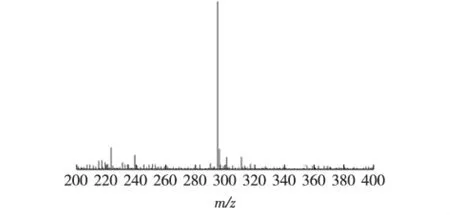
图8 α-熊果苷的LC-ESI-MS谱图Fig.8 Spectra of α-arbutin by LC-ESI-MS
3 结论
1)通过实验证明了α-CGT酶能催化将麦芽糊精上葡萄糖转糖基到对苯二酚上,合成α-熊果苷。较优反应条件:DE 8%~10%的麦芽糊精作为供体底物,对苯二酚150 mmol/L,麦芽糊精60 g/L,pH 6.0,在40℃下反应24 h。通过对产物的分离提取、结构鉴定,确定该产物为α-熊果苷。
2)单纯利用α-CGT酶也可催化合成α-熊果苷,但产量相对较低,并且副产物较多,给分离纯化带来困难。α-CGT酶和淀粉葡萄糖苷酶的双酶催化法,不仅提高了α-熊果苷的产量,减少了副产物的生成,并且降低了分离纯化难度,独具优势。
3)酶法催化原料简单,生产周期短,提取纯化方便,但酶无法重复利用。下一步可考虑采用固定化酶催化合成α-熊果苷,固定化酶可重复利用,节约生产成本。
[1]周桦,吴晓势,张晓炜,等.毛细管气相色谱法测定化妆品中熊果苷[J].中国公共卫生,2002,18(5):584.
[2]郑晓珂,毕跃峰,冯卫生,等.卷柏化学成分研究[J].药学学报,2004,39(4):266-268.
[3]李安良,杨淑琴,郭秀茹,等.熊果苷的进展[J].日用化学工业,2000,30(2):62-65.
[4]Kurosu J,Sato T,Keishiro Y,et al.Enzymatic synthesis of αarbutin by α-anomer-selective glucosylation of hydroquinone using lyophilized cells of Xanthomonas campestris WU-9701[J].J Biosci Bioeng,2002,93(3):328-330.
[5]Sugimoto K,Nishimura T,Nomura K,et al.Syntheses of arbutinα-glycosides and a comparison of their inhibitory effects with those of α-arbutin and β-arbutin on human tyrosinase[J].Chem Pharm Bull,2003,5l(7):798-801.
[6]Sugimoto K,Nishimura T,Nomura K,et al.Inhibitory effects of αarbutin on melanin synthesis in cultured human melanoma cells and a three-dimensional human skin model[J].Biol Pharm Bull,2004,27(4):510-514.
[7]姚斌,沈晓兰,潘亚菊.α-熊果苷的研究进展[J].中国现代应用药学杂志,2005,22(1):32-33.
[8]Funayama M,Arakawa H,Yamamoto R,et al.Effects of alpha and beta arbutin on activity of tyrosinases from mushroom and mouse melanoma[J].Biosci Biotechnol Biochem,1995,59(1):143-144.
[9]Nishimura T,KometaniT,OkadsS.Inhibitory effectsof hydroquinone-o-glueoside on melanin synthesis[J].Yakugaku Zasshi,1995,115(8):626.
[10]梦原.研发动态[J].中国化妆品,2002(24):94.
[11]刘锋,江涛,任素梅.熊果苷合成研究进展[J].日用化学工业,2004,34(4):242-244.
[12]王亚芳,周宁娜,张建军.熊果苷镇咳、祛痰及平喘的药效学研究[J].中草药,2003,34(8):739-741.
[14]Seo E S,Jin K,Lee J H,et al.Synthesis and characterization of hydroquinone glucoside using Leuconostoc mesenteroides dextransucrase[J].Enzyme Microb Technol,2009,45(5):355-360.
[15]Seo D H,Jung J H,Ha S J,et al.High-yield enzymatic bioconversion of hydroquinone to α-arbutin,a powerful skin lightening agent,by amylosucrase[J].Appl Microbiol Biotechnol,2012,94(5):1189-1197.
[16]Kitao S,Shimaoka Y,Sekine H.Production of phenol glycoside:JP,06153976[P].1994-06-03.
[17]Wang P,Brett D,Hamitrarida S,et al.Multienzymic synthesis ploy(hydroquinone)for use as a redox polymer[J].J Am Chem Soc,1995,117(51):12885-12886.
[18]Gill I,Valivety R.Enzymatic glycosylation in plasticized glass phases:a novel and efficient route to synthesize o-glyciside[J].Angew Chem Int Ed,2000,39(21):3804-3808.
[19]李群良,张欣英,杨克迪,等.巨大芽孢杆菌 Bacillus megaterium NCIB 8508蔗糖磷酸化酶生物催化合成α-熊果苷的研究[J].化学与生物工程,2011,28(4):46-48.
[20]张欣英,严伟,李群良,等.野油菜黄单胞菌胞内粗酶液催化合成 α-熊果苷[J].化学与生物工程,2012,29(4):64-67.
[21]Wu P H,Nair G R,Chu I M,et al.High cell density cultivation of Escherichia coli with surface anchored transglucosidase for use as whole-cell biocatalyst for α-arbutin synthesis[J].J Ind Microbiol Biotechnol,2008,35:95-101.
[22]刘春巧,张淑荣,张鹏.嗜麦芽黄单胞菌 BT-112催化制备α-熊果苷[J].日用化学工业,2005,35(6):364-367.
[23]王秀捧,张淑荣,刘春巧,等.嗜麦芽黄单胞菌游离细胞催化合成 α-熊果苷[J].微生物学通报,2007,34(3):417-420.
[24]韦祎,张淑荣,刘春巧,等.添加表面活性剂对α-熊果苷发酵的影响[J].化工学报,2007,58(9):2352-2356.
[25]Liu C Q,Li D,Zhang P,et al.Efficient production of α-arbutin by whole-cell biocatalysis using immobilized hydroquinone as a glucosyl acceptor[J].J Mol Catal B:Enzymatic,2013,91∶1-7.
[26]BenderH.Production characterization and application of cyclodextrin[J].Adv Biotechnol Proc,1986(6):31-71.
[27]Vassileva A,Burhan N,Beschkov V,etal.Cyclodextrin glucanotransferase production by free and agar gel immobilized cells of Bacillus circulans ATCC 21783[J].Process Biochem,2003,8(11):1585-1591.
[28]Kometani T,Terada Y,Nishimura T,et al.Transglycosylation to hesperidin by cyclodextrin glucanotransferase from an alkalophilic Bacillus species in alkaline pH and properties of hesperidin glycosides[J].Biosci Biotechnol Biochem,1994,58(11):1990-1994.
[29]Lee Y H,Baek S G,Shin H D,et al.Transglycosylation reaction of cyclodextrin glucanotransferase in the attrition coupled reaction system using raw starch as a donor[J].Appl Microbiol Biotechnol,1993,21(5):461-467.
[30]Shimoda K,Sato D, Hamada H. Synthesis of β-malt oligosaccharides of α-tocopherol derivatives by Xanthomonas campestris and cyclodextrin glucanotransferase and their antiallergic activity[J].Chem Lett,2009,38(3):930-931.
[31]Mathew S,Adlercreutz P.Regioselective glycosylation of hydroquinone to α-arbutin by cyclodextrin glucanotransferase from Thermoanaerobacter sp[J].Biochem Eng J,2013,79:187-193.
