脂肪酶YCJ01拆分对位取代α-苯乙醇
2015-10-25李文豪何冰芳
秦 燕,李文豪,汪 斌,何冰芳
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
光学纯的α-苯乙醇及其衍生物是许多医药、精细化学品及香料等物质的合成中间体[1],其中对位取代的α-苯乙醇作为代表,其R和S两种对映异构体均为重要的医药中间体,(S)-1-(4-甲基苯基)乙醇是合成食品添加剂姜黄酮的中间体[2];(S)-1-(4-甲氧基苯基)乙醇是1-(4-甲基苯基)-1-(4-甲氧基苯基)-乙硫醇的中间体[3];(R)-1-(4-甲基苯基)乙醇则可以用来合成具有防癌功能的硒化合物[4],(R)-1-(4-甲氧基苯基)乙醇可以合成环丙烷甲酸中间体,进而合成用于治疗癌症的溶血磷脂酸受体的异恶唑基拮抗剂[5]等。目前,对位取代α-苯乙醇衍生物的单一对映体可以通过不对称合成、化学拆分和酶法拆分等获得,其中酶法催化的拆分反应具有反应条件温和、手性选择性高等优点,因而越来越受到人们的重视[6]。
脂肪酶是一类广泛应用于类脂化合物水解、合成以及酯交换的高效生物催化剂,多数脂肪酶在催化过程中具有高度的区域选择性、立体选择性,并且在反应中不需要添加辅因子等特点。另外,脂肪酶可以接受众多复杂的非天然化合物作为底物,因此,利用脂肪酶的高度立体选择性,在有机相中通过转酯反应进行对位取代的α-苯乙醇衍生物的手性拆分备受人们的关注。然而现有报道中对1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的酶法拆分的研究比较少,其中Hatzakis等[7]对脂肪酶拆分1-(4-甲氧基苯基)乙醇做过初步研究,但是其在拆分过程中转化率较低且产物e.e.p值仅为88%;王晨等[8]研究了多种脂肪酶对1-(4-甲氧基苯基)乙醇拆分,其中Novozyme 435及PS IM(P.cepacia)脂肪酶显示了很好的拆分效果,然而在整个反应体系中底物浓度低,酶用量大。因而,进一步开发能够高效拆分1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的脂肪酶具有重大意义。
本课题组Yao等[9]筛选获得1株耐有机溶剂脂肪酶产生菌Burholderia ambifaria YCJ01,该菌株所产的脂肪酶YCJ01不仅在60℃下稳定而且用25%(体积分数)有机溶剂(甲醇、二甲基亚砜(DMSO)等)处理60 d后仍有较高的活力,展现出了优异的温度稳定性和有机溶剂耐受性。在有机相催化方面具有广泛的应用前景。
本文中,笔者拟采用脂肪酶YCJ01对1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的选择性酯化拆分,优化反应工艺,以期实现这两种医药中间体的高效手性拆分。
1 材料与方法
1.1 材料
脂肪酶产生菌B.ambifaria YCJ01(CCTCC No:2011058),该脂肪酶核酸序列GenBank登录号为JQ733583[10]。1-(4-甲基苯基)乙醇购于东京化成工业株式会社。1-(4-甲氧基苯基)乙醇购于阿法埃莎(天津)化学有限公司。其他试剂均为市售分析纯。
1.2 培养基
活化培养基(LB培养基,g/L):酵母粉5、蛋白胨10、NaCl 10、琼脂 20。
发酵培养基:糊精8 g/L、酵母粉5.2 g/L、牛肉膏7.8 g/L、MgSO40.5 g/L、K2HPO42 g/L、菜籽油5 mL/L、TritonX-1000.75 mL/L。pH 8.0。
1.3 脂肪酶粗酶粉的制备
从冻存管中接菌株B.ambifaria YCJ01于LB平板上,30℃培养12 h后,接取一环于发酵培养基中,于30℃、180 r/min的摇床上培养72 h。
取脂肪酶发酵上清液,置冰水浴中,收集(NH4)2SO4饱和度为65%时沉淀下来的蛋白,在pH7.0、50 mmol/L的磷酸缓冲液中透析1 d后,冷冻干燥得脂肪酶YCJ01粗酶粉。
1.4 脂肪酶催化拆分对位取代α-苯乙醇
转酯化拆分反应在5 mL具塞反应瓶中进行。初始反应体系为2 mL预脱水的异丙醚,拆分底物(R,S)-α-苯乙醇衍生物 30 mmol/L,酰基供体(乙酸乙烯酯、丁酸乙烯酯)300 mmol/L,添加脂肪酶YCJ01酶粉10 mg。在180 r/min的恒温摇床中反应一定时间,检测底物的转化率和光学纯度。
采用戴安P680型高效液相色谱(HPLC)检测。1-(4-甲基苯基)乙醇的检测条件:色谱柱为Chiral OJ-H柱(4.6 mm×250 mm);流动相为正己烷/异丙醇溶液(体积比为95∶5)。[1-(4-甲氧基苯基)乙醇的检测条件:色谱柱为Chiral AD-H柱(4.6 mm×250 mm);流动相为正己烷/异丙醇溶液(体积比为85∶15)]。其余条件如下:流速1 mL/min;检测波长220 nm;柱温30℃。底物1-(4-甲基苯基)乙醇的R型及S型对映体的保留时间分别为10.9 min和12.6 min,产物酯的R型及S型对映体的保留时间分别为6.7和7.1 min;底物1-(4-甲氧基苯基)乙醇的R型及S型对映体的保留时间分别为6.2和6.4 min,产物酯的R型及S型对映体的保留时间分别为3.9和4.4 min。
底物 转 化 率 (C)=e.e.s/(e.e.s+e.e.p)×100%,底物对映体过量值(e.e.s)=(cS-cR)/(cS+cR)×100%,产物对映体过量值(e.e.p)=(cS1-cR1)/(cS1+cR1)×100%,对映体选择率E=ln[1-C(1+e.e.p)/ln[1 -C(1 -e.e.p)]。式中:cR、cS为反应后残留2个对映体的浓度(mmol/L),cR1、cS1为反应后生成的酯的2个对映体的浓度(mmol/L)。
2 结果与讨论
2.1 酶法催化对位取代α-苯乙醇手性拆分反应中酯化产物构型分析
根据现有文献中关于α-苯乙醇衍生物分析的相关报道,笔者采用Chiral OD-H柱(4.6 mm×250 mm)对反应中底物和产物的构型进行了分析,结合文献[8,11]可知,对于(R,S)-1-(4-甲基苯基)乙醇,脂肪酶YCJ01可以选择性地催化S型的底物生成酯化产物S型的乙酰-对甲基苯乙酯,光学纯的R-1-(4-甲基苯基)乙醇并未发生反应。而对于(R,S)-1-(4-甲氧基苯基)乙醇则结果相反,脂肪酶YCJ01优先选择催化R型底物生成R型的丁酰-对甲氧基苯乙酯,S型的1-(4-甲氧基苯基)乙醇未发生反应,其相关选择性的机制有待于进一步研究。据此可以判断其2种底物的反应式,如图1所示。

图1 脂肪酶YCJ01拆分对位取代α-苯乙醇Fig.1 Lipase YCJ01 catalyzed transesterification resolution of para-(R,S)-α-phenylethanol
2.2 温度对拆分反应的影响
在生物催化反应中,温度既影响酶的活力,也影响酶的立体选择性,因而对反应的影响很大[12]。考察温度对脂肪酶YCJ01拆分1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇反应的影响,反应6 h的结果见图2。由图2可知:随着温度的升高底物1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的转化率和e.e.s值均呈现先升后降的过程,但是e.e.p值在整个升温过程中变化不大,说明脂肪酶YCJ01的选择性并没有发生变化。1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的反应转化率分别在50、30℃下达到最高,分别为49.59%和49.34%。所以,脂肪酶 YCJ01拆分1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的最适反应温度分别为50、30℃。
2.3 酰基供体与底物摩尔比对拆分反应的影响

图2 温度对拆分反应的影响Fig.2 Effects of temperature on chiral resolution of α-phenylethanol
对于拆分反应而言,不同的底物有不同的最佳酰基供体且酰基供体的浓度直接影响酶催化反应的平衡,从而影响反应的速度[13]。因此,考察1-(4-甲基苯基)乙醇与乙酸乙烯酯的摩尔比和1-(4-甲氧基苯基)乙醇与丁酸乙烯酯的摩尔比对脂肪酶YCJ01催化转酯反应的影响,反应6 h的结果见图3。由图3可知,随着酰基供体比例的提高,底物转化率和e.e.s值先升后降。这可能是由于随着酰基供体比例的提高,反应平衡向正方向进行,但过高的比例引起底物抑制且降低了反应速率,导致转化率和e.e.s值下降。E值变化不大,说明脂肪酶YCJ01的选择性并没有发生变化。当1-(4-甲基苯基)乙醇与乙酸乙烯酯和1-(4-甲氧基苯基)乙醇与丁酸乙烯酯的摩尔比分别为1∶6和1∶5时,转化率达到最高,分别为49.64%和49.79%。所以分别选取1-(4-甲基苯基)乙醇与乙酸乙烯酯的摩尔比为1∶6和1-(4-甲氧基苯基)乙醇与丁酸乙烯酯的摩尔比为1∶5时为最适反应摩尔比。
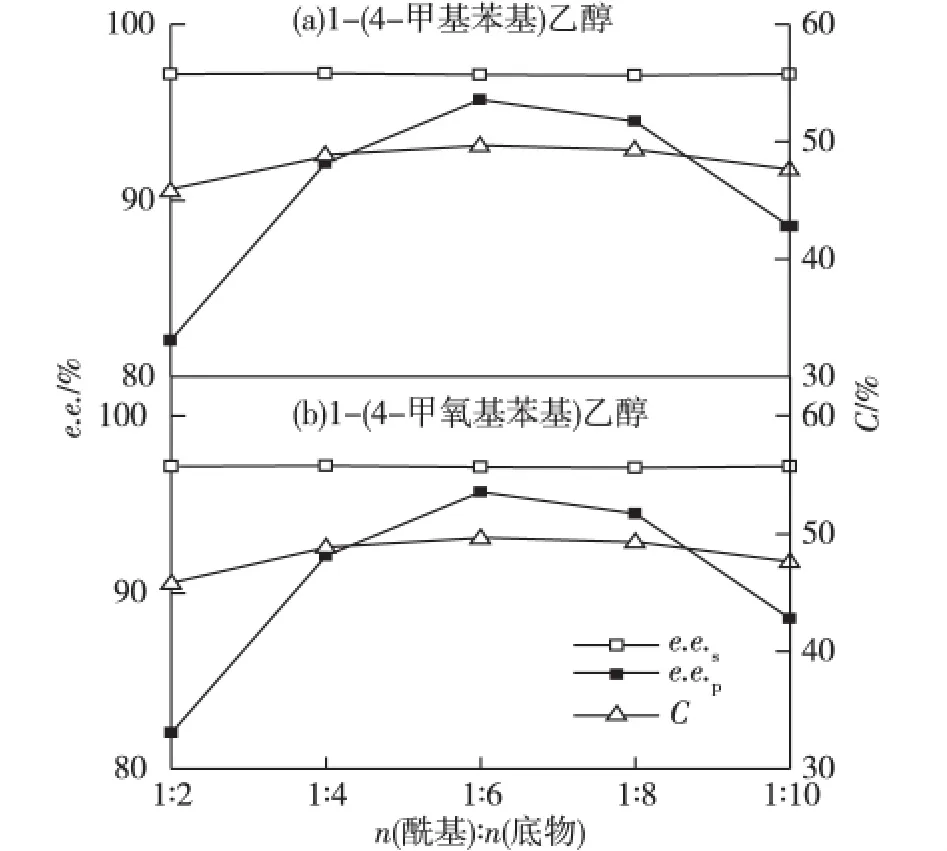
图3 酰基供体与底物的摩尔比对拆分反应的影响Fig.3 Effects of mole ratio of acyl doner to substrate on chiral resolution
2.4 底物浓度对拆分反应的影响
在普通的生物催化体系中,当底物浓度较低时,反应速率与底物浓度成正比,不存在底物抑制现象,当底物浓度达到一定程度或过高时,可能会存在底物抑制和酶活性中心的使用效率受限[14]。本研究分别在上述优化反应条件下,考察了1-(4-甲基苯基)乙醇的浓度和1-(4-甲氧基苯基)乙醇的浓度对反应的影响,反应6 h的结果见图4。由图4可知:当1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇处于低浓度时,反应速率随着底物浓度的提高而加快,当底物浓度分别增加到180和150 mmol/L时,反应速率达到最大值,继续提高时,反应速率下降。e.e.p值变化不大,说明脂肪酶YCJ01的选择性并没有发生变化。所以1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的浓度分别为180 mmol/L(24.5 g/L)和150 mmol/L(22.8 g/L)时为反应的最适底物浓度。

图4 底物浓度对拆分反应的影响Fig.4 Effects of substrate concentration on chiral resolution
2.5 脂肪酶YCJ01拆分对位取代α-苯乙醇的进程曲线
在上述优化条件下分别研究了1-(4-甲基苯基)乙醇和1-(4-甲氧基苯基)乙醇的拆分反应进程曲线,结果见图5。由图5可知:1-(4-甲基苯基)乙醇的拆分体系反应21 h后,底物转化率达到49.96% ,e.e.s值为 97.1% 、e.e.p值为 97.2% ,对映体的选择性(E)>200;1-(4-甲氧基苯基)乙醇的拆分体系反应12 h后,底物转化率达到49.82%,e.e.s值为 97.7%、e.e.p值为98.4%,对映体的选择性(E)>200。Hatzakis等[7]利用脂肪酶拆分 1-(4-甲氧基苯基)乙醇,其转化率及产物e.e.p均较低;王晨等[8]筛选了对1-(4-甲氧苯基)乙醇选择性较高的脂肪酶,而底物浓度仅为1 mmol/L,脂肪酶用量为50 U/mL,时空产率低;本研究利用自主研发的脂肪酶粗酶粉手性拆分对位取代α-苯乙醇,底物浓度分别达到了180和150 mmol/L,表明脂肪酶YCJ01对对位取代α-苯乙醇具有很高的催化效率。

图5 反应时间对拆分反应的影响Fig.5 Effects of feaction time on chiral resolution
3 结论
采用脂肪酶YCJ01在非水相体系中拆分对位取代α-苯乙醇,在异丙醚体系中,1-(4-甲基苯基)乙醇和乙酸乙烯酯的浓度分别为180 mmol/L和1080 mmol/L,反应21 h后,产物为S型的乙酰-对甲基苯乙酯和 R型的对甲基苯乙醇,底物转化率达到49.96% ,e.e.s为 97.1% 、e.e.p为 97.2% ,对映体的选择性E>200;1-(4-甲氧基苯基)乙醇和丁酸乙烯酯的浓度分别为150 mmol/L和750 mmol/L,反应12 h后,产物为R型的丁酰-对甲氧基苯乙酯和S型的对甲氧基苯乙醇,底物转化率达到49.82%,e.e.s为97.7%,e.e.p为98.4%,对映体的选择性(E)>200。本实验中一直采用游离游离脂肪酶YCJ01做研究,不可重复利用,在后续的工作中,将对脂肪酶YCJ01进行固定化研究,以期提高其在催化过程中的重复利用率。
[1]秦丽娜,喻晓蔚,徐岩.非水相中微生物脂肪酶催化转酯化拆分(R,S)-α-苯乙醇[J].催化学报,2011,32(10):1639-1644.
[2]Nave S,Sonawane R P,Elford T G,et al.Protodeboronation of tertiary boronic esters:asymmetric synthesis of tertiary alkyl stereogenic centers[J].J Am Chem Soc,2010,132(48):17096-17098.
[3]MacLellan P,Clayden J.Enantioselective synthesis of tertiary thiols by intramolecular arylation of lithiated thiocarbamates[J].Chem Commun,2011,47(12):3395-3397.
[4]Brondani P B,Guilmoto N M A F,Dudek H M,et al.Chemoenzymatic approaches to obtain chiral-centered selenium compounds[J].Tetrahedron,2012,68(51):10431-10436.
[5]Hutchinson J H,Seiders T J,Wang Bowei,et al.Isoxazolyl antagonists of lysophosphatidic acid receptors:UK,2470833[P].2010-11-08.
[6]Heinsman N,Franssen M C R,Van Der Padt A,et al.Lipasemediated resolution of branched chain fatty acids[J].Biocatal Biotransform,2002,20(5):297-309.
[7]HatzakisN S,Smonou I.Asymmetrictransesterification of secondary alcohols catalyzed by feruloyl esterase from Humicola insolens[J].Bioorg Chem,2005,33(4):325-337.
[8]王晨,王文凯,陈华勇,等.脂肪酶催化拆分1-(4-甲氧基苯基)乙醇的研究[J].现代食品科技,2009,25(4):379-381.
[9]Yao C J,Cao Y,Wu S,et al.An organic solvent and thermally stable lipase from Burkholderia ambifaria YCJ01:purification,characteristics and application for chiral resolution of mandelic acid[J].J Mol Catal B:Enzymatic,2013,85:105-110.
[10]何冰芳,姚长进,曹艳,等.高稳定性耐有机溶剂脂肪酶产生菌及脂肪酶和其基因与应用:中国,102329745A[P].2012-01-25.
[11]TurgutY,AzizogluM,ErdoganA,etal.β-Hydroxyamide derivatives of salicylic acid as organocatalysts for enantioselective reductions of prochiral ketones[J].Tetrahedron:Asymmetry,2013,24(13):853-859.
[12]MatteisV D.Temperatureand solventeffectson enzyme stereoselectivity:inversion temperature in kinetic resolutions with lipases[J].Chem Commun,2000,23:2351-2352.
[13]Yu D,Wang Z,Zhao L,et al.Resolution of 2-octanol by SBA-15 immobilized Pseudomonas sp.lipase[J].J Mol Catal B:Enzymatic,2007,48(3):64-69.
[14]Wang Z,Wang R,Tian J,et al.The effect of ultrasound on lipasecatalyzed regioselective acylation of mangiferin in non-aqueous solvents[J].J Asian Nat Prod Res,2011,12(1):56-63.
