超声辅助酶促合成丙二酸单对硝基苄酯
2015-10-25赵四方韩萍芳
李 亚,赵四方,韩萍芳
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南通科技职业学院 环境与资源系,江苏 南通 226007)
丙二酸单对硝基苄酯是一种重要的生物医药中间体,目前该物质主要采用化学方法合成,如由丙二酸和对硝基苄醇经过酯化、碱酸调和及精制等步骤制得[1-2];或在丙二酸存在条件下,催化丙二酸双酯水解得到[3]。这些反应过程具有原料成本高,反应能耗大,后处理程序复杂,产品纯度较低等缺点,且易造成环境污染。酶催化技术,尤其是以固定化脂肪酶为催化剂直接催化酯化反应可以有效解决这些问题。固定化脂肪酶具有稳定性高、易与底物及产物分离、可重复利用、提高脂肪酶的利用效率、降低反应成本等众多优点,在生命科学、生物医学、食品科学、化学化工及环境科学等领域得到广泛应用[4-8]。然而,固定化脂肪酶催化酯化反应为非均相反应,液态底物容易在固定化脂肪酶颗粒表面形成边界层,液相主体中的反应底物必须穿过边界层才能到达固定化脂肪酶分子表面,因而强化底物与固定化脂肪酶、底物与底物之间的传质是提升反应速率的关键。
朱凯等[9]和 Liu等[10]研究发现超声是一种增强传质作用的有效手段,有助于提升酶促反应速率。在固定化脂肪酶催化酯化反应中引入超声,一方面有利于底物由液相主体传递到酶分子活性中心及产物的脱离,另一方面可以加速底物的溶解[11]。彭杨等[12]研究发现超声会影响脂肪酶的稳定性。
笔者将超声应用于固定化脂肪酶Novozym 435催化合成丙二酸单对硝基苄酯反应,考察超声固定化脂肪酶协同作用对酯化反应的影响,对超声辅助Novozym 435催化合成丙二酸单对硝基苄酯反应条件进行优化,并与常规恒温振荡水浴方式下的实验结果进行对比,以期为合成丙二酸单对硝基苄酯提供新的思路。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
Novozym 435固定化脂肪酶(BR),南京奥多福尼生物技术有限责任公司;丙二酸(AR)、对硝基苄醇(AR)、甲苯(AR)、甲醇(色谱纯),国药集团化学试剂有限公司;实验用水为自制去离子水。
1.1.2 实验仪器
CS-3型水听器,中科院声学研究所;DGCI-1200型超声处理器(含换能器),无锡德嘉电子有限公司;HN型超声波发生器,无锡市华能超声电子有限公司;SR8型示波器,江苏扬中电子仪器厂;DSHZ-300A型旋转式恒温振荡器,太仓实验设备有限公司;Summit高效液相色谱仪,美国戴安公司。
1.2 实验方法
1.2.1 丙二酸单对硝基苄酯含量测定
采用高效液相色谱法测定丙二酸单对硝基苄酯含量,具体分析条件为采用Alltech-C18色谱柱,柱温为40℃,紫外检测器波长254 nm,以0.02 mol/L甲醇-磷酸缓冲溶液(体积比7∶3)为流动相,流速为 0.6 mL/min,取样量为 20 μL[13]。
1.2.2 丙二酸单对硝基苄酯收率计算
丙二酸单对硝基苄酯的收率计算见式(1)。
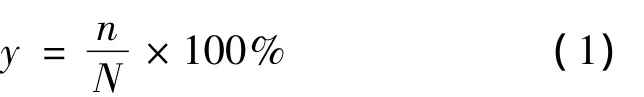
式中:n为实际得到丙二酸单对硝基苄酯的物质的量,mmol;N为理论丙二酸单对硝基苄酯的物质的量(以对硝基苄醇加入量计),mmol。
1.2.3 反应时间和温度对酶促合成丙二酸单对硝基苄酯的影响
在100 mL三角瓶中加入0.4 g Novozym 435,振荡使酶分散均匀。快速加入0.5 g对硝基苄醇和0.34 g丙二酸及一定体积甲苯溶剂,分别置于振荡水浴(180 r/min)或连续作用的超声反应器(声强为0.5 W/cm2)中反应,考察反应时间和温度对丙二酸单对硝基苄酯收率的影响。
1.2.4 底物浓度和Novozym 435浓度对酶促合成丙二酸单对硝基苄酯的影响
分别在超声声强0.5 W/cm2、频率20 kHz、温度30℃、反应时间5 h作用下和温度45℃、反应时间8 h的振荡水浴中考察对硝基苄醇浓度和Novozym 435浓度对丙二酸单对硝基苄酯收率的影响。
1.2.5 超声对酶促合成丙二酸单对硝基苄酯的影响
在3.0 g/L Novozym 435、4.0 g/L对硝基苄醇、反应时间为5 h、反应温度为30℃条件下,考察超声对丙二酸单对硝基苄酯收率和Novozym 435重复使用性能的影响。
2 结果与讨论
2.1 反应时间对丙二酸单对硝基苄酯收率的影响
考察振荡水浴和超声作用时反应时间对丙二酸单对硝基苄酯收率的影响,结果如图1所示。由图1可知:在25℃的振荡水浴中,产物丙二酸单对硝基苄酯收率随着时间延长而增加,反应8 h趋于稳定,最大收率为38.7%。超声作用下和振荡水浴中,产物丙二酸单对硝基苄酯收率随时间变化趋势基本相同。但与振动水浴相比,超声作用下反应5 h即达到平衡,最大收率为62.3%,提升产物收率的同时,有效缩短了反应时间。
2.2 反应温度对丙二酸单对硝基苄酯收率影响结果
温度是影响化学反应的重要因素,温度升高有利于加速反应,但是在酶催化反应中,温度过高会导致酶变性失活。考察振荡水浴和超声辐照条件下,反应温度对丙二酸单对硝基苄酯收率的影响,结果如图2所示。由图2可知:在振荡水浴中和超声作用下,最佳反应温度分别为45和30℃。这是因为脂肪酶对温度较为敏感,低温不利于酶活的发挥,产物收率较小;高温致使脂肪酶失活,产物收率下降较明显。在超声辅助条件下,当温度超过40℃时,丙二酸单对硝基苄酯收率下降较为显著。这可能是因为高温条件利于超声空化作用的发生,剧烈的空化作用破坏了脂肪酶的空间构象,导致其催化活力下降,产物收率降低[14]。因此,后续超声辅助酶促酯化反应都在30℃下进行。
2.3 对硝基苄醇浓度对丙二酸单对硝基苄酯收率影响
在对硝基苄醇和丙二酸摩尔比为1∶1、4.0 g/L Novozym 435条件下,考察超声作用下和振荡水浴中底物对硝基苄醇浓度对酶促酯化反应的影响,结果如图3所示。由图3可知:在振荡水浴中,当对硝基苄醇质量浓度为6.0 g/L时,丙二酸单对硝基苄酯收率达到最大值62.4%。刘辉等[15]研究表明,对硝基苄醇对酶促酯化反应有促进作用,而酸对酶促酯化反应起抑制作用。因醇酸摩尔比固定,增加对硝基苄醇浓度,丙二酸浓度随之增大,过高浓度的丙二酸降低反应体系的pH,导致脂肪酶的活性降低,抑制酶促反应的进行,丙二酸单对硝基苄酯收率降低。在超声辅助酶促酯化反应过程中,对硝基苄醇质量浓度为4.0 g/L时,产物丙二酸单对硝基苄酯收率达到最大值78.1%,超声有效强化了传质,增加了底物之间及底物与酶的接触几率,进而增加了反应速率,且丙二酸浓度相对较低,对反应抑制作用较弱,因此产物收率相对较高。
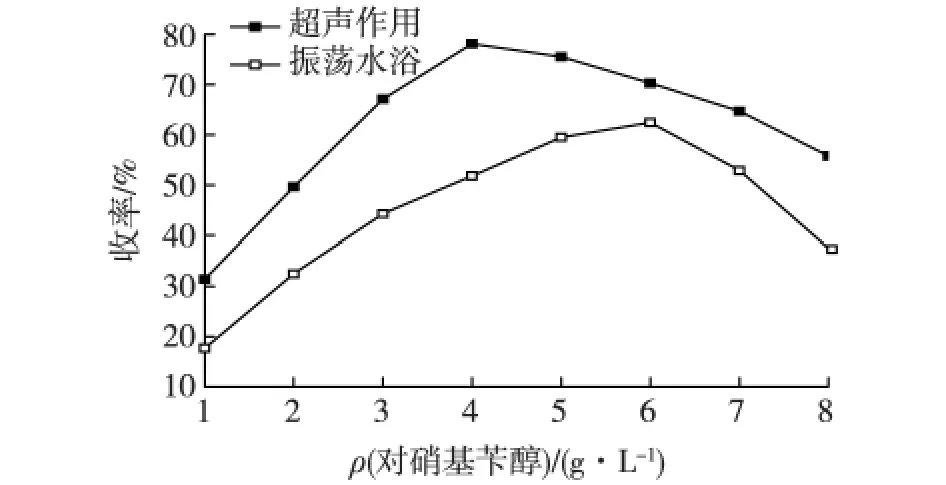
图3 对硝基苄醇浓度对丙二酸单对硝基苄酯收率的影响Fig.3 Effects of 4-nitrobenzyl alcohol concentration on mono-p-nitrobenzyl malonate yield
2.4 Novozym 435用量对丙二酸单对硝基苄酯收率的影响
作为酯化反应的催化剂,脂肪酶浓度是影响酶促反应的关键因素。增大脂肪酶浓度,即增大酶的活性位点与底物接触的几率,因此产物收率增大。但是,固定化酶价格相对较高,因此在酶促酯化反应中需综合考虑其成本。对超声辅助和振荡水浴中酶促酯化反应的催化剂Novozym 435浓度进行了优化,结果见图4。由图4可知:在振荡水浴中和超声作用下,Novozym 435质量浓度分别为4.5和3.0 g/L时,丙二酸单对硝基苄酯收率达到稳定。说明该浓度下的固定化脂肪酶分子周围的底物浓度已达到平衡,继续增加其浓度,对反应平衡影响较小;超声作用的传质效果高于振荡作用,有效增大了酶与底物的接触几率,因而在提升产物收率的同时减少了脂肪酶用量,节约了反应成本。

图4 Novozym 435浓度对丙二酸单对硝基苄酯收率的影响Fig.4 Effects of Novozym 435 concentration on mono-p-nitrobenzyl malonate yield
2.5 超声频率对丙二酸单对硝基苄酯收率的影响
Entezari等[16]研究认为,改变超声频率会改变稳态空化泡,超声振动过程产生的辐射压力和微射流会对脂肪酶分子和酶促化学反应产生影响。在超声声强为0.5 W/cm2时,考察超声频率对酶促酯化反应的影响,结果见图5。由图5可知:超声频率较低时,丙二酸对硝基苄酯收率较高,20和24 kHz的超声作用下酶促酯化反应产物收率分别为77.1%和81.6%。超声频率高于28 kHz,产物收率随超声频率的增加而减小。这可能是因为频率增加,超声空化气泡的存在周期缩短,空化核来不及成长为空化泡;在低频超声作用下,空化泡的存在周期较长,有利于脂肪酶分子形成活性更强的空间构象,催化活力增强,产物丙二酸单对硝基苄酯的收率较高[17]。从节约成本考虑,后续实验中选用20 kHz超声。

图5 超声频率对丙二酸单对硝基苄酯收率的影响Fig.5 Effect of ultrasonic frequency on mono-p-nitrobenzyl malonate yield
2.6 超声声强对丙二酸单对硝基苄酯收率的影响
声强是超声酶促酶促酯化反应的重要影响因素,超声强度低对反应过程传质促进作用小,超声强度过高又会造成脂肪酶失活[18-19]。考察超声强度对Novozym 435催化酯化反应的影响,结果见图6。超声强度采用量热法测定[20],超声频率为20 kHz。由图6可知:当超声声强小于0.8 W/cm2时,酯化产物丙二酸单对硝基苄酯的收率随着超声声强的增加而迅速增大,超声声强为0.8 W/cm2时达到最大值89.7%,声强超过0.8 W/cm2,产物收率降低。这可能是因为适宜强度的超声作用强化了传质,阻止固定化脂肪酶分子周围形成水膜,加速酶促反应。但是,超声声强过高,剧烈的超声空化作用会破坏脂肪酶分子的空间构象,导致脂肪酶蛋白的变性失活[21],丙二酸单对硝基苄酯收率减小。
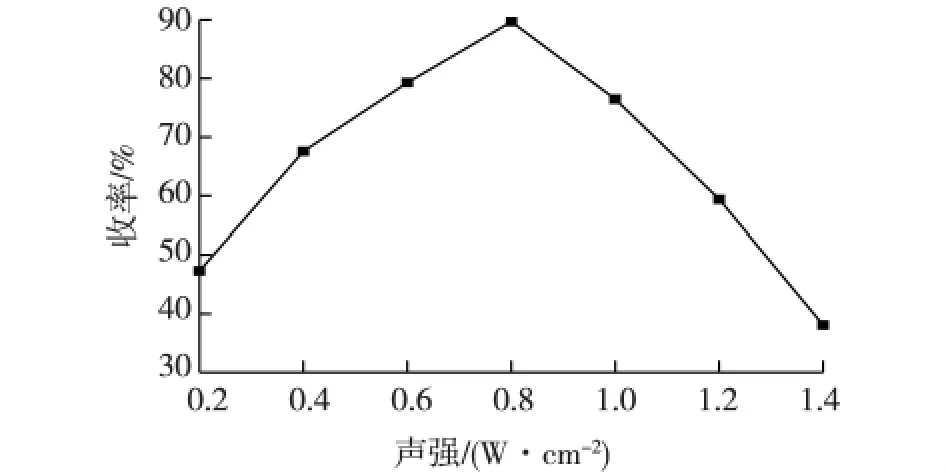
图6 超声声强对丙二酸单对硝基苄酯收率的影响Fig.6 Effect of ultrasonic intensity on mono-p-nitrobenzyl malonate yield
此外,固定化脂肪酶价格昂贵,重复利用可以降低酶促反应成本。在超声辅助酶促反应最佳条件下,重复使用Novozym 435催化合成丙二酸单对硝基苄酯,考察超声对固定化脂肪酶重复使用性能的影响,结果见图7。由图7可知:Novozym 435重复使用8次后,丙二酸单对硝基苄酯收率仍可达到69.3%,说明超声辅助作用于固定化脂肪酶催化合成丙二酸单对硝基苄酯反应较为稳定。
3 结论

图7 超声作用对固定化脂肪酶重复使用性能的影响Fig.7 Effects of ultrasonic treatment on reusability of immobilized lipase
研究了超声辐照作用下非水介质中固定化脂肪酶Novozym 435催化促丙二酸和对硝基苄醇合成丙二酸单对硝基苄酯的反应,考察了超声作用对酶促酯化反应的影响,对超声作用下酶法合成反应条件进行了优化,并与振荡水浴条件下的酶促反应结果进行了对比。当反应温度为30℃、Novozym 435质量浓度为3.0 g/L时,对硝基苄醇质量浓度为4.0 g/L,底物摩尔比1∶1时,在频率为 20 kHz、声强为0.8 W/m2的超声作用下反应5 h,产物丙二酸单对硝基苄酯最大收率为89.7%。与振荡水浴相比,温度降低了15℃,时间缩短了3 h,酶用量减少了1.5 g/L,而产物收率增加了 18.2%。超声作用下Novozym 435重复应用于酯化反应8次,产物收率仍达到69.3%。
[1]俞健钧,朱小飞,王德峰.一种培南类药物中间体丙二酸单对硝基苄酯的生产方法:中国,102276476A[P].2011-12-14.
[2]Ishikura T,Matsuyama S.Crystal modification of magnesium salt of mono-p-nitrobenzyl malonate and process for producing the same:US,5087734A[P].1992-02-11.
[3]Kunikata K.Process for producing mono-p-nitrobenzyl malonate:US,5516934A[P].1996-05-14.
[4]Huang J,Liu Y,Wang X.Silanized palygorskite for lipase immobilization[J].J Mol Catal B:Enzymatic,2009,57(1):10-15.
[5]Li Y,Wang W,Han P.Immobilization of Candida sp.99-125 lipase onto silanized SBA-15 mesoporous materials by physical adsorption[J].Korean J Chem Eng,2014,31(1):98-103.
[6]Zhu K,Wang J,Wang Y,et al.Synthesis of retinyl palmitate catalyzed by Candida sp.99-125 lipase immobilized on fiber-like SBA-15 mesoporous material[J].J Nanosci Nanotechnol,2011,11(9):7593-7602.
[7]Yin C,Liu T,Tan T.Synthesis of vitamin A esters by immobilized Candida sp.lipase in organic media[J].Chin J Chem Eng,2006,14(1):81-86.
[8]胡集铖,王欢,李亚,等.γ-Fe2O3-凹土超顺磁性纳米复合材料固载猪胰脂肪酶[J].生物加工过程,2014,12(2):12-16.
[9]朱凯,张文娟,韩萍芳,等.超声酶促维生素A棕榈酸酯反应的动力学[J].南京工业大学学报:自然科学版,2011,33(3):53-57.
[10]Liu Y,Jin Q,Shan L,et al.The effect of ultrasound on lipasecatalyzed hydrolysis of soy oil in solvent-free system[J].Ultrason Sonochem,2008,18(4):402-407.
[11]朱国辉,黄卓烈,丘泰球,等.功率超声对酶促反应的影响[J].应用声学,2001,20(4):45-48.
[12]彭杨,穆青,魏微,等.超声辅助脂肪酶催化L-抗坏血酸脂肪酶酯的合成[J].食品科学,2011,32(12):101-105.
[13]胡海洋,姜权,郭灿城.高效液相色谱法分析对硝基甲苯氧化产物[J].湖南城市学院学报:自然科学版,2006,15(2):60-61.
[14]Braginskaya F I,Zaitzeva E A,Zorina O M,et al.Low intensity ultrasoniceffectson yeasthexokinase[J].RadiatEnviron Biophys,1990,29(1):47-56.
[15]刘辉,朱凯,王伟,等.酶法制备一氯乙酸对硝基苄酯及催化反应动力学模型[J].高校化学工程学报,2012,26(2):272-278.
[16]Entezari M H,Kruus P.Effect of frequency on sonochemical reactions:I.oxidation of iodide[J].Ultrason Sonochem,1994,1(2):75-79.
[17]钱卫卫,韩萍芳,吕效平.超声作用下KF/CaO催化酯交换反应制备生物柴油[J].燃料化学学报,2010,38(1):52-56.
[18]Xiao Y M,Wu Q,Cai Y,et al.Ultrasound-accelerated enzymatic synthesis of sugar esters in nonaqueous solvents[J].Carbohydr Res,2005,340(13):2097-2103.
[19]Bracey E,Stenning R A,Brooker B E.Relating the microstructure of enzyme dispersions in organic solvents to their kinetic behavior[J].Enzyme Microb Technol,1998,22(3):147-151.
[20]Tian Z M,Wan M X,Wang S P,et al.Effects of ultrasound and additives on the function and structure of trypsin[J].Ultrason Sonochem,2004,11(6):399-404.
[21]Gebicka L,Gekicki J L.The effect of ultrasound on heme enzymes in aqueous solution[J].J Enzyme Inhibition Med Chem,1997,12(2):133-141.
