南极细菌Pseudoalteromonas sp.3-3-1-2产胞外多糖条件优化
2015-10-25杜宗军林学政
李 凯,杜宗军,林学政
(1.国家海洋局 第一海洋研究所,海洋生物活性物质重点实验室,山东 青岛 266061;2.山东大学(威海),海洋学院,山东 威海 264209)
生物活性多糖因其具有调节生物体生理功能和增强免疫力的作用而成为国内外的科学研究热点,其中极端环境细菌产生的胞外多糖(exopolysaccharides,EPS)更是引起了人们广泛的关注[1-2]。南极地区有着光照辐射变化极大、海水含盐度高、南极海域常年水温极低和光照时间呈季节性等独特的地理及气候特征[3],造就了独特的南极微生物生态系统。南极海冰中存在着大量的微生物及其产生的EPS,这些EPS在南极海冰这一极端环境中的能源传输和细胞保护等方面中起着重要作用[4]。
由于南极微生物产生的EPS成分十分复杂且含量都不高,这造成了对某种特定微生物的EPS进行研究和应用的困难,因此在实验室条件下对南极微生物进行产EPS的条件优化,对于发现和研究南极微生物活性EPS均有着重要的意义[5]。微生物的EPS产量受到各种因素的影响,包括氮源、碳源、盐度和装液量等;同时,随着渗透压和温度等物理条件的改变,EPS产量也会改变[4]。南极细菌Pseudoalteromonas sp.3-3-1-2分离于南极普里兹湾海域水样,经16S rRNA分子鉴定属于假交替单胞菌[6],其产生的 EPS 对大菱鲆的非特异性免疫[6],显著或极显著地提高黄盖鲽免疫器官(脾脏和后肠)的淋巴细胞增殖和呼吸爆发活性;并对脾脏、肝脏和后肠的ACP活力和T-SOD活力均有着明显的提高作用(尚未发表)。
响应面法是先利用合理的试验设计得出一定的实验数据,再采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析得到预测模型,解决多元变量对实验结果影响的问题[7]。本文中笔者拟通过单因素试验、Box-Behnken试验设计和Design-Expert响应面分析等,对南极细菌Pseudoalteromonas sp.3-3-1-2产EPS条件进行优化,以期为活性EPS的进一步研究及其应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种
南极细菌Pseudoalteromonas sp.3-3-1-2由国家海洋局第一海洋研究所海洋生物活性物质重点实验室菌种库保存并提供。
1.1.2 培养基
种子培养基为Zobell 2216E培养基:酵母膏1.0 g/L,蛋白胨5.0 g/L,V(过滤陈海水):V(自来水)=2∶1。挑取经活化的菌株3-3-1-2单菌落,接入50 mL(100 mL锥形瓶)液体种子培养基中,低温摇床振荡培养72 h(150 r/min、10℃),制成种子液。
1.2 试验方法
1.2.1 测定方法
生物量测定:将菌液进行适当稀释,用722分光光度计于600 nm处测定吸光度OD600,以未接菌的培养基稀释相同倍数作空白对照。
EPS测定:取1 mL菌液于10000 r/min离心5 min后,取0.5 mL上清液加入3倍体积的95%乙醇,于4℃自然沉降4 h,再次10000 r/min离心5 min后去上清液,沉淀物在室温条件下静置晾干后加入1 mL蒸馏水溶解,即为粗EPS溶液;取适量该溶液用苯酚-硫酸法[8]测定其EPS含量,以未接菌的培养基进行相同处理后做空白对照。
1.2.2 碳源对南极细菌3-3-1-2生长和EPS产量的影响
选择稀释10倍的Zobell 2216 E培养基作为基础培养基,以减少蛋白胨和酵母粉中碳源和氮源对菌株利用外加碳源和氮源的影响。分别在基础发酵培养基中加入10.0 g/L的果糖、蔗糖、麦芽糖、葡萄糖、乳糖和可溶性淀粉,按接种量1%接种种子液,低温摇床振荡培养5 d(150 r/min、10℃),研究不同碳源对菌株生长和EPS产量的影响;确定最佳碳源后,调整其添加量(10、20、30、40、50 和 60 g/L),以确定最佳添加量。
1.2.3 氮源对南极细菌3-3-1-2生长和EPS产量的影响
选择稀释10倍的Zobell 2216 E培养基作为基础培养基,以10.0 g/L蔗糖为碳源,分别加入10.0 g/L 的蛋白胨、(NH4)2SO4、尿素、酵母浸膏、KNO3、酵母粉、NH4NO3和牛肉浸膏为氮源,按接种量1%接种种子液,低温摇床振荡培养5 d(150 r/min、10℃),研究不同氮源对菌株生长和EPS产量的影响;确定最佳氮源后,调整其添加量(5.0、10.0、15.0、20.0、25.0和30.0 g/L),以确定最佳添加量。
1.2.4 培养基盐度对南极细菌3-3-1-2生长和EPS产量的影响
以蒸馏水替代Zobell 2216 E培养基中的过滤陈海水和自来水,往其中添加不同量的NaCl,调整其盐度分别为1.5%、3.0%、4.5%、6.0%和9.0%。按1%接种量接入种子液,低温摇床振荡培养5 d(150 r/min、10℃),研究培养基盐度对菌株生长和EPS产量的影响。
1.2.5 培养温度对南极细菌生长和EPS产量的影响
按1%接种量接种种子液于Zobell 2216 E培养基中,分别在5、10、15和20℃摇床振荡培养5 d(150 r/min),研究温度对菌株生长和EPS产量的影响。
1.2.6 培养基初始pH对南极细菌3-3-1-2生长和EPS产量的影响
用0.5 mol/L的HCl或NaOH溶液调整Zobell 2216 E 培养基的初始 pH 分别为5、6、7、8、9和10,按1%接种量接入种子液,低温摇床振荡培养5 d(150 r/min、10℃),研究培养基初始pH对菌株生长和EPS产量的影响。
1.2.7 Design-Expert响应面试验及分析
根据单因素试验结果选择出影响菌株3-3-1-2产EPS的主要因素,采用Design-Expert响应面软件进行Box-Behnken响应面设计,以发酵液中的产糖量为响应值,并对试验结果进行回归分析,从而获得南极细菌Pseudoalteromonas sp.3-3-1-2产EPS的最佳条件。
2 结果与讨论
2.1 单因素试验结果
2.1.1 碳源对南极细菌3-3-1-2生长和EPS产量的影响结果
考察碳源对菌株3-3-1-2的生长和EPS产量的影响,结果见图1。由图1可知:尽管在对照培养基Zobell 2216 E中菌株3-3-1-2的生长最好,但其EPS产量却很低,表明菌体生物量的增加并没有促进EPS相应的积累。当在基础培养基中添加葡萄糖或蔗糖为碳源时,菌株3-3-1-2的菌体生物量虽然较低,但均提高了菌株EPS产量;尤其以蔗糖作为碳源时,其EPS产量是对照培养基Zobell 2216E的17.75倍,极大地提高了菌体的EPS产量。以淀粉为碳源时,其发酵液EPS产量未检测出,这可能与本实验EPS含量测定时,以未接菌的相同培养基作对照,而淀粉自身即为多糖物质,菌体生长所消耗的多糖可能多于自身所产EPS所致。
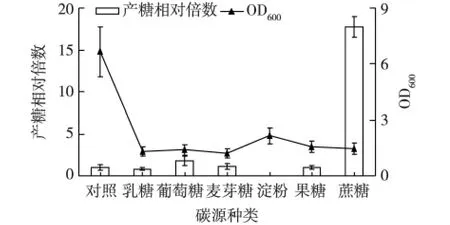
图1 不同碳源对菌株3-3-1-2生长和EPS产量的影响Fig.1 Effects of different carbon sources on cell growth and EPS production of strain 3-3-1-2
2.1.2 蔗糖初始添加量的确定
考察蔗糖添加量对菌株3-3-1-2的生长和EPS产量的影响,结果见图2。由图2可知:随着蔗糖添加量的增加,菌体的生物量和EPS产量都逐渐增加;当蔗糖添加量在40 g/L时,菌体生物量和EPS产量最高;之后都随着蔗糖添加量的增加反而有不同程度的降低,其中EPS产量的下降幅度比生物量更明显。因此,确定最佳的蔗糖添加量为40 g/L。
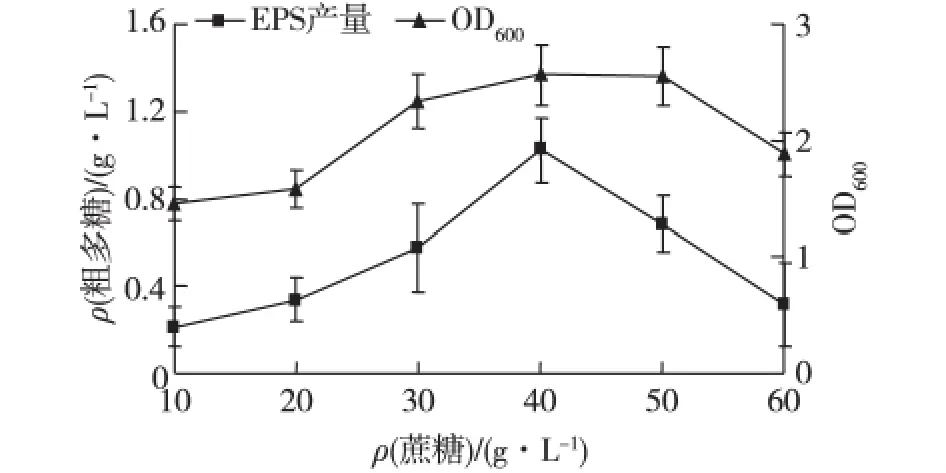
图2 蔗糖初始添加量对菌株3-3-1-2生长和EPS产量的影响Fig.2 Effects of initial sucrose adding amount on cell growth and EPS production of strain 3-3-1-2
碳源不仅为细菌生长提供碳素,而且碳源亦为菌体提供能量。不同的碳源可以明显影响微生物的代谢过程,由于酶系统的差异,不同微生物对碳源的利用情况也有所不同[8]。不同碳源对EPS的产量和糖分子的大小会造成不同程度的影响[9-10],如 Grobben 等[10]将菌株 Lactobacillus delbruckii分别以果糖和葡萄糖作为碳源来培养,得到2种不同的EPS产物。Chen等[11]研究发现,不同碳源对细菌次级代谢产物的产量有明显的影响。本试验结果表明,菌株3-3-1-2生长所需的最佳碳源与产EPS所需的最佳碳源并不一致,蔗糖作为碳源时,菌株3-3-1-2菌体生物量并不高,但 EPS产量最高,这与Gancel等[8]研究结果相似,而与 Yuan 等[12]研究结果(EPS产量0.9 g/L)有所不同。
2.1.3 氮源对南极细菌3-3-1-2生长和EPS产量的影响
考察氮源对菌株3-3-1-2的生长和EPS产量的影响,结果见图3。由图3可知:以蛋白胨和牛肉浸膏作为氮源时,菌体生物量均高于对照培养基——Zobell 2216 E培养基,但其EPS产量却低于对照培养基;而以KNO3为氮源时,虽然菌体生物量低于对照培养基,但是其EPS产量却是对照培养基中的9.5倍,同时在尿素、酵母浸膏和酵母粉作为氮源时,EPS产量分别约是对照培养基的4倍、4倍和3倍。由此可见,KNO3是菌株产EPS的最佳氮源。
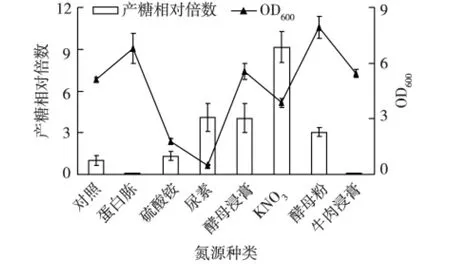
图3 不同氮源对菌株3-3-1-2生长和EPS产量的影响Fig.3 Effects of different nitrogen sources on cell growth and EPS production of strain 3-3-1-2
2.1.4 KNO3初始添加量的确定
考察KNO3的初始添加量对菌株3-3-1-2的生长和EPS产量的影响,结果见图4。由图4可知:随着培养基中KNO3添加量的增加,菌体生物量逐渐降低,说明过高浓度的KNO3不利于菌体的生长;而菌体的EPS产量呈先增加后减少的趋势,当KNO3添加量在10.0 g/L时,EPS产量最高,之后随添加量的增加,EPS产量反而降低。因此,KNO3的最佳添加量为10.0 g/L。
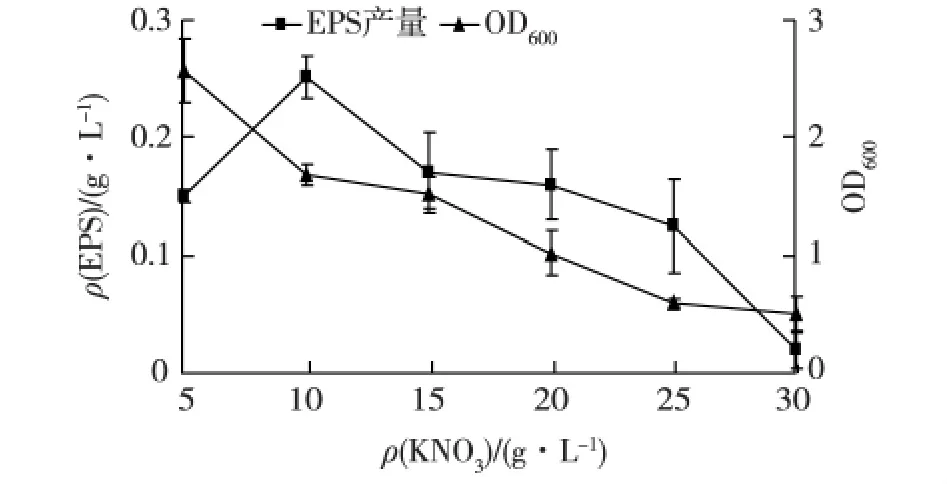
图4 KNO3初始添加量对菌株3-3-1-2生长和EPS产量的影响Fig.4 Effects of initial potassium nitrate adding amount on cell growth and EPS production of strain 3-3-1-2
氮源是组成蛋白质和核酸的必要元素之一。有机氮源可以为菌体提供某些无机氮源无法合成的氨基酸,而无机氮源可以更快地被微生物吸收利用[13]。本试验结果表明,KNO3作为氮源时,虽然菌体生物量较低,但EPS产量最高,这与李信等[14]对蛹虫草菌EPS的发酵工艺优化研究结果类似。
2.1.5 培养基盐度对南极细菌生长和EPS产量的影响结果
考察培养基盐度对菌株3-3-1-2生长和EPS产量的影响,结果见图5。由图5可以看出:菌株3-3-1-2在不同盐度(0~9.0%)下均可生长和产生EPS。较低盐度(0~3.0%)时,培养液中,菌体生物量和EPS产量随着盐度的升高逐渐增加;在较高盐度(3.0%~9.0%)培养液的菌体生物量和EPS产量相差不大,在盐度为4.5%时,菌株3-3-1-2的EPS产量最高。
盐度主要影响细菌渗透压的调节[15]。本试验结果表明,较高盐度(3.0% ~9.0%)下,菌株3-3-1-2 EPS的产量比较低盐度(0~3.0%)有所提高,这与李江[5]研究发现高盐能促进南极细菌 S-15-13 EPS的积累相似。
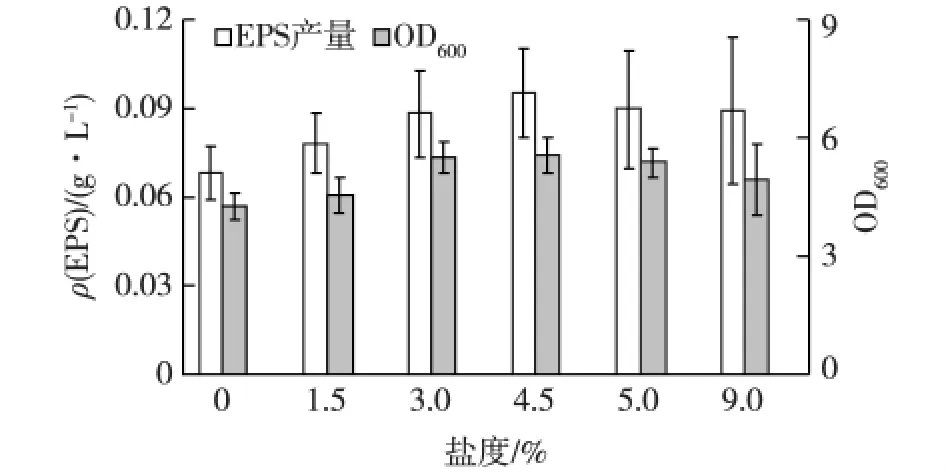
图5 不同盐度对菌株3-3-1-2生长和EPS产量的影响Fig.5 Effects of different salinity on cell growth and EPS production of strain 3-3-1-2
2.1.6 培养温度对南极细菌3-3-1-2生长和EPS产量的影响结果
考察培养温度对菌株3-3-1-2生长和EPS产量的影响,结果见图6。由图6可知:温度对菌株生长和EPS产生有着不同的影响趋势。菌体生物量随着培养温度的升高而逐渐降低,可见低温有利于菌体生物量的积累;EPS产量随着培养温度的升高逐渐增加,在15.0℃时,EPS产量最高,之后又有所降低。
培养温度对EPS产量的影响主要体现在对菌体生长的影响上,适当的温度可以提高菌体内各种酶活性,提高新陈代谢的速度,从而提高EPS的产量。培养温度过低会影响细菌的生长速度,不利于EPS的合成与积累;而温度过高一方面使得部分酶活性变低,另一方面菌体新陈代谢过快,培养基营养物质消耗过度,大大降低 EPS前体物质的含量[16],从而减少了EPS的产生与积累。本试验中菌株3-3-1-2的最适生长温度和EPS产量最高时的培养温度不同,可能是因为激活EPS合成系统所需要酶的最适温度与其最适生长温度不同引起的[8]。结果表明,菌株3-3-1-2在15.0℃培养条件下的EPS产量比低温条件下(5.0℃和10.0℃)高,这 与 Mancuso 等[17]研 究 发 现 南 极 细 菌CAM025在10.0℃时的EPS含量比高温条件下(20.0和30.0℃)高30倍以上的研究结果有所不同。
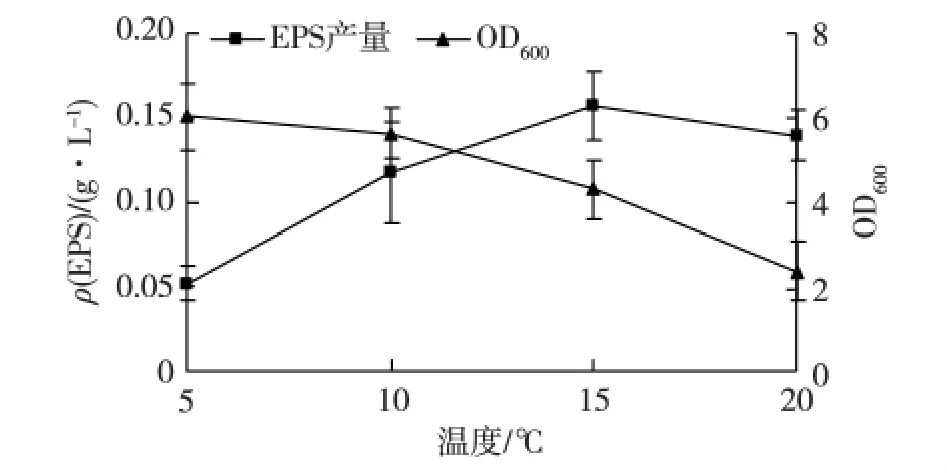
图6 温度对菌株3-3-1-2生长和EPS产量的影响Fig.6 Effects of different temperature on cell growth and EPS production of strain 3-3-1-2
2.1.7 培养基初始pH对南极细菌3-3-1-2生长和EPS产量的影响结果
考察培养基初始pH对菌株3-3-1-2生长和EPS产量的影响,结果见图7。由图7可知:尽管初始pH为7时菌株的生长最好,pH在7~10的范围内,其培养液的菌体生物量均基本一致。在初始pH为9时,菌株EPS的产量最高。
培养基的初始pH和培养过程中pH的控制,对胞外多糖的合成具有显著影响[18]。Vaningelgem等[19]研 究 发 现,嗜 热 链 球 菌 Streptococcus thermophilus ST 111在培养基营养成分相同的条件下,调控pH条件下EPS的产量是不调控pH条件下产量的5倍。其原因可能是环境pH变化可引起细胞膜电荷的变化,影响细胞膜的功能,细胞的形态和结构,进而影响菌体对营养物质的吸收和代谢产物的生物合成[20]。结果表明,中性和弱碱性环境有利于菌株的生长,而碱性环境更有利于EPS地产生和积累,这与 Kumar等[9]研究发现大多数菌株产EPS要求的培养基pH为中性有所不同。
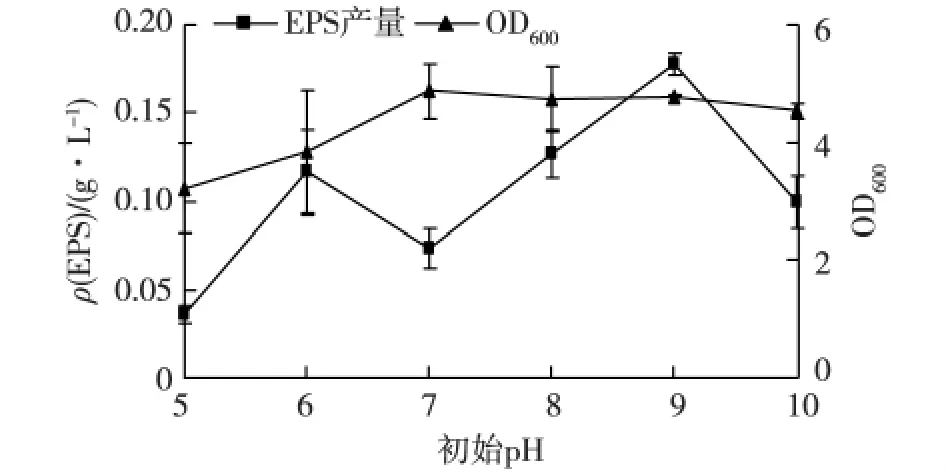
图7 初始pH对菌株3-3-1-2生长和EPS产量的影响Fig.7 Effects of different initial pH on cell growth and EPS production of strain 3-3-1-2
2.2 Design-Expert响应面法优化南极细菌3-3-1-2产EPS条件
2.2.1 影响南极细菌3-3-1-2产EPS的关键因素
根据单因素试验结果确定蔗糖、KNO3和温度为菌株3-3-1-2产EPS的关键因素,3因素水平分别选取蔗糖添加量 30.0、40.0和 50.0 g/L,KNO3添加量 5.0、10.0 和 15.0 g/L,温度 10.0、15.0和20.0℃。采用Design-Expert响应面软件对其进行Box-Behnken响应面设计(表1),以发酵液的产糖量Y为响应值,对试验结果进行回归分析(表2),从而研究菌株3-3-1-2产 EPS的最佳条件。
2.2.2 二次回归方程拟合及方差分析
利用Design-Expert软件对表2数据进行多元二次回归拟合,得到回归方程 Y=-6.25412+2.96362 X1+ 2.866 75X2+ 0.183 55X3-0.3475X1X2+0.015X1X3+0.0704X2X3-0.335-1.3405-0.009。
回归方程的方差分析和可信度分析如表2和表3所示。由表2和表3可以看出,蔗糖添加量对菌体产糖量影响显著(P=0.0114<0.05),KNO3添加量影响不显著(P=0.1594>0.05),温度对菌体产糖量极显著(P=0.0042<0.01);回归模型F值检验显著(P=0.0013<0.01),失拟项不显著(P=0.1023>0.05),说明模型在被研究的整个区域具有较好的拟合度。从模型可信度分析可知,其决定系数(R2)=94.48% >80.00%,矫正决定系数(Adj.R2)=87.38%,说明模型对试验预测的准确性有87.38%;Y的变异系数(C.V.=5.12)较低,说明试验的操作性高。但预测决定系数(Prep.R2=0.3110)较低,这可能与菌株3-3-1-2产EPS不稳定有关。总体来说,回归模型具有较好的拟合度,在一定的条件下可以用回归方程对菌株3-3-1-2 EPS产量进行分析和预测。
利用Design-Expert软件对二次回归模型进行规范分析,通过回归方程来分析绘制分析图,考察所拟合的相应曲面形状,蔗糖浓度、KNO3浓度和温度之间的等高图和立体分析图分别如图8、9和10所示。

表1 Box-Behnken试验设计与结果Table 1 Design and results of Box-Behnken experiments
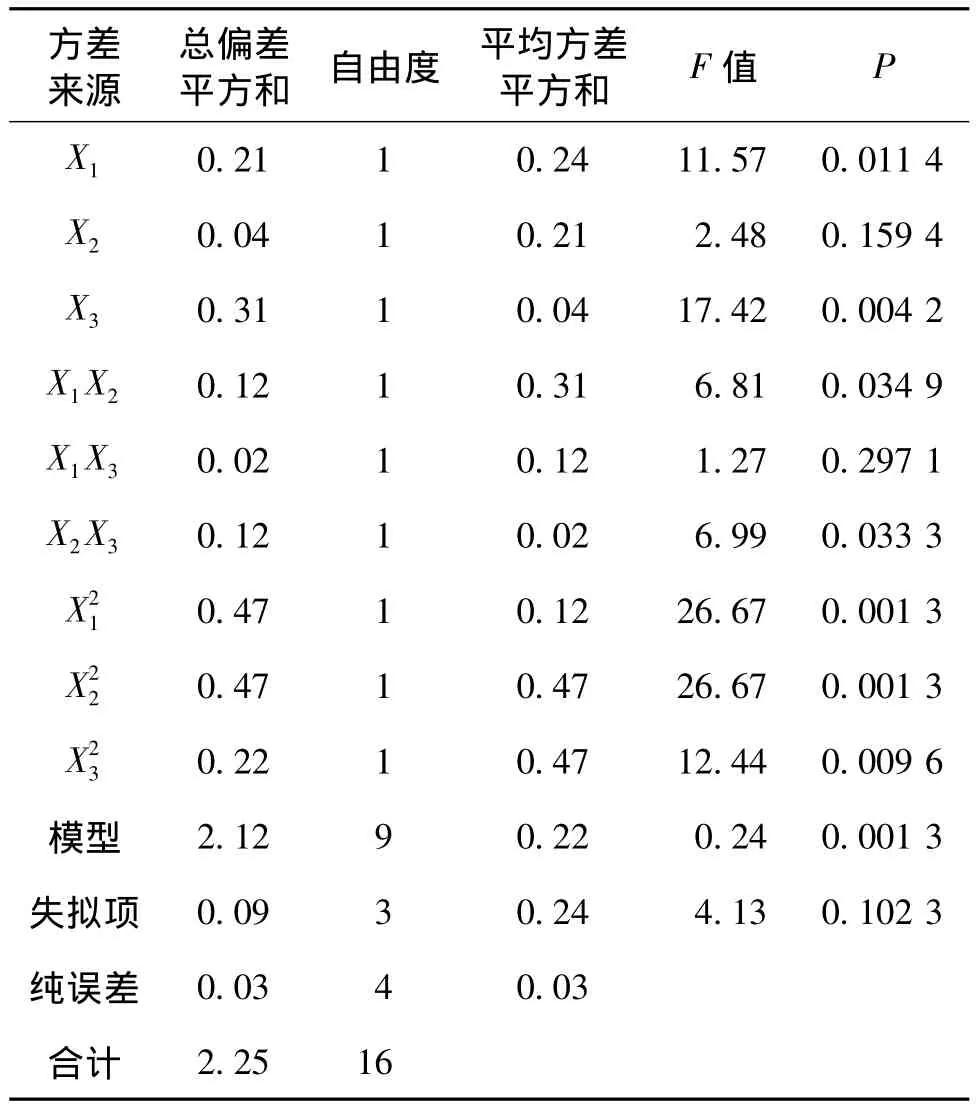
表2 回归方程方差分析Table 2 ANOVA for the RSM experiment
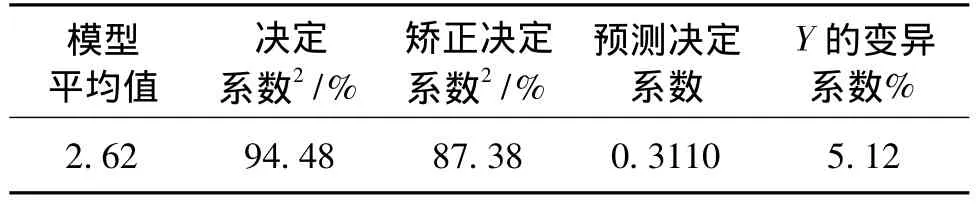
表3 模型可信度分析Table 3 Reliability analysis for the modle
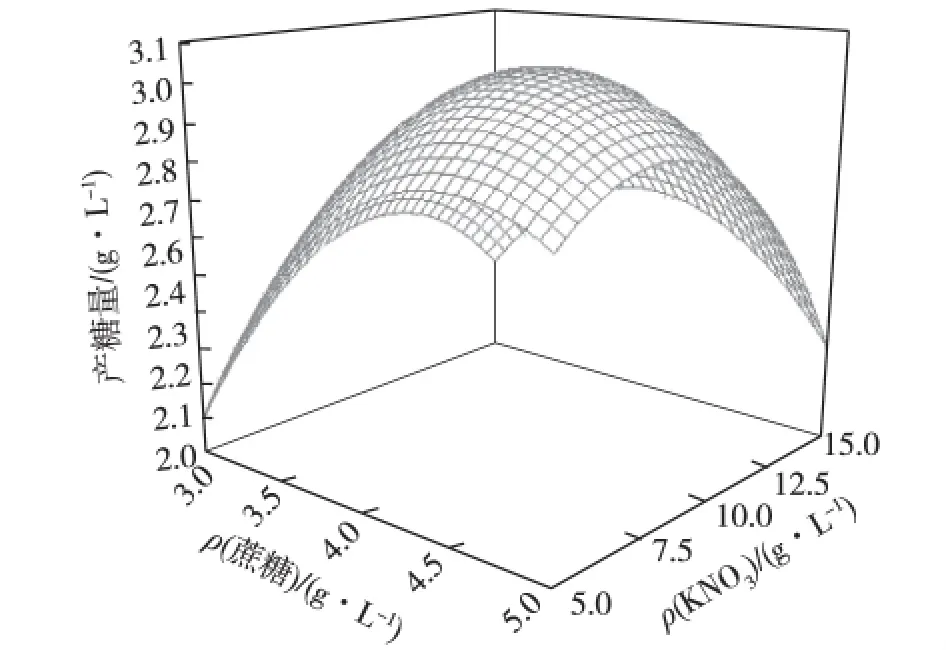
图8 蔗糖和KNO3用量对EPS产量的交互影响Fig.8 Reciprocal effects of sucrose concentration and potassium nitrate concentration on EPS production
2.2.3 各因素最优值的确定
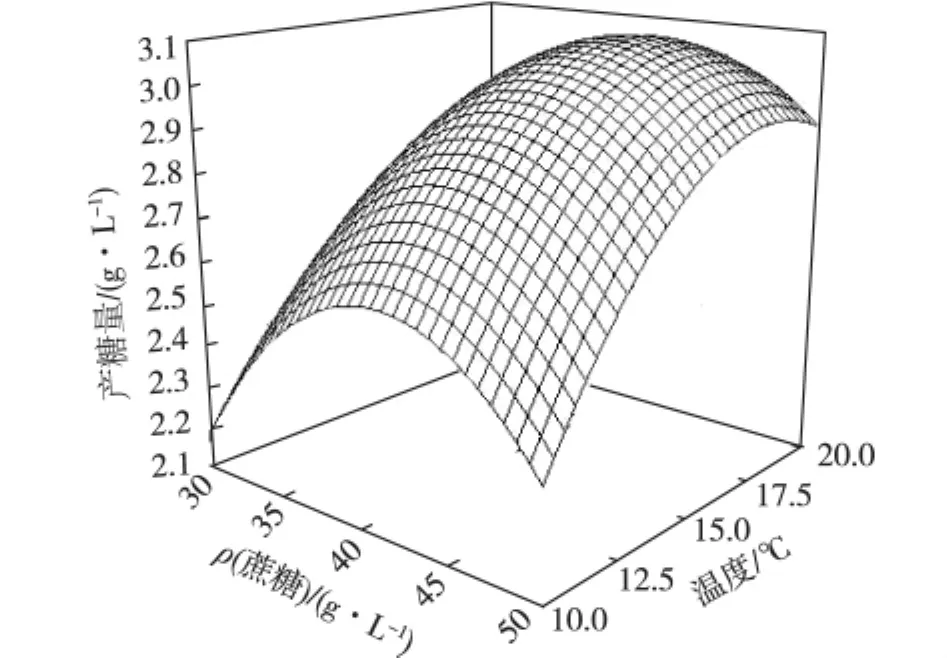
图9 蔗糖浓度和温度对EPS产量的交互影响Fig.9 Reciprocal effects of sucrose concentration and temperature on EPS production
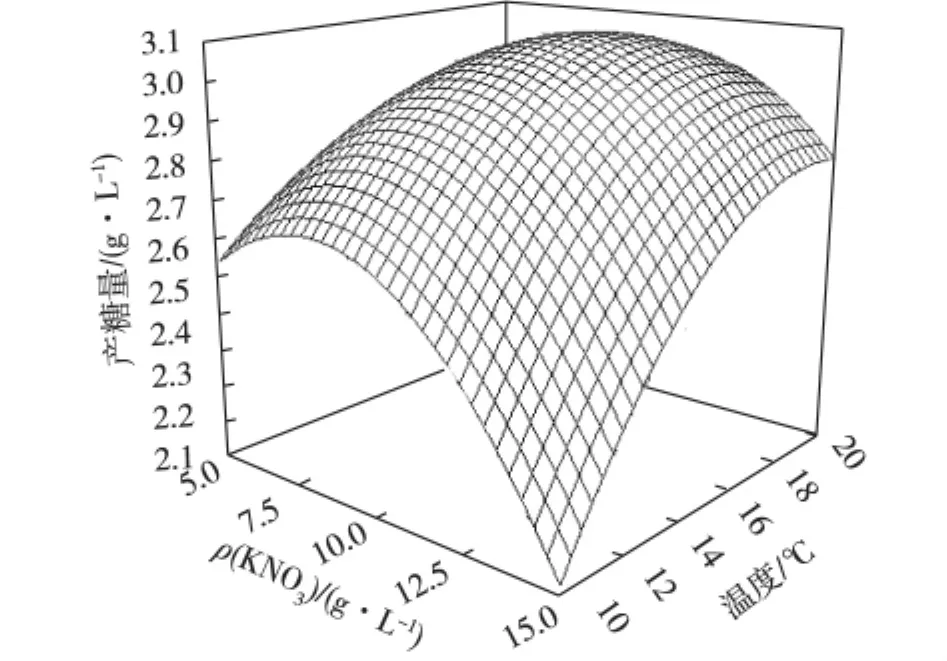
图10 KNO3浓度和温度对EPS产量的交互影响Fig.10 Reciprocal effects of potassium nitrate concentration and temperature on EPS production
利用Design-Expert软件进行岭脊分析[21],得到各因素的最佳添加量分别为蔗糖43.1 g/L,KNO39.6 g/L,温度17.3℃,最佳响应值为3.096 g/L,可信度为98.8%。再根据试验操作的合理性和可操作性确定在基础培养基中添加蔗糖43.1 g/L,KNO39.6 g/L,温度 17.3 ℃,转速 150 r/min,pH 9,接种量1%,进行3组试验,每组3个样本进行发酵试验,得到3组的平均EPS产量为2.89、3.03和2.78 g/L。试验结果与预测值较为接近,说明回归方程能够较真切地反映各因素对产糖量的影响。
传统的发酵条件优化大多采用单一的单因素设计,或者较简单的正交试验,笔者针对单一使用响应面法的不足之处,高效整合单因子试验和响应面中心组合设计等统计学方法[22],准确快速地实现了南极细菌3-3-1-2产EPS条件的优化,获得了较理想的结果。本研究从众多影响细菌产EPS的因素中筛选出了主要因素并实现了因素水平的优化,极大地提高了南极细菌3-3-1-2的产糖量,使其最高产量可高达3.03 g/L,为以后EPS的扩大生产和工业化利用提供了一定的科学依据。
3 结论
南极细菌Pseudoalteromonas sp.3-3-1-2最适生长条件和最佳产EPS条件并不完全一致;产EPS发酵培养基的最佳碳源和氮源分别为蔗糖和KNO3,其最佳添加量分别为43.1 g/L和9.6 g/L,最适温度为17.2℃,最适pH为9,最适盐度为4.5%;优化后菌体粗多糖产量可达3.03 g/L。
[1]Leung Y K,Liu C,Koon J C M,et al.Polysaccharide biological response modifiers[J].Immunol Lett,2006,105(2):101-104.
[2]Schepetkin IA,Quinn M T.Botanicalpolysaccharides:macrophage immunomodulation and therapeutic potential[J].Int Immuns Pharmacol,2006,6(3):317-333.
[3]张波涛,缪锦来,李光友,等.极地微生物活性物质研究进展[J].海洋科学,2004,28(2):58-63.
[4]Nichols C A, Guezennec J, Bowman J P. Bacterial exopolysaccharidesfrom extreme marine environments with special consideration of the southern ocean,sea ice,and deep-sea hydrothermal vents:a review[J].Marine Biotechnol(NY),2005,7(4):253-271.
[5]李江.南极适冷菌Pseudoalteromonas sp.S-15-13胞外多糖的研究[D].青岛:中国海洋大学,2006.
[6]赵惠娅,刘同军,郑风荣,等.产胞外多糖极地微生物的筛选及其胞外多糖对大菱鲆免疫活力的初步研究[J].海洋科学进展,2013,3(2):237-246.
[7]Kalil J,Maugeri F,Rodrigues M I.Response surface analysis and simulation as a tool for bioprocess design and optimization[J].Process Biochem,2000,35:539-550.
[8]Gancel F,Novel G.Exoplysaccharide production by Streptococ-cus salivarius sp.thermal ophilus cultures condition of production[J].J Dairy Sci,1994,77(3):685-688.
[9]Kumar A S,Mody K,Jha B.Bacterial exopolysaccharides:a perception[J].J Basic Microbiol,2007,47(2):103-107.
[10]Grobben G J,Smith M R,Sikkema J,et al.Influence of fructose and glucose on the production of exopolysaccharides and the activities of enzymes involved in the sugar metabolism and the synthesis of sugar nucleotides in Lactococcus delbruckii sp.burglarious NCFB 2772[J].J Microbiol Biotechnol,1996,46:279-284.
[11]Chen Wei,Zhao Zhao,Chen Shifei,et al.Optimization for the production ofexopolysaccharide from Fomesfomentariusin submerged culture and its antitumor effect in vitro[J].Bioresour Technol,2008,99:3187-3194.
[12]Yuan Baojing,ChiXiaoyan,ZhangRijun.Optimization of exopolysaccharides production from a novel strain of Ganoderma lucidum CAU5501 in submerged culture[J].Braz J Microbiol,2012,44(2):233-242.
[13]Shih I L,Pan K,Hsieh C.Influence of nutrition components and oxygen supply on the mycelia growth and bioactive metabolites production in submerged culture of Antrodia cinnamomea[J].Process Biochem,2006,41∶1129-1135.
[14]李信,许雷.蛹虫草菌胞外多糖发酵工艺优化[J].化工冶金,1998,19(3):254-259.
[15]Thomas D N,Dieckmann G S.Antarctic sea ice:a habit for extremophiles[J].Science,2002,295:641-644.
[16]刘慧,熊丽霞,韩睿,等.脏灵谷元干酪乳酸菌KL1高产胞外多糖发酵条件优化研究[J].中国农业通报,2008,24(11):117-121.
[17]Mancuso Nichols C,Garon S,Bowman J P,et al.Production of exopolysaccharides by Antarctic marine bacterial isolates[J].J Appl Microbiol,2004,96:1057-1066.
[18]张彬,谢明勇,殷军艺,等.响应面分析法优化超声波提取茶多糖工艺的研究[J].食品科学,2008,29(3):322-328.
[19]Vaningelgem F,Zamfir M,Adriany T,et al.Fermentation conditions affecting the bacterial growth and exopolysaccharide production by Streptococcus thermophilus ST 111 in milk-based medium[J].J Appl Microbiol,2004,97(6):1257-1273.
[20]Shu C H,Lung M Y.Effect of pH on the production and molecular weight distribution of exopolysaccharide by Antrodia camphorata in batch cultures[J].Process Biochem,2004,39:931-937.
[21]罗玲泉,刘成国,黄祥元,等.岭脊法分析具有高产EPS特性的乳酸菌的发酵酸乳条件[J].乳酸科学与技术,2007(2):73-80.
[22]欧宏宇,贾士儒.SAS软件在微生物培养条件中的应用[J].天津轻工业学院学报,2001,36:14-17.
