新疆天山花楸黄酮类物质对酪氨酸酶的抑制机制
2015-10-25付建红周晨婕陈清西
付建红,祁 瑞,郑 静,周晨婕,陈清西
(1.新疆师范大学生命科学学院,新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐 830054;2.厦门大学生命科学学院,福建 厦门 361005)
酪氨酸酶(EC 1.14.18.1,tyrosinase)是一种结构复杂的多亚基的含铜氧化还原酶[1],广泛存在于微生物和动植物中。它能够催化单酚羟化成二酚(单酚酶活性),并把二酚氧化成醌(二酚酶活性);醌在非酶促条件下形成反应终产物黑色素[2]。由于酪氨酸酶既是生物体内黑色素合成的关键酶,又与昆虫的伤口愈合与发育[3],果蔬的褐变[4]有密切关系,所以抑制酪氨酸酶活性是降低产生的黑色素量、防止褐变的有效途径之一。筛选高效、安全的酪氨酸酶抑制剂,对于果蔬保鲜、皮肤美白和生物杀虫剂的研制都具有重要意义。国内外对酪氨酸酶的研究主要集中在酶的分离纯化、催化机制、活性调控以及酪氨酸酶基因在生物体内的生理作用等方面,目前其三维结构仍未得到[1]。对于该酶抑制剂的研究,国内外很多学者致力于寻找特异的、高效的酪氨酸酶抑制剂,研究其抑制作用机制及抑制剂的应用[5]。
黄酮类化合物广泛存在于植物中,尤其是许多中药材中含量丰富,属于酚类化合物。研究表明:黄酮具有多种药理活性,其中包括抗氧化作用、消炎作用、抗癌和抗基因诱变作用等[6]。Kubo 等[7]从天然植物(茴芹、腰果等)中提取了一系列酪氨酸酶抑制剂,经检测主要为黄酮类天然产物,测定了它们对蘑菇酪氨酸酶的效应机制。Xie等[8]研究了一系列黄酮类化合物对酪氨酸酶活力的影响,实验结果表明:栎精、高良姜精、非瑟酮、3,7,4-三羟基黄酮和桑色素等黄酮醇都是酪氨酸酶的竞争性抑制剂。天山花楸(Sorbus tianshanica Ruprer)为蔷薇科花楸属的多年生小乔木或灌木,主产新疆。天山花楸是传统的民族药用植物,主治肺结核、哮喘、咳嗽、胃炎、胃痛、维生素A和 C缺乏症[9],主要含有黄酮类、氰苷类、萜类、有机酸、甾体化合物和多种酶等,其中黄酮类化合物是其主要活性成分[10]。目前尚未见有关天山花楸提取物抑制酪氨酸酶活力的报道。笔者采用超声波辅助法提取天山花楸黄酮类物质。以天山花楸黄酮类物质作为效应物,研究其对蘑菇酪氨酸酶二酚酶活力的影响及抑制作用机制,探讨抑制剂和酶分子间结合作用的分子模型,以期为天山花楸黄酮类物质在食品、医药及化妆品等领域的开发和应用提供科学依据。
1 材料和方法
1.1 材料与试剂
天山花楸的茎枝采自新疆巴里坤天山山脉南麓;芦丁标准品购自中国药品生物制品检定所;蘑菇酪氨酸酶(比活力为6680 U/mg)、L-多巴(LDOPA)、二甲亚砜(DMSO)均购自Sigma公司;其他试剂均为国产分析纯;使用的蒸馏水为去离子重蒸水,无特别说明,该文中溶液均为去离子重蒸水配制。
1.2 主要仪器
KQ5200E型超声波清洗器,昆山市超声仪器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;EYELA型旋转蒸发仪,上海爱朗仪器有限公司;DU800型分光光度计,美国贝克曼库尔特有限公司;DKB-501A型超级恒温水槽,上海精宏实验设备有限公司;高速粉碎机,姜堰市银河仪器厂。
1.3 天山花楸黄酮类物质的提取
将天山花楸枝条洗净、低温干燥后粉碎。称取天山花楸枝粉末6 g,加入300 mL体积分数为60%的乙醇溶液搅拌均匀,置于超声波清洗器中进行超声波处理,超声波功率为200 W,超声温度为30℃,超声时间为120 min;真空抽滤提取物,滤液用旋转蒸发仪蒸发浓缩,冷冻干燥后得到天山花楸黄酮提取物。将提取物用含体积分数为5%DMSO的磷酸盐缓冲液溶解,制成15 mg/mL的提取物溶液,再分别吸取0、25、50、75 和 100 μL 提取物溶液加入到3.0 mL酪氨酸酶测活体系中,得到质量浓度分别为0、0.125、0.25、0.375 和 0.5 mg/mL 的天山花楸黄酮提取物溶液。
1.4 芦丁标准曲线的绘制
标准曲线的测定参照文献[11]。精密称取芦丁标准品13.2 mg,用体积分数为60%乙醇溶液溶解,配制质量浓度为0.528 mg/mL的芦丁标准溶液。分别准确吸取芦丁标准溶液0、0.4、0.8、1.2、1.6和2.0 mL置于10 mL容量瓶内,分别加入2.0、1.6、1.2、0.8、0.4 和 0 mL 体积分数为 60% 乙醇溶液;在此体系中依次分别加入质量分数为5%NaNO2溶液0.5 mL(摇匀静置6 min)、质量分数为10%Al(NO3)3溶液0.5 mL(放置6 min)和质量分数为4%的NaOH溶液4.0 mL,最后用体积分数为60%乙醇溶液定容,摇匀后静置15 min,于510 nm处测定吸光度(A510)。用体积分数为60%乙醇溶液作空白参比液,以芦丁质量浓度为横坐标、吸光度为纵坐标绘制标准曲线。
1.5 对酪氨酸酶二酚酶活力影响的测定
酪氨酸酶二酚酶活力的测定参照文献[12]。以0.5 mmol/L的L-DOPA为底物,在0.05 mol/L磷酸盐缓冲液(pH=6.8)的3.0 mL酶测活体系中,先加入0.1 mL不同质量浓度的提取物溶液于比色杯中,再加入2.8 mL底物溶液和0.1 mL蘑菇酪氨酸酶溶液,立刻混匀,在30℃恒温条件下测定A475随时间的增长直线,从直线斜率即可求得二酚酶活力,产物的消光系数(ε)按 ε =3700 L/(mol·cm)计算[13]。酶活力单位(U)定义为每分钟催化L-DOPA氧化产生1 μmol产物的酶量。以相对酶活力对提取物浓度作图,得到提取物的浓度效应曲线。
相对酶活力按式(1)计算。

式中:Vc为对照组(不含提取物)的酶活力(OD475·min-1),Vs为样品组(含有不同质量浓度的提取物)的酶活力(OD475·min-1)。
1.6 对酪氨酸酶二酚酶活力的抑制机制考察
在酶活力测定体系中,固定底物(L-DOPA)浓度为0.5 mmol/L,加入不同质量浓度的天山花楸黄酮提取物溶液,改变酪氨酸酶的加入量,测定酶活力与酶质量浓度的关系,进而测定酶促反应速率与酶质量浓度的关系。根据酶促反应速度与酶质量浓度的相关性判断天山花楸黄酮提取物对酪氨酸酶二酚酶活力的抑制作用机制。
在测活体系中固定酪氨酸酶的质量浓度,加入不同质量浓度的天山花楸黄酮提取物溶液,改变底物(L-DOPA)的浓度,测定不同浓度底物下的酶促反应初速率,初速率是通过吸光度的改变值求得,即酶反应初速率=1000A475/3.7。通过Lineweaver-Burk双倒数作图,比较酶催化反应的动力学参数,包括表观米氏常数(Km)和最大反应速率(vmax)的变化来判断抑制类型,并以直线斜率和纵轴截距对抑制剂(提取物)浓度二次作图,求得对游离酶的抑制常数(KI)和对酶-底物络合物的抑制常数(KIS)。
1.7 体外抗氧化活性的测定
采用1,1-二苯基-2-三硝基苯肼自由基(DPPH·)法测定天山花楸黄酮提取物清除自由基的能力[14]。在3.0 mL测活体系中,依次加入1.0 mL 0.1 mol/L醋酸缓冲液(pH5.5),1.87 mL无水乙醇,0.1 mL 3 mmol/L的DPPH·(溶于乙醇),最后加入0.03 mL终质量浓度为0~0.525 mg/mL的天山花楸黄酮提取物溶液,立刻混匀,在25℃恒温条件下反应20 min,测定517 nm处的吸光度值。以加入Vc为对照,计算DPPH·的相对活性,计算方法参照文献[14]。
2 结果与讨论
2.1 天山花楸黄酮的提取工艺
以吸光度(A)为纵坐标,芦丁质量浓度(ρ)为横坐标绘制标准曲线,得到线性回归方程A=11.425ρ-0.0179,相关系数 R=0.9999,表明在0.02~0.10 mg/mL内吸光度和芦丁质量浓度线性关系良好。
天山花楸黄酮类物质提取的单因素试验主要考察提取溶剂乙醇的体积分数、超声时间和料液比对黄酮得率的影响。在单因素试验的基础上,运用正交试验设计优化提取工艺,确定超声波辅助法提取天山花楸黄酮的最佳提取工艺为6 g天山花楸枝条粉末,加入体积分数为60%的乙醇溶液300 mL,搅拌均匀后进行超声波处理,超声波功率为200 W,超声温度30℃,超声时间120 min。最后用体积分数为60%的乙醇溶解天山花楸黄酮提取物,于510 nm下测定吸光值。根据回归方程得到天山花楸提取物中黄酮的质量浓度,黄酮得率为2.75%。
2.2 对蘑菇酪氨酸酶二酚酶活力的影响
以天山花楸黄酮提取物为效应物,研究它对蘑菇酪氨酸酶活力的影响。在以L-DOPA为底物的测活体系中,加入不同质量浓度的天山花楸黄酮提取物(效应物)溶液,以不加效应物为对照,测定相对酶活力,结果如图1所示。由图1可知:天山花楸黄酮提取物导致酶活力下降一半的浓度(IC50)为0.27 mg/mL,对蘑菇酪氨酸酶二酚酶活力有较强的抑制作用,随着效应物质量浓度的增大,相对酶活力呈指数下降。
2.3 对蘑菇酪氨酸酶二酚酶的抑制作用机制的判断
在固定底物(L-DOPA)浓度的测活体系中,加入不同质量浓度的天山花楸黄酮提取物溶液,改变酶的加入量,测定经天山花楸黄酮提取物作用后酪氨酸酶二酚酶活力与加入酶量之间的关系,结果如图2所示。由图2可知:酶活力对酶量作图得到一组通过原点的直线。随着天山花楸黄酮提取物质量浓度的增大,直线的斜率逐渐下降,说明天山花楸黄酮提取物对蘑菇酪氨酸酶的抑制作用属于可逆过程。也就是说天山花楸黄酮提取物是通过抑制酶活力而导致催化效率降低,而不是通过减少有效酶量导致酶活力下降。
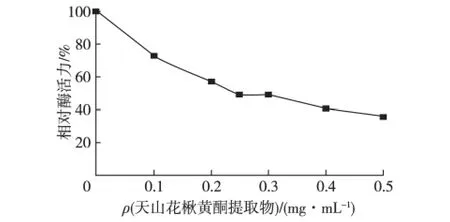
图1 天山花楸黄酮提取物对酪氨酸酶二酚酶活力的影响Fig.1 Effect of flavonoid extract of Sorbus tianschanica Ruper stems on activity of diphenolase of tyrosinase

图2 天山花楸黄酮提取物对酪氨酸酶二酚酶活力的抑制作用机制Fig.2 Determination of the inhibitory mechanism of flavonoid extract from Sorbus tianschanica Ruper on diphenolase of tyrosinase
2.4 对蘑菇酪氨酸酶二酚酶的抑制类型和抑制常数的测定
在酶活力测定体系中,固定酪氨酸酶的质量浓度,改变底物L-DOPA浓度,测定不同浓度底物对酶促反应速度的影响,以Lineweaver-Burk双倒数作图法来判断抑制机制类型,结果如图3所示。由图3可知:随着天山花楸黄酮提取物质量浓度的增大,直线的斜率和截距也相应增大,Km增大而vmax减小,表明效应物既影响酶对底物的亲和力也影响酶的催化作用。天山花楸黄酮提取物对酪氨酸酶的抑制类型表现为混合型,说明该提取物既能与游离酶(E)结合,也能与酶-底物配位化合物(ES)结合,但抑制作用强度不同。以双倒数直线的斜率(图3(b))和纵轴截距(图3(c))对天山花楸黄酮提取物质量浓度二次作图,均为直线,分别求出天山花楸黄酮提取物对游离酶的抑制常数(KI)为0.218 mg/mL和对酶-底物配位化合物的抑制常数(KIS)为0.313 mg/mL。KI<KIS,说明天山花楸黄酮提取物对酪氨酸酶游离酶的抑制作用较对酶-底物配位化合物的抑制作用强,底物对酶被天山花楸黄酮提取物的抑制有一定的保护作用。

图3 天山花楸黄酮提取物对酪氨酸酶二酚酶的抑制类型和抑制常数的测定Fig.3 Detemination of inhibition type and inhibition constant of flavonoid extract from Sorbus tianschanica Ruper on diphenolase of tyrosinase
2.5 天山花楸黄酮提取物的体外抗氧化活性
采用DPPH·法研究天山花楸黄酮提取物清除自由基的活性。在DPPH·活性的测定体系中,加入不同质量浓度的天山花楸黄酮提取物溶液,以不加提取物为对照,测定DPPH·的相对活性,实验结果见图4。由图4可知:导致DPPH·活性下降一半的天山花楸黄酮提取物的质量浓度(IC50)为0.18 mg/mL,同时测定了阳性对照 Vc的 IC50为0.021 mg/mL(图5),可见天山花楸黄酮提取物具有一定的清除DPPH·的能力。
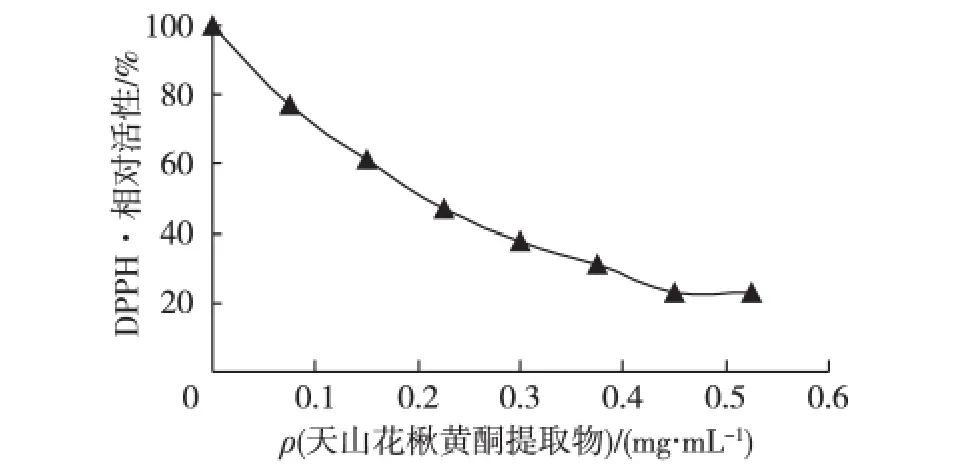
图4 天山花楸黄酮提取物的抗氧化活性Fig.4 Effect of flavonoid extract from Sorbus tianschanica Ruper on activity of antioxidation

图5 Vc的抗氧化活性Fig.5 Effect of vitamin C on activity of antioxidation
3 结论
1)以天山花楸枝条为原料,结合超声波辅助乙醇方法对天山花楸中的黄酮进行提取,将加入到体积分数为60%乙醇溶液的天山花楸枝条粉末,搅拌均匀后进行超声波处理,在超声波功率200 W,超声温度30℃,超声时间120 min的工艺条件下黄酮得率最高。
2)天山花楸黄酮提取物对蘑菇酪氨酸酶有较强的抑制活性,导致酪氨酸酶二酚酶活力下降50%所需的提取物浓度(IC50)为0.27 mg/mL。酶的抑制动力学研究表明,天山花楸黄酮提取物对酪氨酸酶二酚酶表现为混合型可逆抑制,即该提取物既通过与底物L-DOPA竞争蘑菇酪氨酸酶的活性中心来抑制酶活性,又通过反应产生酶-底物-抑制剂三元配位化合物(EIS)而产生抑制作用。DPPH·实验显示天山花楸黄酮提取物具有一定的抗氧化活性,其对酶的抑制作用机制可能与其抗氧化活性作用机制相关。
天山花楸作为新疆丰富且尚未充分利用的资源,若能妥善加以利用,研制新型的酪氨酸酶抑制剂,则能扩大资源的利用范围,具有较高的实际应用价值。
[1]陈清西,宋康康.酪氨酸酶的研究进展[J].厦门大学学报:自然科学版,2006,45(4):731-737.
[2]Osvaldo Z,Antonella B,Patrizia C,et al.Truffle-thio-flavours reversibly inhibit truffle tyrosinase [J].FEMS Microbiol Lett,2003(220):81-88.
[3]Sánchez Ferrer A,Rodríguez López J N,García Cánovas F,et al.Tyrosinase:a comprehensive review of its mechanism [J].Biochim Biophysica Acta,1995,1247(1):1-11.
[4]Martinez M V,Whitaker J R.The biochemistry and control of enzymatic browning[J].Trends Food Sci Technol,1995,6(6):195-200.
[5]陈清西,林建峰,宋康康.酪氨酸酶抑制剂的研究进展[J].厦门大学学报:自然科学版,2007,46(2):274-282.
[6]李楠,刘元,候滨滨.黄酮类化合物的功能特性[J].食品研究与开发,2005,26(6):139-141.
[7]Kubo I,Kinst Hori I,Isiguro K,et al.Flavonols from H.inuloides.tyrosinase inhibitory activity and structural criteria[J].Bioorg Med Chem,2000,8:1585-1591.
[8]Xie L P,Chen Q X,Huang H,et al.Inhibitory effects of some flavonoidson the activity ofmushroom tyrosinase[J].Biochemistry(Moscow),2003,68(4):487-491.
[9]李迪民,陈坚.天山花楸水提取液药理学研究[J].中草药,1996,26(6):302.
[10]于明,李铣.花楸属植物化学成分和药理作用及其研究进展[J].辽宁中医学院学报,2004,6(5):364-366.
[11]李容,张婧萱,廖保宁,等.超声波提取少花龙葵总黄酮及鉴别方法[J].中国处方药,2012,10(2):46-48.
[12]Chen Q X,Song K K,Wang Q,et al.Inhibitory effects of mushroom tyrosinase by some alkylbenzaldehydes[J].Enzyme Inhibition Med Chem,2003,18(6):491-496.
[13]黄璜,刘晓丹,陈清西.苯甲醛族化合物对蘑菇酪氨酸酶抑制作用的研究[J].厦门大学学报:自然科学版,2003,42(1):98-101.
[14]Khatib S,Nerya O,Musa R.Chalcones as potent tyrosinase inhibitors:the importance of a 2,4-substituted resorcinol moiety[J].Bioorg Med Chem,2005,13(2):433-441.
