来源于瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶在毕赤酵母中的表达
2015-10-24汪艳李晓陈勇武运
汪艳李晓,陈勇武运
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,乌鲁木齐 830052)
来源于瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶在毕赤酵母中的表达
汪艳1李晓1,2陈勇1武运2
(1.新疆农业大学动物科学学院,乌鲁木齐830052;2.新疆农业大学食品科学与药学学院,乌鲁木齐830052)
厌氧真菌Neocallimastix frontalis是瘤胃中降解木聚糖和纤维素的主要微生物之一,其木聚糖酶具有潜在的应用价值。对来源于Neocallimastix frontalis木聚糖酶基因Xyn11B进行密码子优化;通过全基因合成优化后的木聚糖酶基因Xyn11Bm,构建该基因的酵母表达载体pPIC9K-Xyn11Bm,并在毕赤酵母GS115中诱导表达。摇瓶水平时,重组Xyn11Bm酶活性最高为4 874.8 U/mL。在10 L发酵罐中诱导96 h后,重组Xyn11Bm的酶活性为5 139.7 U/mL,菌体湿重和干重达到216.7 g/L和117.3 g/L。酶学性质分析表明,重组Xyn11Bm的最适反应温度为50℃,最适反应pH为5.0。在pH5.0-8.0时该酶具有较好的稳定性,但温度稳定性较差。底物特异性分析表明,重组Xyn11Bm可水解燕麦木聚糖、桦木木聚糖和可溶性木聚糖4-O-Me-D-glucurono-D-xylan,但不降解地衣多糖和大麦β-葡聚糖。结果表明重组Xyn11Bm具有潜在的应用价值。
Neocallimastix frontalis;木聚糖酶;毕赤酵母;密码子优化;酶学性质
反刍动物瘤胃是一个降解植物纤维的高效厌氧发酵罐,微生物包括细菌、真菌和原虫等[1]。对瘤胃厌氧真菌的研究发现瘤胃厌氧真菌的纤维素酶和木聚糖酶活性比瘤胃纤维素分解细菌、原虫以及工业用产酶微生物木霉菌等分泌的酶活性都高,如其纤维素分解酶活性是瘤胃纤维素分解细菌产生的酶活性的5倍[2]。基因工程技术为利用瘤胃微生物基因资源提供了可能。通过构建真核和原核工程菌,一些瘤胃微生物木聚糖酶基因实现了异源表达。如厌氧真菌Neocallimastix patriciarum的木聚糖酶基因XynA在大肠杆菌中表达的水平最高为672 U/mg;经截短表达后,其中的一个克隆表达的木聚糖酶活性达到1 229 U/mg[3]。另一个来源于N. patriciarum的木聚糖酶基因Xynsk1-9在大肠杆菌中表达后,纯化的木聚糖酶比活性达到10 371.04 U/mg[4]。来源于Orpinomyces sp. PC6的Xyn1基因在毕赤酵母、链霉菌和芽孢杆菌均获得了表达,最大反应速度达到1 770 μmol/(min·mg)[5]。Neocallimastix frontalis与Neocallimastix patriciarum相似,均为单中心菌体厌氧真菌,由其产生的木聚糖酶在植物细胞壁的降解中起着重要作用[6]。Xyn11B是Neocallimastix frontalis木聚糖酶基因簇中的一员,属于糖苷水解酶第11家族成员。研究发现,糖苷水解酶第11家族中的木聚糖酶较其它家族木聚糖酶活力更高[7]。Xyn11B是否是值得开发的一种基因资源,目前还不确定。
密码子优化是提高蛋白质异源表达水平的重要途径。有关源于Neocallimastix frontalis的Xyn11B基因优化及其在毕赤酵母中的表达还未见报道。本研究以瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶基因Xyn11B为基础,在不改变氨基酸序列的情况下,根据密码子的偏爱性等对该基因进行密码子优化,构建毕赤酵母表达载体并在毕赤酵母GS115中进行诱导表达,对重组木聚糖酶的酶学性质进行研究,以期获得具有工业应用价值的重组木聚糖酶的基因工程菌。
1 材料与方法
1.1 材料
分泌型表达载体pPIC9K及其宿主菌毕赤酵母(Pichia pastoris)GS115购自Invitrogen 公司;大肠杆菌DH5α为本实验室保存。
1.2 方法
1.2.1 瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶Xyn11B基因的优化与合成 在GenBank中检索出厌氧真菌Neocallimastix frontalis木聚糖酶Xyn11B基因序列(登录号:AY131336.1),根据酵母密码子偏爱性对Xyn11B的密码子进行初步替换;为便于后续基因克隆和重组质粒线性化,采用Oligo 6.0分析替换后基因序列中的限制性内切酶切割位点,通过密码子调整,消除基因序列中的Bgl II、Sac I、Sal I、EcoR I和Not I的切割位点;为提高mRNA的稳定性和表达水平,采用BioEdit 7.0分析调整后基因序列中mRNA隐蔽剪接位点,并再次对密码子进行调整,以消除其中的隐蔽剪接位点GGTAAG、GGTGAT、AATAAA、ATTTA、PolyT和PolyA。采用RNA Structure 3.2对mRNA二级结构的自由能进行分析,筛选获得自由能最低的序列,并命名为Xyn11Bm。以JCat程序计算优化前后的相对优化度值(CAI)。将优化后的核苷酸序列送交上海生工生物工程有限公司进行全基因合成。
1.2.2 重组Xyn11Bm毕赤酵母工程菌的构建与筛选
合成的Xyn11Bm用EcoR I和Not I(大连TaKaRa公司)双酶切,并重组至经同样限制性内切酶酶切的毕赤酵母表达载体pPIC9K(美国Invitrogen 公司)上,转化大肠杆菌DH5α,经DNA测序鉴定无误的重组载体命名为pPIC9K-Xyn11Bm。用Sal I对pPIC9K-Xyn11Bm线性化,以ECM399电转化仪(美国BTX公司)电击转化毕赤酵母GS115(美国Invitrogen 公司)感受态细胞,将转化后的菌液涂布在最小葡萄糖培养基(Minimal dextrose medium,MD)平板上,于30℃培养约48 h至出现克隆子。挑选生长正常的菌落进行甲醇利用表型鉴定,对甲醇利用表型正确的克隆通过遗传霉素G418硫酸盐筛选获得含高拷贝目的基因的重组酵母工程菌。
1.2.3 重组Xyn11Bm毕赤酵母木聚糖酶活性初筛 将筛选获得的抗4 mg/mL遗传霉素G418的7个菌株分别接种于含有5 mL 缓冲复合甘油培养基(Buffered minimal glycerol-complex medium,BMGY)的50 mL试管中,29℃振荡培养24 h后离心用缓冲复合甲醇培养基(Buffered minimal methanol-complex medium,BMMY)重悬,每隔24 h加入甲醇,共培养48 h,甲醇最终浓度为0.5%。培养结束后离心收集上清,以燕麦木聚糖为底物测定酶活性。活性最高的菌株送中国微生物菌种保藏管理委员会普通微生物中心保藏。
1.2.4 重组Xyn11Bm毕赤酵母的PCR鉴定 取1 mL菌液参考唐天乐等[8]的方法提取酵母染色体DNA。以 5'AOX1(5'-GACTGGTTCCAATTGACAAGC-3')/3'AOX1(5'-GCAAATGGCATTCTGACATCC-3')为上下游引物进行PCR鉴定。PCR体系为dNTP 2.0 μL、10×PCR buffer 2.5 μL、5'AOX1 2 μL、3'AOX1 2 μL、Taq酶1.0 μL、DNA 2.0 μL、ddH2O 13.5 μL,总体积25.0 μL。PCR反应条件为:95℃预变性5 min;94℃ 45 s,65℃ 45 s,72℃ 45 s,共30个循环;72℃延伸5 min。取5 μL PCR产物用1%琼脂糖凝胶电泳检测。
1.2.5 重组Xyn11Bm酶活性的测定 采用二硝基水杨酸法测定木聚糖酶活性[9]。取适当稀释的酶液200 μL,1.0%的桦木木聚糖400 μL,于50℃反应5-10 min,立即加入1 mL二硝基水杨酸溶液,振荡混匀后于95℃水浴5 min显色。冷却后加入3.4 mL去离子水,振荡混匀后于540 nm处测定吸光度。
1.2.6 Xyn11Bm-12在摇瓶水平条件下的表达 选取在初筛时酶活性最高的重组菌Xyn11Bm-12,按照pPIC9K产品说明在250 mL三角瓶中诱导表达。分别取诱导培养前和诱导培养后12、24、36、48、60、72、84和96 h的样品进行SDS-PAGE电泳。取96 h的样品上清用平板刚果红法定性判断木聚糖酶的活性[10]。
1.2.7 Xyn11Bm-12在10 L发酵罐中的高效表达 参考杨玉霞等[11]的方法利用10 L自动发酵罐进行液体深层发酵,持续诱导144 h。每12 h取样10 mL用于测定酶活性、上清蛋白质浓度、菌体湿重和干重。
1.2.8 重组Xyn11Bm的纯化 发酵产物经离心后取6 mL上清以Vivaspin 6(美国Millipore公司)超滤浓缩至1 mL,浓缩后的上清用G-75葡聚糖凝胶(美国Bio-Rad公司)进行层析纯化,每管收集1 mL。以GeneQuant核酸蛋白检测仪(美国Anersham Biosciences公司)测定层析液OD280,根据OD280值将处于同一吸收峰的样品等量混合,并测定合并样品的酶活性。
1.2.9 重组Xyn11Bm的酶学性质
1.2.9.1 最适反应温度及热稳定性 最适反应温度的测定:取纯化酶液分别在20、30、37、40、50、60、70、80和90℃条件下测定酶活性。热稳定性的测定:取纯化酶液分别在30、37、40、50、60、70和80℃条件下保持30 min,在最适温度及pH值条件下测定其剩余酶活性。
1.2.9.2 最适反应pH值及pH值的稳定性 最适反应pH值的测定:取纯化酶液分别在pH为2.2、3、4、5、6、7、8、9、10和10.6下在最适温度条件下测定酶活性。pH值稳定性的测定:取纯化酶液分别在pH为2.2、3、4、5、6、7、8、9、10和10.6下保持30 min,在最适温度及pH值条件下测定其剩余酶活性。
1.2.9.3 底物特异性 取适量纯化后酶液,分别以大麦β-葡聚糖、地衣多糖、燕麦木聚糖、桦木木聚糖和可溶性木聚糖4-O-Me-D-glucurono-D-xylan(美国Sigma公司)为底物在最适温度及pH值条件下测定酶活性。
2 结果
2.1 瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶
Xyn11B基因的优化
优化前后序列比对如图1所示。经Jcat软件计算,优化后的核苷酸序列CAI由0.31提高到0.90,G+C含量由44.1%下降到42.2%。优化后序列与优化前序列的相似性为85.07%。与优化前序列相比,优化后序列中共对121个氨基酸残基的密码子进行了优化,有151个核苷酸被替换。利用RNA Structure 5.3软件对优化前后的最低自由能进行分析表明,优化对mRNA的最低自由能影响不大,优化前最低自由能为-286.60 KJ/mol,优化后为-277.90 KJ/mol。
2.2 重组Xyn11Bm毕赤酵母工程菌的筛选、活性
测定和PCR鉴定
通过G418硫酸的筛选,共获得抗4 mg/mL的菌株7个。酶活性(图2)显示,7个菌株都具有木聚糖酶活力,其中最高的是12号(命名为Xyn11Bm-12),为2 541 U/mL。该菌株送交中国微生物菌种保藏管理委员会普通微生物中心后获得保藏号为CGMCC No.9398。图3显示,Xyn11Bm-12工程菌在2 000 bp处出现两条DNA条带,其中分子量大的为AOX1基因的PCR产物,分子量小的为目的基因相关产物。这表明Xyn11Bm基因已插入毕赤酵母GS115染色体DNA中。

图1 瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶Xyn11B基因的原始序列和优化序列的比较
2.3 重组Xyn11Bm基因在毕赤酵母中的表达
2.3.1 Xyn11Bm-12在摇瓶水平条件下的表达 如图4所示,随着诱导时间的延长,木聚糖酶活性逐渐提高,到诱导后84 h时,酶活性达到最大值,为4 874.8 U/mL。图5显示,酵母菌GS115和转化空表达载体pPIC9K的酵母菌在培养96 h后没有产生透明圈,说明其培养上清液无木聚糖酶活性。而Xyn11Bm-12在诱导96 h后的培养上清液产生了清晰可见的透明圈,进一步表明Xyn11Bm基因在毕赤酵母GS115中获得了表达,并且具有木聚糖酶活性。SDS-PAGE分析(图6)表明,随着诱导时间的延长培养上清液中出现了一条分子量约为44.3 kD的蛋白质条带。在本试验中,该酶蛋白由339个氨基酸组成,理论分子量为37.02 kD。从SDS-PAGE电泳图谱可以看出,在毕赤酵母中表达的瘤胃厌氧真菌Neocallimastix frontalis木聚糖酶的分子量比理论分子量稍微大一些,可能是因为蛋白质糖基化的结果。
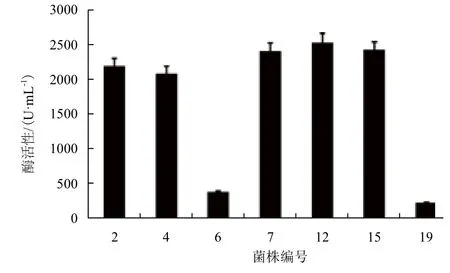
图2 7个重组Xyn11Bm酵母菌株酶活性的比较

图5 平板刚果红法鉴定重组木葡聚糖酶Xyn11Bm的活性

图6 Xyn11Bm-12培养上清的SDS-PAGE电泳图谱
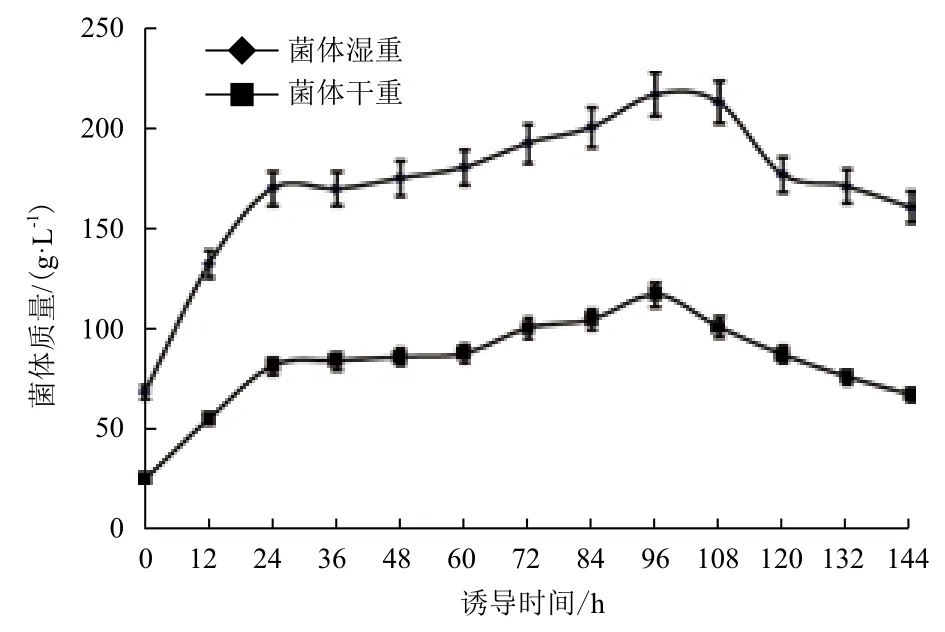
图7 Xyn11Bm-12在10 L发酵罐中菌体湿重和干重含量的变化
2.3.2 Xyn11Bm-12在10 L发酵罐中的高效表达
图7显示,随着诱导时间的延长,发酵物湿重和干重含量逐渐增加,在诱导96 h时菌体湿重和干重达到最大值,分别为216.7 g/L和117.3 g/L,之后逐渐下降。到发酵结束时,菌体湿重和干重为160.7 g/L和67.5 g/L。图8显示,木聚糖酶活性和比活性呈相似的变化规律。随着诱导时间的延长,木聚糖酶活性不断增加,在诱导第96 h时发酵液的酶活性最高为5 139.7 U/mL,之后逐渐下降。在诱导144 h结束时仅为3 577.2 U/mL。
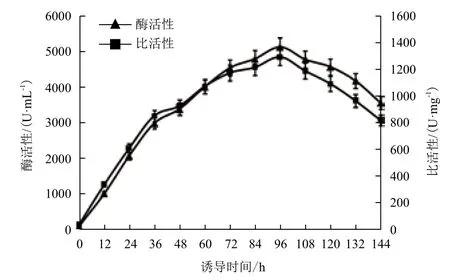
图8 Xyn11Bm-12在10 L发酵罐中酶活性的变化
2.4 重组Xyn11Bm的酶学性质
2.4.1 重组Xyn11Bm的最适温度和热稳定性 图9显示,在20-50℃之间,随着温度的升高,相对酶活性逐渐提高,超过50℃后,酶活性逐渐下降,表明该酶的最适反应温度为50℃。热稳定性试验表明,重组木聚糖酶Xyn11Bm在20-40℃左右的条件下具有较好的稳定性。但是当温度超过40℃后,酶活性迅速下降,升到70℃时已基本无活性,表明重组Xyn11Bm不耐受高温。
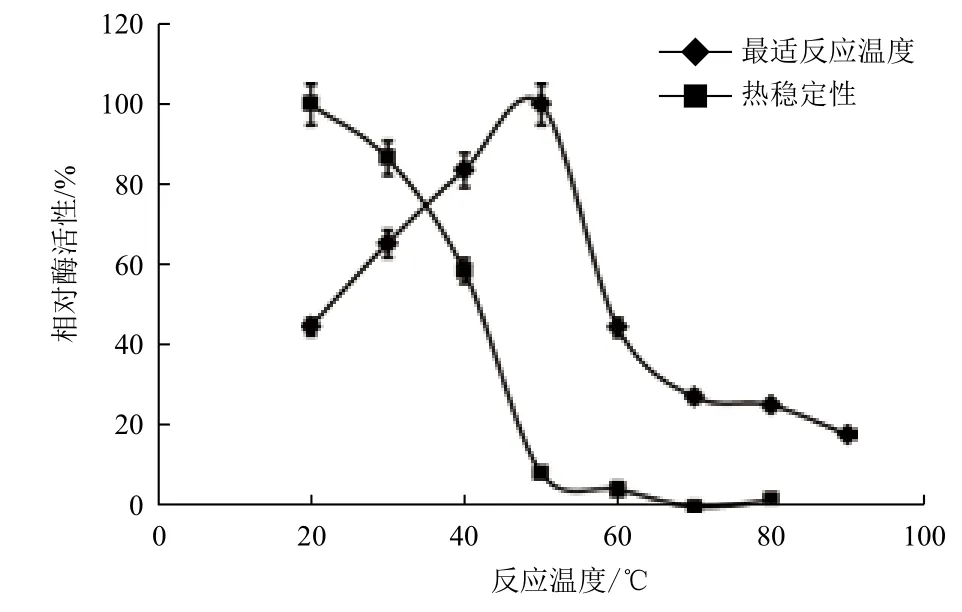
图9 重组Xyn11Bm的最适温度和热稳定性
2.4.2 重组Xyn11Bm的最适pH和pH稳定性 如图10所示,重组Xyn11Bm的最适反应pH为5.0,并且在pH6.0-10.6条件下也有较高活力,在pH10.6时相对酶活性为96.95%。Xyn11Bm酶在pH5.0-8.0的条件下具有较好的稳定性,剩余的活力在80%以上,表明重组Xyn11Bm具有一定的耐酸碱性。
2.5 重组木聚糖酶的底物特异性
图11显示,重组木聚糖酶Xyn11Bm可水解燕麦木聚糖、桦木木聚糖和可溶性木聚糖,相对活性分别为15%、100%和175%;但该酶不降解地衣多糖和大麦β-葡聚糖。
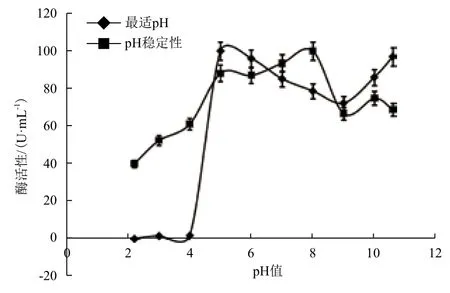
图10 重组Xyn11Bm的最适pH和pH稳定性
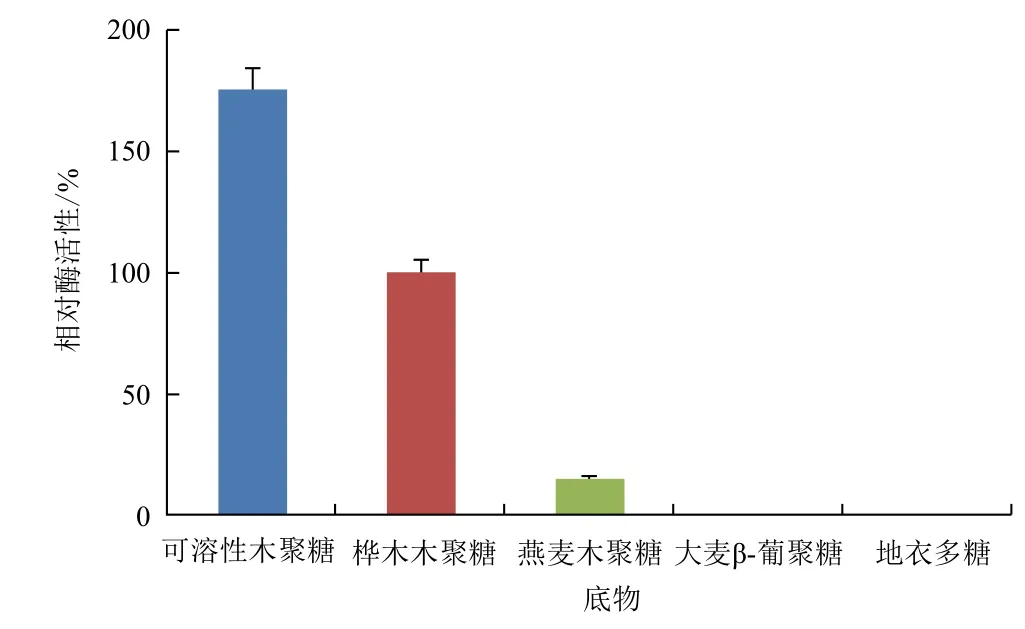
图11 重组Xyn11Bm的的底物特异性
3 讨论
木聚糖水解酶系主要包括主链上的水解酶β-D-1,4内切木聚糖酶(EC 3.2.1.8,简称木聚糖酶)、β-D-1,4外切木糖苷酶和侧链上的水解酶α-L-阿拉伯呋喃糖苷酶、α-葡萄糖醛酸酶以及乙酰木聚糖酯酶等。在这些酶中,β-D-1,4内切木聚糖酶对木聚糖降解起主要作用[12]。厌氧真菌Neocallimastix frontalis是瘤胃中降解木聚糖和纤维素的主要微生物之一,研究者先后从中分离获得了Xyn11A、Xyn11B、Xynsk等多个木聚糖酶基因并在大肠杆菌中获得表达,并且Xyn11B的比酶活性最高,达到3 794 U/mg[13]。虽然大肠杆菌表达系统由于其培养成本廉价以及操作过程简单,常被作为外源基因表达的首选。但是,木聚糖酶在大肠杆菌中表达后往往表达水平较低甚至没有活性。这主要是因为稀有密码子的存在和翻译后需后续进一步加工的缘故,如形成二硫键和糖基化。木聚糖酶通常需要N-糖基化,而大肠杆菌对表达的外源蛋白只具有O-糖基化作用[5]。与大肠杆菌相比,酵母表达系统更具优势:具有翻译后的修饰、可高密度发酵、将外源蛋白分泌到培养基便于纯化、不含大肠杆菌毒素更易于在食品中应用等[14]。因此,本研究首选利用毕赤酵母GS115表达Xyn11B基因。
提高外源基因在宿主中的表达的途径之一是对外源基因的密码子进行优化。当外源基因中含有稀有密码子时将严重制约其在宿主中的表达[15]。在对外源基因密码子优化时,主要应考虑稀有密码子的替换、消除AT富集区和G+C含量的调整。除此以外,本研究还考虑了mRNA隐蔽剪接位点和自由能。通过对外源基因密码子优化后,大量外源基因在毕赤酵母中得到了高水平表达。如纤维素酶基因优化后酶活性提高1.24倍[15],外切葡聚糖酶基因优化后表达水平提高了25%[11]。Tsai等[16]利用酿酒酵母和毕赤酵母分别表达了源于瘤胃厌氧真菌Neocallimastix frontalis的一个木聚糖酶基因,在诱导10 d后木聚糖酶活性分别达到5 400 U/mL和6 200 U/mL。在本试验中,优化后的Xyn11Bm基因在毕赤酵母中诱导表达96 h时酶活性最高达到5 139.7 U/mL。这说明,该基因工程菌具有一定的应用价值。
培养基是影响酵母生长的重要因素之一。在利用毕赤酵母GS115进行高密度发酵时,Invitrogen推荐基础盐培养基(Basal salts medium,BSM)和PMT1微量元素溶液搭配使用[17]。但近期的研究发现,毕赤酵母在BSM中生长时延滞期较长,因此宿主菌要达到对数生长期所需的时间也较长[18]。毕赤酵母在高密度发酵时菌体干重一般在75-100 g/L[19]。菌体湿重和干重是反映高密度发酵的重要指标,提高受体酵母菌的生长速度有利于外源基因的表达。本研究采用了FM22/PMT4培养基,在诱导培养96 h时发酵液中菌体湿重和干重分别达到了274.6 g/L和123.6 g/L。本研究结果表明,FM22/PMT4培养基更有利于毕赤酵母的生长,因此,可能也更有利外源基因的表达。
范志恒[20]报道,以不同底物评价黑曲霉木聚糖酶活性时,以小麦木聚糖为底物时的酶活最高,其次是燕麦木聚糖,再次是山毛榉木聚糖,以桦木木聚糖为底物时的酶活最低。本研究中表达的重组木聚糖酶可以水解燕麦木聚糖、桦木木聚糖和可溶性木聚糖,并且酶活性有较大差别。燕麦木聚糖属于水不溶性木聚糖,桦木木聚糖属于部分水不溶性木聚糖,木聚糖酶通过内切方式作用于木聚糖主链内部的β-1,4木糖苷键,降低木聚糖的聚合度[21]。溶解率大的聚糖,其结构支链多或聚合度小,因此更易于分解。此外,不同来源的木聚糖在分子结构,尤其在侧链构成上存在差异,并影响木聚糖酶的结合与水解[22]。这可能是导致不同底物表现出不同酶活性的原因之一。
4 结论
本研究实现了Neocallimastix frontalis木聚糖酶基因Xyn11Bm在毕赤酵母中的高密度发酵,最高酶活性为5 139.7 U/mL,最适反应温度为50℃,最适反应pH为5.0。该酶在pH5.0-8.0之间具有较好的稳定性,可水解燕麦木聚糖、桦木木聚糖和可溶性木聚糖,但不降解地衣多糖和大麦β-葡聚糖。
[1] 冯仰廉. 反刍动物营养学[M]. 北京:科学出版社, 2004:1-144.
[2] Lee SS, Shin KJ, Kim WY, et al. The rumen ecosystem:as a fountain source of novel enzymes—Review[J]. Asian-Australasian Journal of Animal Sciences, 1999, 12(6):988-1001.
[3] Xue GP. Recombinant xylanase:WO, 93/25671[P]. 1993.
[4] Hseu RS, Huang YH. Recombinant xylanases derived from anaerobic fungi, and the relevant sequences, expression vectors and hosts:US,7226772[P]. 2007.
[5] Juturu V, Wu JC. Microbial xylanases:Engineering, production and industrial applications[J]. Biotechnology Advances, 2012, 30(6):1219-1227.
[6] 裴彩霞. 反刍动物瘤胃微生物及其利用[M]. 北京:中国农业科学技术出版社, 2012:1-169.
[7] 王国增. 不同环境中木聚糖酶基因多样性分析及宏基因组来源的新基因克隆与表达[D]. 北京:中国农业科学院, 2011.
[8] 唐天乐, 高炳淼, 长孙东亭, 等. 高质量毕赤酵母基因组DNA提取方法比较[J]. 生物技术通报, 2010(1):196-199.
[9] 陆文清, 何丽花, 曹云鹤. 饲料用木聚糖酶活力测定的研究[J].饲料工业, 2009, 30(4):16-20.
[10] Zhao S, Huang J, Zhang C, et al. High-level expression of an aspergillus niger endo-β-1, 4-glucanase in pichia pastoris through gene codon optimization and synthesis[J]. Journal of Microbiology and Biotechnology, 2010, G20(3):467-473.
[11] 杨玉霞, 张慧玲, 汪艳, 等. 产琥珀酸丝状杆菌1, 3-1, 4-β-葡聚糖酶基因在毕赤酵母中的表达[J]. 南京农业大学学报,2014, 37(4):123-130.
[12] 范志恒, 李鹂. 体外模拟消化研究不同来源木聚糖酶对麸皮降解的影响[J]. 饲料广角, 2011(2):33-34.
[13] Ahmed S, Riaz S, Jamil A. Molecular cloning of fungal xylanases:an overview[J]. Applied Microbiology and Biotechnology, 2009,84(1):19-35.
[14] Zepeda AB, Figueroa CA, Abdalla DS, et al. Biomarkers to evaluate the effects of temperature and methanol on recombinant Pichia pastoris[J]. Brazilian Journal of Microbiology, 2014, 45(2):475-483.
[15] Akcapinar GB, Gul O, Sezerman U. Effect of codon optimization on the expression of Trichoderma reesei endoglucanase 1 in Pichia pastoris[J]. Biotechnology Progress, 2011, 27(5):1257-1263.
[16] Tsai CT. Huang C. Overexpression of the Neocallimastix frontalis xylanase gene in the methylotrophic yeasts Pichia pastoris and Pichia methanolica[J]. Enzyme and Microbial Technology,2008, 42(6):459-465.
[17] Invitrogen. Pichia Expression Kit. For expression of recombinant proteins in Pichia pastoris(Revision A. 0)[M]. 2014:1-100.
[18] Charoenrat T, Khumruaengsri N, Promdonkoy P, et al. Improvement of recombinant endoglucanase produced in Pichia pastoris KM71 through the use of synthetic medium for inoculum and pH control of proteolysis[J]. Journal of Bioscience and Bioengineering, 2014,16(2):193-198.
[19] Higgins DR, Cregg JM. Pichia protocols[M]. Humana Press:In Methods in Molecular Biology, 1998, 103:1-264.
[20] 范志恒. 不同底物及NaOH的添加对木聚糖酶酶活测定的影响[J]. 饲料广角, 2011, 11:36-37.
[21] 江华, 薄开静. 燕麦木聚糖选择性吸附分离内切木聚糖酶[J].林产化学与工业, 2008, 28(4):49-54.
[22] Bastawde KB. Xylan structure, microbial xylanases, and their mode of action[J]. World Journal of Microbiology and Biotechnology,1992, 8(4):353-368.
(责任编辑 马鑫)
Expression of a Xylanase Gene Originated from Rumen Anaerobic Fungi Neocallimastix frontalis in Pichia pastoris
Wang Yan1Li Xiao1,2Chen Yong1Wu Yun2
(1. College of Animal Science,Xinjiang Agricultural University,Urumqi830052;2. College of Food Science and Pharmacy,Xinjiang Agricultural University,Urumqi830052)
The anaerobic fungus Neocallimastix frontalis is one of main microorganisms in the rumen degrading xylan and cellulose and its xylanase has the potential application value. In this study, a xylanase gene Xyn11B originated from N. frontalis was codon optimized, and the optimized gene Xyn11Bm was synthesized. Based on the gene engineering technology, the yeast expression vector pPIC9K-Xyn11Bm was constructed, and the xylanase was induced and expressed in Pichia pastoris GS115. In shake flask level, enzyme activity of the recombinant Xyn11Bm reached the maximum up to 4874.8 U/mL. In 10 L fermentor, at 96 h after induction, the activity of recombinant enzyme was 5139.7 U/mL, cell wet weight and dry weight were 216.7 g/L and 117.3 g/L. Enzymatic properties analysis showed that the optimum reaction temperature and pH of Xyn11Bm were 50℃ and 5.0. In pH5.0-8.0, the enzyme had sound stability, but poor temperature stability. Substrate specificity analysis showed that recombinant Xyn11Bm could hydrolyze oat spelt xylan, birch xylan and soluble xylan 4-O-Me-D-glucurono-D-xylan, but not degrade lichenin and barley β-glucan. This indicated that the recombinant Xyn11Bm had potential application value.
Neocallimastix frontalis;xylanase;Pichia pastoris;codon optimization;enzymatic properties
10.13560/j.cnki.biotech.bull.1985.2015.05.029
2014-09-01
新疆维吾尔自治区高技术研究发展项目(201211104),新疆研究生科研创新项目(XJGRI2013112)
汪艳,女,硕士研究生,研究方向:酶的基因工程;E-mail:312577269@qq.com;李晓为共同第一作者
陈勇,男,教授,研究方向:饲用酶制剂;E-mail:xjaucy@hotmail.com
