家蝇抗真菌肽-溶菌酶基因的克隆、表达及序列分析
2015-10-24彭传林魏川川吴建伟王宇3修江帆尚小丽赵学军
彭传林魏川川吴建伟王宇,3修江帆尚小丽赵学军
(1.贵阳医学院寄生虫学教研室,贵阳 550004;2.皖北煤电集团总医院,宿州 234000;3.贵州省疾病预防控制中心,贵阳 550004)
家蝇抗真菌肽-溶菌酶基因的克隆、表达及序列分析
彭传林1,2魏川川1吴建伟1王宇1,3修江帆1尚小丽1赵学军1
(1.贵阳医学院寄生虫学教研室,贵阳550004;2.皖北煤电集团总医院,宿州234000;3.贵州省疾病预防控制中心,贵阳550004)
旨在对家蝇抗真菌肽MAF-1-溶菌酶(LZM)基因进行生物信息学分析,并进行融合基因MAF-1-LMZ的克隆和表达分析。从GenBank获得家蝇抗真菌肽MAF-1和溶菌酶LZM的编码序列,分析和预测这两种蛋白质的结构和功能。PCR扩增融合蛋白质抗真菌肽-溶菌酶的基因 MAF-1-LMZ,将其克隆到原核表达载体pET-28a中,重组质粒pET-28a-MAF-1-LMZ在大肠杆菌OrigmiB/DE3中经用IPTG诱导表达,表达产物MAF-1-LMZ通过SDS-PAGE电泳进行鉴定,采用小试管法倍比稀释法进行活性验证。结果显示,融合蛋白质MAF-1-LMZ序列的ORF为969 bp,编码322个氨基酸残基,理论分子量为35 468.6 Da,等电点为8.31,在大肠杆菌OrigmiB/DE3中得到成功表达。其纯化后的目的蛋白具有抗真菌活性。
家蝇;抗真菌肽-溶菌酶;重组表达;序列分析
深部真菌感染日益成为导致肿瘤放化疗、器官移植及艾滋病等免疫力低下病人死亡的主要原因[1],严重威胁着人类的健康[2,3]。抗真菌药物较为有限,其本身具有毒副作用并且耐药现象日益增加。寻求和研发安全有效的抗真菌药至关重要。本课题组前期研究中,家蝇抗真菌肽MAF-1(Musca domestica antifungalpeptide-1)在体外被验证具有抗真菌活性,可能是一种全新的以α螺旋为主的线性昆虫抗真菌肽[4]。家蝇溶菌酶(lysozyme,LZM)是一类非特异性免疫因子,在机体的先天免疫中发挥重要作用,可破坏菌体胞壁、导致细菌死亡,而对人体无毒副作用[5]。为了寻求新型的抗菌蛋白质或抗真菌-抗细菌融合蛋白质,近年来国内外先后报道了有关抗菌肽类基因以及与其它相关基因融合的克隆和表达[6-10],Lu等[11]报道了家蝇天蚕素与人溶菌酶融合表达。但目前将家蝇的抗真菌肽MAF-1与抗细菌的溶菌酶LZM进行融合表达未见报道。将二者构建成融合蛋白质,使其具有真菌肽和溶菌酶的活性,降低细菌的耐受性,对家蝇抗真菌肽和家蝇溶菌酶作为新药研发具有重要意义。本研究利用酶切、连接重组家蝇抗真菌肽MAF-1与家蝇溶菌酶LZM的基因,对其编码的重组蛋白质MAF-1-LMZ结构特征进行预测分析和克隆表达,旨在为进一步研究该重组融合基因的功能奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 家蝇,由贵阳医学院寄生虫教研室常规饲养;载体pET-28a、大肠杆菌菌株DH5α、OrigmiB/DE3由贵阳医学院寄生虫教研室常规保存。
1.1.2 主要试剂及设备 限制性内切酶EcoR I、Hind III及Xho I、T4连接酶、rTaq酶、DNA Marker、Protein Marker、PCR产物胶回收试剂盒、DNA产物纯化试剂盒、质粒小量提取试剂盒均购于大连宝生物科技公司;其他试剂均为国产分析纯。PCR扩增仪(德国Eppendorf公司);稳压稳流电泳仪(美国GE公司);紫外分光光度计(美国GE公司);Millipore 0.22 μm/0.45 μm滤器(美国Merck Millipore公司);Milli-Q超纯水仪(法国Mill-ipore Pharmacia公司)。
1.1.3 引物合成和DNA测序 基因扩增引物和重组质粒DNA测序由上海生物工程有限公司完成。
1.2 方法
1.2.1 MAF-1、LMZ基因的识别 利用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI,http://www.ncbi.nlm.nih.gov/)网站的ORF Finder(开放阅读框探寻器)确定其完整编码序列和编码的氨基酸序列。利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis Systerm,ExPASy,http://ca.expasy.org/)Proteomics Server(http://ca.expasy.org/)所提供的蛋白质在线分析工具,如protparam(http://au.expasy. org/tools/protparam.html)预测氨基酸序列的分子量、等电点、稳定性指数等理化性质;InterPro Scan(http://www.ebi.ac.uk/InterProScan/)预测氨基酸序列中的功能域;Sec(https://www.predictprotein. org/upgrade/Sec/)预测氨基酸序列中的拓扑结构。
1.2.2 MAF-1-LMZ融合基因的扩增 利用prmer5.0软件,根据GenBank获得家蝇抗真菌肽(登录号:HM178948)和家蝇溶菌酶(登录号:XP_0051784-89.1)基因序列和pET-28a多克隆位点设计特异性引物。引物为:MAF-1 F:5'-GGAATTCGAATCTGCCCCCGCCCCTGAGGT-3',MAF-1 R :5'-CCCAAGCTTGGCATGGGGCTTCATTTCCTTGGC-3',下划线为EcoR I 和Hind III限制性酶切位点;LMZ F:5'-GCCAAG CTTATGTACAACATTTCTGGTT-3',LMZ R:5'-CGGC TCGAGTCAAAAACAATCATCAACACT-3',下划线为Hind III和Xho I限制性酶切位点。
从家蝇3龄幼虫提取RNA,逆转录cDNA为模板分别进行PCR扩增。MAF-1 PCR条件:94℃预变性5 min;94℃ 30 s,63℃ 30 s,72℃ 30 s,共30个循环;72℃延伸10 min。LMZ PCR条件:94℃预变性5 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,共30个循环;72℃延伸10 min。扩增产物用2%琼脂糖凝胶电泳回收。
1.2.3 重组原核表达质粒的构建及鉴定 将回收的目的基因MAF-1、LMZ及表达载体pET-28a分别用限制性内切酶EcoR I 和Hind III;Hind III和Xho I;EcoR I和Xho I进行双酶切。并将目的基因酶切产物按一定比例与表达载体pET-28a酶切产物连接过夜,转化大肠杆菌OrigmiB/DE3感受态细胞,卡那霉素筛选阳性克隆。对阳性克隆提取质粒进行PCR、双酶切和测序鉴定。
1.2.4 MAF-1-LMZ在大肠杆菌Origmi/DE3中的诱导表达 取50 μL培养过夜的阳性克隆菌液,加入含卡那霉素的5 mL LB培养基中(菌液/培养基为1/100),37℃,250 r/min振摇至OD600为0.6时,加入IPTG至终浓度0.25 mmol/L诱导表达16 h。离心收集菌体,在沉淀中加入80 mL 1×SDS-PAGE上样缓冲液,煮沸8-10 min,12 000 r/min离心取上清10 μL进行15% SDS-PAGE分析。
1.2.5 重组蛋白的大量诱导、纯化 按照上述方法对阳性克隆进行大量诱导表达,离心收集菌体,按每克菌体加入3 mL细菌细胞壁裂解液重悬菌体,反复冻融后冰上超声裂解(功率150 W,持续1 s,停3 s,共180 s),4℃,12 000 r/min,离心20 min后收集上清,分别取上清和沉淀样品处理后进行SDSPAGE判断该重组蛋白的可溶性。收集上清,用0.45 μL滤膜过滤,参照镍离子金属螯合剂亲和层析柱说明书进行蛋白纯化,收集蛋白洗脱液,再将洗脱的目的蛋白在PBS透析液(pH7.4)中4℃透析24 h。并根据说明书,用Bradford法对经过以上步骤获得的重组蛋白进行蛋白定量,于-80℃保存备用。
1.2.6 重组蛋白质MAF-1-LMZ抗真菌活性检测 将白色念珠菌Candida albicans ATCC10231制备成新鲜的菌悬液每毫升含1×107个菌细胞。在无菌的96孔细胞培养板中进行,分别于每孔中加入50 μL灭菌双蒸水后,向第一孔加入50 μL纯化后的重组蛋白质,混匀后从第一孔中吸取上述混合液50 μL加入到第二孔,以此类推做倍比稀释,再向每孔中加入菌悬液50 μL,设置无菌蒸馏水为阴性对照,氟康唑为阳性对照,充分混匀后于30℃培养24 h,取培养物接种至培养基中30℃培养24 h后,观察有无菌落生长并对菌落计数。
2 结果
2.1 MAF-1-LMZ基因序列及蛋白质理化性质预测

图1 MAF-1-LMZ序列及其ORF编码的氨基酸序列
MAF-1基因编码序列包含一个完整的开放阅读框(ORF)为537 bp,编码178个氨基酸;LMZ基因编码序列包含一个完整的ORF为435 bp,编码145个氨基酸。融合基因MAF-1-LMZ编码序列包含的ORF为969 bp,编码322个氨基酸(图1)。ExPASy中ProtParam预测MDLMZ的理论分子量为35 468.6 Da,等电点为8.31。280 nm处的摩尔消光系数为39 460 M-1cm-1,0.1%浓度的ABS为1.098。若其成熟肽N-末端为蛋氨酸时,预测在哺乳动物网状细胞体外表达的半衰期为30 h,在酵母和大肠杆菌中表达的半衰期分别>20和10 h。预测MAF-1-LMZ在溶液中不稳定指数为32.29,低于阈值40,其性质稳定;MAF-1-LMZ的疏水指数为85.22,疏水性较高。
2.2 MAF-1-LMZ亚细胞定位分析ExPASy中TargetP预测
MAF-1-LMZ有信号序列,在第18和19个氨基酸之间有断裂点,提示MAF-1-LMZ在细胞外分泌,未发现线粒体、过氧化酶体、溶酶体和细胞核等亚细胞定位序列。
2.3 InterPro Scan分析MAF-1-LMZ蛋白质结构域
结果显示,家蝇抗真菌肽MAF-1-溶菌酶(LZM)融合蛋白中分别含有抗真菌肽MAF-1的结构域(1-178 aa),功能结构域(128-153 aa),是一全新的昆虫抗真菌肽;溶菌酶(LZM)功能域(182-322 aa),活性位点位于232-250 aa,属于溶菌酶超家族。
2.4 蛋白质拓扑结构分析Sec预测
α螺旋(H)和无规卷曲(L)比例是37.67∶53.99,β折叠(E)和无规卷曲(L)比例是8.34∶53.99,二级结构以α螺旋(H)为主。预测每个氨基酸的溶剂可及性(solvent accessibility,Acc),超过16%的表面暴露的定义为暴露氨基酸(e),其余氨基酸为包埋氨基酸(b)。从分析结果来看,一部分氨基酸残基(39.63%)包埋在蛋白质内部,一部分氨基酸残基(44.91%)暴露在溶液界面。
2.5 pET28a-MAF-1-LMZ质粒构建及鉴定
特异性引物分别扩增目的基因MAF-1、LMZ,2%琼脂糖凝胶电泳后切胶回收目的基因,获得约534 bp的MAF-1和435 bp的LMZ两个片段。将重组质粒pET28a-MAF-1-LMZ进行PCR和双酶切后约在1 000 bp有一清晰的条带,与目的基因(969 bp)的大小基本相符(图2),测序结果证实重组质粒中插入序列正确,表明重组质粒构建成功。
2.6 蛋白表达纯化结果
将构建好的重组质粒pET28a-MAF-1-LMZ转化到 E.coli OrigmiB/DE3中经IPTG诱导表达,15% SDS-PAGE分析结果(图3第 5、6 泳道)显示,约在 35 kD左右处出现目的表达条带。将蛋白进行纯化,结果如图 4第7泳道所示,证明目的蛋白纯化成功。Bradford 法测得该蛋白浓度为0.37 mg/mL。
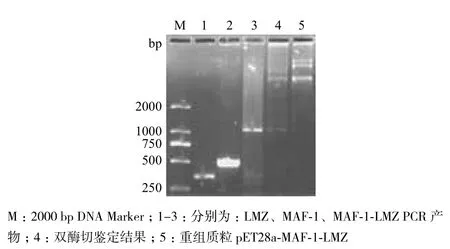
图2 重组质粒PCR及双酶切鉴定

图3 SDS-PAGE分析pET28a-MAF-1-LMZ表达纯化效果
2.7 重组蛋白质MAF-1-LMZ抗真菌活性
以白色念珠菌(ATCC10231)为指示菌,采用Quantity One克隆菌落计数法检测重组蛋白质MAF-1-LMZ的抗真菌活性。结果(表1,图4)显示,100 μg/mL的重组蛋白质MAF-1-LMZ具有明显的抗真菌活性。

表1 重组蛋白质MAF-1-LMZ的抗真菌效果
3 讨论
抗真菌制剂的活性及选择性是由其与真菌相互作用的方式决定的。白色念珠菌是临床常见致病菌,白色念珠菌细胞壁结构复杂,细胞壁厚约25 μm,约占细胞干重的25%,是一种坚韧的结构。其化学组分较特殊,主要由内层的葡聚糖、中间的蛋白质分子及外层的甘露聚糖组成。细胞壁上还含有少量类脂和几丁质。葡聚糖是白色念珠菌细胞壁含量最高的多糖。大量葡聚糖分子聚集,形成了念珠菌细胞壁的纤维网络结构[12-14]。溶菌酶主要是通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使菌体细胞壁出现缺口或被溶解,导致内容物外流,从而达到抑制菌体生长或杀灭菌体的作用。抗真菌肽MAF-1吸附在白色念珠菌细胞表面,通过在真菌细胞质膜上形成通道后,进入细胞逐步在细胞内聚集。抑制真菌生物膜的形成,破坏菌体细胞膜的完整性,导致细胞内容物外泄、细胞核碎裂,细胞器结构紊乱[15,16]。另有研究表明,溶菌酶与抗真菌肽具有协同作用,可能是抗真菌肽破坏细菌外膜后利于溶菌酶作用于其细胞壁[17,18]。临床上联合应用抗菌药物治疗真菌感染已成共识,其理论基础是联合不同药物在体内的协同作用,增强杀菌作用,减少单药在体内作用的剂量依赖性,减少药物的毒副作用。本研究在联合用药的理论基础上,通过基因重组表达,将MAF-1、LMZ构建成融合蛋白,利用融合蛋白协同作用,更好地发挥其生物学活性。

图4 重组蛋白质MAF-1-LMZ抗真菌活性检测
将目的蛋白在核酸水平上连接,一种连接方法是根据表达载体上的酶切位点在目的基因两端分别引入限制性酶切位点,两端各有限制性酶切位点供目的基因插入连接。另一种连接方法是通过PCR合成,采用低疏水性及低电荷效应的氨基酸组成的多肽接头序列直接包含在重组目的基因当中,称为Gene SOEing[19,20]。本研究采用前者,将限制性酶切位点分别设计在待扩增的引物中,分别扩增获得目的基因,将待融合的两个扩增产物用限制性酶酶切后连接起来。此方法简便易行,因不需要在基因序列上引入氨基酸组成的多肽接头序列,从而减少了蛋白酶的攻击[21-24]。
本研究根据GenBank中家蝇抗真菌肽与溶菌酶基因分别设计特异性引物,以家蝇3日龄幼虫提取总RNA后逆转录cDNA为模板,分别成功扩增出目的基因,测序结果证实与 GenBank获得家蝇抗真菌肽(登录号:HM178948)和家蝇溶菌酶(登录号:XP_005178489.1)序列相符,通过生物信息学分析显示该基因序列的ORF为969 bp,编码322个氨基酸,理论分子量为35 468.6 Da,等电点为8.31。所构建的重组质粒经PCR、双酶切及测序鉴定成功。SDS-PAGE结果表明家蝇抗真菌肽-溶菌酶在大肠杆菌OrigmiB/DE3中成功表达。重组质粒在大肠杆菌OrigmiB/DE3中经IPTG诱导表达,并成功纯化目的蛋白,15% SDS-PAGE分析显示纯化蛋白与目的蛋白分子量大小相符。抗真菌活性检测结果显示,重组融合蛋白质MAF-1-LMZ,其浓度在100 μg/mL时具有明显的抗真菌活性。说明重组融合蛋白质在诱导表达过程中没有降解失活,并证实融合蛋白质具有抗真菌活性,此研究结果与刘文丽等[25]报道蛋白质保守结构域与抗菌活性相关,以及胡国强等揭示了构-效相关是一致的[26]。这为进一步研究新型抗菌融合蛋白MAF-1-LMZ的生物学活性及产业化开发奠定了基础。
4 结论
本研究成功构建pET-28a-MAF-1-LMZ重组原核表达载体并表达出融合MAF-1-LMZ蛋白,对纯化条件进行了初探,获得了纯度较高的目的蛋白。实验显示重组融合蛋白MAF-1-LMZ具有抗真菌活性。
[1] 张圣岸, 王盛标, 黄强, 等. ICR深部真菌感染的现状和对策[J]. 中国医药导报, 2008, 5(3):98-100.
[2] Miceli MH, Diaz JA, Lee SA. Emerging opportunistic yeast infections[J]. The Lancet Infect Dis, 2011, 11(2):142-151.
[3] Guery BP, Arendrup MC, Auzinger G, et al. Management of invasive candidiasis and candidemia in adult non-neutropenic intensive care unit patients:PartⅠ. Epidemiology and Diagnosis[J]. IntensiveCare Med, 2009, 35(1):55-62.
[4] Fu P, Wu JW, Guo G. Purification and molecular identification of an antifungal peptide from the hemolymph of Musca domestica(housefly)[J]. Cell Mol Immunol, 2009, 6(4):245-251.
[5]Masschalck B, Michiels CW. Antimicrobial properties of lysozyme in relation to foodborne vegetative bacteria[J]. Critical Reviews in Microbiology, 2003, 29:191-214.
[6]Arcidiacono S, Soares JW, Meehan AM, et al. Membrane permeability and antimicrobial kinetics ofcecropin P1 against Escherichia coli[J]. J Pept Sci, 2009, 15:398-403.
[7] Jin FL, Xu XX, Zhang WQ, et al. Expression and characterization of a housefly cecropin gene in the methylotrophic yeast, Pichia pastoris[J]. Protein Expr Purif, 2006, 49(1):39-46.
[8] Xu XX, Jin FL, Yu XQ, et al. Expression and purification of a recombinant antibacterial peptide, cecropin, from Escherichia coli[J]. Protein Expr Purif, 2007, 53(2):293-301.
[9] Zheng XL, Wang W. High-level expression of housefly cecropin A in Escherichia coli using a fusion protein[J]. Asian Pacific Journal of Tropical Medicine, 2010, 3(6):421-426.
[10] Liang YL, Wang JX, Zhao XF, et al. Molecular cloning and characterization of cecropin from the housefly(Musca domestica),and its expression in Escherichia coli[J]. Dev Comp Immunol,2006, 30(3):249-257.
[11] Lu X, Jin X, Zhu J, et al. Expression of the antimicrobial peptide cecropin fused with human lysozyme in Escherichia coli[J]. Appl Microbiol Biotechnol, 2010, 87(6):2169-2176.
[12] Brand A, Lee K, Veses V, Gow NA. Calcium homeostasis is required for contact-dependent helical and sinusoidal tip growth in Candida albicans hyphae[J]. Mol Microbiol, 2009, 71(5):1155-1164.
[13] Li HL, Liu JG, Huang XT, et al. Characterization, expression and function analysis of DAX1 gene of scallop(Chlamys farreri Jones and Preston 1904)during its gametogenesis[J]. Journal of Ocean University of China, 2014, 13(4):696-704.
[14]Gao L, Sun R, Liang Y, et al. Cloning and functional expression of a cDNA encoding stearoyl-ACP Delta9-desaturase from the endosperm of coconut(Cocos nucifera L. )[J]. Gene, 2014, 549(1):70-76.
[15]Wang K, Yan J, Dang W, et al. Dual Antifungal properties of cationic antimicrobial peptides polybia-MPI:Membrane Integrity disruption and inhibition of biofilm formation[J]. Peptides, 2014, 56:22-29.
[16]Ferre R, Melo MN, Correia AD, et al. Synergistic effects of the membrane actions of cecropin-melittin antimicrobial hybrid peptide BP100[J]. Biophys J, 2009, 96:1815-1827.
[17] Calle Waert L, Michiels CW. Lysozymes in the animal kingdom[J]. Oiosci, 2010, 35:127-160.
[18]Schmitt P, Mercado L, Diaz M, et al. Characterization and functional recovery of a novel antimicrobial peptide(CECdir-CECret)from inclusion bodies after expression in Esherichia coli[J]. Peptides,2008, 29:512-519.
[19]Xu Z, Zhong Z, Huang L, et al. High-level production of bioactive human beta-defensin-4 in Escherichia coli by soluble fusion expression[J]. Appl Microbiol Biotechnol, 2006, 72:471-479.
[20] Hsu SY, Lin YS, Li SJ, et al. Co-expression of a heat shock transcription factor to improve conformational quality of recombinant protein in Escherichia coli[J]. Journal of bioscience and bioengineering, 2014, 118(3):242-248.
[21] Traxlmayr MW, Obinger C. Directed evolution of proteins for incre-ased stability and expression using yeast display[J]. Arch Biochem Biophys, 2014, 526(2):174-180.
[22] Sakamoto S, Taura F, PutalunW, et al. Construction and expression of specificity-improved single-chain variable fragments against the bioactive naphthoquinone, plumbagin[J]. Biol Pharm Bull,2009, 32:434-439.
[23] Xu Y, Liu J, Liang L, et al. Molecular cloning and characterization of three cDNAs encoding 1-deoxy-d-xylulose-5-phosphate synthase in Aquilaria sinensis(Lour. )Gilg[J]. Plant physiology and biochemistry, 2014, 82:133-141.
[24] Zhang R, Xu Y, Xiao R, et al. Optimized expression of(S)-carbonyl reductase in Pichia pastoris for efficient production of(S)-1-phenyl-1, 2-ethanediol[J]. Journal of Basic Microbiology, 2014,54(8):873-879.
[25]刘文丽, 张兰威, Josh shi, 等. Ⅱa 类乳酸菌细菌素构效关系的研究进展[J]. 食品工业科技, 2013, 34(21):369-372.
[26]胡国强, 张忠泉, 王海燕, 等. 氟喹诺酮C3稠杂环体系的合成及抗肿瘤活性(III):恩诺沙星均三唑并噻二嗪酮衍生物[J].化学学报, 2009, 67(21):2592-2596.
(责任编辑 马鑫)
Cloning,Expression and Sequence Analysis of Musca domestica Antifungal Peptide-1 and Musca domestica Lysozyme
Peng Chuanlin1,2Wei Chuanchuan1Wu Jianwei1Wang Yu1,3Xiu Jiangfan1Shang Xiaoli1Zhao Xuejun1
(1. Department of Parasitology,Guiyang Medical College,Guiyang550004;2. General Surgery of Wanbei Coal-electricity Group General Hospital,Suzhou234000;3. Guizhou Center for Disease Control and Prevention,Guiyang550004)
The aim of this study is to have bioinformatics analysis of Musca domesitca antifungal peptide-1(MAF-1)and lysozymeb(LMZ), also clone fused MAF-1-LMZ gene and have expression analysis of it. The encoding sequences of MAF-1 and LMZ were fetched from GenBank, and the structures and functions of 2 proteins were analyzed and predicted. The gene MAF-1-LMZ was amplified by polymerase chain reaction(PCR), then was ligated into pET 28a and transformed into E. coli Origmi(DE3)competent cell, and induced with IPTG. The fusion protein MAF-1-LMZ in the expression vector was analyzed by SDS-PAGE. The activity of the protein was validated by methods of small test tube and doubling dilution. The open reading frame of the MAF-1-LMZ was 969 bp, encoding a putative protein consisting of 322 amino acids with a predicted molecular weight of 35 468.6 Da and pI of 8.31, indicating the gene expressed in E. coli Origmi(DE3)successfully. The purified target protein had the antifungal activity.
Musca domestica;antifungal peptide-1 with Lysozyme;recombinant expression;sequence analysis
10.13560/j.cnki.biotech.bull.1985.2015.05.031
2014-09-01
国家科技支撑计划(2011BAC06B12),国家自然科学基金项目(81360254),贵州省科学技术基金项目(黔科合J字[2012]2038号)
彭传林,男,硕士研究生,主治医师,研究方向:分子生物学;E-mail:2463749164@qq.com
吴建伟,男,博士,教授,研究方向:昆虫免疫及应用;E-mail:wjw@gmc.edu.cn
