重组慢病毒载体介导不同启动子驱动的绿色荧光蛋白在多种(不同)细胞中的表达影响
2015-10-21张玲1翁云层1张云2帅丽芳3李婷婷1王文敬1李红卫1赵卫4黎诚耀1
张玲1 翁云层1 张云2 帅丽芳3 李婷婷1 王文敬1 李红卫1 赵卫4 黎诚耀1★
·论著·
重组慢病毒载体介导不同启动子驱动的绿色荧光蛋白在多种(不同)细胞中的表达影响
张玲1 翁云层1 张云2 帅丽芳3 李婷婷1 王文敬1 李红卫1 赵卫4 黎诚耀1★
目的比较不同启动子的慢病毒转导细胞后,在不同细胞系中驱动绿色荧光蛋白表达的效率高低。方法采用3种不同启动子的转移质粒,与包装质粒共转染293T细胞,转染60 h后,收集慢病毒上清。用等量的三种慢病毒液转导5种细胞系(293A、MOLT-4、PC3、DU145及RM1),72 h后,荧光显微镜下观察转导效果;流式细胞仪计数转导效率。结果不同启动子(Ubiquitin,EF1α,CMV)在5种细胞系中驱动绿色荧光蛋白的表达及转导效率不同。在293A和PC3细胞中,CMV为最强启动子,转导率分别为(94.83±2.87)%和(20.90±3.15)%;但在MOLT-4和DU145细胞中,EF1α为最强启动子,转导率分别为(74.27±2.14)%和(25.13±4.95)%;在RM1细胞中,Ubiquitin为最强启动子,转导率为(16.77±0.38)%。结论在慢病毒载体介导基因表达研究中,要考虑选取合理的细胞和启动子以获得高效的转导效率。
重组慢病毒;绿色荧光蛋白
慢病毒(lentiviru,LV)由HIV-1改建而来,基因转移效率高效而稳定。不论是细胞处于有丝分裂活跃期还是处于分裂缓慢期及分裂终末期,LV均可以进行转导;由LV携带整合入宿主基因组的目的基因可以在宿主细胞中进行长期而稳定的表达;LV可兼容多个转录启动子,可以同时进行多个基因的表达研究;可容纳较长片段的外源基因(10 kb),大多数的cDNA都能被克隆入LV[1-10]。LV的上述优点使其成为体内和体外基因转移的一种有效工具。本文意在构建不同启动子的转移质粒,包装重组慢病毒,观察不同启动子在不同细胞系中驱动绿色荧光蛋白表达效率高低。
1 材料与方法
1.1不同启动子的转移质粒(pTY-EF1α-eGFP和pTY-CMV-eGFP)及pFUGW
不同启动子的转移质粒pTY-EF1α-eGFP和pTY-CMV-eGFP由本室前期构建完成,pFUGW及包装质粒pSPAX2和pMD2.G由南方医科大学肿瘤研究所提供。
1.23种不同启动子的慢病毒包装及滴度测定
应用Qiagen公司无内毒素的质粒大量提取试剂盒提取pFUGW、pTY-EF1α-eGFP、pTY-CMV-eGFP、pSPAX2及pMD2.G用以转染。紫外分光光度计测定质粒的浓度与纯度。测得的浓度分别为pMD2.G:0.85μg/μL,pPAX2:0.93μg/μL,pFUGW:0.65 μg/μL,pTY-EF1a-eGFP:1.09 μg/μL,pTYCMV-eGFP:1.21 μg/μL。-20℃保存。慢病毒的制备采用文献报道方法[11]。转染采用脂质体法进行,转染前一天消化传代293T细胞,分别在3个T75细胞培养瓶中培养,待第二天细胞长满至90%左右可以进行转染。该包装系统中pMD2.G:pPAX2:pTY-EF1a-CMV(pTY-CMV-eGFP、pFUGW)= 8∶15∶20(质量比)。转染前30 min~60 min,去除293T细胞培基,加入Opti-MEM®RI medium 1.7 mL;轻轻混匀(上下混)脂质体2000,吸17 μL至0.5 mL Opti-MEM®RI medium(一个EP管)中,混匀,室温放置5 min(Solution B);将1.2 μg pMD2. G、4.0 μg pPAX2、6.7 μg pTY-EF1a-eGFP或3.3 μg pTY-CMV-eGFP或3.3 μg pFUGW加入0.5 mL Opti-MEM®RI medium中(另一个EP管)混匀(Solution A);将A液加入B液中,混匀后室温放置20 min;将AB混合液加入293T细胞中(加液体时细胞面朝上,以免冲落细胞);6~8 h后用吸管吸去瓶中的AB混合液,加入完全培养基3 mL;12 h在倒置荧光显微镜下观察转染情况,60 h~72 h后收集病毒上清,4℃,3 000 rpm,离心15 min,吸取上清,再经过0.45 μm一次性滤器过滤。收集病毒液,滴度测定采用本室已建立的慢病毒荧光定量PCR方法,包装的慢病毒核酸能达到109copies/mL。
1.3病毒滴度测定
病毒滴度测定采用RT-QPCR法,针对LV 3′-LTR,参考[12]设计引物和探针,合成了用以定量LV核酸拷贝数的引物和探针,Probe(LTR-3):AGTAGTGTGTGCCCGTCTGTTGTGTG;Primer Forward(LTR-1):TAAAGCTTGCCTTGAGTGCT;Primer Reverse(LTR-2):GTCTGAGGGATCTCTA GTTACCAG。对3种包装的LV,及其中LV-EF1a-EGFP病毒浓缩前后的病毒RNA,全部进行逆转录,将cDNA产物和质粒标准品同时进行Real Time PCR反应定量。pTY-EF1a-eGFP质粒标准品浓度1.09 μg/μL,换算成核酸拷贝数为1.06×1014copies/mL。10倍倍比稀释为7个浓度,即standard 1∶1.06×1014,standard 2∶1.06×1013,standard 3∶1.06× 1012,standard 4∶1.06×1011,standard 5∶1.06×1010,standard 6∶1.06×109,standard 7∶1.06×108,同时设一个阴性对照。Real Time PCR反应体系如下:2.5 μL 10×PCR buffer(MgCl2),0.5 μL dNTP(10 mM),0.4 μL ROX DyeⅡ(50×),1 μL LTR1(10 μM)1 μL LTR2(10 μM)1 μL LTR3(5 μM),0.4 μL FastStart Taq(5 U/μL)14.2 μL ddH2O,4 μL LV cDNA,总反应体系为25 μL。在PCR仪上按下列条件进行反转录反应。在Stratagene Mx3005P荧光定量PCR仪上进行定量PCR反应,反应条件如下:95℃10 min预变性,95℃30 s变性,55℃退火与延伸1 min,进行45个循环反应;在55℃延伸的步骤对荧光信号进行采集。由标准曲线可得病毒滴度。
1.4不同启动子的慢病毒转导不同细胞系
293A、DU145、PC3、RM1细胞为贴壁细胞,待培养瓶中细胞生长到80%~90%时,消化传代细胞,调整细胞浓度为5×105个/孔,后铺6孔板,每孔3 mL,每种细胞铺4个孔,3孔用以加病毒液,并设1个空白细胞对照。上述贴壁细胞铺板培养12 h后,吸掉细胞培养基上清,校正病毒液至109copies/mL,然后将3种LV按每孔加入200 μL病毒液,37℃孵育1h后每孔加入2.8 mL 2%FBS DMEM维持液;MOLT-4为悬浮细胞,将适宜密度的MOLT-4细胞吹打分散均匀,调整细胞浓度为5×105个/mL后铺6孔板,每孔3 mL细胞液,铺3个细胞孔,并设1个空白细胞对照。将3种LV(LV-UBI-eGFP、LV-EF1α-eGFP、LV-CMV-eGFP)直接加入MOLT-4细胞孔,每孔加入200 μL LV。将6孔板置于37℃5%CO2的细胞培养箱继续培养。将实验重复进行3次。72 h后在荧光显微镜下观察GFP的表达情况或通过FACS计数GFP表达阳性率。
1.5统计学分析
采用SPSS 13.0 One-Way ANOVA进行方差分析。
2 结果
2.1荧光显微镜观察eGFP表达情况
LV-CMV-eGFP、LV-EF1a-eGFP、LV-Ubi-eGFP 3种LV转导293A、MOLT-4、PC3、DU145、RM1细胞系72 h后,荧光显微镜下观察,不同启动子驱动的GFP表达情况不同,如图1所示。在293A细胞中,3种启动子驱动蛋白表达作用均较强,但CMV驱动绿色荧光蛋白作用最强;在MOLT-4和DU145细胞中,EF1α驱动绿色荧光蛋白作用最强;在PC3细胞中,CMV驱动绿色荧光蛋白作用最强;在RM1细胞中,Ubiquitin驱动绿色荧光蛋白作用最强。
2.2流式细胞技术检测LV转导不同细胞系的转导效率高低
采用流式细胞技术对不同启动子的LV转导不同细胞系的转导效率进行了分析。3种不同启动子(Ubiquitin,EF1α,CMV)的LV在5种细胞系(293A、MOLT-4、PC3、DU145及RM1)中的转导效率不同(见表1)。在293A和PC3细胞中,启动子为CMV的LV转导率最高分别为(94.83± 2.87)%和(20.90±3.15)%;但在MOLT-4和DU145细胞中,启动子为EF1α的LV转导率最高,分别为(74.27±2.14)%和(25.13±4.95)%;在RM1细胞中,启动子为Ubiquitin的LV转导率最高,为(16.77±0.38)%。
2.3统计学分析
对于UBI、EF1α和CMV不同启动子介导的不同细胞系转导率分析,P值均为0.000,3种启动子在5种细胞组内的转导率差异显著,两两比较,UBI、EF1α和CMV启动子均在293A细胞上为转导率最高。对于UBI、EF1α和CMV不同启动子介导的同一细胞系转导率分析,对于DU145细胞系,P>0.05,显示3种启动子的转导率无显著差异。对于293A、PC3、RM1细胞系,P<0.05,显示3种启动子在同种细胞中转导率差异显著。两两比较,293A和PC3中CMV启动子最强,RM1中UBI最强。
3 讨论
本研究比较了含有3种不同启动子(EF1α、CMV、UBI)的LV,分别转导不同的细胞系293A、MOLT-4、DU145、PC3及RM1。实验观察到不同启动子介导的不同细胞转导率差异显著。
据报道,CMV是目前最强的启动子[12]。但我们的研究表明,并不是在所有的细胞系中CMV驱动活性都最强。结果如图1所示,在293A细胞中,3种启动子驱动蛋白表达作用均较强,但CMV驱动绿色荧光蛋白作用最强;在MOLT-4和DU145细胞中,EF1α驱动绿色荧光蛋白作用最强;在PC3细胞中,CMV驱动绿色荧光蛋白作用最强;在RM1细胞中,Ubiquitin驱动绿色荧光蛋白作用最强。这与流式细胞技术检测的不同启动子的LV在5种细胞系上的转导效率结果相一致(表1)。文献[13-14]探讨了CMV、EF1α和PGK启动子在293T、HOS及Hela细胞中的活性,结果表明,在293T细胞中,CMV驱动GFP表达能力是EF1α和PGK的4.2~6.3倍,在HOS细胞中,CMV和EF1α有相同的驱动活性。但在Hela细胞中,EF1α驱动活性最强。这与我们在293细胞系中监测的结果一致,CMV启动子驱动活性最强,且不同启动子在不同细胞系中的驱动活性是不一致的,提示基因表达研究时选取适宜的启动子以驱动目的基因的表达。
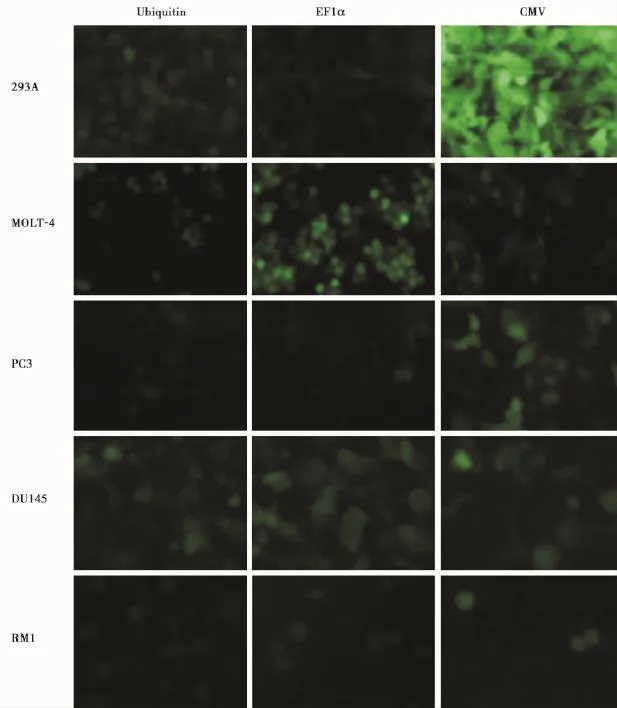
图1 不同启动子驱动的GFP在不同细胞系中的表达Figure 1GFP expression among various cells lines
表1 流式细胞术检测LV转导72 h后各细胞系阳性细胞百分率(±s)Table 1 The percentage of positive counts among different cell cultures transduced with lentivirus for 72 h by flow cytometry(x±s)
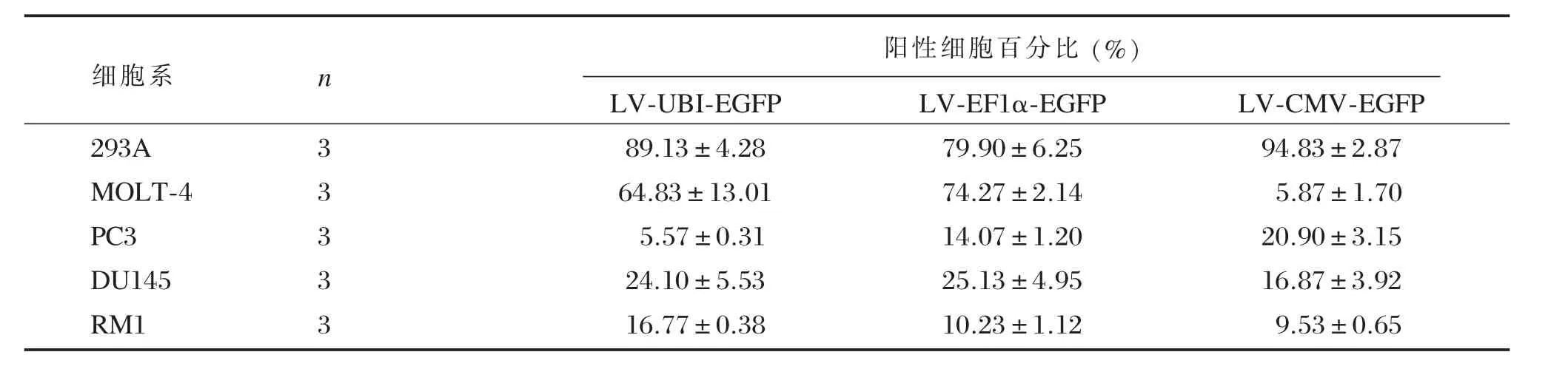
表1 流式细胞术检测LV转导72 h后各细胞系阳性细胞百分率(±s)Table 1 The percentage of positive counts among different cell cultures transduced with lentivirus for 72 h by flow cytometry(x±s)
阳性细胞百分比(%)细胞系n 293A MOLT-4 PC3 DU145 RM1 3 3 3 3 3 LV-UBI-EGFP 89.13±4.28 64.83±13.01 5.57±0.31 24.10±5.53 16.77±0.38 LV-EF1α-EGFP 79.90±6.25 74.27±2.14 14.07±1.20 25.13±4.95 10.23±1.12 LV-CMV-EGFP 94.83±2.87 5.87±1.70 20.90±3.15 16.87±3.92 9.53±0.65
Li[15]等研究了不同启动子的LV转导神经系统细胞活性的研究。在不同的神经元和细胞培养物中,蛋白表达水平差异显著。他们系统地评价了不同启动子驱动的外源基因在小鼠大脑皮层神经元、小脑颗粒细胞及分化和未分化的神经母细胞瘤中表达活性的强弱。在原代皮层神经元中,Ubiquitin C启动子驱动外源基因表达作用最强。PGK启动子驱动基因表达活性也较强,但是CMV和MND启动子驱动活性较弱,只有少量神经元细胞表达外源基因。但在小脑颗粒细胞及分化的SHSY5Y细胞中,CMV驱动活性最强。这为LV应用于神经系统提供了指导作用。MOLT-4为人急性淋巴细胞性白血病细胞系,PC3、DU145为人前列腺癌细胞、RM1为小鼠前列腺癌细胞,启动子在上述细胞系中的驱动活性研究,为选用适宜启动子的LV以使目的基因在上述靶细胞中高效表达奠定基础。
本研究表明不同启动子在不同细胞内驱动EGFP表达能力不同。针对特定靶细胞和组织,选择最适宜的启动子构建重组LV,有效驱动外源基因的高效表达,进而对实现LV转导的基因治疗具有重要指导意义。
[1]Lois C,Hong EJ,Pease S,et al.Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors[J].Science,2002,295(5556):868-872.
[2]Pfeifer A,Ikawa M,DaynY,et al.Transgenesis by lentiviral vectors:Lack of gene silencing in mammalian embryonic stem cells and preimplantation embryos[J]. Proc Natl Acad Sci USA,2002,99(4):2140-2145,2988-2993.
[3]Lai Z,Brady RO.Gene transfer into the central nervous system in vivo using a recombinant lentivirus vector[J]. J Neurosci Res,2002,67(3):363-371.
[4]Zufferey R.Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery[J].J Virol,1998,72(12):9873-9880.
[5]Yu X,Zhan X,Cheng L,et al.Lentiviral vectors with two independent internal promoters transfer high-level expression of multiple transgenes to human hematopoietic stem-progenitor cells[J].Molecular Therapy,2003,7(6):827-838.
[6]Xiang Y,Li B,Wang JM,et al.Gene transfer to human trabecular meshwork cells in vitro and ex vivo using HIV-based lentivirus[J].Int J Ophthalmol,2014,7(6):924-929.
[7]Yi Y,Noh MJ,Lee KH.Current advances in retroviral gene therapy[J].Curr Gene Ther,2011,11(3):218-228.
[8]Lombardi G,Calistri A,Curtarello M,et al.HIV-1-mediated delivery of a short hairpin RNA targeting vascular endothelial growth factor in human retinal pigment epithelium cells[J].Br J Ophthalmol,2009,93(2):244-248.
[9]Valtink M,Stanke N,Knels L,et al.Pseudotyping and culture conditions affect efficiency and cytotoxicity of retroviral gene transfer to human corneal endothelial cells[J].Invest Ophthalmol Vis Sci,2011,52(9):6807-6813.
[10]Ghanbari JA,Salehi M,Zadeh AK,et al.A preliminary step of a novel strategy in suicide gene therapy with lentiviral vector[J].Adv Biomed Res,2014,3:7.
[11]Tian X,Wang G,Xu Y,et al.An improved tet-on system for gene expression in neurons delivered by a single lentiviral vector[J].Hum Gene Ther,2009,20(2):113-123.
[12]Foecking MK,Hofstetter H.Powerful and versatile enhancer promoter unit for mammalian expression vectors[J].Gene,1986,45(1):101-105.
[13]Gensheng M,Francesco M,Jia Y,et al.DNA context and promoter activity affect gene expression in lentiviral vectors[J].ACTA BIOMED,2008,79(3):192-196.
[14]Gonzalez P,Caballero M,Liton PB,et al.Expression analysis of the matrix GLA protein and VE-cadherin gene promoters in the outflow pathway[J].Invest Ophthalmol Vis Sci,2004,45(5):1389-1395.
[15]Mingjie L,Nada H,Ying L,et al.Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells[J].Journal of Neuroscience Methods,2010,189(1):56-64.
Green florescence protein expression in various cells driven by different promoters among lentivirus
ZHANG Ling1,WENG Yunceng1,ZHANG Yun2,SHUAI Lifang3,LI Tingting1,WANG Wenjing1,LI Hongwei1,ZHAO Wei4,LI Chengyao1★
(1.Department of Transfusion Medicine,School of Biotechnology,Southern Medical University,Guangzhou,Guangdong,China,510515;2.Department of Orthopaedics,Linqu Traditional Chinese Medicine Hospital,Weifang,Shandong,China,262600;3.Guangzhou Millitary Center for Disease Control and Prevention,Guangzhou,Guangdong,China,510515;4.School of Public Health and Tropical Medicine,Southern Medical University,Guangzhou,Guangdong,China,510515)
ObjectiveTo compare the GFP expression efficiency of transduced cells driven by lentivirus with different promoters.Methods293T cells were co-transfected with packaging plasmids and three kinds of transfer plasmids.Then the supernatant was collected after 60 hours.5 cell lines(293A,MOLT-4,PC3,DU145 and RM1)were transduced by equal load of these lentivirus.72 hours later,GFP expression was observed with florescence microscope and transduction efficency was counted by FASC.ResultsGFP expression and transduction efficiency among 5 cell lines were different.Among 293A and PC3 cells,CMV promoter was the strongest one and transduction efficiency can achieve(94.83±2.87)%and(20.90±3.15)%,respectively.But among MOLT-4 and DU145 cells,EF1α promoter was the strongest one and transduction efficiency can achieve(74.27±2.14)%and(25.13±4.95)%,respectively.In RM1 cells,Ubiquitin promoter was the strongest one and it can achieve(16.77±0.38)%.ConclusionIn the study of gene expression mediated by lentivirus,proper cell lines and promoters should be selected to obtain high efficiency.
Recombinant lentivirus;Green florescent protein
国家自然科学基金(81301433)
1.南方医科大学生物技术学院输血医学系,广东,广州510515 2.临朐县中医院骨外科,山东,潍坊261000 3.广州军区疾病预防控制中心,广东,广州510515 4.南方医科大学公共卫生与热带医学学院,广东,广州510515
黎诚耀,E-mail:chengyaoli@hotmail.com
