四川麸醋醋醅中优良醋酸菌的筛选及其产酸特性
2015-10-21邵向丽刘书亮李建龙胡欣洁邓维琴韩新锋
邵向丽,赵 爽,刘书亮,李建龙,胡欣洁,赵 勤,何 利,邓维琴,韩新锋
(四川农业大学食品学院,四川雅安625014)
四川麸醋醋醅中优良醋酸菌的筛选及其产酸特性
邵向丽,赵爽+,刘书亮*,李建龙,胡欣洁,赵勤,何利,邓维琴,韩新锋
(四川农业大学食品学院,四川雅安625014)
从四川麸醋醋醅中筛选获得5株高产酸菌株(C9-4、C12-4、A30-16、A12-7和A30-14-2),对其进行形态学、生理生化鉴定及16S rDNA分子鉴定,结果显示,5株菌均为巴氏醋杆菌(Acetobacter pasteurianus)。其产酸特性表明,菌株C9-4、A30-16和A30-14-2能耐受9%(v/v)乙醇;5株菌均能耐受4%(v/v)底酸;补加酒精实验表明,菌株C9-4的连续产酸能力最强;菌株C9-4、A30-16、A30-14-2在40℃时仍能产酸;相同条件下,菌株C9-4、A30-16、A30-14-2产酸速率优于菌株C12-4和A12-7。5株醋酸菌产酸总量从高到低依次为:A30-16>C12-4>C9-4>A30-14-2>A12-7。
四川麸醋,醋酸菌,筛选,鉴定,特性
食醋作为一种重要的传统调味品,不仅具有特殊的风味,而且对一些食源性致病细菌具有一定的抑制作用[1],长期食用还能达到缓解疲劳、调节血糖、脂质代谢及促进食欲的功效[2]。四川麸醋以麸皮等为主要原料,采用生料固态发酵的传统工艺,以独特的药曲加黑曲为糖化剂,加入酵母菌与麸皮拌和后入池发酵,主要依靠环境中的醋酸菌进行,发酵周期一个月以上[3-4]。四川麸醋的传统固态发酵工艺在实际生产中存在淀粉利用率低、生醋酸度低、生产周期长等问题,因此筛选出优良的醋酸菌对食醋产业的发展至关重要[5-6]。
王电垒等[7]筛选到两株耐高温醋酸菌Ⅱ9、Ⅵ13,菌株在40℃酒精中转化率均可达到73.2%以上;席青等[8]从山西醋醅中筛选出1株优势产酸菌(醋化醋杆菌奥尔兰亚种),其产酸量为66.92g/L,酒精转化率为72.42%;Maria Gullo等[9]从意大利香醋中分离出的部分菌株可耐25%高浓度葡萄糖;T T Kadere等[10]从肯尼亚棕榈酒中筛出的醋酸菌在25~40℃范围内生长良好;朱其瀚等[11]从镇江恒顺醋厂的醋醅中分离纯化出1株巴氏醋杆菌,该菌株能产生3种有机酸:乳酸、乙酸、酒石酸;而许伟从镇江香醋醋醅中筛选到1株能产乙酸、琥珀酸、焦谷氨酸、α-酮戊二酸、酒石酸5种有机酸的醋酸菌;通过生物强化实验,菌株总酸最高达到74g/L,出醋率提高7%~25%[12],与山西陈醋、镇江香醋等食醋中筛选到的优良醋酸菌株相比较,从四川麸醋中筛选优良醋酸菌的报道并不多见,陈娟等[13]从四川保宁醋醋醅中筛选出1株恶臭醋杆菌,相同条件下,其产酸量(33.8g/L)明显低于其他醋酸菌菌株。
本文旨在从四川麸醋传统生料固态酿造的醋醅中分离筛选出具有耐高温、耐酒精、耐底酸的高产酸优势醋酸菌,为食醋生产提供菌种资源。
1 材料与方法
1.1材料与仪器
醋醅采自四川阆中保宁醋厂不同发酵期的醋醅;菌株巴氏醋杆菌巴氏亚种(Acetobacter pasteurianus subsp.pasteurianus),CICC编号:7015;恶臭醋杆菌混浊变种1.41(Acetobacter rancens var. turbidans),CICC编号:20064均购自中国工业微生物菌种保藏中心;甲醇、乙酸、L-乳酸、草酸、柠檬酸、酒石酸、丙酮酸、L-苹果酸、琥珀酸均为色谱纯;TIANDZ柱式细菌DNAOUT购于四川省绵阳天泽基因工程有限公司;Prem ix Taq、Gold View核酸染料、DNA Marker DL2000、琼脂糖均购于宝生物工程(大连)有限公司;细菌通用引物,上游引物:5’-AGAG…TTTGATCCTGGCTCAG-3’,下游引物:5’-TACGGCTACCTTGTTACGACTT-3’ 由上海英骏(invitrogen)生物技术有限公司合成;其他试剂均为分析纯。
PCR仪(My CyclerTM Thermal Cycler)Bio-Rad;凝胶成像仪(Quantity One System)Bio-Rad;LC-10A2010C HT型液相色谱仪、LC-solution工作站日本岛津公司;气相色谱-质谱联用仪(Agilent 7890A-5975C)美国安捷伦公司;AS10200A超声波清洗器天津奥特赛恩斯公司;Milli-Q超纯水仪美国密理博公司。
1.2培养基
分离纯化培养基:酵母膏10g,葡萄糖10g,琼脂粉20g,CaCO320g,蒸馏水1000m L,培养基添加50m L溴甲酚紫溶液,pH为自然,使用前加3%(v/v)无水乙醇。
基础培养基:酵母膏10g,葡萄糖10g,使用前加入3%(v/v)无水乙醇。
产酸培养基:酵母膏10g,葡萄糖10g,使用前加入7%(v/v)无水乙醇。
斜面保藏培养基:酵母膏10g,葡萄糖10g,琼脂粉20g,CaCO320g,蒸馏水1000m L使用前加入3%(v/v)无水乙醇。
以上培养基均需121℃,灭菌15m in。
1.3实验方法
1.3.1醋酸菌的分离筛选流程醋醅→增菌培养→稀释涂布→分离纯化[8]→镜检→斜面保藏→产醋酸定性实验[14]→产酸定量实验[15]→甘油保种。产酸定量实验以菌株20064和菌株7015为对照菌株。
1.3.2产醋酸菌株的鉴定通过16S rDNA遗传学鉴定方法[16]和生理生化、形态学鉴定方法(参照《伯杰氏细菌鉴定手册(第8版)》与《常见细菌系统鉴定手册》)对菌株进行鉴定。
1.3.3菌株的产酸特性
1.3.3.1不同乙醇浓度对菌株产酸的影响将通过产酸定量实验筛选得到的高产酸醋酸菌于30℃,120r/m in振荡培养(22±2)h活化后,分别接种于乙醇含量分别为3%、4%、5%、6%、7%、8%、9%(v/v)的产酸培养基中,30℃、120r/m in振荡培养72h,测定产酸量。相同条件下,测定菌株20064和7015的产酸量。
1.3.3.2补加乙醇对菌株产酸的影响将通过产酸定量实验筛选得到的高产酸醋酸菌于30℃,120r/m in振荡培养(22±2)h活化后,分别接种于乙醇含量为3%(v/v)的基础培养基中,每隔24h补加1%(v/v)无水乙醇,30℃,120r/m in振荡培养72h,测定产酸量。相同条件下,测定菌株20064和7015的产酸量。
1.3.3.3不同浓度底酸对菌株产酸的影响将通过产酸定量实验筛选得到的高产酸醋酸菌于30℃,120r/m in振荡培养(22±2)h活化后,分别接种于基础培养基中,底酸(乙酸)浓度分别为1%、1.5%、2%、2.5%、3.0%、3.5%、4.0%(v/v),30℃,120r/m in振荡培养72h,测定产酸量。相同条件下,测定菌株20064和7015的产酸量。
1.3.3.4不同培养温度对菌株产酸的影响将通过产酸定量实验筛选得到的高产酸醋酸菌于30℃,120r/m in振荡培养(22±2)h活化后,分别接入产酸培养基后,分别于28、30、35、37、40℃,120r/m in振荡培养72h,测定产酸量。相同条件下,测定菌株20064和7015的产酸量。
1.3.5产酸曲线的测定将菌株分别接入装有100m L产酸培养基的300m L的三角瓶中,于30℃、120r/min振荡培养10d,每天测一次产酸量。相同条件下,测定菌株20064和7015的产酸量。
1.3.6发酵液中有机酸的测定将5株菌株(C9-4、C12-4、A12-7、A30-14-2、A30-16)分别接入产酸培养基100m L/300m L的三角瓶中,30℃、120r/min振荡培养72h,取发酵液,12000r/m in离心10m in,再取上清液,0.22μm滤膜过滤,弃去初滤液,取续滤液用于HPLC检测。
色谱条件:Carbomix H-NP 10μm,7.8mm×300mm;柱温58℃;流动相2.5mmol/L H2SO4;进样体积10μL,流速0.6m L/m in;检测波长210nm。
按不同样品目标峰的峰面积对应的浓度进行定量[17-18]。
2 结果与分析
2.1高产酸菌株的筛选
从自然发酵的麸醋醋醅中分离纯化得到12株产酸菌株,其产酸量均高于对照菌株20064,其产酸量如表1所示,结合菌株分离至不同发酵天数的醋醅,由表得出菌株C9-4、C12-4、A 12-7、A30-14-2、A30-16为较高产酸菌株,因此选择该菌株作为后续实验的研究对象。

表1 不同菌株的产酸量Table 1 Acid production of different strains
2.2菌株鉴定结果
菌株在碳酸钙平板上的菌落形态及镜检的个体形态(10×100)如图1所示。菌落呈淡黄色或乳白色,菌落形态圆形、隆起、光滑,边缘不整齐,5株醋酸菌菌株经革兰氏染色,在油镜下进行观察,其均呈杆状或短杆状,单生、对生或呈链状。

图1 菌株的菌落及个体形态特征Fig.1 The colony and individual characteristics of strains
对其中5株菌C9-4、C12-4、A12-7、A30-14-2、A30-16进行了生理生化鉴定和16S rDNA遗传学鉴定,生理生化鉴定结果见表2,从表2中可以看出5株菌均不能在Hoyer-Frateur培养基上生长,不能产5-酮基葡萄糖酸盐和纤维素,但却均可产醋酸,C12-4、A12-7菌株可以产葡萄糖酸盐。
图2为5株菌16S rDNA的PCR产物的琼脂糖凝胶电泳图,经检测,其片段大小均在1500bp左右,将其测序结果提交NCBI后获得登录号,分别是KF707665、KF707666,KF707667、KF707668、KF707669。采用Blast在Genbank中进行相似性比对,并对5株菌构建其系统发育树(如图3所示)。根据形态学、生理生化指标及16S rDNA序列分析可判定5株菌均为巴氏醋杆菌(Acetobacter pasteurianus)。

图2 菌株16S rDNA的PCR产物的琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of 16S rDNA gene PCR products of strains

图3 基于16S rDNA基因序列构建的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA gene sequences
2.3菌株的产酸特性
2.3.1菌株对不同酒精浓度的适应性如图4所示,随着乙醇含量的增加,菌株的产酸量均呈现先增后减的趋势。其中,菌株A30-16对乙醇的耐受性较好,在乙醇含量7%时,产酸量最高(55.51g/L),其和对照菌株7015(7%,54.18g/L)相当,优于菌株20064(6%,41.81g/L);菌株C9-4、C12-4和A12-7的产酸量在乙醇含量为6%时最高,分别为45.51、42.98、39.46g/L;菌株A30-14-2的产酸量在乙醇含量为5%时达到最高值(41.54g/L);菌株C9-4、A30-16和A30-14-2能耐受9%(v/v)乙醇。
2.3.2补加乙醇对菌株产酸的影响以菌株20064及7015作为对照,对5株高产酸醋酸菌进行补加酒精实验,如图5所示,补加乙醇后,5株菌的最终产酸量均高于对照菌株20064(34.48g/L);菌株C9-4的产酸量最高,为43.60g/L,其次分别是菌株C12-4(41.83g/L)、菌株A30-14-2(41.61g/L)、菌株A30-16(41.46g/L)、菌株A12-7(39.83g/L)。

表2 菌株的生理生化鉴定结果Table 2 Physiological and biochemical identification results of different strains

图4 菌株对不同酒精度浓度的适应性Fig.4 Adaptability of strains to differentalcohol
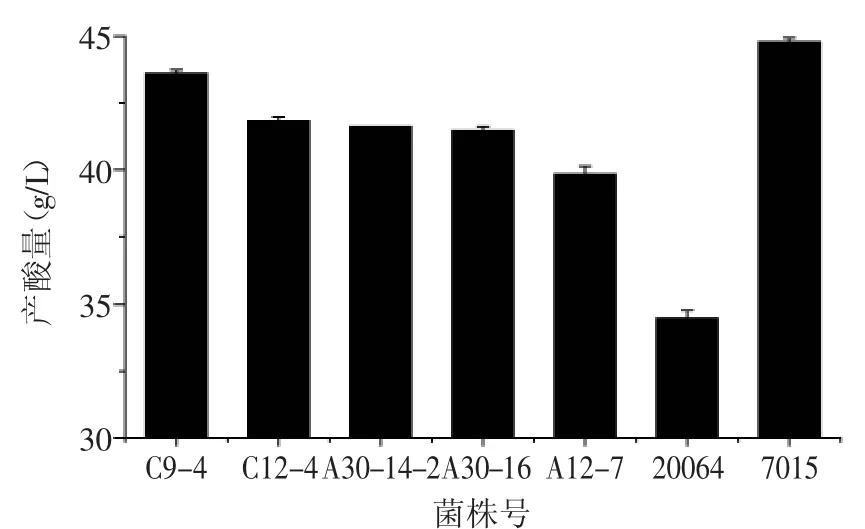
图5 补加乙醇对菌株产酸的影响Fig.5 The effectofadding ethanol test to strains producting acid
2.3.3菌株对不同浓度底酸的适应性以菌株20064及7015作为对照,对5株高产酸醋酸菌进行底酸适应性实验,结果如图6所示,5株菌均能耐受4%(v/v)底酸;菌株A30-16的产酸量在底酸浓度≤4%的范围内,随底酸浓度的增加而增加;其他菌株的产酸量随底酸浓度的增加均呈现先增加后减少的变化趋势;菌株A30-16、A30-14-2和C9-4对底酸的耐受力较菌株C12-4和A12-7强。

图6 菌株对不同浓度底酸的适应性Fig.6 Adaptability of strains to differentbottom acid concentration
2.3.4菌株对不同温度的适应性以菌株20064及7015作为对照,对5株高产酸醋酸菌进行温度适应性实验,如图7所示,在28~40℃范围内,菌株C12-4的产酸量随温度的升高持续快速减少,菌株A30-14-2随温度的升高基本呈等差数列减少;菌株C9-4、A12-7、A30-16的产酸量随温度的升高均呈现先增加后减少的趋势,并在34℃达到最高值;菌株C9-4、A 30-14-2和A30-16的产酸量在28~40℃范围内波动相对较小,对温度的适应范围广,尤其是菌株C9-4、菌株A30-14-2和菌株A30-16能耐受40℃的高温并产酸,产酸量达到20g/L以上。
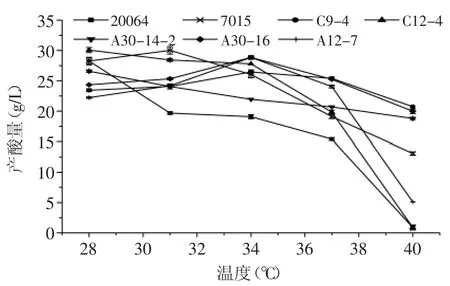
图7 菌株对不同温度的适应性Fig.7 Adaptability of strains to different temperature
2.3.5菌株的产酸曲线以菌株20064及7015作为对照,绘制5株高产酸醋酸菌的产酸曲线。如图8所示,菌株A30-14-2、C9-4、A30-16的产酸量在0~5d迅速增加,5~10d缓慢增加;菌株C12-4、A12-7的产酸量在0~10d内呈“S”型变化趋势,0~3d产酸量基本不增加,3~6d迅速增加,6~10d又呈现缓慢增加的趋势。表明菌株A30-14-2、C9-4和A30-16的产酸速率及对环境的适应性优于菌株C12-4和A12-7。

图8 菌株的产酸曲线Fig.8 Acid producing curve of strains
2.3.6菌株产有机酸情况由表3可知,5株菌株均被检出5种以上的有机酸,均未检出乳酸;菌株C9-4、A 12-7未检出柠檬酸,菌株C9-4、C12-4未检出苹果酸;菌株C12-4产酒石酸的量显著高于其他菌株,菌株A30-16产乙酸的量显著高于其他菌株;产酸总量从高到低依次为:A30-16>C12-4>C9-4>A30-14-2>A 12-7。
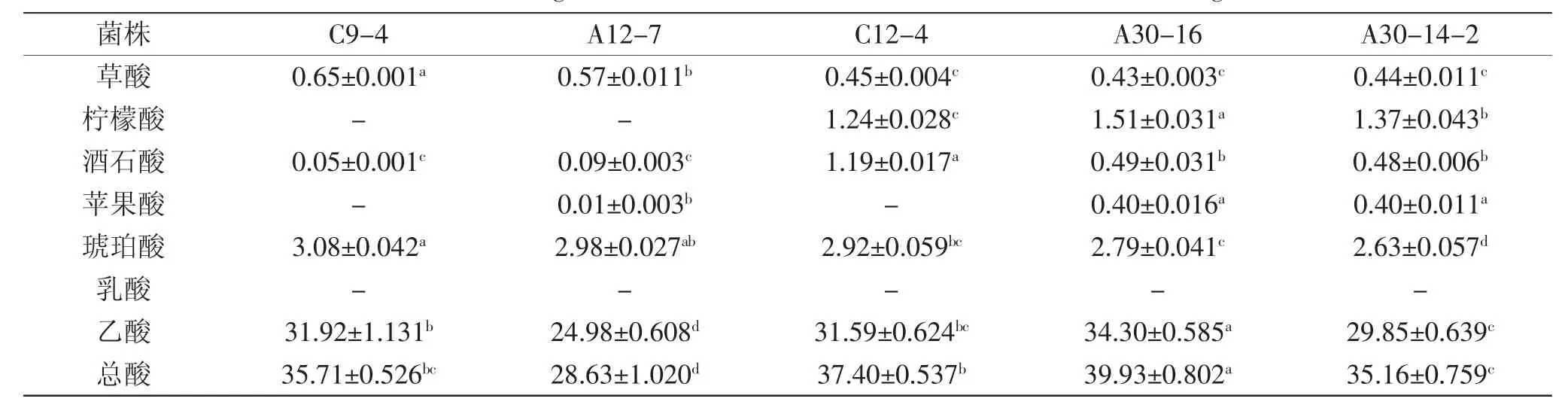
表3 不同菌株发酵液中有机酸的含量(mg/mL)Table 3 Contentof organic acids in the fermentation broth of different strains(mg/mL)
3 结论与讨论
从四川麸醋醋醅中筛选到5株高产酸菌株C9-4、C12-4、A30-16、A12-7和A30-14-2均为巴氏醋杆菌。5株菌的产酸特性表明,菌株A30-16对酒精的耐受力最强,可耐受9%(v/v)乙醇,在乙醇含量7%时,产酸量最高为55.51g/L;补加乙醇实验结果显示菌株C9-4的产酸量最高(43.60g/L)。底酸浓度适应性实验结果表明菌株A30-16对底酸的耐受力最强;同时,5株醋酸菌均能产5种以上有机酸。获得的5株醋酸菌尤其是菌株A30-16和C9-4可作为优良菌种用于四川麸醋及其他种类食醋、果醋等发酵醋产品的酿造。
据余宁华等报道[19-20],乳酸和酒石酸是以麸醋为代表的保宁醋的特征性有机酸,尤其是乳酸含量明显高于其他有机酸,成就了保宁醋酸味柔和、酸中回甜的特点;但本文从四川麸醋醋醅中筛选的巴氏醋杆菌的醋酸发酵液中均未检出乳酸;结合Shin Haruta等[21]和许玮等[12]研究结果,可以推测四川麸醋中大量的乳酸可能来源于其醋醅中存在的乳酸菌。
[1]Entani E,Asai M,Tsujihata S,et al.Antibacterial action of vinegar against food-bornepathogenicbacteriaincluding Escherichia coli O157∶H7[J].Journal of Food Protection®,1998,61(8):953-959.
[2]张平真.中国酿造调味食品文化——酱油食醋篇[M].北京:新华出版社,2001:142.
[3]李幼筠.四川麸醋剖析[J].中国酿造,1990(2):1.
[4]张奶英,刘书亮,杨勇,等.四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J].食品工业科技,2014,35(11):174-178.
[5]包启安.醋酸菌与其发酵的机理[J].中国调味品,1989(8):1-3.
[6]Wu J J,Ma Y K,Zhang F F,et al.Biodiversity of yeasts,lactic acid bacteria and acetic acid bacteria in the fermentation of“Shanxi aged vinegar”,a traditional Chinese vinegar[J].Food Microbiology,2012,30(1):289-297.
[7]王电垒,马应伦,于瑞琪,等.耐高温醋酸菌分离与筛选的实验[J].中国酿造,1998(2):18-19.
[8]席青,张德纯,管晓冉.山西醋醅中醋酸菌的分离及初步鉴定[J].中国微生态学杂志,2010,22(3):225-228.
[9]Gullo M,Caggia C,De Vero L,et al.Characterization of acetic acidbacteriain“traditional balsamicvinegar”[J]. International JournalofFood Microbiology,2006,106(2):209-212.
[10]Kadere T T,Miyamotoo T,Oniango R K,et al.Isolation and identification of the genera Acetobacter and Gluconobacter in coconut toddy(mnazi)[J].African Journal of Biotechnology,2008,7(16):2963-2971.
[11]朱其瀚.镇江香醋发酵过程中微生物分离及其产酸特性[D].无锡:江南大学,2008.
[12]许伟.镇江香醋醋酸发酵过程微生物群落及其功能分析[D].无锡:江南大学,2011.
[13]陈娟,刘军,李丽,等.传统固态发酵酿醋产酸菌株的分离筛选及初步鉴定[J].中国调味品,2011,36(2):43-46.
[14]李素燕.醋酸菌的分离鉴定及冬枣醋饮料的研制[D].天津:天津大学,2008.
[15]张忠明.高产醋酸菌的筛选及其形态生化特征研究[J].甘肃农业大学学报,2006,41(6):83-86.
[16]朱其瀚,许伟,窦文芳,等.镇江香醋醋醅中产酸菌的分子鉴定[OL].[2008-03-18].中国科技论文在线,http://www.paper. edu.cn/releasepaper/content/200803-473.
[17]余永建,邓晓阳,陆震鸣,等.高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化[J].食品科学,2014,35(4):55-59.
[18]Uckoo R M,Jayaprakasha G K,Nelson S D,et al.Rapid simultaneous determination of amines and organic acids in citrus using high-performance liquid chromatography[J].Talanta,2011,83(3):948-954.
[19]余宁华,陆震鸣,许伟,等.基于主成分分析的中国发酵食醋有机酸含量差异性分析[J].食品与发酵工业,2010,36(10):144-148.
[20]李国权,陆振鸣,余永建,等.镇江香醋有机酸风味特征的分析[J].中国调味品,2013,38(11):63-65.
[21]Haruta S,Ueno S,Egawa I.et al.Succession of bacterial and fungal communities during a traditional potfer-mentation of rice vinegar assessed by PCR-mediated denaturing gradient gel electrophoresis[J].Internation-gal Journal of Food Microbiology,2006,109(1-2):79-87.
Screening of high quality acitic acid bacteria from grains of Sichuan bran vinegar and its characteristics of producting acid
SHAO Xiang-li,ZHAO Shuang+,LIU Shu-liang*,LI Jian-long,HU Xin-jie,ZHAO Qin,HE Li,DENG W ei-qin,HAN Xin-feng
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
Five high-yielding acetic acid bacteria(C9-4,C12-4,A30-16,A12-7 and A30-14-2)were screened from Sichuan b ran vinegar g rains,they were all identified as Acetobacter pasteurianus by analysis of morphological,physiological and biochem ical characteristics,and 16S rDNA genetic identification.The results of acid-p roducing characteristics of the 5 high-yield ing strains showed that C9-4,A30-14-2 and A30-16 could adap ted to 9%(v/v)ethanol,allof the 5 strains could stand 4%acid concentration.The results of ethanol addition tests showed that strain C9-4 could transform ethanol to acid continuously most.C9-4,A30-16 and A30-14-2 could stillp roduce acid at40℃.Acid p roducing rates of strains C9-4,A30-16 and A30-14-2 were higher than that of strains C12-4 and A12-7 under the same cond ition.The total amount of organic acids p roduced by the 5 strains were as follows:A30-16>C12-4>C9-4>A30-14-2>A12-7.
Sichuan bran vinegar;acetic acid bacteria;sc reening;identification;characteristics
TS201.1
A
1002-0306(2015)06-0203-06
10.13386/j.issn1002-0306.2015.06.037
2014-07-04+并列第一作者
邵向丽(1990-),女,本科,研究方向:食品科学与工程。赵爽(1990-),女,硕士研究生,研究方向:食品微生物。
刘书亮(1968-),男,博士,教授,主要从事食品微生物与发酵方面的研究。
四川省科技厅科技支撑计划(2013NZ0055)资助。
