大鼠气道平滑肌细胞中微丝纤维形态特征的定量分析*
2015-10-19陈树越徐杨潘艳罗明志曾慧龙邓林红
陈树越,徐杨,潘艳,罗明志,曾慧龙,邓林红△
(1.常州大学 信息科学与工程学院,常州 213164) (2.常州大学 生物医学工程与健康科学研究院,常州市呼吸医学工程重点实验室,江苏 常州 213164)
1 引 言
肌动蛋白聚合形成的微丝纤维,有时也称为应力纤维,是成纤维细胞和平滑肌细胞等间充质细胞的细胞骨架的重要组成部分,对细胞变性、组织缺损以及创伤修复等具有十分重要的作用[1-3]。因此,对细胞内微丝纤维的形态学进行定量化的表征和分析在研究这类细胞的物理行为中具有重要意义。
目前,研究者们对成纤维细胞等的生物学行为及其在组织创伤修复等临床应用方面进行了大量的研究工作。例如Kim等做了关于脂肪来源的干细胞(ADSC)是否对人类皮肤成纤维细胞分泌影响的研究,通过实验证明了ADSC能够促进成纤维细胞分泌,适合运用于皮肤的创伤恢复[4]。邢帮荣等进行了表皮生长因子与碱性成纤维细胞生长因子促进创面修复的比较研究,发现在创面修复中、晚期使用碱性成纤维细胞生长因子能够促进创面的再上皮化[5]。相对而言,对细胞内微丝纤维形态的定量化研究近年来才越来越受到研究者们的重视。例如Comin等人提出了一套针对肌纤维的细胞图像特征分析方法,其中不仅对细胞内微丝纤维进行了特征提取,并且对提取出的特征进行了长度等特征量的定量分析和对方法准确度进行了数据分析[6]。
本研究利用激光扫描共聚焦显微镜对大鼠气道平滑肌细胞的微丝纤维结构进行了观察和显微拍照,通过形态学与阈值处理相结合的方式对指定细胞切面的微丝纤维进行了形状特征提取,并从形状特征的角度选定适合的形状特征量对微丝纤维进行了定量分析。这些研究可望为定量表征和分析细胞的物理行为,如变形和迁移运动等提供新方法。
2 激光扫描共聚焦显微镜及大鼠气道平滑肌细胞的微丝结构特点
2.1 激光扫描共聚焦显微成像的原理
激光扫描共聚焦显微成像(LSCM)[7-8]是近代最先进的细胞生物医学分析手段之一,已经广泛地运用于生物医学的研究中[9],它除了光学显微镜部分外,还由激光发射器、扫描装置、计算机系统、光检测器以及图像传输等五部分组成。
与传统的显微成像方法相比,激光扫描共聚焦显微成像通过只检测反射自焦平面的光线部分从而防止由于焦平面上下散射光线对图像的影响,明显提高了图像的分辨率和对比度,并且通过精细地平面光切,经过计算机三维重建之后,可以从任意角度对实验样本进行三维剖面以及整体结构的观察分析。
2.2 实验材料
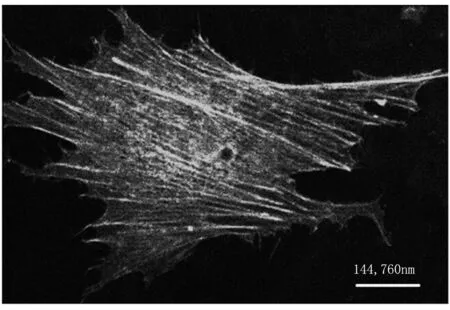
(a)
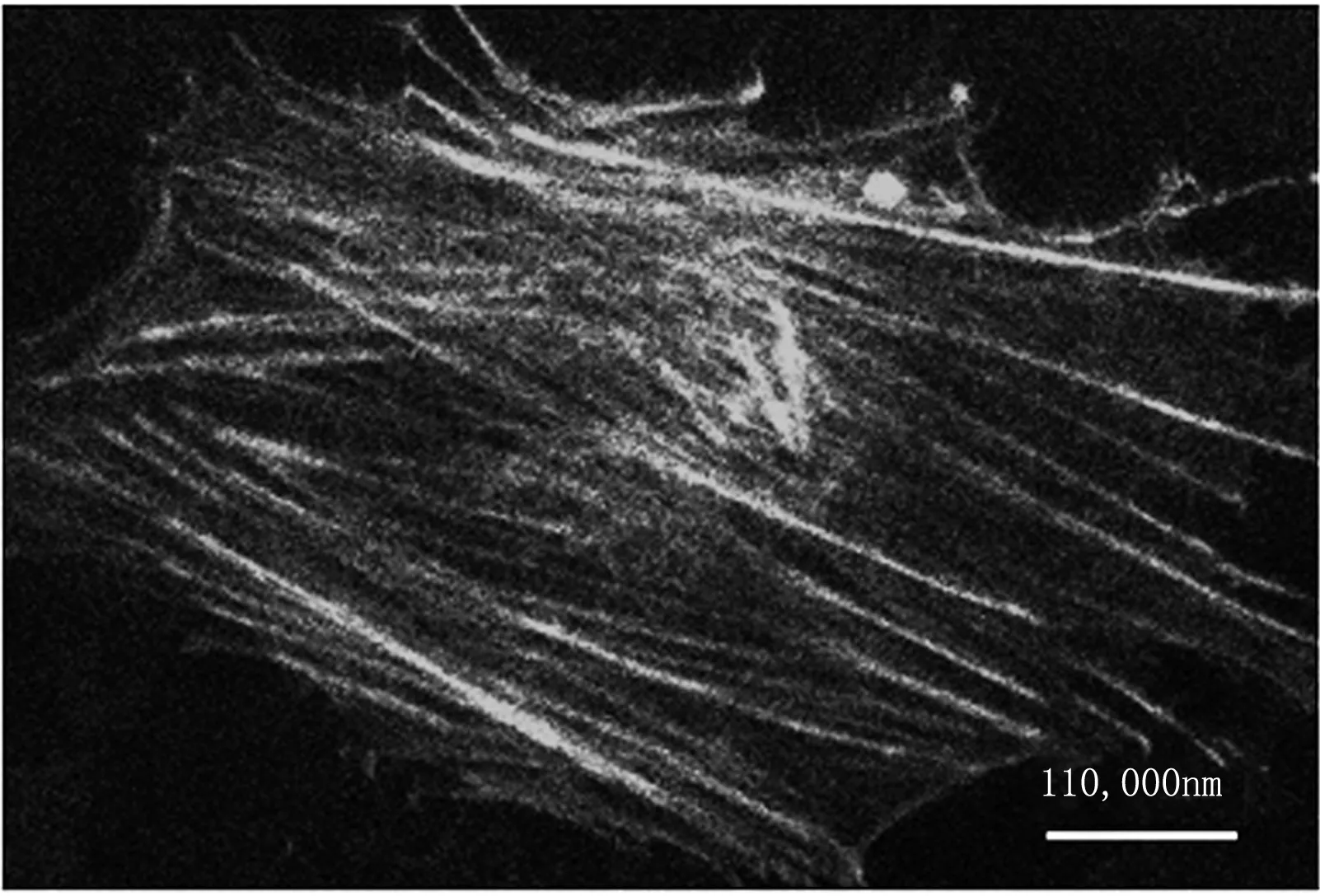
(b)
Fig1Representativemicroscopicimagesofthemicrofilamentsinairwaysmoothmusclecellsoriginal image of cell I (a) and cell II (b)
3 大鼠气道平滑肌细胞微丝纤维的结构特征分析
3.1 细胞微丝纤维结构提取
为了能够对细胞微丝结构进行有效提取,我们利用形态学与阈值分割相结合的方式对图1所示的细胞显微图像进行处理,其流程见图2。首先,利用33的中值滤波对图像中存在的大颗粒椒盐噪声进行有效地滤除,并利用截止频率为10的巴特沃斯滤波器对图像进行锐化处理,再结合数学形态学,以半径为1的圆盘矩阵对图像进行开运算处理,滤除小颗粒的椒盐噪声,最后通过全局阈值分割提取微丝纤维结构并将其骨骼化。
巴特沃斯高通滤波器通过控制截止频率D0,可以获得不同的锐化效果,n阶截止频率为D0的巴特沃斯高通滤波器的转移函数可表示为[10]:
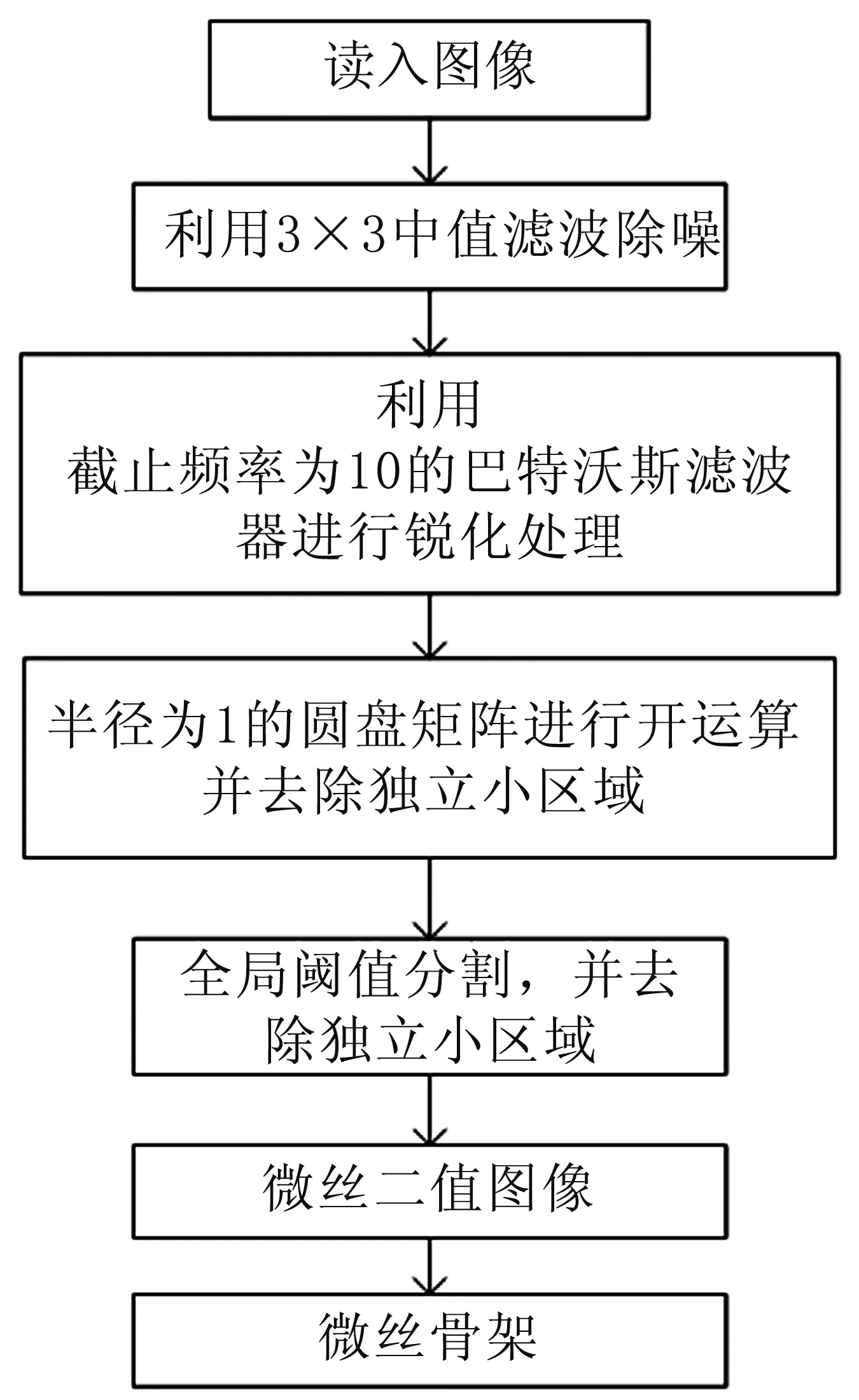
图2 提取细胞微丝纤维结构的流程图
(1)
其中D(i,j)为点(i,j)到频率平面原点的距离。
设B为结构元素,集合A为待处理的图像,利用结构元素B对A进行开运算可记为:
A·B=(AΘB)⨁B
(2)
其中,A·B可以看成是B在A内平移后的并集,通过B对A进行腐蚀,再利用B对A进行膨胀,能够除去掉A中不能包含结构元素B的对象区域,并且断开狭窄的连接,去除细小的突出部分。利用上述方法处理图2中的细胞显微图像,提取得到大鼠气道平滑肌细胞微丝纤维结构的结果见图3。从中可见细胞的微丝纤维主干较好地被分割出来,并且骨骼化后的效果也较好,提高了特征分析的准确性。
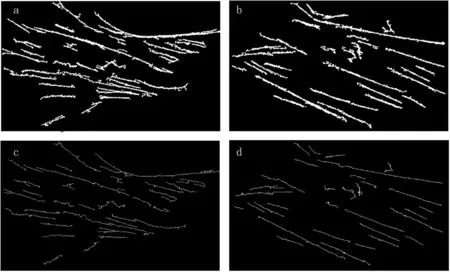
图3经过图像处理提取得到的气道平滑肌细胞微丝纤维结构
a、b:细胞I、II的微丝纤维二值图像,c、d:细胞I、II的微丝纤维结构骨骼化后的骨架形态
Fig3Theintracellularstructureofmicrofilamentsofairwaysmoothmusclecellsextractedviaimageprocessing.
a, b:The binary images of cell I and II, respectively. c, d:The skeleton image of the microfilaments in cell I and II, respectively
3.2 大鼠气道平滑肌细胞微丝纤维形状的特征分析
形状特征即为物体表现出来的视觉特征,其具有直观性和易理解性的特点。形状特征一般可以分为两类[11],一类是基于边界的特征,一类则是基于区域的特征。
(1)微丝纤维几何特征分析
随着城镇经济社会发展,京津冀、长三角和珠三角城市群的居民生活用电量逐渐上升,用电量差距越来越大。京津冀、长三角和珠三角城市群的居民生活用电量及变化率见图1。
我们采用了边界和区域特征结合的方法描述大鼠气道平滑肌细胞微丝纤维的形状特征,包括微丝纤维数量、长度、宽度3个几何形状因子,并以此作为描述依据,对小鼠平滑肌细胞微丝纤维结构进行了定量分析。
微丝纤维数量N作为常见的区域形状特征描述因子,基于标记图像中连通域的思想[12],通过对提取出的细胞微丝纤维骨架进行标记,实现微丝纤维数量的统计。该方法不仅能够有效地对微丝纤维进行统计标记,而且计算简单,运算速度快。
当细胞内部结构发生变化的时候,微丝纤维的长度、宽度也会随之发生变化。设微丝长度为L,微丝宽度为W。对骨骼化后的微丝纤维进行各个连通域内的像素数Ni的统计,可以计算出各微丝纤维的长度,即:
Li=Ni,i∈(1,N)
(3)
微丝纤维宽度可以采用微丝纤维面积Si与长度Li的比值表达,即:
(4)
通过统计各个微丝纤维的长度Li、宽度Wi,可以计算出细胞内微丝纤维的平均长度和宽度。
(2)微丝纤维分布特征分析
微丝纤维的区域分布是细胞后续行为功能的重要参数,利用灰度共生矩阵分析其灰度的空间分布来描述微丝纤维的区域分布特征,选择能量、熵、逆差距三个参数作为描述因子反映区域变化。
设f(x,y)为图像中的一个点,f1(x1,y1)为偏离它的一点,设该点对的灰度范围为(g1,g2),令f(x,y)遍历整个图像,则会得到一组(g1,g2)值,设其灰度值级为k,则(g1,g2)可能存在k的平方种,统计在各个灰度级上出现的次数,得出一个矩阵,并根据各级(g1,g2)出现的次数计算出概率p(g1,g2),这种矩阵即为灰度共生矩阵。
设E为角度方向二阶矩阵即能量,其体现图像的灰度分布均匀程度和规则变化程度,E值越大则说明纹理分布不均匀,集中在某一块,纹理呈规则性变化,E越小则表明纹理分布均匀。E可表达为[13]:
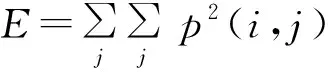
(5)
设H为熵值,其体现图像纹理分布的离散程度,H越大则表明其灰度空间分布越分散,H越小则表明其灰度空间分布越集中。H可表达为[13]:
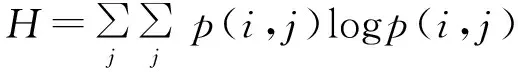
(6)
设I为逆差距,其体现图像纹理的局部变化程度,I越大表明图像纹理局部均匀,反之I越小表明图像纹理局部不均匀。I可表达为[13]:
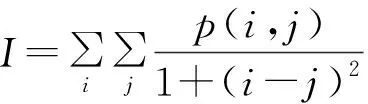
(7)
4 实验结果与分析
4.1 微丝纤维几何特征实验分析
本次实验分别从两组细胞切片组中随机选取两张切片图像(见图1 细胞I、II),按以上所述方法对细胞内微丝纤维数量、长度、宽度进行统计分析。
图4为选定的两个细胞切片中序号为1~32的微丝纤维的长度统计结果。从图中可清晰地看出细胞内微丝纤维的长度分布。细胞I的微丝纤维长度整体大于细胞II的微丝纤维长度,长度分布于15.53~174.87μm之间,其中最长的微丝长约174.87μm,贯穿整个细胞切面,其平均微丝纤维长度为41.63μm;细胞II的微丝纤维长度分布于6.83~92.25μm之间,其中最长的微丝纤维长度约92.25μm,平均微丝纤维长度为26.32μm。
图5为这两个细胞切面图像中微丝纤维的宽度统计结果。可见细胞I和细胞II中微丝纤维的宽度整体上相近。细胞I的微丝纤维宽度分布于0.03~0.18μm之间,平均宽度为0.08μm;细胞II的微丝纤维宽度分布于0.01~0.47μm之间,平均宽度为0.09μm。
表1为上述二个典型的细胞切片中微丝纤维的几何形态统计结果的特征值与样品实际参考值(括号中为计算值与实际值之间的相对误差),包括微丝纤维的数量、平均长度、平均宽度。从表中数据可以看出,计算值与实际参考值相近,误差较低,能够较为有效地对大鼠气道平滑肌细胞中微丝纤维进行数量、长度等几何特征统计。
表1大鼠气道平滑肌细胞中微丝纤维的几何特征实际值与计算值
Table1Actualvaluesandstatisticalvaluesofshapeandorientationofmicrofilamentsinairwaysmoothmusclecells
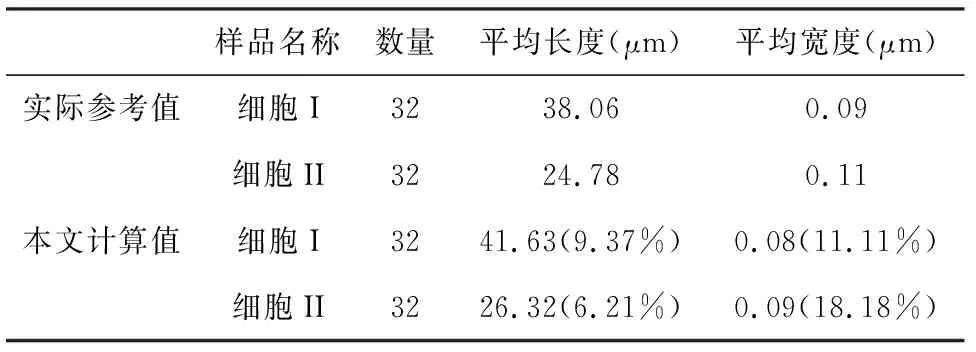
样品名称数量平均长度(μm) 平均宽度(μm)实际参考值细胞I3238.060.09细胞II3224.780.11本文计算值细胞I3241.63(9.37%)0.08(11.11%)细胞II3226.32(6.21%)0.09(18.18%)
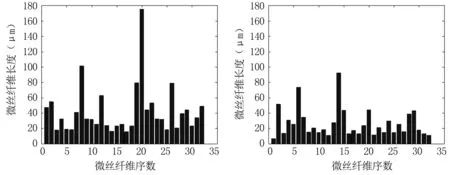
图4大鼠气道平滑肌细胞微丝纤维长度统计结果
细胞I(左)和细胞II(右)的微丝纤维长度分布
Fig4Thestatisticalresultsoflengthdistributionofthemicrofilaments.
The length distribution of microfilaments in cell I (left panel) and cell II (right panel)
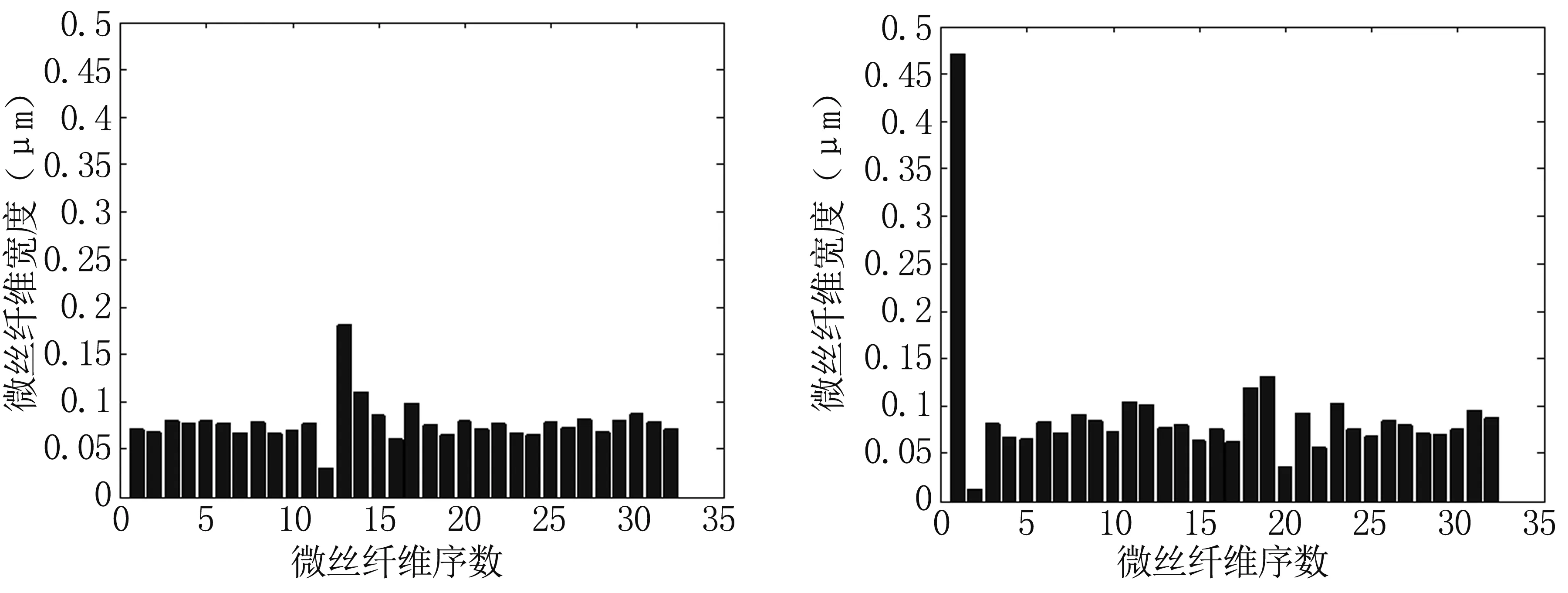
图5 大鼠气道平滑肌细胞微丝宽度统计结果细胞I(左)和细胞II(右)的微丝纤维宽度分布Fig 5 The statistical results of microfilaments in airway smooth muscle cells.The width distribution of microfilaments in cell I (left panel) and cell II (right panel)
4.2 微丝纤维分布特征实验分析
利用灰度形态学对图1中两组细胞图像分别作微小膨胀和微小腐蚀,仿真细胞微丝的生理、病理或应力响应的变化状态,并利用灰度共生矩阵进行分析这种变化。
图6为两组细胞的生理、病理或应力响应的变化仿真图像,对细胞I微丝二值图像进行微小膨胀,对细胞II微丝二值图像进行微小腐蚀。

图6大鼠气道平滑肌细胞微丝纤维生理、病理或应力响应的变化仿真图像
细胞I(左)做膨胀处理和细胞II(右)做腐蚀处理
Fig6Physiological,pathologicalorstressresponsechangingsimulationimageofthemicrofilamentsinairwaysmoothmusclecells
Expansion treatment in cell I (left panel) and Corrosion treatment in cell II (right panel)
表2为两组细胞纤维生理、病理或应力响应的变化仿真前后,灰度共生矩阵参数变化(括号中为各参数变化大小),从表中数据可以看出在模拟细胞行为变化前后,能量和熵值会根据仿真行为的变化而出现较为显著的变化,尤其是熵的相对变化分别达到了29.60%和37.11%。而逆差距则无明显变化。在对细胞I微丝做膨胀模拟实验时,会出现能量明显降低而熵值明显增大情况,分别改变了-7.06%和+29.60%;在对细胞II微丝做收缩模拟实验时,会出现能量明显增大而熵值明显降低情况,分别改变了+7.85%和-37.11%。
表2大鼠气道平滑肌细胞中微丝纤维生理、病理或应力响应的变化仿真前后灰度共生矩阵参数值
Table2GLCMvaluesofmicrofilamentsinairwaysmoothmusclecellswithchangesinphysiological,pathological,orstressresponse
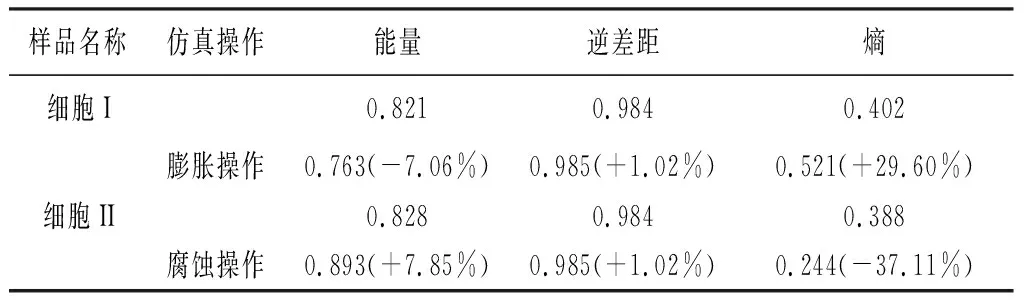
样品名称仿真操作能量逆差距 熵细胞I0.8210.9840.402膨胀操作0.763(-7.06%)0.985(+1.02%)0.521(+29.60%)细胞II0.8280.9840.388腐蚀操作0.893(+7.85%)0.985(+1.02%)0.244(-37.11%)
5 结论
通过形态学结合阈值分割对大鼠气道平滑肌细胞内部微丝纤维的主干进行有效提取,并从形状特征的角度,以数量、长度、宽度三个特征量对细胞切面进行了形状特征的定量分析,从分析结果可以看出,所给出的方法能够较为精确地计算出细胞内部微丝长度、宽度等几何特征量,测量结果与实际结果相近,且利用几何形态学对图像进行微腐蚀和微膨胀的操作来进行纤维生理、病理或应力响应的变化仿真实验。通过灰度共生矩阵计算仿真前后变化发现,在模拟微丝膨胀和收缩行为时,能量和熵会发生明显变化。形态特征作为几何特征可以直观描述细胞内部微丝纤维的形态变化,且结合纹理特征能够作为纤维生理、病理或应力响应的区域特征变化依据,在细胞指定切面分析这种变化,有利于研究者们从二维平面的角度对细胞进行全面分析。
