人全血IL-1β ELISA法在医疗器械热原体外检测的应用
2015-10-19范春光孙立魁刘增祥刘成虎李春令侯丽
范春光,孙立魁,刘增祥,刘成虎,李春令,侯丽
(山东省医疗器械产品质量检验中心; 山东省医疗器械生物学评价重点实验室,山东 济南 250101)
1 引 言
热原检测是医疗器械生物学评价中的重要项目。目前,医疗器械热原检测试验有两种:细菌内毒素检测法(鲎试剂法)和兔法。2009年,欧洲药典收录了体外热原检查法,美国FDA也接受了5种基于人免疫细胞的注射用药热原体外试验法[1]。研究[2]表明,人全血IL-1β ELISA试验是较为理想的体外检测法。但是,此方法并未在医疗器械领域广泛应用。本实验中,我们验证了人全血IL-1β试验应用于医疗器械热原检测的可行性,并对该法中人全血与样品直接孵育(直接接触法)测得的内毒素当量和人全血与样品浸提液孵育(浸提液法)测得量进行了比较与分析。此方法有很好的应用前景,某一试验样品在经过特异性确认后,可以应用此方法作为以上两种方法的替代方法。
2 试验材料及仪器
2.1 试验材料
人抗凝新鲜全血(至少4人混合),无菌无热原生理盐水(山东华鲁制药有限公司,批号:1311182161),人IL-1β ELISA试剂盒(ExCell,批号:ZJBIBZAD03),脂多糖O113(LPS O113)(LIST BIOLOGICAL,批号:4331B1),脂磷壁酸(LTA)(SIGMA,批号:044M4000V),一次性使用无菌无热原输液器为市售商品。
2.2 仪器
采血管(BD,K2EDTA,批号:4034487),采血针(BD,0.6×20mm×180mm,批号:1349187),无菌无热原1.5mL反应管(AXYGEN,批号:311-08-081),15mL反应管(AXYGEN,批号:100525-02904),微量移液器(eppendorf,1μL-5mL),无菌无热原枪头(200μL,KG1232,批号:130714;1mL,KG1232,批号:130105),离心机(SIGMA,型号:1-14K),37°C培养箱(memmert,型号:ICP700),250°C烘箱(BINDER,型号:FED240),酶标仪(Thermo,型号:Multiscan MK3)。
3 试验方法
3.1 样品制备
在洁净室洁净工作台内用经除热原处理的手术剪、镊子(250℃,30 min)剪取无菌无热原输液器滴斗部分,裁剪至0.5 cm×0.5 cm大小数十片备用。用无菌无热原生理盐水溶解LPS O113稀释至2 ng/mL,用微量移液器吸取10 μL溶液小心置于输液器滴斗小片上,洁净工作台内过夜晾干,制备LPS O113阳性样品A。用无菌无热原生理盐水溶解LTA稀释至2 mg/mL,用微量移液器吸取10 μL溶液小心置于输液器滴斗小片上,过夜晾干,制备LTA阳性样品B。孵育前1 h,按照细菌内毒素检查法要求制备样品浸提液。取阳性样品A10片加入1 ml生理盐水,置于37℃孵育1 h后,震荡得到样品浸提液C,同法制备样品B浸提液D。
3.2 加样孵育
3.2.1分别将100 μL浓度为0、25、50、100、200、400、800 pg/mL的LPS O113(溶于生理盐水)加入盛有1 ml生理盐水的1.5 ml反应管中,标记为R0、R1、R2、R3 、R4、R5、R6,每种浓度平行制备3管,用于制作浓度反应标准曲线。
3.2.2取1.5 ml反应管,加入1.1 ml生理盐水,再分别加入样品A、B,各平行制备3管。取1.5 ml反应管,加入1 ml生理盐水,分别加入样品A、B,再加入100 μL R3(100 pg/mL),用于计算内毒素回收率,各平行制备3管标记为A+、B+。取1.5 ml EP管加入1 ml生理盐水,再分别加入100 μL浸提液C、D,各平行制备3管。另取EP管,加入900 uL生理盐水,后分别加入100 μL浸提液C、D,再加入100 μL R3(100 pg/mL),用于计算内毒素回收率,各平行制备3管标记为C+、D+。在加入血液之前,混合物要在无菌操作台放置至少1 h。
3.2.3选取4名健康志愿者(24-29岁,两周内未服药)采用无菌、无热原抗凝采血管静脉采血,采血后经白细胞分类计数排除感染,等体积混合,4 h内使用。将100 μL混匀的抗凝鲜血加入到每一个反应管内,使总体积为1 200 μL,盖上各反应管,轻轻混匀。
3.2.4将反应管静置于37℃,5%CO2潮湿培养箱内过夜(14-24 h),13 000 g离心2 min,取上清。
3.3 检测
按人IL-1β ELISA试剂盒说明书操作,测定各反应管上清IL-1β的含量。
3.4 计算
3.4.1根据试剂盒中IL-1β标准品浓度梯度与相应的吸光度值(OD值)建立标准曲线。根据得到的回归方程计算各反应管内IL-1β的含量。
3.4.2根据不同浓度梯度的内毒素O113的量与相应的IL-1β的含量建立标准曲线并计算回归方程。
3.4.3计算试验溶液的内毒素当量及其内毒素回收率。当回收率在50%~200%之间,则认为在此试验条件下,试验溶液不干扰试验系统。
3.4.4对直接接触法测得的内毒素当量和浸提液法测得量进行比较与分析。
4 结果
4.1根据试剂盒中IL-1β标准品浓度梯度(y)与相应的吸光度值(OD值)(x)建立了标准曲线1(见图1)。线性回归方程为:y=400.84x-48.18,R2=0.999。
4.2根据以上回归方程计算得到各反应管内IL-1β的含量,根据不同浓度梯度的内毒素O113的量(x)与相应的IL-1β的含量(y)建立标准曲线(见图2),并得到回归方程:y=226.45Ln(x)-1020.40,R2=0.96。
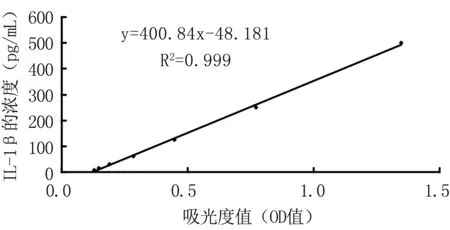
图1 IL-1β检测标准曲线
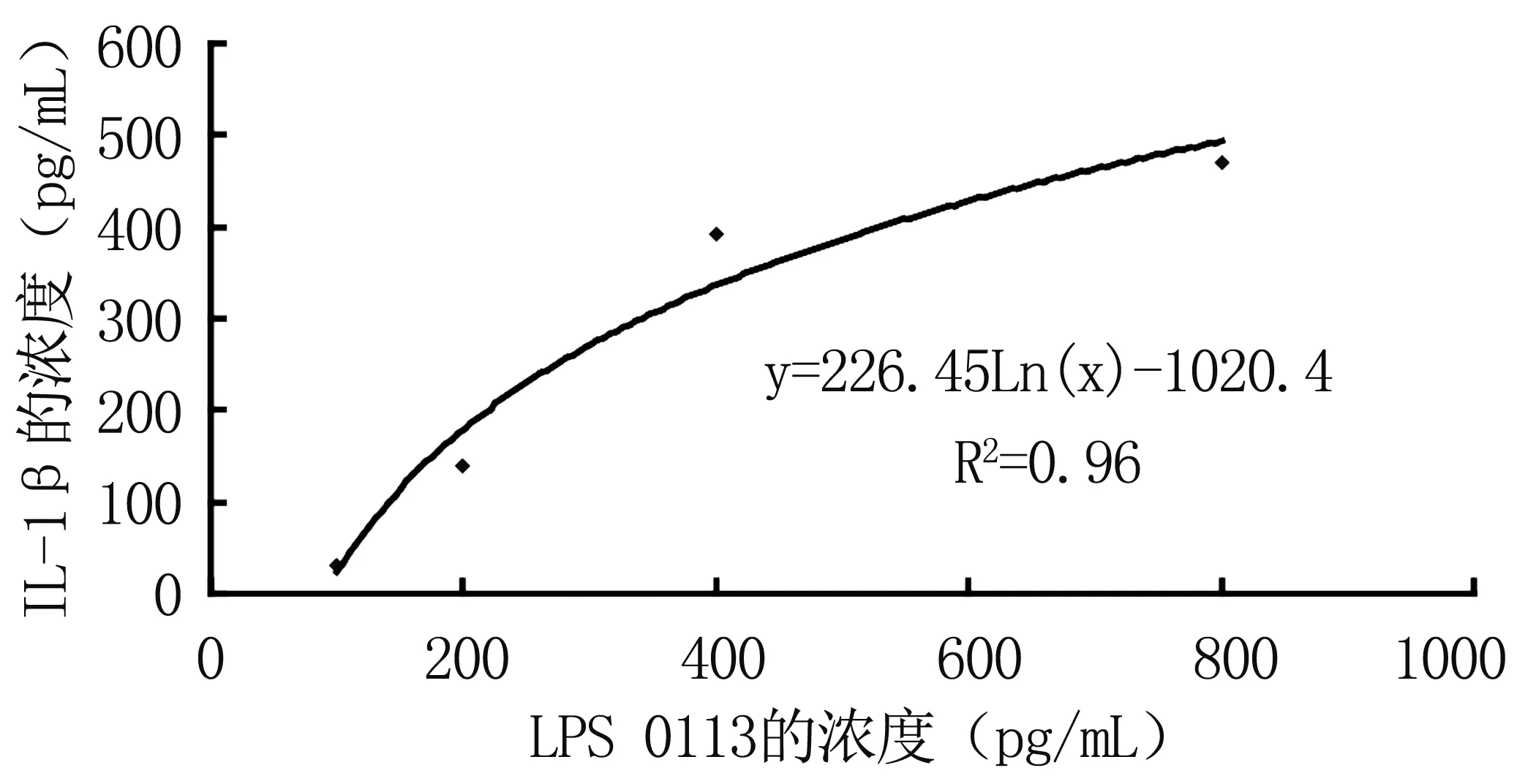
图2 IL-1β回归方程曲线
4.3根据曲线回归方程得到了试验溶液的内毒素当量平均值及回收率见表1。
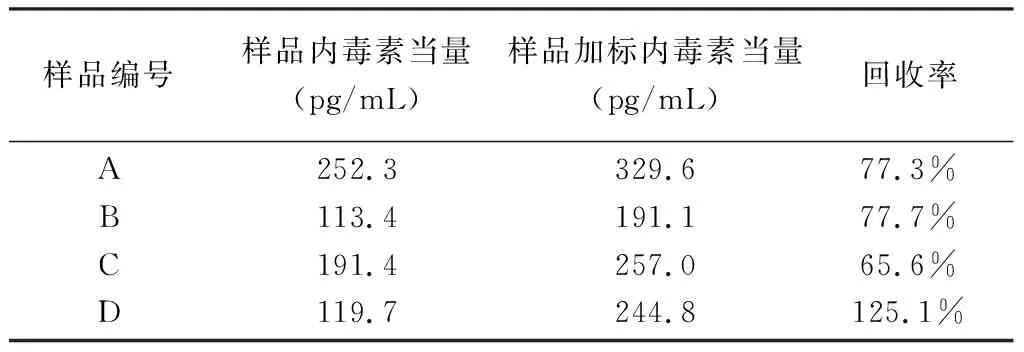
表1 各试验溶液内毒素当量及回收率
4.4样品A、B直接接触法与浸提液法的测得结果对比见表2。
表2直接接触法与浸提液法的测得结果对比
Table2Comparisonoftheresultsbetweendirectcontactmethodandextractmethod
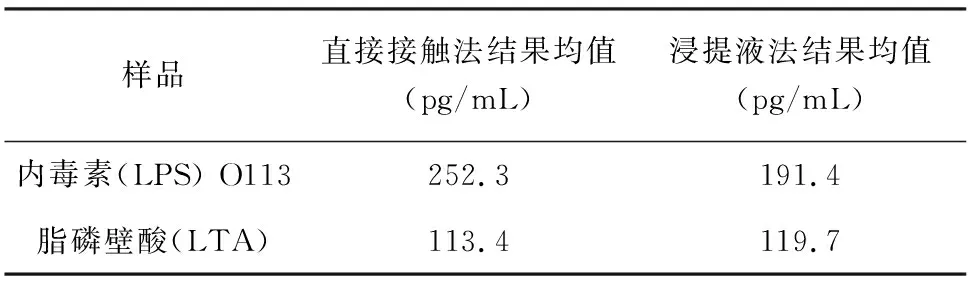
样品直接接触法结果均值(pg/mL)浸提液法结果均值(pg/mL)内毒素(LPS) O113252.3191.4脂磷壁酸(LTA)113.4119.7
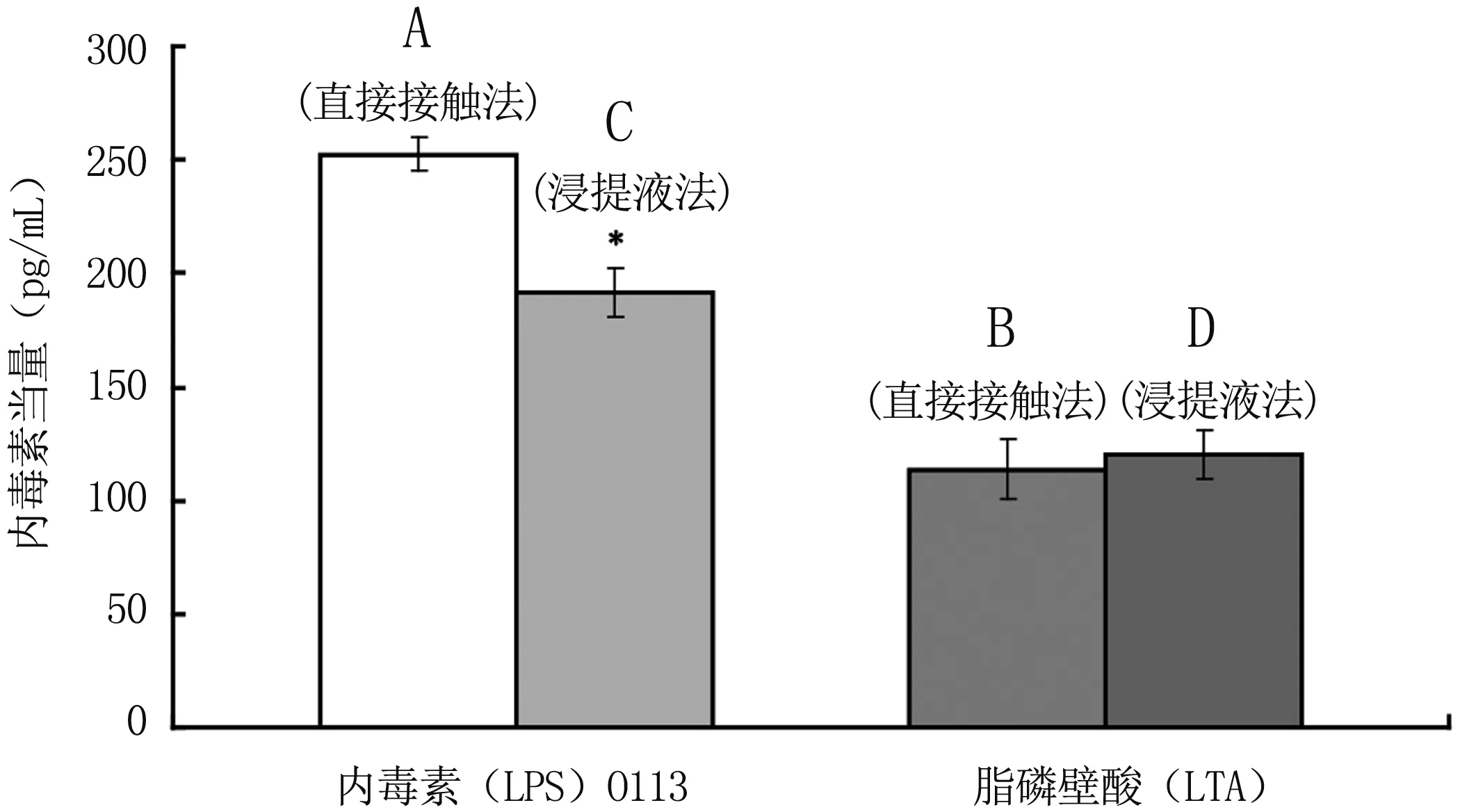
图3直接接触法与浸提液法的测得结果对比
Fig3Comparisonoftheresultsbetweendirectcontactmethodandextractmethod
5 讨论
人全血IL-1β ELISA法是单核细胞激活试验(MAT)的一种。热原物质进入人体后,会激活单核细胞使其释放IL-1β、IL-6和TNF-α等细胞因子。MAT对以上细胞因子进行定量检测以间接反映热原物质的量。其中,IL-1β的检测具有较高的信噪比,是较好的细胞因子热原标志物。所以,人全血IL-1β ELISA法是单核细胞激活试验中最为理想的热原体外检测法。
在本实验中,我们制备了内毒素阳性样品和非内毒素阳性样品以及其浸提液。实验结果证明,以上样品均能采用人全血IL-1β ELISA法进行检测。在实际应用过程中,对于一些小型医疗器械如血管支架、角膜接触镜等可以采用直接接触法;对于不易直接接触的样品,可按照内毒素检查法制备样品浸提液后,采用此法进行检测。
本研究表明,在本实验系统内,100 pg/mL内毒素当量浓度的溶液即可稳定刺激人全血释放出可以检测到的IL-1β,在采用内毒素检查法中的细菌内毒素工作标准品替代LPSO113作为本法标准品的试验中,0.125 EU/mL的浓度即可被检测出。此试验的灵敏度完全能够满足检测要求。
本实验中,内毒素O113阳性样品组,人全血IL-1β法直接接触法测得的内毒素当量高于样品浸提液中的测得量;脂磷壁酸(LTA)阳性样品组,直接接触法测得值与浸提液测得值量相当。出现以上结果的原因可能是因为两种物质的溶解度不同导致的,按现有的浸提方法可能无法保证样品上的内毒素被完全浸提下来,而脂磷壁酸较易于浸提。研究表明,按照现有的浸提方法无法保证医疗器械中致热原,特别是其表面粘附的细菌碎片等残留物被有效浸提出来[3],而且有研究发现,移植物表面粘附的细菌碎片释放的内毒素是导致移植失败的重要原因[4]。人全血IL-1βELISA试验可以通过直接接触法进行更为有效地检测,而这一优势是传统方法所不具备的。
本试验证明,非内毒素类致热原如LTA也可使用本方法检测。本方法检测谱较宽,能够刺激人体产生IL-1β的热原物质,理论上均可通过本法检测出。另外,本法采用人全血检测,消除了种属差异的问题,而且也契合了“3R”原则,有利于动物福利的保护,也符合体外试验替代动物试验的大趋势。
相信经过后续工作的不断完善,热原体外检测法——人全血IL-1β法能够应用于医疗器械生物学安全评价系统中,为医疗器械的使用提供更为安全有效的保障。
