人心脏干细胞向心肌细胞分化的研究
2015-10-19侯红吕安林达晶侯兆蕾
侯红,吕安林,达晶,侯兆蕾
(第四军医大学,西安市第二医院,西安 710003)
1 引 言
心脏干细胞(Cardiac Stem Cells,CSCs)[1]是存在于心脏中具有自我复制、克隆形成、多向分化潜能的干细胞,具有显著定向分化为心脏细胞系趋势[2-4]。自体心脏干细胞移植治疗不存在伦理问题、无免疫排斥反应,具有更广泛的临床应用前景,将成为治疗心血管疾病理想的种子细胞。目前国内外关于心脏干细胞向心肌细胞诱导分化的研究较多,大多数为动物实验,且实验方法不同诱导分化的效率也颇有差异[5-6]。本实验将研究5-氮杂胞苷(5-azacytidine, 5-AZ)和血管紧张素II(Angiopoietin-2, Ang II)分别及其联合体外诱导人c-kit+CSCs向心肌细胞分化,通过Western Blotting检测诱导分化后细胞心肌特异性肌钙蛋白I (Cardiac Troponin I ,cTn I)、 缝隙连接蛋白43(Connexin43,Cx43)的表达;用流式细胞仪对不同诱导方案心肌细胞分化率进行分析,寻找提高诱导分化率的方案。
2 材料和方法
2.1 材料
实验细胞来自人右心耳组织经酶消化、培养、流式分选纯化的人心脏干细胞。
2.2 实验试剂
Ham’SF-12培养基(美国 Hyclone);DMEM/F-12培养基(美国 Hyclone);胎牛血清(FBS,美国 Hyclone);Humanβ-FGF(美国PeproTech);L-谷氨酰胺(美国Hyclone);Ⅱ型胶原酶(美国MP);0.05% 胰酶-0.02 mmol /L EDTA(美国Sigma);PE 标记 CD117(美国BioLegend);链霉素(科昊生物试剂公司);青霉素(科昊生物试剂公司);5-氮杂胞苷(5-AZA)(美国Sigma);血管紧张素 Ⅱ(Ang II)(美国Sigma);RIPA裂解液(江苏碧云天公司);BCA蛋白浓度测定试剂盒(江苏碧云天公司);BSA胎牛血清白蛋白(美国Sigma);肌钙蛋白I单抗(cTn I)(美国Abcam);缝隙连接蛋白43(Cx43)(美国Abcam);抗β-Tubulin兔多抗(北京康为世纪公司);山羊抗兔、小鼠Ig G HRP(北京康为世纪公司);山羊抗小鼠Ig G -FITC(北京康为世纪公司);山羊抗兔 Ig G-Cy3(北京康为世纪公司);5×蛋白上样缓冲液(江苏碧云天公司);ECL显影试剂盒(江苏碧云天公司);SDS-PAGE(晶彩生物公司)。
2.3 仪器
CO2细胞孵箱(HERA cell 150 德国 Thermo),超净工作台(SW-OJ-1F 苏净集团安泰公司),低温高速离心机(BiofugeStratos德国Thermo),流式细胞仪(FACSAria美国BD),高速离心机(BiofugeStratos)(德国Thermo),超纯水纯化系统(美国Millipore),电热恒温水温箱(SW2-261-79上海医用恒温设备厂),电泳仪(Power-Pzc)(美国Bio-RAD),UVP分析核酸蛋白凝胶成像系统(VVP)(美国BioSpectrum),转膜仪(TRANS-BLOT)(美国Bio-RAD)。
3 方法
3.1 人心脏干细胞向心肌细胞诱导分化
选取无菌分选纯化后融合90%左右的c-kit+CSCs进行诱导、分化,实验随机分为四组:(1)对照组(Control组 心脏干细胞培养液),(2)5-AZA诱导组(10 μmol/L),(3)Ang II诱导组(0.1 μmol/L),(4)5-AZA和Ang II联合诱导组(10 μmol/L +0.1 μmol/L)。对照组更换心脏干细胞培养液;5-AZA、Ang II单独诱导组诱导24 h后弃去诱导培养液,PBS洗涤2次,更换心脏干细胞培养液;5-AZA和Ang II联合诱导组24 h后,弃去5-AZA诱导培养液,PBS洗涤2次,更换Ang II诱导培养液,24 h后PBS洗涤2次,更换心脏干细胞培养液。诱导结束后,每隔2 d更换心脏干细胞培养液1次,在含5 %CO2/95 %空气的37℃恒温孵箱中培养4周。诱导4周后进行各项测定。
3.2 人心脏干细胞向心肌细胞诱导分化的测定
3.2.1诱导分化后心肌细胞特异蛋白cTn I、Cx43 Western Blot测定 收集诱导4周后各组细胞加入裂解液提取细胞总蛋白,12 000 rpm,4℃离心20 min。上清液1∶4加入5×蛋白上样缓冲液混匀,100℃沸水煮10 min,冷却后- 20℃保存备用。配胶、上样、电泳,溴酚蓝指示条带距离玻璃板下端1.0 cm时关闭电源开关停止电泳并转膜。立春红染色后5 %脱脂奶粉封闭。分别孵一抗(Cx43 1∶5000、cTn I 1∶2000、抗β-tublin 1∶4 000),摇床4℃过夜。孵二抗: HRP标记的山羊抗兔、小鼠Ig G二抗(1∶2 000),室温摇床慢摇孵育1 h。加入显影剂,放于凝胶成像系统中曝光成像。
3.2.2诱导分化后心肌细胞分化率流式细胞学测定 0.05 %胰酶-0.02 mmol /L EDTA 1 ml消化收集诱导4周的细胞。PBS洗涤调整细胞悬液密度约1 ×106个细胞 /ml,加入0.1 % TritonX-100室温孵育,PBS洗涤重悬滴加cTn I抗体,37℃孵育1 h,再加FITC标记的山羊抗小鼠Ig G,37℃避光孵育30 min,4 %多聚甲醛固定20 min。最后流式细胞仪测定各组FITC标记阳性细胞的比例。
4 统计学分析
所有实验数据采用SPSS16.0统计软件进行分析,实验数据采用均数±标准差(±S)表示,组间比较采用单因素方差分析(ANOVA)的Tukey检验,P<0.05为具有统计学差异、P<0.01为具有显著统计学差异。
5 结果
5.1 诱导分化后细胞cTn I、Cx43的表达
诱导4周后用Western blotting 法测定各组细胞心肌特异性蛋白cTn I、Cx43的表达。实验结果显示:四组细胞均有cTn I、Cx43表达,对照组表达最弱,5-AZA和Ang II联合组表达最强,5-AZA组表达高于Ang II组,Ang II组表达高于对照组,各组细胞中Cx43的表达量高于cTn I的表达(见图 1 a)。统计学分析cTn I、Cx43表达量,结果显示:5-AZA组、5-AZA和Ang II联合组蛋白表达高于对照l组,有显著统计学差异(P < 0.01);5-AZA和Ang II联合组蛋白表达高于Ang II组,有显著统计学差异(P < 0.01);5-AZA和 Ang II联合组蛋白表达高于5-AZA组,有统计学差异(P<0.05);5-AZA组蛋白表达高于Ang II组,有统计学差异(P<0.05);Ang II组蛋白表达高于Control组,有统计学差异(P<0.05)(见图 1b、c)。
5.2 诱导分化后心肌细胞分化率分析
采用流式细胞仪测定细胞FITC标记cTn I的表达,测定诱导4周后各组细胞心肌细胞分化率,分化率分别为:对照组37.1 %(见图2a)、5-AZA组59.2 %(见图2b)、Ang II组46.7%(见图 2c)、5-AZA和Ang II联合组68.6 %(见图 2d);各组细胞诱导分化率统计学分析结果显示:对照组(27.86±4.52)%、5-AZA组(52.71±7.40) % 、Ang II(40.48±7.02) %、5-AZA和Ang II联合组(64.74±6.11)%;5-AZA组、5-AZA和Ang II联合组心肌细胞分化率高于对照组,有显著统计学差异(P<0.01);5-AZA和 Ang II联合组心肌细胞分化率高于Ang II组,有显著统计学差异(P<0.01);Ang II组心肌细胞分化率高于对照组,有统计学差异(P<0.05); 5-AZA和 Ang II联合组心肌细胞分化率高于5-AZA组,有统计学差异(P<0.05);5-AZA组心肌细胞分化率高于Ang II组,有统计学差异(P< 0.05)(见图 2e)。
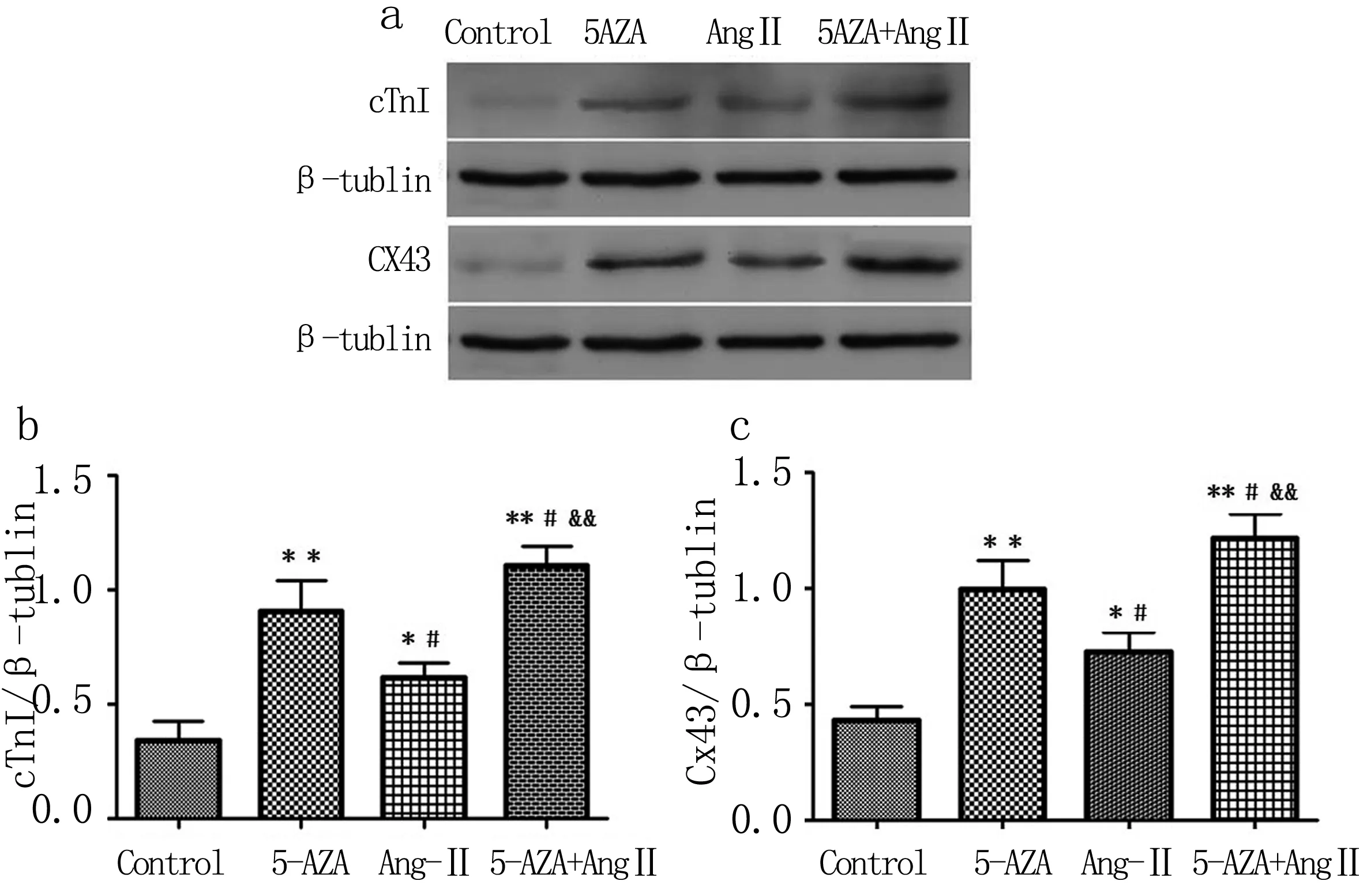
图1人c-kit+CSCs诱导4WcTnI、Cx43Westernblotting测定图
Fig1ElectrophoresisofcTnIandCx43proteinineachgroupinducedhuman
诱导4周后各组细胞cTn I、Cx43 Western blotting测定,每组细胞都有cTn I和Cx43表达,5-AZA和Ang II联合组表达最强,对照组表达最弱(a);各组细胞cTn I、Cx43蛋白定量统计分析图 (b、c);**P<0.01 vs Control组;*P<0.05 vs Control组;#P<0.05 vs 5-AZA组;&&P<0.01 vs Ang II组。
6 讨论
大量实验研究发现,心脏干细胞可以改善缺血性心肌病的心功能[7-8],是新兴治疗心血管疾病的种子细胞。但如无诱导分化因子(例如DMSO、BMP2、5-AZA)的存在,心肌干细胞分化成心肌细胞的阳性率较低。5-AZA、Ang II是经典的干细胞诱导剂,多见于骨髓间充质干细胞,胚胎干细胞等向心肌细胞分化。5-AZA具有一定的细胞毒性,借鉴大量的动物实验结果及本实验的预实验,诱导1 d细胞死亡率明显降低,同时诱导分化率较高,故本实验诱导时间为1 d。近些年的研究显示,5-AZA也可以诱导人CSCs向心肌细胞分化,相关机制不甚明确,可能机制为5-AZA是胞嘧啶核苷类似物,与DNA结合后具有抑制DNA甲基化作用,DNA去甲基化后可激活表型特异型基因[9],激活肌细胞特异基因的表达[10],如早期心肌形成转录因子GATA4和Nkx2.5基因表达[11-12],促进生肌调节因子MyoD的表达等,从而促进干细胞向心肌样细胞分化,也有研究表明Notch信号通路可能参与并发挥重要的作用[13-14]。Smits AM[15]和He Jiaqiang[16]等实验中5-AZA诱导人CSCs后心肌细胞分化率可高达70%左右,其原因可能是诱导时间不同,在相同诱导剂量的条件下,国外实验诱导时间多为3 d,本实验诱导时间为1 d,也可能是细胞种类相关,Smits AM在实验中用的是人Sca-1+CSCs。
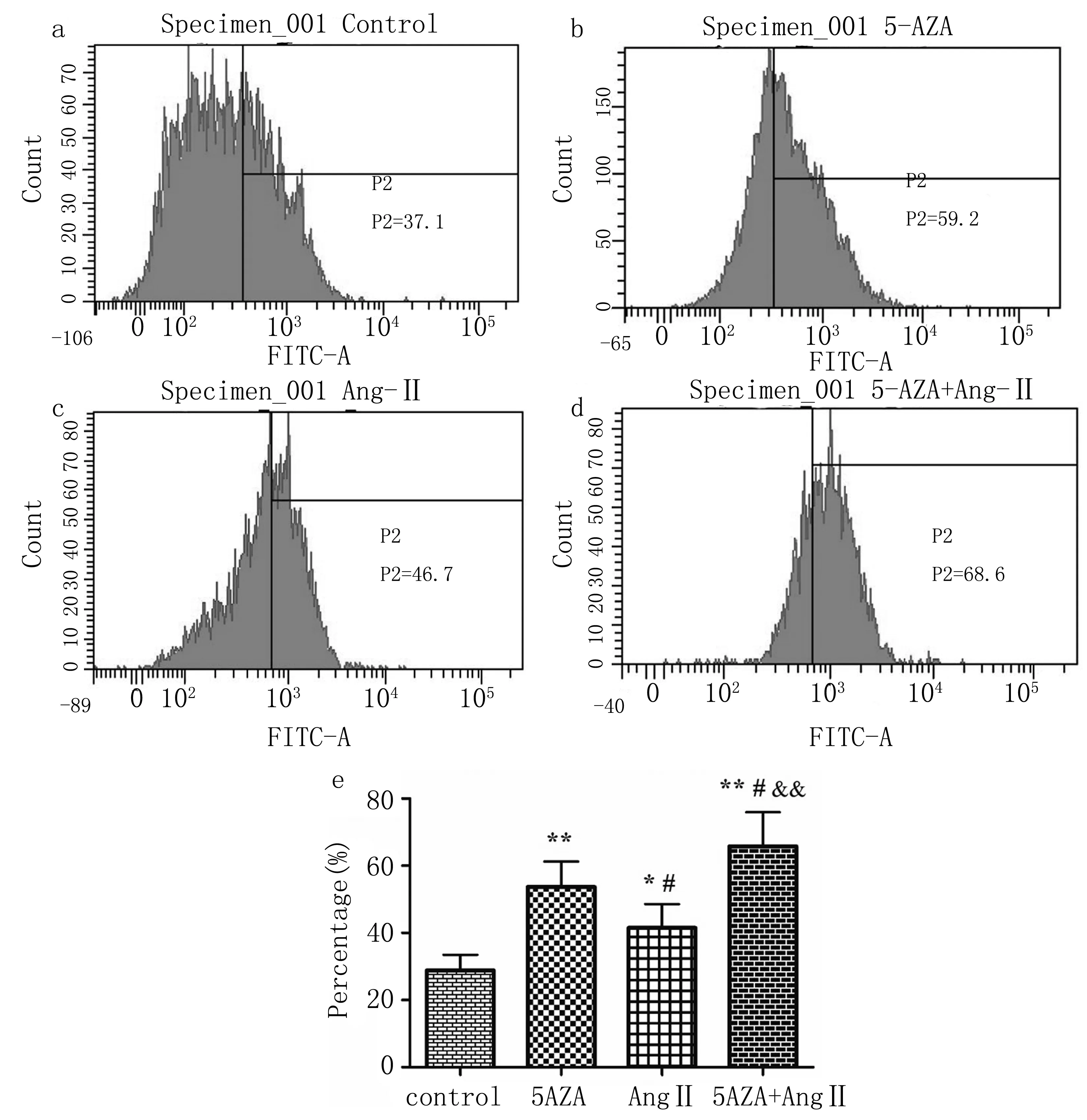
图2人c-kit+CSCs心肌细胞诱导分化率图( %)
Fig2HistogramofcTnIandCx43proteinineachgroupinducedhumanCSCS
诱导4周各组心肌细分化率流式细胞学测定,对照组37.1 %(a)、5-AZA组59.2 %(b)、Ang II46.7 %(c)、5-AZA和Ang II联合组68.6%(d);各组分化率统计分析(e)**P<0.01 vs 对照组;*P<0.05 vs 对照组;#P<0.05 vs 5-AZA组;&& P < 0.01 vs Ang II组。
Ang II是人体正常存在的一种多肽类激素,也是心肌细胞裂解液中的重要生物活性物质,参与构成心肌微环境,具有多种生物学效应。Ang II可诱导多种间充质[17]及胚胎干细胞向心肌样细胞分化,相关机制尚不十分清楚,可能因为Ang II与其受体结合后能活化多条信号通路,导致多种细胞活化[18]。Ang II可引起MAPK发生酪氨酸磷酸化活化ERK,通过激活ERK信号通路促进干细胞向心肌细胞分化[19],活化的ERK1/2也可移位入核,磷酸化一系列转录因子,引起细胞增殖、分化[20]。Ang II也可促进细胞β-TGF基因、β-TGF受体基因表达,从而通过PKA、PKC信号通路促进干细胞向心肌细胞分化[21]。目前,Ang II在CSCs诱导分化中鲜见,近期研究显示,CSCs细胞有Ang II受体[22],Ang II与CSCs表面受体结合后可能通过上述相同的机制诱导其向心肌细胞分化。近期的研究显示,Notch信号通路通过调节Nkx2.5基因表达,可促进CSCs向心肌细胞分化[23],相关机制有待于进一步研究。5-AZA和Ang II联合诱导人c-kit+CSCs分化为心肌细胞的分化率较高,其机制可能加强了某些共同的通路,也可能作用不同的独立通路而起到协同作用,其具体机制有待于进一步研究探讨。
