甲醇为原料联合制备碳酸二甲酯、甲缩醛和二甲醚反应体系热力学计算及节能分析
2015-10-17丁晓墅李乃华王淑芳赵新强王延吉
丁晓墅,李乃华,王淑芳,赵新强,王延吉
甲醇为原料联合制备碳酸二甲酯、甲缩醛和二甲醚反应体系热力学计算及节能分析
丁晓墅1,李乃华2,王淑芳1,赵新强1,王延吉1
(1河北工业大学化工学院,河北省绿色化工与高效节能重点实验室,天津 300130;2天津商业大学理学院,天津 300134)
围绕碳酸二甲酯的高效、绿色、安全、节能合成目标,构建了联合生产碳酸二甲酯、甲缩醛和二甲醚反应体系及节能工艺。借助Aspen Plus软件对独立反应及复杂体系进行了热力学分析。由结果可知,升高反应压力或降低温度可明显提高碳酸二甲酯的平衡组成;与甲缩醛和二甲醚合成工艺相耦合后,可大幅提升甲醇平衡转化率,由0.5%~5.9%提高到91.7%~96.3%。根据热力学计算结果和动力学因素,提出顺序生产碳酸二甲酯、甲缩醛和二甲醚的串联催化反应器工艺。甲缩醛和二甲醚的分离采用简单精馏方式,碳酸二甲酯和水共沸物的分离采用变压精馏,3种产品的质量浓度均可达到99%以上。可有效解决单独生产碳酸二甲酯和甲缩醛生产中原料循环量大、能耗高和易爆炸等缺陷。
碳酸二甲酯;甲缩醛;二甲醚;模拟;生产;化学过程
引 言
碳酸二甲酯(DMC)作为汽油添加剂,添加6%可使汽油的燃烧性能和抗爆性能得到明显改善[1];作为柴油添加剂,添加15%能较大幅度地降低柴油机的碳烟排放[2];甲缩醛(DMM)可作为潜在柴油添加剂,添加5%~10%可使发动机的碳烟排放明显下降,并使热效率有所提高[3-4],且可用于合成更具潜力的燃油添加剂聚甲醛二甲醚[5];二甲醚(DME)是一种多用途的清洁环保能源,作为新型清洁燃料可替代柴油或液化气[6]。
DMC被称为绿色化学品。其合成方法有光气法、酯交换法、甲醇-尿素法、甲醇-CO2法及甲醇氧化羰基化法等。其中,甲醇气相氧化羰基化合成法具有原料廉价易得、工艺路线简单及环境友好等特点。但是,该法存在甲醇单程转化率低,大量甲醇需要循环的问题。并且,由于循环混合物中有未反应的氧气,也会带来安全隐患。如王淑芳等[7-8]开发出的PdCl2-CuCl2-KOAc/AC催化剂,在150℃、0.3 MPa时,甲醇的单程转化率为10%,DMC空时收率为785 g·L-1·h-1。Yang等[9]对活性炭载体进行了预处理,认为碱性官能团有助于活性物质碱性氯化铜的形成。在130℃、常压条件下,甲醇的转化率为7.3%,DMC空时收率为390 g·L-1·h-1。在此基础上开发出PdCl2-CuCl2-KOAc/AC@Al2O3催化剂,反应过程热效应小,催化剂稳定性提高。在反应压力0.3 MPa、反应温度160℃,CH3OH/CO/O2=3.6/2.3/1,原料气空速7100 h-1时,DMC的最大空时收率为700 g·(L cat)-1·h-1,对甲醇和CO的选择性分别为98%和70%[10]。Richter等[11-12]制备出了无Cl的Cu(I)/Y分子筛,在170℃、1.2 MPa条件下,甲醇转化率为10%,DMC的空时收率为632 g·L-1·h-1;李忠等[13-14]利用焙烧CuCl2和酸性Y分子筛混合物制备出了CuІY型催化剂,在140℃、常压条件下,甲醇转化率为4.4%,DMC的空时收率为97 mg·g-1·h-1。
甲醇直接催化氧化合成DMM已成为研究者广泛研究的工艺,在经济性和环境上都较工业化的醇醛缩合法更为有利,但存在甲缩醛和甲醇分离困难等问题[15-16]。常见催化剂有Re系催化剂[17-19]、杂多酸催化剂[20-21]和钒钛催化剂[22-23]。郭荷芹等[24]研究发现V2O5/CeO2催化剂于160℃下催化合成DMM可获得17%的CH3OH转化率和89.8%的DMM选择性。陈文龙等[25]研究发现RuO2/Al2O3催化剂在120℃下催化合成DMM可获得15%的CH3OH转化率和81.1%的DMM选择性。
甲醇气相脱水法合成DME是国内外广泛使用的生产工艺。Mobil公司在常压、200℃条件下,以H-ZSM5为催化剂,甲醇转化率为80%,二甲醚的选择性大于99%。上海石油化工研究院[26]也已建成年产2000 t的DME脱水装置,甲醇转化率大于60%,二甲醚选择性大于99%,催化剂寿命可超过半年。史立杰等[27]开发了二氧化硅负载全氟磺酸树脂催化剂,在反应温度184℃时,取得甲醇转化率92%,二甲醚选择性接近100%,经350 h实验测试,活性和稳定性没有明显变化。Ladera等[28]开发了H4SiW12O40/ TiO2催化剂应用于此反应,在反应温度180℃时,也获得了比较理想的结果。
甲醇单程转化率低,必然带来原料大量循环而消耗能量的问题。为此,本文提出以甲醇为原料联合制备碳酸二甲酯、甲缩醛和二甲醚的工艺路线。在化学平衡计算的基础上,结合实验数据进行了能量分析。
1 联合制备碳酸二甲酯、甲缩醛和二甲醚工艺路线
DMC作为环境友好的燃油添加剂和DMM作为潜在的燃油添加剂,来提高汽油或柴油的性能。DME是一种清洁燃料,可替代柴油。它们主要用于解决燃油使用过程中带来的环境污染问题。并且,DMC和DMM作为混合添加剂可能弥补各自单独使用时的缺点。
甲醇氧化羰基化合成DMC的主反应式为
2CH3OH + CO + 1/2O2(CH3O)2CO + H2O
甲醇选择氧化合成DMM的主反应式为
3CH3OH + 1/2O2(CH3O)2CH2+ 2H2O
甲醇脱水合成DME的主反应式为
2CH3OH(CH3)2O + H2O
由此可见,它们的共同特点是均以甲醇为原料。因此,设计如图1所示的联合制备的工艺路线。反应器由三段串联组成,第1段装填甲醇氧化羰基化合成DMC催化剂(Ⅰ),第2段装填甲醇选择氧化合成DMM催化剂(Ⅱ),第3段装填甲醇脱水合成DME催化剂(Ⅲ)。通过氧化羰基化、氧化及脱水三段反应将甲醇全部转化,通过前两段反应将氧气全部转化,CO循环到反应器进口,作为合成DMC的原料。该工艺路线的目标是联合生产环境友好的燃油添加剂(DMC)、潜在燃油添加剂(DMM)和清洁燃料(DME),去除高耗能的甲醇循环过程,将氧气完全反应掉,保证分离过程的安全。
2 计算方法
热力学计算采用Aspen Plus软件。由Gibbs反应器(Gibbs reactor,RGibbs)模型,根据原子平衡准则,计算系统的Gibbs自由能趋于最小值时,相平衡和化学平衡的物料组成。由于体系内存在汽液平衡体系,故流程模拟中物性方法选为NRTL-RK。液相物流性质通过NRTL方程计算,气相物流性质选用RK方程计算。NRTL方程能以较少的特征参数关联推算混合物的相平衡,适用于非理想性较高的体系,借助二元参数直接推算出活度系数,推算出多元汽液平衡系统的性质。RK方程形式简单,参数可普遍化处理,仅需知道纯物质的临界数据就可应用,数学上可得到方程的解析解,适用于工程应用。通过状态方程和活度系数模型预测体系汽液相平衡。
NRTL模型(=0.3)计算液相组分活度系数

其中
G=exp(-) (2)

=0.3+d(-273.15K) (4)
RK状态方程的形式为
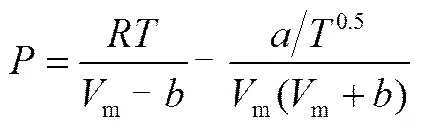
其中
(6)

(8)
(9)
3 结果与讨论
3.1 各反应的热力学性质
利用REquil模型计算了甲醇为原料制备DMC、DMM、DME反应体系主副反应的热力学性质。各反应如式(10)~式(15)所示,分别为甲醇氧化羰基化生成DMC、甲醇氧化生成甲酸甲酯(MF)、甲醇脱水生成DME、甲醇氧化生成DMM、CO氧化生成CO2、DMC水解生成甲醇和CO2。
2CH3OH + CO + 1/2O2(CH3O)2CO + H2O (10)
2CH3OH + O2HCOOCH3+ 2H2O (11)
2CH3OH(CH3)2O + H2O (12)
3CH3OH + 1/2O2(CH3O)2CH2+ 2H2O (13)
CO + 1/2O2CO2(14)
(CH3O)2CO + H2O2CH3OH + CO2(15)
图2为各个反应的反应热随反应温度的具体变化情况。可知,在考察的反应温度范围(360~600 K)内,除DMC水解反应(Rec-15)是吸热反应外,其余5个反应都是放热反应。DME的生成反应(Rec-12)为微放热反应。CO深度氧化反应(Rec-14)放热量最大,其次就是生成DMC反应(Rec-10),说明DMC的生成反应是个强放热反应,MF(Rec-11)和DMM(Rec-13)的生成反应放热值相对低些。因此,在催化剂开发、反应器设计及操作过程中,应重点考虑热量的转移,防止“飞温”现象的产生。
图3为各个反应的Gibbs自由能随反应温度的变化情况。可知,在考察的反应温度范围内,所有反应的Dr均小于0,即各个反应可自发进行。各曲线的斜率表示化学反应的Gibbs自由能对温度的敏感度,目标产物DMC的生成反应(Rec-10)的Gibbs自由能曲线的斜率最大,说明反应温度的变化对其平衡产率影响最大。其次是CO深度氧化反应(Rec-14)和DMC水解反应(Rec-15)。各反应容易进行的顺序为:Rec-11>Rec-14>Rec-13≈Rec-10> Rec-15> Rec-12,即MF的生成反应较易发生,其次是CO深度氧化反应,然后才是DMC的生成反应,且与DMM的生成反应接近。所以需要选择适宜的催化剂,从动力学角度选择性地催化主反应,加快主反应的速度,抑制副反应。
3.2 甲醇氧化羰基化复杂物系化学平衡组成
根据甲醇气相氧化羰基化合成碳酸二甲酯的实验结果[5-6],在PdCl2-CuCl2-KOAc/AC催化剂上,反应体系的主要生成物有DMC、MF、CO2和H2O。反应物为甲醇、CO和O2。根据甲醇气相氧化羰基化催化合成DMC的适宜反应条件,在原料进料比为CH3OH:CO:O2=4:2:1 时,利用RGibbs模型计算了平衡组成随反应温度和压力的变化关系,结果如表1所示。
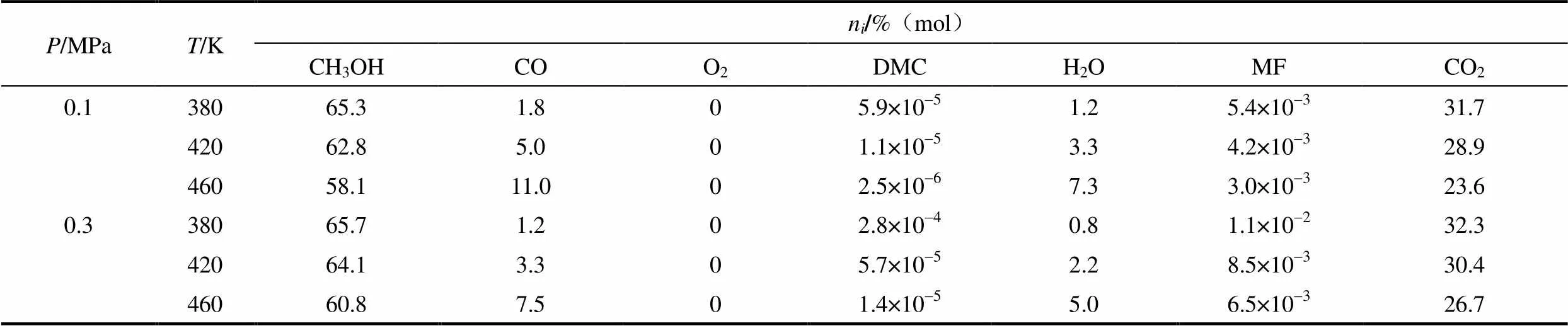
表1 PdCl2-CuCl2-KOAc/AC催化剂上复杂物系的化学平衡组成
可知,在达到化学平衡时,PdCl2-CuCl2- KOAc/AC催化剂上的主要产物为CO2和H2O,目标产物DMC和副产物MF的平衡组成很低。但MF组成高于DMC两个数量级左右;反应温度的升高使DMC平衡组成明显下降,副产物MF平衡组成也在下降,但下降幅度较小。随着反应压力的升高,DMC的平衡组成明显上升,MF的平衡组成也呈上升趋势,但上升幅度较DMC小。在420 K时,反应压力从0.1 MPa增加到0.3 MPa(实验条件)时,DMC的组成增加了5倍。因此,在实际反应中要注意控制反应温度和压力。从表1还可以看出平衡转化率随反应温度和反应压力的变化。O2的平衡组成为零,说明其已完全转化。图4和图5分别列出了甲醇和CO平衡转化率的变化。CH3OH的平衡转化率较小,且随反应温度的升高而增大,表明其氧化生成水和CO2占有优势。随反应压力的变化趋势正好相反,在0.1 MPa、460 K时,CH3OH的理论转化率最高为5.90%。CO的平衡转化率随反应温度的增大而急剧下降,在0.1 MPa下,360 K时CO的理论转化率为97.0%,增高到460 K时下降到64.5%;随反应压力的增加而提高,且在反应温度较高时,CO的平衡转化率的增加量更大。总之,从热力学分析角度而言,O2是可以完全转化的,这样可保证在反应后续处理过程中无O2,避免爆炸,提高安全性。
综上所述,在热力学上,低温、高压有利于提高DMC的平衡组成;DMC平衡组成对温度和压力的敏感度高于副产物MF,应注意控制反应温度和压力。甲醇平衡转化率较低,应考虑其提高方法。
3.3 联合生产DMC、DMM和DME体系的化学平衡组成及可行性分析
如3.2节所述,在甲醇氧化羰基化合成碳酸二甲酯反应体系中,甲醇单程平衡转化率很低,在360~460 K温度范围为0.5%~5.9%。有大量未反应甲醇原料要循环使用。该过程需要进行冷凝分离和再进料升温,以及动力输送等,消耗大量能量。因此,为了实现其节能,必须提高甲醇单程转化率,减少循环量。利用RGibbs模型计算了平衡组成随反应温度和压力的变化关系,结果如表2所示。

表2 联合生产碳酸二甲酯、甲缩醛和二甲醚反应体系的平衡组成Table 2 Chemical equilibrium composition of combined production of DMC, DMM and DME from methanol
进一步计算原料CH3OH、O2和CO平衡转化率随反应温度和反应压力的变化情况,结果如图6和图7所示。与图4和图5中甲醇氧化羰基化合成DMC反应体系平衡转化率对比,可以看出,联合制备碳酸二甲酯、甲缩醛和二甲醚反应体系使甲醇平衡转化率显著提高,在0.1 MPa、460 K时,由5.9%提高到91.7%;随反应温度的升高而降低,随反应压力的变化不明显。同时,CO平衡转化率也明显提高,由64.5%提高到93.1%。这说明联合生产DMC、DMM和DME复杂反应系统在热力学上是可行的,明显减少甲醇的循环量,达到节能目的。
3.4 联合生产DMC、DMM和DME工艺过程节能分析
甲醇气相氧化羰基化生产DMC和甲醇直接氧化生产DMM均存在分离困难、工艺复杂和能耗高等缺点。通过热力学计算已验证联合生产DMC、DMM和DME工艺是可行的,结合反应方程式及动力学匹配情况,模拟计算在原料进料比为CH3OH:CO:O2=8:2:1时的联合生产工艺过程,并进行能量消耗分析。复杂体系中碳酸二甲酯和水存在共沸体系,采用UNIFAC-DMD法预测其汽液平衡数据。在常压下,水和DMC于360.45 K形成DMC浓度为57%的共沸物,在0.9 MPa时,水与DMC形成DMC浓度为39%的共沸物。共沸物的分离不能仅凭借简单精馏塔,需采用强化精馏或其他手段,如常用的萃取精馏、变压精馏、反应精馏和共沸精馏等。DMC和水共沸物组成随压力的变化满足变压精馏的操作要求,即压力的变化应使共沸组成的变化大于5%;故DMC和水共沸物分离采用变压精馏方式进行[29]。
3.4.1 模拟流程建立
图8列出了甲醇联合生产DMC、DMM和DME的工艺流程图。原料CH3OH、CO和O2混合后进入预热器(E-1)预热形成混合物料流股(S-1),随后进入DMC合成反应器(R-1)、DMM合成反应器(R-2)和DME合成反应器(R-3),反应器出口物料(S-4)经过冷凝器(E-2)和分离器(V-1),分成气相物流(RE-CO)和液相物流(S-6)。液相产物流经过泵(P-1)改变压力后,通过DME精馏塔(T-1)后得到产品DME;其他产品物流(S-8)经DMM初精馏塔(T-2)后得到部分产品DMM,进一步经DMM吸收分离塔(V-2)后分离得到其余产品DMM;含有DMC和H2O的产品经DMC常压精馏塔(T-3)和高压精馏塔(T-4)分离后,即得到产品DMC和水相物流。各模块的模拟条件如表3所示,其中各反应器的条件来源于文献[8,13-14],认为无其他副反应发生,并对实验进行理想化处理,即DMC合成反应器中DMC的选择性为100%,DMM合成反应器中O2的转化率为100%,DME合成反应器中CH3OH的转化率为100%。
E-1—heat exchanger;R-1—reactor of DMC;R-2—reactor of DMM;R-3—reactor of DME;E-2—condenser;V-1—flash chamber;P-1~P-3— pump;T-1—rectifying tower of DME;T-2—rectifying tower of DMM;V-2— separator of DMM; T-3— normal pressure rectifying tower of DMC; T-4—variable pressure rectifying tower of DMC

表3 流程中各模块的模拟条件Table 3 Process conditions for each block
3.4.2 模拟结果
联合生产反应体系模拟流程中各个原料和产品流股及中间流股的物料组成及焓值如表4和表5所示,分离工段精馏塔的操作参数及能耗如表6所示。可以看出,DMM和DME的分离采用简单精馏方式,DMC和H2O共沸物的分离采用变压精馏,经分离工段后3种产品的质量分数均可达到99%以上;但是,通过变压精馏后,水相出口物流中仍含10%的碳酸二甲酯。经过构建联产工艺,可将原料甲醇和氧气的利用率最大化,物料焓值转化率最高,有效解决未反应原料循环量大、能耗高和易爆炸等缺点。

表4 甲醇为原料合成DMC、DMM和DME工艺流程中各个原料和产品流股的物料组成Table 4 Composition of various streams of raw material and product in process of gas-phase oxidative carbonylation of methanol to DMC synthesis
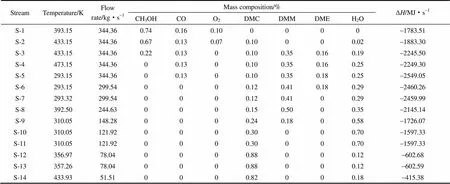
表5 甲醇为原料合成DMC、DMM和DME工艺流程中各个中间流股的物料组成Table 5 Composition of various streams of intermedium in process of gas-phase oxidative carbonylation of methanol to DMC synthesis

表6 精馏塔的操作参数和热负荷Table 6 Operation parameters and heat duty of distillation towers
4 结 论
围绕碳酸二甲酯的高效、绿色、安全、节能合成目标,在高选择性催化剂开发和复杂体系热力学分析的基础上,构建了联合生产(潜在)燃油添加剂碳酸二甲酯(DMC)、甲缩醛(DMM)和二甲醚(DME)反应体系及节能工艺(简称3DM工艺)。
(1)在PdCl2-CuCl2-KOAc/AC催化剂上,由反应物甲醇、CO、O2和生成物DMC、MF、CO2、H2O组成的复杂反应体系达到平衡时,目标产物DMC的平衡组成很低,主要为CO2和H2O副产物,说明合成DMC反应不宜在平衡条件下进行;升高反应压力和降低温度可明显提高DMC的平衡组成;甲醇平衡转化率最高为5.9%,使原料大量循环而消耗能量;O2可完全转化,使分离过程安全化成为可能;CO的平衡转化率最高为97.0%,但应注意抑制其完全氧化反应。
(2)在甲醇氧化羰基化合成DMC的基础上,将其与甲醇氧化合成DMM反应和甲醇脱水合成DME体系耦合,构建联合生产(潜在)燃油添加剂DMC、DMM和DME的复杂反应体系。该体系使甲醇平衡转化率显著提高,由0.5%~5.9%提高到91.7%~96.3%,可明显减少甲醇原料的循环量而实现节能;生成物中目标产物的平衡组成为:DME≫DMM>DMC;根据此规律及动力学因素,提出了按DMC→DMM→DME顺序的串联催化反应器工艺(3DM工艺)。
(3)借助Aspen Plus软件,对3DM工艺流程中反应工段和分离工段进行模拟。DMM和DME的分离采用简单精馏方式,DMC和H2O共沸物的分离采用变压精馏,经分离工段后3种产品的质量浓度均可达到99%以上。可有效解决单独生产DMC和DMM中原料循环量大、能耗高和易爆炸等缺陷。
References
[1] Wang Guoliang(王国良), Li Chaoheng(李朝恒), Pei Xudong(裴旭东), Meng Fandong(孟凡东). Synthesis of dimethyl carbonate by catalytic coupling reaction and its use as gasoline additive [J].(石油炼制与化工), 2003, 34(9): 40-43.
[2] Yao Bo(姚波), Pan Keyu(潘克煜), Shi Kefeng(石科峰), Ma Zhen(马震). Investigation on combustion and emissions characteristics of diesel fuel and dimethyl carbonate blend fuel [J].(内燃机学报), 2003, 21(2): 101-105.
[3] Zhang Guangde(张光德), Xia Xinxiang(夏新祥), Qiao Xinqi(乔信起), Fang Junhua(方俊华). Effect of methylal fuel additive on performances of diesel engine [J].(内燃机工程), 2005, 26(2): 37-39.
[4] Hartl M, Seidenspinner P, Jacob E, Wachtmeister G. Oxygenate screening on a heavy-duty diesel engine and emission characteristics of highly oxtgenated oxymethylene ether fuel OME1 [J]., 2015, 153: 328-335.
[5] Wu J B, Zhu H Q, Wu Z W, Qin Z F, Yan L, Du B L, Fan W B, Wang J G. High Si/Al ratio HZSM-5 zeolite: an efficient catalyst for the synthesis of polyoxymethylene dimethyl ethers from dimethoxymethane and trioxymethylene [J]., 2015, DOI: 10.1039/C4GC02510E.
[6] Zheng Xiaobin(郑晓斌), Huang Dafu(黄大富), Zhang Tao(张涛), Xu Yuting(徐玉婷), Xiao Ji(肖吉), Dong Lichun(董立春). Recent development of dimethyl ether synthesis: catalyst and production process [J].(化工进展), 2010, 29(2): 149-156.
[7] Wang Shufang(王淑芳), Zhao Xinqiang(赵新强), Wang Yanji(王延吉). Analysis of influencing factors on gas phase catalytic synthesis of dimethyl carbonate from methanol [J].(化学反应工程与工艺), 2004, 20(1): 29-35.
[8] Wang Shufang(王淑芳), Cui Yongmei(崔咏梅), Zhao Xinqiang(赵新强), Wang Yanji(王延吉). Analysis of deactivation of PdCl2-CuCl2-KOAc/AC catalyst for synthesis of dimethyl carbonate [J].()(化工学报), 2004, 55(12): 2008-2014.
[9] Yang P, Cao Y, Wei L D, Deng J F, Fan K N. Effect of chemical treatment of activated carbon as a support for promoted dimethyl carbonate synthesis by vapor phase oxidative carbonylation of methanol over Wacker-type catalysts [J].:, 2003, 243(2): 323-331.
[10] Ding X S, Dong X M, Kuang D T, Wang S F, Zhao X Q, Wang Y J. Highly efficient catalyst PdCl2-CuCl2-KOAc/AC@Al2O3for gas-phase oxidative carbonylation of methanol to dimethyl carbonate: Preparation and reaction mechanism [J]., 2014, 240: 221-227.
[11] Richter M, Fait M J G, Eckelt R, Schneidar M, Radnik J, Heidemann D, Fricke R. Gas-phase carbonylation of methanol to dimethyl carbonate on chloride-free Cu-precipitated zeolite Y at normal pressure [J]., 2007, 245(1):11-24.
[12] Richter M, Fait M J G, Eckelt R, Schreier E, Schreier M, Pohl M M, Fricke R. Oxidative gas phase carbonylation of methanol to dimethyl carbonate over chloride-free Cu-impregnated zeolite Y catalysts at elevated pressure [J].:, 2007, 73(3/4): 269-281.
[13] Li Zhong(李忠), Wen Chunmei(文春梅), Wang Ruiyu(王瑞玉), Zheng Huayan(郑华艳), Xie Kechang(谢克昌). Chloride-free Cu2O/AC catalyst prepared by pyrolysis of copper acetate and catalytic oxycarbonylation [J].(高等学校化学学报), 2009, 30(10): 2014-2031.
[14] Li Z, Wang R Y, Zheng H Y, Xie K C. Preparation of CuІY catalyst using CuCl2as precursor for vapor phase oxidative carbonylation of methanol to dimethyl carbonate [J]., 2010, 89(7): 1339-1343.
[15] Royer S, Sécordel X, Brandhorst M, Dumeignil F, Cristol S, Dujardin C, Capron M, Payen E, Dubois J L. Amorphous oxide as a novel efficient catalyst for direct selective oxidation of methanol to dimethoxymethane [J]., 2008, (7): 865-867.
[16] Chen S, Meng Y L, Zhao Y J, Ma X B, Gong J L. Selective oxidative of methanol to dimethoxymethane over mesoporous Al-P-V-O catalysts [J]., 2013, 59(7): 2587-2593.
[17] Yuan Youzhu(袁友珠), Cao Wei(曹为), Tsai Khi-Rui(蔡启瑞), Iwasawa Yasuhiro(岩泽康裕). Correlation of performance and structure of supported rhenium catalysts for methanol selective oxidation [J].(高等学校化学学报), 2002, 23(5): 902-905.
[18] Cao Hu(曹虎), Zheng Yan(郑岩), Ma Jun(马珺), Li Junping(李军平), Zhao Ning(赵宁), Wang Xiuzhi(王秀芝), Zhang Qitong(张启同). One-step synthesis of dimethoxymethane from methanol over ReO/ZrO2[J].(燃料化学学报), 2007, 35(3): 334-338.
[19] Li Huan(李欢), Li Junping(李军平), Xiao Fukui(肖福魁), Wei Wei(魏伟), Sun Yuhan(孙予罕). One-step synthesize of dimethoxymethane from methanol over Mn/Re/Cu catalysts [J],(燃料化学学报), 2009, 37(5): 613-617.
[20] Liu H C, Enrique I. Selective one-step synthesis of dimethoxymethanemethanol or dimethyl ether oxidation on H3+nVMo12-nPO40Keggin structures [J]., 2003, 107 (39): 10840-10847.
[21] Guo H Q, Li D B, Xiao H C, Zhang J L, Li W H, Sun Y H. Methanol selective oxidation to dimethoxymethane on H3PMo12O40/SBA-15 supported catalysts [J]., 2009, 26(3): 902-906.
[22] Fu Y C, Shen J Y. Selective oxidation of methanol to dimethoxymethane under mild conditions over V2O5/TiO2with enhanced surface acidity [J]., 2007, 21: 2172-2174.
[23] Lu X L, Qin Z F, Dong M, Zhu H Q, Wang G F, Zhao Y B, Fan W B. Selective oxidation of methanol to dimethoxymethane over acid-modified V2O5/TiO2catalysts [J]., 2011, 90: 1335-1339.
[24] Guo Heqin(郭荷芹), Li Debao(李德宝), Chen Congbiao(陈从标), Fan Zhihong(范志宏), Sun Yuhan (孙予罕). One-step oxidation of methanol to dimethyoxymethane on V2O5/CeO2catalyst [J].(催化学报), 2012, 33(5): 813-818.
[25] Chen Wenlong(陈文龙), Liu Haichao(刘海超). Selective oxidation of methanol to dimethoxymethane over RuO2/Al2O3catalysts [J].(化学反应工程与工艺), 2013, 29(5): 462-469.
[26] Cui Shichun(崔世纯), Hu Lizhi(胡力智), Zhu Dongmao(朱冬茂), Cheng Wencai(程文才). The process for making DME by catalytic dehydration of methanol in gas phase [J].(石油化工), 1999, 28(1): 43-45.
[27] Shi Lijie(史立杰), Li Chenjia(李晨佳), Chang Junshi(常俊石). Perfluorosulfonic acid resin catalyst for dimethyl ether synthesis by methanol dehydration [J].(化工进展), 2014, 33(8): 2066-2071.
[28] Ladera R M, Fierro J L G, Ojeda M, Rojas S. TiO2-supported heteropoly acids for low-temperature synthesis of dimethyl ether from methanol [J]., 2014, 312: 195-203.
[29] Holland C D, Gallun S E, Lockett M J. Modeling azeotropic and extractive distillations [J]., 1981, 88(6): 185- 200.
Thermodynamic calculation and energy saving analysis of combined reaction system for production of dimethyl carbonate, methylal and dimethyl ether from methanol
DING Xiaoshu1,LI Naihua2, WANG Shufang1, ZHAO Xinqiang1, WANG Yanji1
(1Hebei Provincial Key Laboratory of Green Chemical Technology and Efficient Energy Saving, School of Chemical Engineering and Technology, Hebei University of Technology, Tianjin 300130, China;2College of Science, Tianjin University of Commerce, Tianjin 300134, China)
To achieve the target of the efficient, green, safe and energy saving synthesis of dimethyl carbonate, a combined reaction system with energy saving is proposed for synthesis of dimethyl carbonate, methylal and dimethyl ether from methanol. Thermodynamics of single reaction and the complex system is analyzed by Aspen Plus software. The results show that there is thermodynamic equilibrium limit for the synthesis of dimethyl carbonate from methanol in gas phase, to improve significantly equilibrium concentration of dimethyl carbonate higher reaction pressure and lower reaction temperature is necessary, even so, large amount of unreacted methanol must be recycled which consume a lot of energy. When synthesis of dimethyl carbonate is combined with methylal and dimethyl ether synthesis, the equilibrium conversion of methanol can be improved observably from 0.5%—5.9% to 91.7%—96.3%. Based on the thermodynamic calculations and kinetics of these reactions, a series process of three catalytic reactors are proposed for synthesis of dimethyl carbonate, methylal and dimethyl ether in order, and the system including reaction and separation processes is simulated. The results show that the mixture of methylal and dimethyl carbonate can be separated by simple distillation and the separation of dimethyl carbonate-H2O azeotrpoe need to employ pressure swing distillation. Mass concentration of three products can be reached above 99%. The process proposed could effectively solve the problems as follows: recycle of large amount un-reacted materials, high energy consumption, easy explosion and so on, which exist in the process for detached production of dimethyl carbonate and methylal.
dimethyl carbonate;methylal;dimethyl ether;simulation;production;chemical processes
10.11949/j.issn.0438-1157.20141673
TQ 03-3
国家自然科学基金重点项目(21236001);高等学校博士学科点专项科研基金项目(20121317110009);河北省重大技术创新项目(12275603Z);天津市高等学校科技发展基金计划项目(20110519);河北省高等学校科学技术研究项目(QN2015163)。
2014-11-12.
Prof. WANG Yanji, yjwang@hebut.edu.cn
supported by the Key Program of the National Natural Science Foundation of China (21236001), the Specialized Research Fund for the Doctoral Program of Higher Education of China (20121317110009), the Major Technological Innovation Project of Hebei Province (12275603Z), the High School Science and Technology Fund Planning Project of Tianjin City (20110519) and the Project of Hebei Province Higher Educational Science and Technology Program(QN2015163).
A
0438—1157(2015)07—2377—10
2014-11-12收到初稿,2015-04-27收到修改稿。
联系人:王延吉。第一作者:丁晓墅(1985—),女,博士,讲师。
