3例微小肝癌MRI演变回顾并文献复习
2015-10-16许雅芳等
许雅芳等
[摘要] 本文回顾分析了2013年2月~2014年11月中国石油中心医院磁共振室收治的3例微小肝癌患者的临床资料,研究了微小肝癌的核磁共振成像(MRI)演变影像。结果显示病灶的初始发现异常均是T2WI,随病灶生长出现扩散受限表现,由此可见MRI对检出微小肝癌更具有优势。
[关键词] 微小肝癌;核磁共振成像;回顾性分析
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-7210(2015)09(b)-0158-04
MRI evolution of 3 cases of micro hepatocellular carcinoma and literature review
XU Yafang WANG Chengjian▲ YANG Jingzhen ZHANG Yu HUO Yingjie ZHAO Yongqiang
Department of Magnetic Resonance Imaging, CNPC Central Hospital, Hebei Province, Langfang 065000, China
[Abstract] This paper retrospectively reviewed the clinical data of 3 cases of small liver cancer from February 2013 to November 2014 in CNPC Central Hospital, and small liver cancer evolution of MRI images was studied, and the results showed that, initial lesions were T2WI, with the growth of lesions, diffusion was limited, thus MRI has more advantages in the detection of small liver cancer.
[Key words] Small liver cancer; Magnetic resonance imaging; Retrospective analysis
小肝癌的定义国内标准不一。以往曾将单发直径≤2.0 cm的肝癌定为微小肝癌[1]。2011年《原发性肝癌诊疗规范》将瘤体直径﹤1 cm定义为微小肝癌,1~3 cm称为小肝癌[2]。笔者对3例(4个)微小癌灶的MRI演变影像进行了回顾性分析,现报道如下:
1 病例资料
1.1 病例一
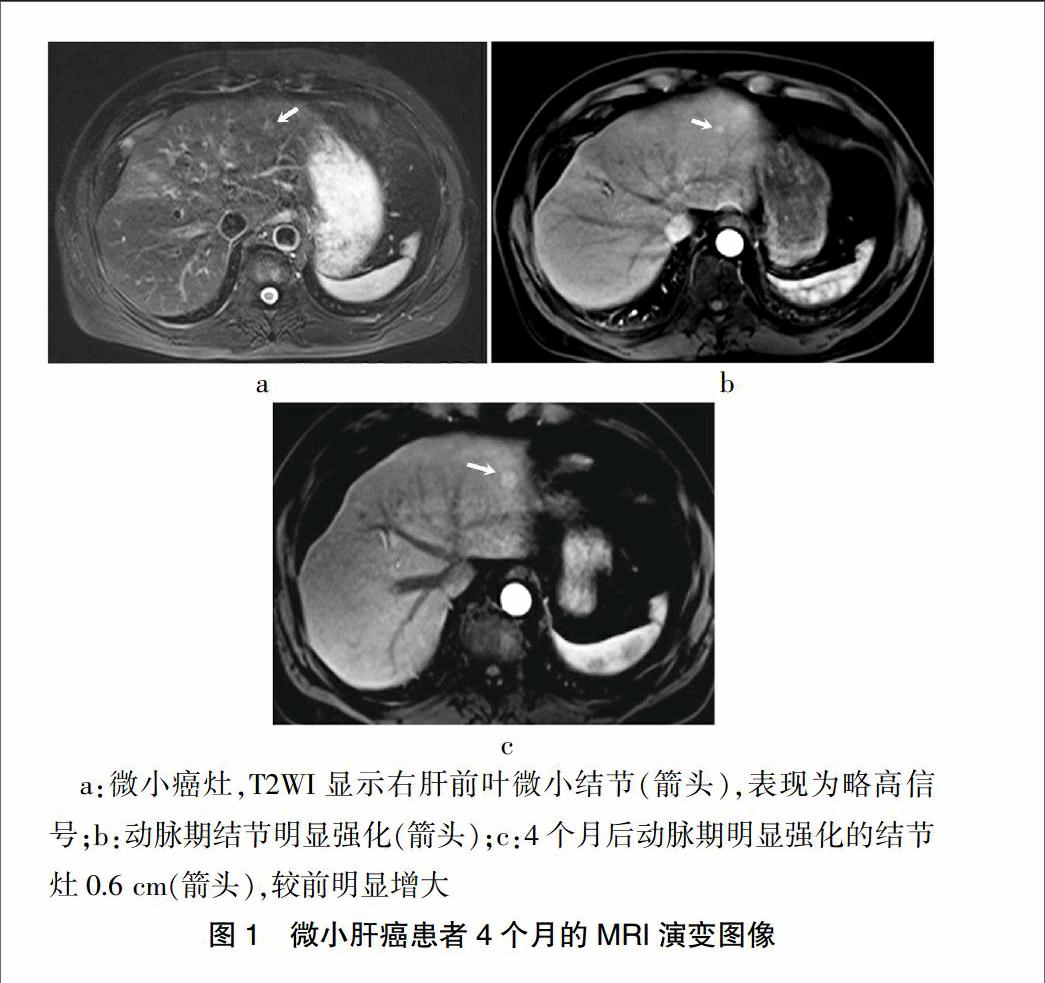
患者,男,47岁,因“腹胀”于2013年2月5日入院,入院诊断:乙肝。核磁共振成像(MRI)发现右肝0.4 cm微小点状灶,磁共振T2加权像(T2WI)略高信号,磁共振T1加权像(T1WI)略低信号,动脉期点状强化(图1a、b),门静脉期等信号。2个月后(2013年4月7日),病灶增大为0.5 cm,形状为结节状,与之前不同的是病灶在门静脉期廓清。4个月后(2013年8月5日),病灶大小增至0.9 cm(图1c),增强后期可见的假包膜。上述3个时期的病灶在磁共振弥散加权成像(DWI)均无扩散受限,甲胎蛋白(AFP)值均正常。CT碘油造影可见该病灶有明确的碘油沉积。患者接受射频消融治疗,至今健在。
1.2 病例二
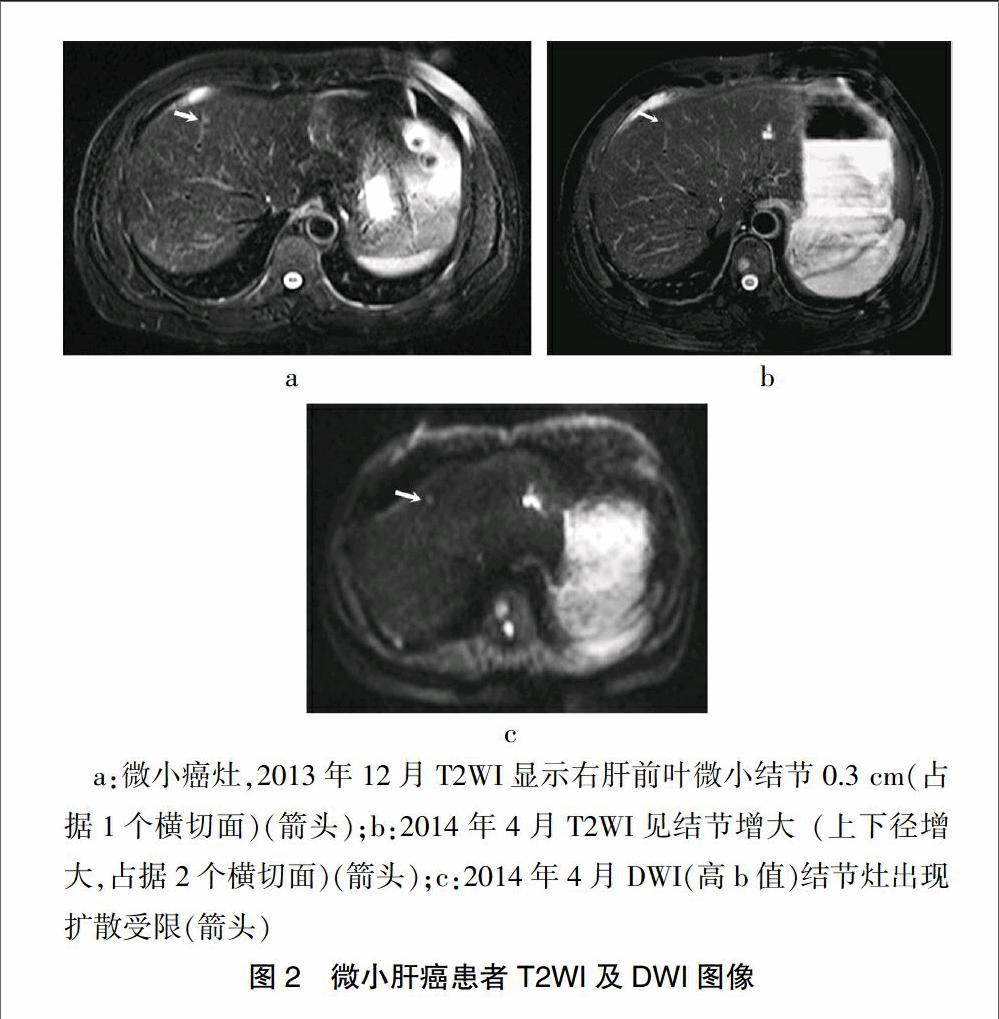
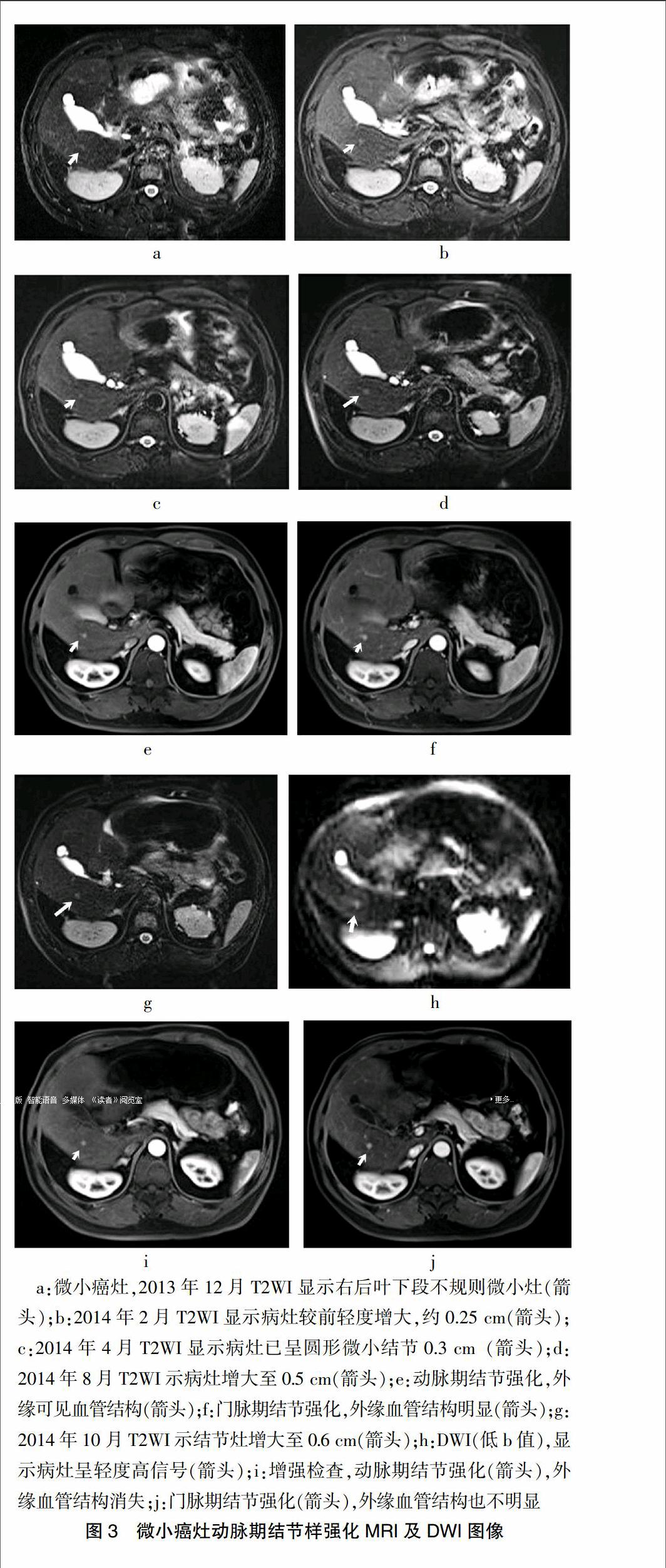
患者,男,48岁,因“消瘦、食欲减退”于2011年12月9日入院,入院诊断:乙肝、结节型肝癌。予结节型肝癌切除术,术后AFP由500 μg/L降至正常。2年后(2013年12月15日),患者AFP轻度升高(50 μg/L),MRI检查右肝前叶上段发现0.3 cm微小灶,T2WI为略高信号(图2a),DWI仅低b值为高信号,增强扫描无强化,高度疑似癌灶。4个月后(2014年4月13日)复查,病灶增至0.5 cm,DWI低、高b值均为高信号(图2b、c),增强扫描仍无强化(AFP值58 μg/L)。由于乏血供病灶,CT碘油造影不能提供帮助。即对病灶行经皮无水酒精消融术(PEI),术后AFP随即降至正常并持续一年半。之后,即2014年10月定期的AFP检测值轻度升高(11 μg/L,正常值为 8 μg/L),随即MRI复查发现右肝后叶下段0.6 cm典型癌结节,即T2WI略高信号,DWI低b值明显高信号,动脉期明显强化(图3 g~j),但门静脉期无廓清,MRI诊断癌灶并行射频消融治疗,随后AFP恢复正常(6 μg/L)。回顾之前系列MRI图像发现:该病灶于2013年12月15日的MRI仅T2WI表现为局灶性略高信号的条索(图3 a)(在此之前该部无异常)。2014年2月复查略有增大,大小约0.25 cm(图3 b)。2014年4月13日复查,病灶已趋于结节形状,约0.3 cm,但其他序列均无异常(图3 c)。2014年8月15日复查T2WI病变较前增至0.5 cm,但病灶与邻近的血管相连,并动脉期、门静脉期明显强化(图3d~f),DWI无扩散受限,当时MRI疑似动-门静脉的异常短路或继发的血管瘤。整个期间(2013年12月15日~2014年9月30日)定期AFP检测均正常(4~5 μg/L)。
a:微小癌灶,2013年12月T2WI显示右肝前叶微小结节0.3 cm(占据1个横切面)(箭头);b:2014年4月T2WI见结节增大(上下径增大,占据2个横切面)(箭头);c:2014年4月DWI(高b值)结节灶出现扩散受限(箭头)
1.3 病例三
患者,女,58岁,因“腹胀、腹痛伴消瘦”入院,入院诊断:乙肝、肝癌。经射频消融治疗后AFP由>1000 μg/L降至30~50 μg/L,但始终不能恢复至正常,2013年5月5日MRI显示位于肝顶的癌灶表现为治疗后的凝固性坏死,但在右后叶下段见T2WI高信号微小结节0.3 cm(图4 a),DWI低b值轻度高信号(图4 b),多期增强无异常。2014年11月9日AFP增至780 μg/L,复查MRI,见原治疗后的病灶区出现复发灶,约2.3 cm。同时发现,一年半之前检出的右后叶下段微小灶增大至0.6 cm,T2WI、DWI、增强扫描均具有癌灶典型的影像表现(图4c~f)。
a:微小癌灶,2013年5月T2WI显示右后叶下段0.3 cm微小结节(箭头);b:2013年5月DWI(低b值)可见0.3 cm微小结节呈轻度扩散受限(箭头);c:2014年10月T2WI显示病灶增大至0.6 cm(箭头);d:DWI(高b值)示病变扩散受限(箭头);e:ADC图示病灶低值(箭头);f:增强扫描动脉期见病灶0.6 cm(箭头)明显强化
2 讨论
3个病例共4个微小癌灶,其病灶MRI的演变表现不一,可归纳为如下特点:①4个病灶的初始发现异常均是T2WI,病灶大小均小于0.4 cm,最小者为不规则的条索形;②血供有两种,即富血供和乏血供,其中,病例一病灶自小到大均为典型富血供;余下两例中的2个病灶由乏血供逐渐演变为富血供;病例二中的另一个病灶由0.3 cm长至0.5 cm的演变过程中,始终是乏血供(可能仍属于癌灶的乏血供阶段);③病变的DWI:病例一中,病灶增至0.9 cm仍无扩散受限;余下3个病灶均表现为随着病灶的生长而逐渐出现扩散受限征并最先以低b值显示;④影像学检查结果与AFP值的关系:病例一的AFP始终正常;其余两例中3个病灶均敏感,而在病灶微小阶段即出现AFP的轻度升高。更值得注意的是,病例二中的一个病灶在0.5 cm时(富血供,DWI阴性)AFP仍在正常值范围内,而2个月后略高于正常(富血供,而DWI变为阳性)。
微小肝癌的影像学搜寻及诊断中,MRI的综合技术优于多层螺旋CT,已被业内认可[3-6]。本组4个癌灶在MRI出现之初均表现为富水性,故得以在T2WI显示,更小的病灶也可不表现为结节的形状。飞利浦Achieua 3.0 T核磁共振系统具有更好的T2WI对比,因此发现微小病灶更具有优势。
肝癌灶的血供,典型为富血供,如病例一。但是,其“快退”及“假包膜”征是随病灶增大才出现,不典型者表现为乏血供或肝动脉及门静脉双期强化。对于乏血供者,有人研究认为[7-9],高级别增生性结节(dysplastic nodules,DN)在向早期肝癌转化过程中存在中间过程,也就是在“结中结”出现之前为乏血供即门静脉供血。另一种观点认为[10],乏血供癌灶的肿瘤细胞似乎是处于一种惰性的生物学行为状态。本组有2个癌灶在更早期乏血供,而后为富血供,在影像表现上符合癌灶的演变规律;而病例二中右肝前叶上段病灶由0.3 cm增至0.5 cm仍旧为乏血供,消融治疗后AFP随即降至正常,尽管没有组织学证实,但仍诊断为癌灶,这样的早期癌灶究竟属于发展演变的中间过程,还是固有性门静脉供血?如果属于前者,那么T2WI所表现的略高信号(富水)、DWI扩散受限(细胞密集)则是这类早期癌灶的主要影像学征象。正因为在癌灶转变形成中,肝细胞的癌变要早于血供的变化,近来学者们对微小肝癌的MRI研究普遍认为,采用肝特异性造影剂在肝胆期(HBP)对乏血供微小肝癌的检查和诊断优于钆喷酸葡胺(Gd-DTPA)[9,11-15]。
病例二中的右肝后叶下段的癌灶在10个月的MRI随访中,前5个月仅仅T2WI有异常改变,8~10个月时病灶出现肝动脉、门静脉两期强化,这种影像特征符合早期癌灶的病理学研究[7-10],即早期肝癌组织内肝窦微血管化不完全(微血管形成数目较少或微血管形成不完善)和/或肿瘤组织内门静脉系统破坏不完全,而导致肝动脉、门静脉双重供血的特殊影像表现。将本组中图3 e、 f与图3 i、 j对照,如果说2014年8月时的图像提示是以门静脉血供仍占优势,而2014年10月时的图像则是以肝动脉血供为主的病灶强化特点。
Kim等[12]对肝癌的影像与病理对照发现,12例≤1 cm癌灶无一例发生微血管侵犯(microvascular invasion,MVI),而1.1~2.0 cm者就有33%存在MVI,表明微小肝癌经治疗具有良好的预后。研究还认为,≤1 cm癌灶若没有典型的动态强化模式时,提示尚没有发生MVI,此时最好的选择与诊断标准是使用肝细胞特异性造影剂MRI检查。
文献研究证明,DWI作为重要的辅助手段用于小肝癌的诊断,可增加诊断的敏感性,但就其特异性而言,仍存在学术争议[16-17]。特别在乏血供的小癌灶,DWI显得更为重要。本组4个微小癌灶中,3个癌灶的扩散受限是渐进性的,也就是说癌灶的细胞密集度随生长而逐渐增加,AFP值也随之轻度升高,后者说明癌灶内尚未分化的肝细胞在分泌一定量的AFP;病例一既无扩散受限,也无AFP值得升高,是否癌灶内没有足够的尚未分化的肝细胞,还是其他什么原因,值得深入研究。也有近期研究认为,使用肝特异性对比剂进行动态灌注增强、HBP期结合T2WI诊断小肝癌,此时DWI没有更多的益处[14]。文献介绍[18],低b值图由于肝实质中血管背景均呈信号丢失而易于凸显病灶,因此搜寻较小的癌灶要优于T2WI。但本组4个癌灶T2WI对其却均有较高的敏感性,这或许可归于病灶中富水成分多于细胞成分之故。
关于微小肝癌AFP值,可因不同患者而异,实践中笔者发现,AFP处于正常值,而随访中突然轻微升高时应及时进行MRI检查。本组4个微小癌灶演变中的MRI表现结合文献有如下提示:①微小肝癌影像学检出与诊断不同于大肝癌甚至小肝癌;②对于肝癌高危人群需采取AFP(应重视检验值的轻微升高)加高场强MRI的定期随访复查;③应密切关注T2WI(压脂肪)上的微小高信号病变及DWI所见;④T2WI、DWI(低、高b值)、细胞外对比剂多期扫描三者是必需的组合,若使用肝细胞特异性对比剂更易于乏血供癌灶的检出和定性。
[参考文献]
[1] 杨广顺,杨宁.肝脏深部微小肝癌的处理[J].中国实用外科杂志,2006,26(9):664-665.
[2] 卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志,2011,27(11):1141-1159.
[3] Park MJ,Kim YK,Lee MW,et al. Small hepatocellular carcinoma:Improved sensitivity by combining gadoxetic acid-enhanced and diffusion-weighed MR imaging patterns [J]. Radiology,2012,264(3):761-770.
[4] Hwang J,Kim SH,Lee MW,et al. Small(≤2.0 cm)hepatocellular carcinoma in patients with chronic liver disease:comparison of gadoxetic acid-enhanced 3.0T MRI and multiphasic 64-multirow detector CT [J]. Br J Radiol,2012,85(7):e314-e322.
[5] 杨正汉,周诚,陈敏,等.肝脏发育不良结节癌变的CT、MRI评价[J].中华放射学杂志,2004,38(5):494-498.
[6] 杨景震,王成健,霍英杰,等.3.0T MR检出和诊断﹤1.0 cm微小肝癌应用体会[J].实用放射学杂志,2014,30(8):1415-1418.
[7] 韦立新,石怀银.肝癌前病变与高分化肝癌的病理诊断与鉴别[J].中华病理学杂志,2006,35(2):117-118.
[8] Kim SH,Lee WJ,Lim HK,et al. SPIO-enhanced MRI findings of well-differentiated hepatocellular carcinomas:correlation with MDCT findings [J]. Korean J Radiol,2009, 10(2):112-120.
[9] Motosugi U,Bannas P,Sano K,et al. Hepatobiliary MR contrast agents in hypovascular hepatocellular carcinoma [J]. J Magn Reson Imaging,2015,41(2):251-265.
[10] 胡敏霞,赵新明,周纯武.高分化肝癌的MSCT表现[J].放射学实践,2012,27(2):186-189.
[11] Yu MH,Kim JH,Yoon JH,et al. Small (≤1 cm) Hepatocellular carcinoma:diagnostic performance and imaging features at gadoxetic acid-enhanced MR imaging [J]. Radiology,2014,271(3):748-760.
[12] Kim MJ,Lee M,Choi JY,et al. Imaging features of small hepatocellular carcinomas with microvascular invasion on gadoxetic acid-enhanced MR imaging [J]. Eur J Radiol,2012,81(10):2507-2512.
[13] Choi JY,Lee JM,Sirlin CB,et al. CT and MR imaging diagnosis and staging of hepatocellular carcinoma:Part I.Development, growth, and spread:key pathologic and imaging aspects [J]. Radiology,2014,272(3):635-654.
[14] Zhao XT,Li WX,Chai WM,et al. Detection of small hepatocellular carcinoma using gadoxetic acid-enhanced MRI:is the addition of diffusion-weighted MRI at 3.0 T beneficial? [J]. J Dig Dis,2014,15(3):137-145.
[15] Ichikawa S,Ichikawa T,Motosugi U,et al. presence of a hypovascular hepatic nodule showing hypointensity on hepatocyte-phase image is a risk factor for hypervascular hepatocellular carcinoma [J]. J Magn Reson Imaging,2014, 39(2):293-297.
[16] Le Moigne F,Durieux M,Bancel B,et al. Impact of diffusion-weighted MR imaging on the characterization of small hepatocellular carcinoma in the cirrhotic liver [J]. Magn Reson Imaging,2012,30(5):656-665.
[17] Lim KS. diffusion-weighted MRI of hepatocellular carcinoma in cirrhosis [J]. Clin Radiol,2014,69(1):1-10.
[18] Bittencourt LK,Matos C,Coutinho AC. Diffusion-weighted magnetic resonance imaging in the upper abdomen:Technical issues and clinical applications [J]. Magn Reson Imaging Clin N Am,2011,19(1):111-131.
(收稿日期:2015-03-26 本文编辑:任 念)
