不同处理仿刺参在0 ℃冰水浴贮藏过程中的品质变化
2015-10-14侯志刚王茂剑赵云苹王共明孟春英井月欣
侯志刚,王茂剑,张 健,赵云苹,刘 昕,王 颖,王共明,孟春英,井月欣
(1.上海海洋大学食品学院,上海 200000;2.山东海洋资源与环境研究院,山东 烟台 264000;3.山东 省海洋生态修复重点实验室,山东 烟台 264006)
不同处理仿刺参在0 ℃冰水浴贮藏过程中的品质变化
侯志刚1,2,王茂剑2,3,*,张健2,3,赵云苹2,刘昕2,王颖1,2,王共明2,孟春英1,2,井月欣2
(1.上海海洋大学食品学院,上海 200000;2.山东海洋资源与环境研究院,山东 烟台 264000;3.山东 省海洋生态修复重点实验室,山东 烟台 264006)
为探究仿刺参贮藏前最佳处理方式和贮藏方式,对在0 ℃冰水浴贮藏期间经未去肠、去肠和漂烫 3 种方式处理的实验组生化特性和营养成分进行测定,对感官 品质进行了评价,并与0 ℃非冰水浴贮藏去肠组的组织结构变化进行比较研究。结果表明:0 ℃冰水浴贮藏期间,随着贮藏时间的延长,3 组仿刺参营养成分损失、挥发性盐基氮(tota l volatile basic nitrogen,TVB-N)值和微生物总数均呈上升趋势,而感 官品质呈下降趋势。0 ℃冰水浴和0 ℃非冰水浴去肠组组织结构变化明显,但两者之间有明显差异。0 ℃ 冰水浴贮藏期间,在生化特性上,3 组仿刺参的TVB-N值都未超过标准。去肠组的微生物总数在第9天 超标,未去肠组在第18天超标。漂烫 组的营养成分损失最少。未去肠与去肠组在胶原蛋白的损失上无显著差异;在第6天总糖溶出量差异显著;第21天三氯乙酸可溶性寡肽溶出量差异显著。在感官品质上,未去肠组在贮藏18 d开始出现异味,在贮 藏21 d出现较多化皮现象;去肠组在12 d就开始出现异味,18 d出现较多化皮现象以及体壁组织变得不 紧密、弹性较差;漂烫组整个贮藏期间都很正常。在组织结构上,漂烫组与未 去肠组变化不明显,而去肠组随着时 间的推移,出现了许多胶原蛋白碎片段。并且与0 ℃非冰水浴去肠组相比,0 ℃冰水浴贮藏的去肠组组织结构变化较小,表明冰水浴环境对仿刺参贮藏比较有利。结果表明,0 ℃冰水浴是一种有效的贮藏方式,漂烫和不去肠适合作为仿刺参0 ℃冰水浴贮藏前的处理方式。
仿刺参;贮藏;营养成分;生化特性;感官评价;组织结构
仿刺参(Apostichopus japonicus)属棘皮动物门、海参纲、楯手目动物、刺参科、刺参属[1]。海参无胆固醇、低脂肪、高蛋白质,且富含多种微量元素,是营养价值极高的保健食品[2-3]。
由于海参极易受到环境因素影响而发生自溶,冷藏条件下7 d就会发生明显的自溶[4],这样严重影响了海参的销售和流通。因此在企业基本上都是将海参干制[5]。随着新技术的不断出现,水产品保鲜的手段越来越多。但在海参的工业保鲜上,现在只局限于传统上的冷冻保鲜,但冷冻存在许多缺陷。对于海参保鲜的相关研究[6-9]较少,主要集中在冰温保鲜、超高压保鲜和海参保鲜剂方面。其中,冰温技术是一种新型有效的保鲜技术,具有多种优点,但冰温保鲜要求较高的技术,方法不易控制,一旦失误易造成巨大的经济损失[10]。超高压技术虽然在品质保持上有一定的效果,但超高压技术成本高,难以在企业中推广应用。而近年来随着消费者对新鲜和无化学保鲜剂水产品需求的增加,工业生产上保鲜剂的应用也受到抑制。目前,较多的水产品气调保鲜的研究表明气调保鲜与低温结合可以显著延长水产品贮藏期[11-12]。但气调保鲜一般应用于成品或半成品 食品 的保鲜上,很少应用于新鲜水产品。
0 ℃冰水浴正好提供了一个类似气调保鲜与低温结合的环境。本实验就是利用冰水浴这样一个环境探讨未去肠、去肠和漂烫处理的仿刺参在贮藏期间营养成分、生化特性、感官品质和组织结构的变化,且对去肠仿刺参在0 ℃冰水浴和非冰水浴环境中的组织结构进行了比较。目的是为了寻找一个合理的贮藏环境和贮藏前仿刺参的处理方式。
1 材料与方法
1.1材料与试剂
新鲜仿刺参购自烟台山水海产有限公司。
酪氨酸、酪素 上海生工生物工程有限公司;L-羟脯氨酸 美国Sigma公司;甲基红指示剂、苏木精、酸性品红(指示剂级别)、其他试剂(均为分析纯)国药集团化学试剂有限公司。
1.2仪器与设备
TP1020全自动组织脱水机、ST5010全自动染色机、LEICA ICC50HD显微镜 德国莱卡公司。
1.3方法
1.3.1原料处理
从购买的新鲜仿刺参中选取362 只体长为(13±2)cm、质量为(85±5)g的仿刺参,随机抽取6 只仿刺参,3只未去肠、3只去肠后,立刻放入-80 ℃冰箱中,以备未去肠组和去肠组贮藏0 d的实验指标测定。分别选取105、105、111只和35只仿刺参用于未去肠组、去肠组、漂烫组0 ℃冰水浴贮藏及去肠仿刺参0 ℃非冰水浴贮藏实验研究。
1.3.1.10 ℃冰水浴贮藏
未去肠组:不做去肠处理,立刻分别放入7 个保鲜盒中,每个盒中15 只,加入蒸馏水2 L和冰袋。每隔3 d从每种贮藏随机抽取一个保鲜盒,进行海参和液体取样。取样后立即将样品放入-80 ℃贮藏。
去肠组:随机挑选105 只仿刺参,立刻去肠后放入7 个保鲜盒中,每盒15 只,加入蒸馏水量2 L和几个冰袋。每隔3 d从每种贮藏随机抽取一个保鲜盒,进行海参和液体取样。取样后立即将样品放入-80 ℃贮藏。
漂烫组:挑选111 只仿刺参在沸水中漂烫2 min后随机抽取6 只立即放入-80 ℃冰箱中,以备漂烫仿刺参贮藏0 d的实验,然后立刻放入保鲜盒中,每盒15 只,加入蒸馏水2 L和冰袋。每隔3 d从每种贮藏随机抽取一个保鲜盒,进行海参和液体取样。取样后立即将样品放入-80 ℃贮藏。
1.3.1.20 ℃非冰水浴去肠贮藏
挑选35 只仿刺参,进行去肠处理,随机分成7 份,分别放入7 个保鲜盒中置于0 ℃冰箱贮藏。每隔3 d从每种贮藏随机抽取一个保鲜盒,进行海参取样,取样后立即将样品放入-80 ℃贮藏。
1.3.2生化特性测定
仿刺参体壁pH值的测定参考曹荣等[13]的方法,取5 g仿刺参体壁加入45 mL蒸馏水进行匀浆,离心后取上清液,用pH计测定;仿刺参挥发性盐基氮(total volatile basic nitrogen,TVB-N)值的测定采用SC/T 3032—2007《水产品中挥发性盐基氮的测定》进行;仿刺参微生物菌落总数的测定采用GB 4789.2—2010《菌落总数测定》进行。
1.3.3仿刺参营养成分的测定
1.3.3.1体壁胶原蛋白含量的测定[14]
取仿刺参样品约2 g于安瓿瓶中,加入2mL 6mol/L盐酸溶液,酒精喷灯封口后于130 ℃条件下水解4h,移至10mL试管中,加2 mol/L NaOH溶液中和至pH 6,定容至100 mL。以蒸馏水为空白。取1 mL样品加入1 mL柠檬酸缓冲液和l mL氯胺T溶液在室温(25 ℃)氧化10 min,加入高氯酸1 mL放置10 min,加入对二甲基氨基苯甲醛1 mL,65 ℃水浴显色20 min,冷却后在560 nm波长处测吸光度A。以羟脯氨酸绘制标准曲线。
1.3.3.2总糖溶出量的测定
准确吸取液体样品,以3 000 r/min离心5 min,取上清液,反复操作3~4 次。测定方法采用苯酚硫酸法。
1.3.3.3三氯乙酸(trichloroacetic acid,TCA)可溶性寡肽溶出量的测定
准确吸取液体样品置于离心管中,加入10% TCA溶液(V样品∶VTCA=1∶1),混匀并静置10 min后10 000 r/min离心,取上清液,采用双缩脲法测定。
1.3.4仿刺参感官评价和组织结构的观察
1.3.4.1感官评价
请6 名有经验的人员参加,根据表1对不同储藏阶段的仿刺参进行评价。其中定义:非质构指标=异味+体表+体壁组织+特征气味,质构指标=咀嚼性+黏性+弹性+硬度+扯断性。

表1 仿刺参0 ℃冰水浴贮藏期间的评分标准Table1 Criteria for sensory evaluation of Apostichopus japonicus stored in 0 ℃ ice-water bath
1.3.4.2组织结构的观察
切片制作:锐利刀片制备 0.5 cm×0.5 cm大小的海参体壁组织块,Bouin氏固定液固定,石蜡包埋,6 μm切片。VG染色流程:常规脱腊及复水后,用Harri's苏木精液染 5~l0 min,然后1%盐酸乙醇溶液分色1~3 s,稍水洗10~30 s,1%氨水返蓝10~30 s,自来水冲洗 10 min,蒸馏水洗,Van Gieson液染5 min,95%乙醇溶液分色和脱水,无水乙醇(Ⅰ)5min,无水乙醇(Ⅱ)5min,二甲苯(Ⅰ),二甲苯(Ⅱ),最后中性树胶封片,于40 倍显微镜下观察并拍照。
1.4数据处理与分析
应用SPSS 22.0统计处理软件进行结果分析,数据采用±s形式,差异显著性水平为P<0.05。曲线采用Origin 9.1进行绘制。
2 结果与分析
2.1生化分析结果
2.1.1pH值的变化

图1 0 ℃冰水浴贮藏期间pH值的变化Fig.1 pH changes of during storage period at 0 ℃ ice-water bath
由图1可以看出,在0 ℃冰水浴贮藏期间,随着贮藏时间的延长,3 种处理仿刺参pH值变化幅度都较小,其中漂烫组变化最小。3 个实验组的pH值总体都呈下降趋势,分析主要原因可能是0 ℃冰水浴环境使仿刺参体壁内的生化反应变得很缓慢,体壁中肌肉层厚度较小[15]和脂肪含量低[16],在贮藏期脂质物质和糖原的降解程度不明显,或即使降解也不足以对pH值产生明显的影响,以及其他成分如三磷酸腺苷所产酸类物质很少等。3 个实验组中只有去肠组在15 d前先下 降 到最低,之后再有略微的升高。据推测可能是微生物的作用致使仿刺参体内含氮物质被分解产生少量如氨、三甲胺、吲哚等物质。图中还显示未去肠组在9 d前pH值基本没变化,而9 d后pH值突然下降。这可能是因为未去肠仿刺参是作为一个整体进行贮藏,仿刺参在9 d前还会进行生命活动,对自身pH值可以进行调节。
2.1.2TVB-N值的变化
由图2可知,在0 ℃冰水浴贮藏期间,3 个实验组TVB-N值的变化规律基本相似,都经历了3 个阶段:延滞阶段、平稳增长阶段和急速增长阶段。从图2可以看到3 个实验组平均上升幅度都不是很大(未去肠组:7.49 mg/100 g,去肠组:12.45 mg/100 g,漂烫组:2.86 mg/100 g),这可能与0 ℃冰水浴环境有很大关系,低温低氧对仿刺参酶活性和微生物活动有一定的抑制作用。而且漂烫组的整个过程TVB-N值上升幅度最小,而且其延滞阶段也最长(9 d)。分析原因可能与仿刺参在漂烫过程中酶变性和大部分微生物的杀死有关。图2还显示未去肠组平稳增长阶段开始时间比去肠组延迟6 d左右,可能的原因是去肠组微生物数量在9 d已超标,而未去肠组在18 d才超标。但分析数据显示未去肠组与去肠组在前18 d TVB-N值差异不显著(P>0.05),这间接说明0 ℃冰水浴环境对微生物活动和仿刺参生化反应有很大的抑制作用。参考相关水产品标准(GB 2733-2005《鲜、冻动物性水产品卫生标准》)中对于TVB-N值不大于30 mg/100 g规定,可知3 种处理方式下仿刺参都处于安全标准内。
2.1.3菌落总数的变化

图3 0 ℃冰水浴藏期间菌落总数的变化Fig.3 Change in total plate c ount during storage at 0 ℃ ice-water bath
由图3可知,在0 ℃冰水浴贮藏期间,3 个实验组菌落总数总体都呈上升趋势。但漂烫组菌落总数明显低于其他两组,这是因为新鲜仿刺参原有的细菌在漂烫过程中被杀死。随着时间的延长,未去肠组和去肠组在0~3 d及漂烫仿刺参在3~6 d的细菌增长速率相比其他时间段都要小的多,可能原因是微生物进入新的环境需要一定的调整时间。在其他的时间段,去肠组3~21 d及漂烫组6~21 d增长速率整体呈先增加后减小趋势,有可能是微生物准备进入平稳期或仿刺参中一些活性物质如皂苷、小分子的寡肽等的产生造成的[17-18]。图3还显示出未去肠仿刺参整体的变化趋势与其他两种有着明显的区别,它从总体来看在整个贮藏期间细菌总数一直在慢慢地升高,主要原因可能是未去肠仿刺参作为一个活体时,自身对外来物有较好的免疫作用,仿刺参体壁和体腔细胞中存在免疫相关酶以及体液中有许多免疫因子[19-22],而且仿刺参肠细胞中的抑菌物质比如溶菌酶[23]。根据相关水产品安全要求(GB 18406.4—2001《农产品安全质量:无公害水产品安全要求》)细菌总数应不大于106CFU/g,可知未去肠仿刺参和去肠仿刺参分别在18 d(6.14 (lg(CFU/g)))和9 d(6.17(lg(CFU/g)))超出安全标准,而漂烫仿刺参(21 d,5.5(lg(CFU/g)))在贮藏期内始终未超出标准。
2.2 营养成分的变化
2.2.1体壁胶原蛋白含量的变化
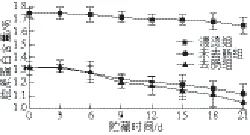
图4 0 ℃冰水浴贮藏期间胶原蛋白含量的变化Fig.4 Change in collagen content during storage at 0 ℃ ice-water bath
由图4可知,在0 ℃冰水浴贮藏期间,3 个实验组胶原蛋白含量变化都呈下降趋势,但变化很小(未去肠仿刺参:0.2%;去肠仿刺参:0.28%;漂烫仿刺参:0.1%)。这主要是因为低温(0 ℃)低氧对蛋白酶活性的抑制以及可能后期微生物次级代谢物对酶活性的抑制。从图4可以看到,漂烫组胶原蛋白含量整体高于另外两种处理仿刺参,并且下降幅度最小(0.1%)。这是因为在漂烫过程中酶变性失活及仿刺参体壁失去了大量的水,而大部分胶原蛋白变性生成明胶[24],致使漂烫组的胶原蛋白含量较高且下降程度小于去肠组和未去肠组。去肠组与未去肠组相比,胶原蛋白含量变化幅度较大,可能的原因是未去肠组仿刺参是个完整的个体,在贮藏前期对自身有调节作用以及对微生物有一定的抵抗能力。但分析数据显示去肠组与未去肠组在整个贮藏期内相比较差异不显著(P>0.05)。这说明仿刺参是否进行去肠处理,对仿刺参在贮藏期内的胶原蛋白含量下降的影响不大。
2.2.2总糖溶出量的变化

图5 0 ℃冰水浴贮藏期间总糖溶出量的变化Fig.5 Change in total sugar dissolution during storage at 0 ℃ ice-water bath
由图5可以看出,0 ℃冰水浴贮藏期间,3 个实验组总糖溶出量变化曲线整体都呈上升趋势。其中,未去肠组与去肠组总糖溶出量变化曲线类似S型曲线,都是在12 d之前的阶段总糖溶出速率越来越快,在12 d后的阶段溶出速率相对之前下降;漂烫组总糖溶出速率随着时间的推移越来越小。从图5还可看出,贮藏21 d未去肠组((18.452 9±0.622 6)μg/mL)与去肠组((19.719 9±0.528 3)μg/mL)在0 ℃冰水浴贮藏过程中总糖的营养损失相差不大,且对所有贮藏时间所得数据进行差异分析可知,两者除第6天差异显著(P<0.05)外,其余贮藏差异不显著(P>0.05)。但漂烫组到贮藏21 d((2.106 5±0.239 6)μg/mL)总糖基本没有损失,主要原因可能是漂烫仿刺参在漂烫时损失了部分糖类物质[25-26],而且使降解糖蛋白和多糖的酶失去了活性。
2.2.3TCA可溶性寡肽溶出量的变化

图6 0 ℃冰水浴贮藏期间TCA可溶性寡肽溶出量的变化Fig.6 Change in TCA soluble oligopeptide dissolution during storage at 0 ℃ ice-water bath
由图6可知,在0 ℃冰水浴贮藏中3 个实验组TCA可溶性寡肽溶出量变化曲线整体上规律类似,但去肠组与未去肠组TCA可溶性寡肽溶出速率有着明显的区别。分析数据可知,未去肠组与去肠组相比,在第21天出现显著差异(P<0.05),其余贮藏时间差异不显著(P>0.05)。这可能主要是未去肠仿刺参是作为一个整体在贮藏前期对自身酶有一定的的调节作用以及去肠海参在第9天微生物数量已超过安全标准造成的这种差异。从图6还可以看出,去肠组和未去肠组曲线整体都要高于漂烫组,推测原因可能是仿刺参在漂烫中部分蛋白质以及含蛋白物质已变性降解[25-26],而且蛋白酶失去了活性。
2.3感官评价与组织结构的观察
2.3.1感官评价
由表2可以看出,在0 ℃冰水浴贮藏期间,不同处理方式和不同贮藏时间对仿刺参贮藏过程中的各个指标的变化有一定的影响。随着贮藏时间的延长,3 个实验组的各个感官指标变化都呈不同程度的下降趋势。多因素方差分析结果表明处理方式对除黏性以外的所有指标变化都有显著的影响(P<0.05),贮藏时间对除扯断性以外的所有指标都有显著的影响(P<0.05)。结合表2和图7可知,随着贮藏期的延长,3 个实验组的综合指标、质构指标、和非质构指标评分都呈下降趋势,且3个实验组之间差异越来越大,特别是非质构指标。比较3 个实验组的各个指标变化可知,漂烫组各个指标的感官评分整体下降速率最小,未去肠组次之。这可能与仿刺参漂烫过程中大量的微生物和酶被破坏以及未去肠仿刺参作为一个整体对自身的变化有调节作用有关。与非质构指标相比,不论何种方式处理,仿刺参质构指标在整个贮藏期间变化幅度都很小,特别是漂烫组和未去肠组。这说明无论何种方式处理仿刺参,贮藏后煮制得到的仿刺参质构特性变化幅度都不大。实际上在整个贮藏期间仿刺参受处理条件影响较大的感官指标是 非质构指标,且处理方式对各个非质构指标的影响显著(P<0.05)。根据评分规则未去肠组在18 d开始出现异味,煮制后的特征气味变得不明显,21 d出现较多的化皮现象;去肠组在12 d就开始出现异味,18 d时煮制后的特征气味开始变得不明显,出现较多的化皮现象,以及体壁组织变得不紧密和弹性较差;漂烫组整个贮藏期间各个指标都很正常。

表2 0 ℃冰水浴贮藏中的感官变化Table2 Sensory quality changes during storage at 0 ℃ ice-water bath

图7 0 ℃冰水浴贮藏期间未去肠组(A)、去肠组(B)、漂烫组(C)的感官评分Fig.7 Sensory scores of samples during storage at 0 ℃ ice-water bath storage
2.3.2组织结构的变化
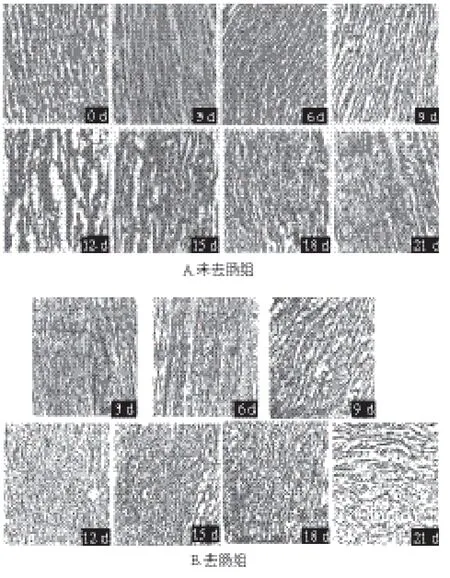

图8 0 ℃冰水浴贮藏期间各组体壁胶原组织的变化Fig.8 Changes in body wall collagen tissue during 0 ℃ ice-water bath storage

图9 0 ℃非冰水浴贮藏期间去肠组体壁胶原组织的变化Fig.9 Changes in body wall collagen tissue during refrigerated storage at 0 ℃
对比图8A~C可知,在整个0 ℃冰水浴贮藏期间3 个实验组中去肠组变化最为明显,而未去肠组次之,漂烫组变化最不明显。这与3 个实验组0 ℃冰水浴贮藏期间感官评价、胶原蛋白及总糖和TCA可溶性寡肽溶出量的变化幅度一致。这不但说明去肠这种方式对仿刺参在0 ℃冰水浴贮藏期间品质变化速率影响最大,而且可以用来部分解释3 个实验组在0 ℃贮藏过程中在胶原蛋白、总糖和TCA可溶性寡肽含量损失上的差异。
在0 ℃冰水浴贮藏期间,未去肠组胶原组织基本没有变化,只是在18 d后出现很少的胶原碎片段。这可能与本身在贮藏期间未去肠组保持完整性有关。去肠组随着时间的推移,碎片段越来越多且产生的碎片段失去了方向性。推测原因可能是去肠仿刺参的完整性被破坏以及贮藏期间微生物强烈的活动。然而漂烫仿刺参胶原组织的变化与未去肠仿刺参类似,基本没有变化,胶原组织从0~21 d分布都很杂乱。造成这种变化的原因主要是漂烫仿刺参在漂烫过程中酶和微生物遭到破坏。而且,虽然漂烫仿刺参在沸水中漂烫了2 min,但胶原组织并没有出现凝聚,这说明漂烫2 min是一个有效的贮藏前处理方式。对比图8B和图9可以看到,同为去肠仿刺参,但有很大的区别,非冰水浴去肠组在贮藏期间体壁组织变化很快,在第9天就明显出现了胶原碎片段,而且12 d之后体壁组织已无法取样观察。这说明水浴对仿刺参品质有很大的影响。
3 结 论
在0 ℃冰水浴贮藏期间生化特性变化方面,3 个实验组的TVB-N值和菌落总数变化规律一致,都呈上升趋势。其中未去肠组和漂烫组整体上升幅度相比于去肠组小。参考相关水产品标准,3 个实验组在整个贮藏期间TVB-N值都未超标,未去肠组与去肠组相比较,在前18 d没出现显著差异(P>0.05),但去肠组在第9天微生物数量超标,未去肠组在第18天超标。比较TVB-N值和微生物总数这两个指标,微生物总数更适宜作为判断仿刺参0 ℃冰水浴中贮藏期的指标。
在0 ℃冰水浴贮藏期间,3 个实验组的胶原蛋白含量、总糖和TCA可溶性寡肽溶出量变化都呈上升趋势,其中漂烫组损失最小。未去肠组与去肠组相比较,在整个贮藏期间,胶原蛋白含量差异不显著、总糖和TCA可溶性寡肽溶出量分别在第6天和第21天存在显著差异(P<0.05),其余贮藏时间差异都不显著(P>0.05)。可见在营养保持上漂烫是0 ℃冰水浴贮藏期间较好的处理方式,然而仿刺参在漂烫过程中会损失部分营养物质[25]。
3 个实验组在0 ℃冰水浴贮藏期间,随着时间的延长,感官品质指标评分越来越低,与TVB-N值和微生物总数的变化趋势相反。其中,漂烫组变化最小,未去肠组次之;未去肠组在18 d开始出现异味;去肠组在12 d就开始出现异味;漂烫组整个贮藏期间各个指标都很正常。表明漂烫是一种长期贮藏有效的处理方式,而未去肠可以作为仿刺参原生态短期贮运的一个可行选择。
未去肠组和漂烫组在组织结构上基本没有变化,去肠组随着时间的延长出现了许多胶原碎片段。而且相对于0 ℃非冰水浴去肠组,0 ℃冰水浴贮藏的去肠组组织结构变化小很多。0 ℃非冰水浴去肠组在12 d后就已经严重自溶无法进行取样观察。这表明冰水浴环境对仿刺参品质的保持有利。
综上所述,0 ℃冰水浴贮藏时一个有效的贮藏方式。在0 ℃冰水浴贮藏期间漂烫组保持品质上都优于其余两种,若要较长期贮藏,选择漂烫更为合适;若要保持仿刺参体壁的原生态,选择未去肠则更为适宜。
[1] 廖玉麟. 中国动物志: 第1卷[M]. 北京: 科学出版社, 1997: 611.
[2] WEN Jing, HU Chaoqun, FAN Singgang. Chemical composition and nutritional quality of sea cucumbers[J]. Journal of the Science of Food and Agriculture, 2010, 90: 2469-2474.
[3] 李熙灿. 海参及海参中的化学成分综述[J]. 辽宁中医学院学报,2004, 6(4): 341-342.
[4] WU Haitao, LI Dongmei, ZHU Beiwei, et al. Proteolysis of noncollagenous proteins in sea cucumber, Stichopus japonicus,bodywall: characterisation and the effects of cysteine protease inhibitors[J]. Food Chemistry, 2013, 141: 1287-1294.
[5] 段续, 王辉, 任广跃, 等. 海参的干制技术及其研究进展[J]. 食品工业科技, 2012, 33(10): 427-431.
[6] 郝梦甄, 胡志和. 超高压和盐渍泡发处理海参的质构和功能成分比较研究[J]. 食品科学, 2013, 34(5): 115-119.
[7] 刘莲凤, 高昕, 许加超, 等. 冰温贮藏条件下刺参组织结构和流变学性质的变化[C]//渔业科技创新与发展方式转变: 2011年中国水产学会学术年会论文摘要集. 2011.
[8] 崔花善, 侯英雪, 李志文, 等. 新鲜海参的保鲜剂配制工艺研究[J].食品研究与开发, 2012, 33(9): 189-193.
[9] 李庆领, 宋吉昌, 吴俊飞, 等. 海参超高压保鲜的工艺研究[J]. 食品科学, 2009, 30(12): 117-119.
[10] 应月, 李保国, 董梅, 等. 冰温技术在食品贮藏中的研究进展. 制冷技术, 2009(2): 12-15.
[11] LYHS U, LAHTINEN J, SCHELVIS-SMIT R. Microbiological quality of maatjes herring stored in air and under modified atmosphere at 4 and 10 ℃[J]. Food Microbiology, 2007, 24: 508-516.
[12] FAGAN J D, GORMLEY T R, U☒MHUIRCHEARTAIGH M M. Effect of modifiedatmosphere packaging with freeze-chilling on some quality parameters of raw whiting, mackerel and salmon portions[J]. Innovative Food Science and Emerging Technologies, 2004, 5: 205-214.
[13] 曹荣, 刘淇, 殷邦忠. 对虾冷藏过程中感官品质与鲜度指标变化研究[J]. 湖南农业科学, 2010(21): 90-94.
[14] WOESSNER J F. The determination of hydroxypro1ine in tissue and protein samples containing small proportions of amino acid[J]. Archives of Biochemistry and Biophysics, 1961, 93(2): 440-447.
[15] 朱蓓薇. 海珍品加工理论与技术的研究[M]. 北京: 科学出版社,2010: 5.
[16] 王际英, 宋志东, 王世信. 刺参体壁的营养成分分析[J]. 中国水产,2009(5): 60-61.
[17] MUNIAIN C, CENTURI☒N R, CAREAGA V P, et al. Chemical ecology and bioactivity of triterpene glycosides from the sea cucumber Psolus patagonicus (Dendrochirotida: Psolidae)[J]. Journal of the Marine Biological Association of the UK, 2008, 88: 817-823.
[18] 王秀霞, 丛丽娜, 王丹, 等. 海刺参i型溶菌酶基因的重组表达及抑菌谱分析[J]. 生物工程学报, 2009, 25(2): 189-194.
[19] 江晓路, 杜以帅, 王鹏, 等. 褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J]. 中国海洋大学学报, 2009, 39(6): 1188-1192.
[20] CANICATTI C, PAGLIARA P, STABILI L. Sea urchin coelomic fluid agglutinin mediates coelomocyte adhesion[J]. European Journal of Cell Biology, 1992, 58: 291-295.
[21] CALOGERO C, DONATELLA C. The hemolysin-producer coelomocytes in Holothuria polii[J]. Developmental and Comparative Immunology, 1988, 12(4): 729-736.
[22] PRENDERGAST R, SUZUKI M. Invertebrate protein stimulating mediators of delayed hypersensitivity[J]. Nature, 1970, 227: 277-279.
[23] 李英辉, 丛丽娜, 朱蓓薇. 海参肠中溶菌酶的分离纯化及其酶学性质[J]. 大连工业大学学报, 2008, 27(3): 193-196.
[24] 朱蓓薇. 海珍品加工理论与技术的研究[M]. 北京: 科学出版社,2010: 40.
[25] JIAO Jian, KANG Haiyan. Studies on losses of some functional components during traditional processing trepang from Apostichopus japonicus[J]. Chinese Journal of Marine Drugs, 2010, 29(4): 46-49.
[26] 李超峰. 海参加工工艺评价及其加工废弃液活性物质研究[D]. 青岛: 中国科学院研究生院海洋研究所, 2013: 55-67.
Quality Changes of Different Processed Apostichopus japonicus Stored in 0 ℃ Ice-Water Bath
HOU Zhigang1,2, WANG Maojian2,3,*, ZHANG Jian2,3, ZHAO Yunping2, LIU Xin2, WANG Ying1,2,WANG Gongming2, MENG Chunying1,2, JING Yuexin2
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 200000, China;2. Shandong Institute of Marine Resources and Environment, Yantai 264000, China;3. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Yantai 264006, China)
To explore the best pretreatment and storage conditions for Apostichopus japonicas, biochemical characteristics,nutritional composition and sensory quality of Apostichopus japonicas with and without intestine as well as subjected to blanching were measured during storage in 0 ℃ ice-water bath and a comparison with Apostichopus japonicas without intestine refrigerated at 0 ℃ for differences in tissue structure was carried out as well. The results showed that during storage in 0 ℃ ice-water bath, with the extension of storage time, nutrient loss, total volatile basic nitrogen (TVB-N) and the total number of microbes of three samples of processed A. japonicus presented an ascending trend and sensory quality declined. Tissue structures of A. japonicus without intestine changed obviously both in 0 ℃ ice-water bath and in a refrigerator at 0 ℃, but there was a big difference between them. During the whole period of 0 ℃ ice-water bath storage, volatile basic nitrogen (TVB-N) contents of all three samples of processed A. japonicus were below standard. Total bacterial count of A. japonicus with intestine exceeded the standard on the 18thday of storage, while that of A. japonicus without intestine on theninth day was higher than the standard. Blanched A. japonicus had minimal loss of nutrients. There was no significant difference in collagen loss between A. japonicas with and without intestine. Meanwhile significant differences in total sugar dissolubility on the sixth day as well as in trichloroac etic acid (TCA) soluble oligopeptide dissolubility on the 21thday were found. In respect of sensory quality, A. japonicus with intestine smelled unpleasant on the 18thday and indicated severe skin ulceration on the 21thday of storage, while the unpleasant smell and serious skin ulceration of A. japonicas without intestine appeared on the 12thand18thdays, respectively, al ong with less tight and elastic body wall tissue. The sensory quality of blanched A. japonicus remained unchanged throughout the storage period. Both blanched A. japonicus and A. japonicuss with intes tine showed no obvious changes in tissue structure. But A. japonicas without intestine formed many collagen fragments with the extension of storage time. A. japonicas without intestine in 0 ℃ice-water bath exhibited relatively smaller changes in tissue structure than when refrigerated at 0 ℃, which indicated that water bath environment was beneficial to A. japonicus storage. Conclusion: Blanching without the removal of intestine and 0 ℃ ice-water bath storage are better for A. japonicas.
Apostichopus japonicus; storage; nutrient content; sensory evaluation; biochemical characteristics; tissue structure
S983
A
1002-6630(2015)14-0250-08
10.7506/spkx1002-6630-201514048
2014-11-25
国家海洋局海洋公益性行业科研专项(201205027;201105029);山东省现代农业产业技术体系刺参产业 创新团队建设项目(SDAIT-08);山东省农业重大应用技术创新项目;烟台市科技发展计划项目(2014ZH081);水生动物营养与饲料泰山学者岗位经费资助项目(TS 200651036)
侯志刚(1989—),男,硕士研究生,研究方向为食品工程。E-mail:154832447@qq.com
王茂剑(1964—),男,研究员,学士,研究方向为食品科学与工程。E-mail:wangmaojian@126.com
