固相萃取-气相色谱-质谱联用法筛查食用菌中的农药残留
2015-10-14胡秋辉张昌娟郑惠华邱伟芬杨文建赵立艳
胡秋辉,张昌娟,郑惠华,邱伟芬,杨文建,赵立艳
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.江苏安惠生物科技有限公司,江苏 南通 226010;3.南京农业大学食品科学技术学院,江苏 南京 210095)
固相萃取-气相色谱-质谱联用法筛查食用菌中的农药残留
胡秋辉1,张昌娟1,郑惠华2,邱伟芬1,杨文建1,赵立艳3
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.江苏安惠生物科技有限公司,江苏 南通 226010;3.南京农业大学食品科学技术学院,江苏 南京 210095)
采用气相色谱-质谱联用结合NAGINATA™软件建立了筛查食用菌中多 种农药残留的分析方法。采用乙腈提取,Carbon-NH2固相萃取小柱净化,气相色谱-质谱联用检测后NAGINATA™软件全智能分析,对照每个 化合物的质谱质量精度以及质谱谱图的谱库给出匹配度,通过保留时间锁定对化合物作定性判断。结果表明,18 种农药在香菇中检出限为0.001~0.050 mg/kg;平均回收率为77%~110%;相对标准偏差为1.1%~6.9%。应用所建立的方法对35 个市售食用菌样品进行了筛查,检测出2 种农药残留,残留量均低于GB 2763—2014《食品中农药最大残留限量》的限量。该方法操作便捷、快速高效,适用于食用菌中农药多残留的快速筛查。
食用菌;NAGINATA™软件;固相萃取;气相色谱-质谱联用;农药残留
食用菌营养丰富,近年来在饮食中所占比例越来越大。但是由于农药的大量使用,使食用菌子实体受到污染,给人类的健康带来危害[1]。因此,农药引起的食用菌中农残超标问题日益受到国内外重视。然而我国食品安全风险监测工作仍存在监测能力不足、风险物质筛查困难、各地区机构检测能力差异大等问题,与发达国家仍有较大差距。近年来,在化学风险物检测领域中,多残留检测已经逐渐 代替单残留检测,成为此领域中的主导,过程中所应用的仪器也由气相色谱(gas chromatography,GC)[2-5]和高效液相色谱[6]为主导逐渐向GC-质谱(GC-mass spectrometry,GC-MS)[7-12]和液相色谱-质谱联用[13-15]为主导转变。其中GC-MS具有气相色谱的高分辨率、质谱检测的高灵敏度等优点,已经被许多国家认可并应用。寒梅等[16]研究了香菇中几种氨基甲酸酯农药残留的GC-MS测定方法,孟晓萌等[17]通过GC-MS对杏鲍菇中16 种有机氯农药进行快速定量定性检测。但是现有的分析方法只是针对特定几种或者一类农药进行检测,分析通量较低,而且对没有列在分析表中的其他污染物无法进行检测。
目前,国内研究者在对食品中风险化合物筛查的研究中通常是用标准品构建谱库来对目标物定性和定量,或者利用已有的谱库(NIST)定性然后用标准品制作标准曲线来定量。NAGINATA™系统软件在GC-MS分析上,可以提供残留农药,环境污染物,容器包装添加剂(塑化剂)等的多成分分析用的近1 000 种化合物的数据库,利用数据库和软件自动检出并定量化学风险物仅需2 min并且无需配制标准溶液和制作标准曲线[18-22]。Du Xu等[23]通过GC-MS结合NAGINATA™软件对扬子江中存在的有机污染物进行了快速筛查并确定了23 种主要的生态风险有机污染物,Ishida等[24]研究了毒品中毒物的快速筛查程序,使用NAGINATA™系统软件,不需要标准物质就能定性半定量分析药物浓度,但是在食用菌样品的风险物检测领域应用较少。
本实验利用GC-MS结合NAGINATA™软件建立食用菌中农药多残留的快速筛查方法,为食用菌样品的快速筛查提供了可靠的技术支持,所研究内容可应用于食用菌样品突发事件的快速处置应急工作,大大缩短样品的分析时间,提高检测筛查的工作效率。
1 材料与方法
1.1材料与试剂
新鲜食用菌(香菇、杏鲍菇、金针菇等) 南京众彩农贸市场;17 种农药标准品(纯度≥95%) 国家标准物质中心;乙腈(农残级) 美国Tedia天地试剂公司;混合内标物(4-氯甲苯-d4(CAS号:485577-24-8)、1,4-二氯苯-d4(CAS号:3855-82-1)、萘-d8(CAS号:1146-65-2)、氘代苊(CAS号:15067-26-2)、菲-d10(CAS号:1517-22-2)、荧蒽-d10(CAS号:93951-69-0)、氘代屈(CAS号:1719-03-5)、二萘嵌苯-d12(CAS号:1520-96-3)) 纯药工业株式会社;NH2固相萃取柱(1 g,6 mL)、Florisil固相萃取柱(500 mg,6 mL)、Carbon-NH2固相萃取柱(1 g,6 mL) 美国Welch公司;无水硫酸镁、氯化钠、丙酮、冰乙酸。
1.2仪器与设备
7890A-5975C GS-MS联用仪 美国安捷伦公司;固相萃取装置 美国Supelco公司;NAGINATA™软件 环亚高科(北京)科技发展有限公司;Allegra 64R台式高速冷冻离心机 美国贝克曼公司;QL-902涡旋混合仪 海门市齐林贝尔仪器制造有限公司;JYL-D051料理机 九阳股份有限公司。
1.3方法
1.3.1样品制备
准确称取10.00 g待测样品于50 mL离心管中,加入20 mL乙腈,匀浆提取2 min,加入4 g无水硫酸镁和1 g氯化钠,涡旋振荡1 min,4 ℃离心10 min(4 000 r/min),将上清液旋蒸浓缩至近干,加1 mL乙腈溶解。取Carbon-NH2固相萃取柱,先用5 mL丙酮-正己烷(1∶1,V/V)活化柱子,将上述样品提取液过柱并收集,用2 mL丙酮-正己烷(1∶1,V/V)分两次洗涤梨形瓶,洗涤液并入固相萃取柱中,用10 mL丙酮-正己烷(1∶1,V/V)洗脱并全部收集,氮吹浓缩至干,用丙酮定容至1 mL,加入2 μL混合内标物,供GC-MS分析。
1.3.2色谱条件
色谱柱:HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口温度:250 ℃;升温程序:初始温度70 ℃,保持2 min,以25 ℃/min升至150 ℃,以3 ℃/min升至200 ℃,以8 ℃/min升至280 ℃,保持10 min,以20 ℃/min升至300 ℃,并保持10 min;载气:氦气,流速1.2 mL/min;进样量:2 μL;进样方式:不分流进样。
1.3.3质谱条件
电子电离源;电子能量70 eV;离子源温度230 ℃,四极杆温度150 ℃;MS调谐方式:DFTPP调谐;质量扫描范围m/z:35~550;扫描速率:2.86 scan/s。
1.3.4NAGINATA™软件分析
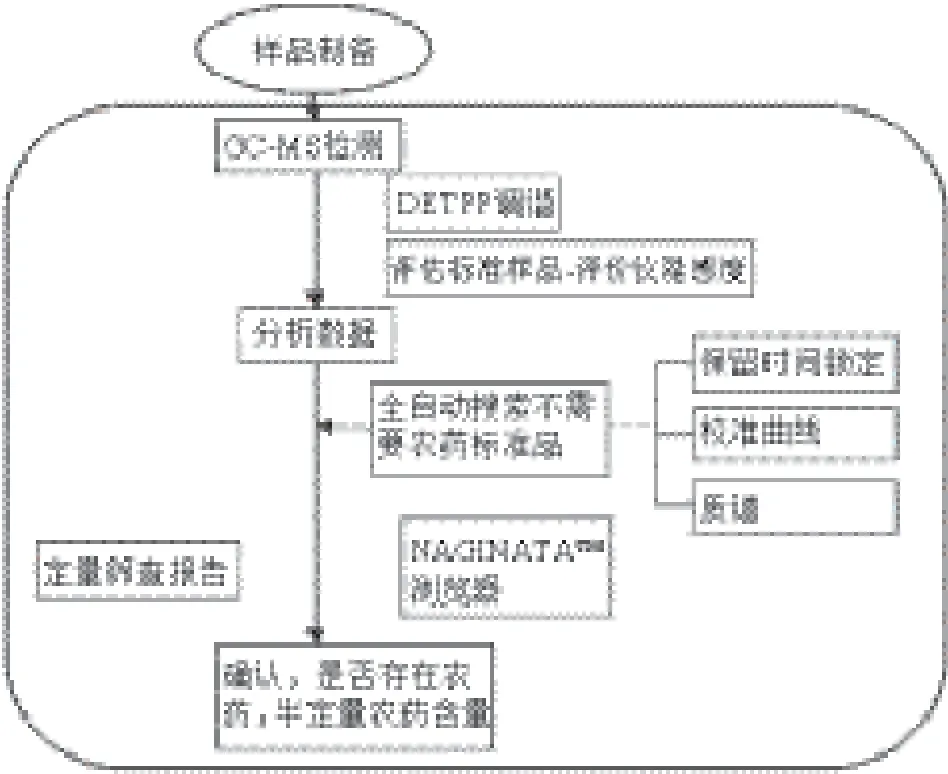
图1 食用菌中18 种农药的快速筛查方法Fig.1 Screening of 18 pesticides using NAGINATA™ software
GC-MS系统状态评价与控制:DFTPP校准→评价装置系统性能(评估标准样品指标见表1,各标准物质的质量浓度均为1 μg/mL)→由RTL锁定保留时间。三元组数据库检出及定量:样品1 mL中添加混合内标物2 μL→三元组数据库自动检出化合物并相对定量仅需2 min。多成分分析时,在测定结果的确认和验证方面非常费时,同时也需要熟练的技巧。利用NAGINATA™软件的手动解析浏览器实现了高效率的多成分分析结果的确认和验证。每一个被检出化合物的定量离子、确认离子的质谱色谱、样品原始谱图、谱库检索谱图、总离子流图等都准确的显示在解析画面上。食用菌中18 种农药的快速筛查流程图见图1。
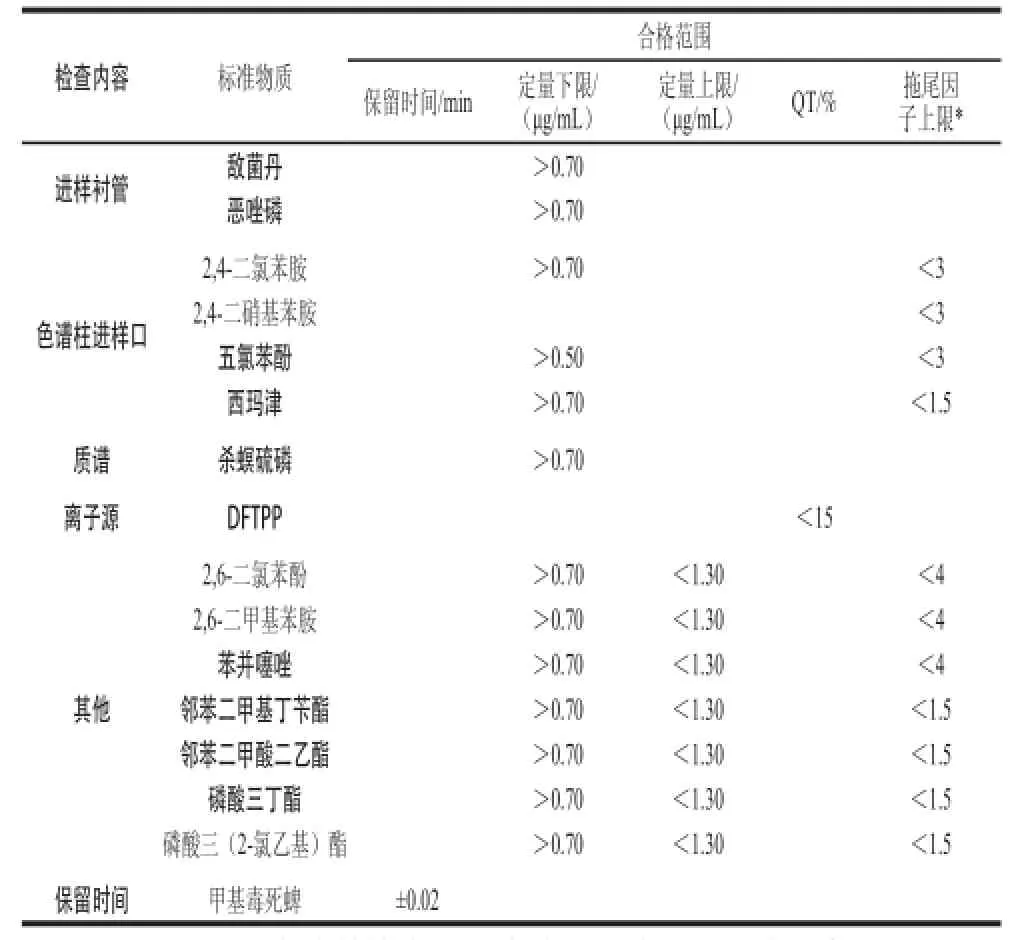
表1 检测GC-MS联用系统状态的标准物质Table1 Standard substances used for the validation of GC-MS system
2 结果与分析
2.1SPE柱萃取条件的优化
食用菌中含有丰富的氨基酸、多糖、蛋白质和多种矿物质等营养成分,基质复杂。能否有效的去除共提取物中的基质干扰是影响食用菌风险化合物筛查方法的关键。在全扫描方式下对香菇的基质共提物进行分析(如图2a所示)并确定主要干扰物为小分子干扰物(烷基和酚类)、脂肪酸类干扰物和大分子干扰物(醇类和酯类)。
以10 mL丙酮-正己烷(1∶1,V/V)为洗脱溶剂,比较了残留分析中常用的Florisil、NH2及Carbon-NH2柱对样品中基质共提物的去除效果。如图2所示,3 种固相萃取小柱均能在一定程度上去除杂质干扰,对杂质的去除作用依次增强,Carbon-NH2柱的净化效果明显优于Florisil和NH2柱,基质干扰效应明显减少。并且Carbon-NH2柱净化后18 种农药的回收率也在73%~118%之间,相对标准偏差不大于13.3%,均符合欧盟农药残留分析质量控制程序要求,所以采用Carbon-NH2柱为固相萃取净化柱。

图2 香菇基质未经净化和经过不同固相萃取小柱净化后的总离子流图Fig.2 TICs of Lentinula edodes treated with various solid-phase extractors
2.2洗脱溶剂的选择和洗脱体积的确定
选择极性不同的丙酮、正己烷和丙酮-正己烷(1∶1,V/V)3 种洗脱溶剂,采用1.3节的前处理方法对样品进行回收率实验。如图3所示,正己烷的极性小,马拉硫磷、敌敌畏、氧化乐果等有机磷类农药的洗脱效果不理想,香菇中18 种农药的回收率仅为59%~87%,相对标准偏差为2.3%~7.9%;丙酮可充分洗脱大部分农药,香菇中18 种农药的回收率在79%~110%之间,相对标准偏差在1.3%~7.1%之间,但由于丙酮极性较强,会同时洗脱下萃取小柱中的杂质,对后续测定造成困扰;以丙酮-正己烷(1∶1,V/V)为洗脱剂时,香菇中18 种农药的回收率为75%~110%,相对标准偏差在1.3~6.9%之间,表明丙酮-正己烷(1∶1,V/V)溶剂能有效提取供试农药,且相对标准偏差较小,洗脱的杂质也较少,所以本实验最终选择丙酮-正己烷(1∶1,V/V)作为洗脱溶剂。分别连续4 次收集5 mL洗脱液,将每一次的洗脱液分别上机测定含量。结果表明,当洗脱液总体积为10 mL时,18 种农药的回收率均能达到80%以上,故洗脱液用量取10 mL。
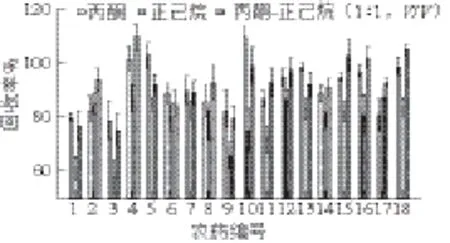
图3 洗脱溶液的选择Fig.3 Selection of the elution solvent
2.3方法的检出限、回收率和精密度及方法适用性
根据欧盟农药残留分析质量控制程序要求,农药平均回收率需在70%~120%之间,重复性(相对标准偏差)低于20%。在香菇中添加18 种农药的混合标准溶液,按1.3节操作步骤,进行3 个水平0.05、0.10 mg/kg和0.20 mg/kg的添加回收率实验,每个添加水平重复5 次。结果见表2。由表2可知,本方法的添加回收率范围为77%~110%,相对标准偏差在1.1%~6.9%之间。以3 倍信噪比确定方法检出限为0.001~0.050 mg/kg。
采用本方法对农贸市场中购买的35 个食用菌样品进行了分析测定,共有溴氰菊酯和氯氟氰菊酯2 种农药检出,含量在0.027~0.033 mg/kg之间,见表3,GB 2763—2014《食品中农药最大残留限量》规定食用菌中溴氰菊酯和氯氟氰菊酯的最大残留限量分别为0.2 mg/kg和0.5 mg/kg,检出的农药残留水平均显著低于国家最大残留限量标准。
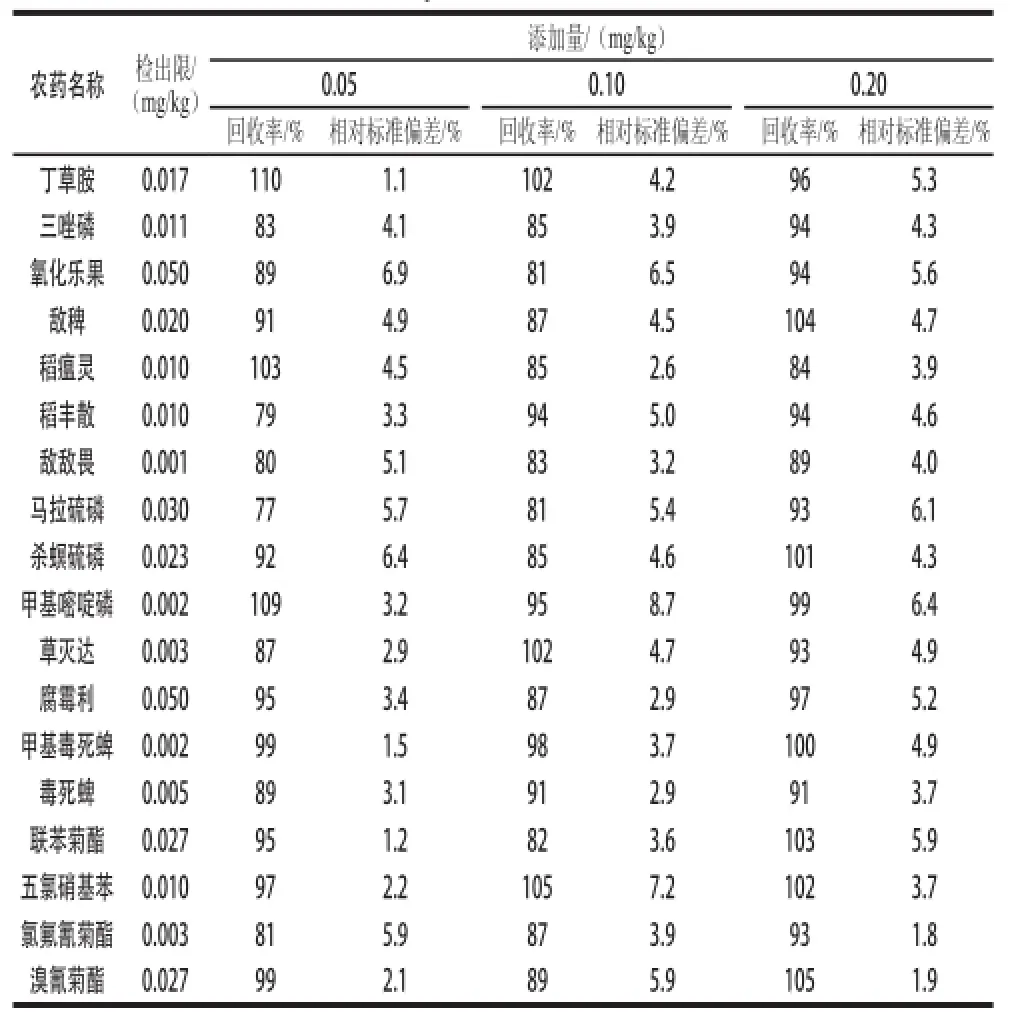
表2 香菇中添加18 种农药标样的回收率、检出限及相对标准偏差(n =5)Table2 Recovery rates with relative standard deviation (RSD), and limits of detection of 18 pesticides in Lentinula edodes (n = 5)
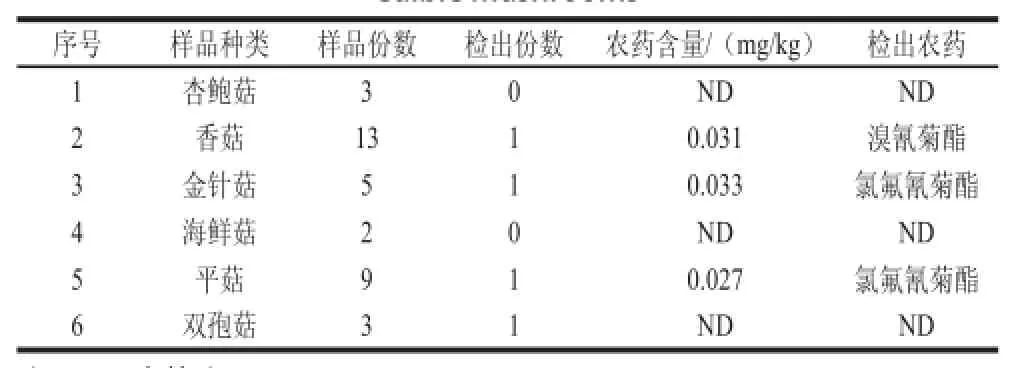
表3 食用菌中农药检出情况Table3 Concentrations and positive rates of pesticide residues in edible mushrooms
3 脚注
本研究建立了一种采用乙腈提取,Carbon-NH2固相萃取小柱净化,丙酮-正己烷(1∶1,V/V)溶液洗脱,GC-MS联用检测后NAGINATA™软件全智能分析的快速筛查食用菌中农药多残留的方法。该方法检出限为0.001~0.050 mg/kg;平均回收率为77%~110%;相对标准偏差为1.1%~6.9%,满足欧盟农药残留分析质量控制程序的要求。通过对35 份食用菌样品农药残留的筛查,获得满意的结果。与传统方法相比无需配制标准溶液和制作标准曲线,节省时间、减少了操作过程中的人为误差。
[1] 唐俊. 食用菌中农药多残留分析方法研究[D]. 合肥: 安徽农业大学,2009: 3-6.
[2] ANWAR T, AHMAD I, TAHIR S. Determination of pesticide residues in fruits of Nawabshah district, Sindh, Pakistan[J]. Pakistan Journal of Botany, 2011, 43(2): 1133-1139.
[3] 王会锋, 冯书惠, 贾斌. 香菇中40 种农药残留量的气相色谱法测定[J].食品科学, 2010, 31(20): 335-341.
[4] DARKO G, A KOTO O. Dietary intake of organophosphorus pesticide residues through vegetables from Kumasi, Ghana[J]. Food Chemical Toxicology, 2008, 46(12): 3703-3706.
[5] 姬晓灵, 屈爱桃, 汪岭, 等. 黑木耳中7 种拟除虫菊酯类农药残留的气相色谱检测方法[J]. 现代预防医学, 2010, 37(2): 1346-1348.
[6] 李永新, 孙成均, 赵剑虹, 等. 高效液 相色谱法同时测定蔬菜水果中的12 种农药残留[J]. 色谱, 2006, 24(3): 251-255.
[7] 陈捷, 徐娟, 谢建军, 等. 气相色谱-串联质谱多反应监测及同步子离子全扫描定性定量分析蔬菜中287 种农药残留[J]. 分析试验室,2013, 32(6): 30-40.
[8] ŠTAJNBAHER D, ZUPANČIČ-KRALJ L. Multiresidue method for determination of 90 pesticides in fresh fruits and vegetables using solid-phase extraction and gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2003, 1015(1): 185-198.
[9] HÚŠKOVÁ R, MATISOVA E, KIRCHNER M. Fast GC-MS pesticide multiresidue analysis of apples[J]. Chroatographia, 2008, 68(1): 49-55.
[10] KEIKO K, KUM I N, TAKAHIRO U, et al. Rapid and reliable screening method for detection of 70 pesticides in whole blood by gas chromatography-mass spectrometry using a constructed calibrationlocking database[J]. Legal Medicine, 2012, 14(2): 93-100.
[11] 张立金, 王晓. 基质固相分散-气相色谱-质谱法检测水果中的农药多残留[J]. 食品科学, 2009, 30(16): 262-265.
[12] CHANDRA S, MAHINDRAKAR A N, SHINDE L P. Gas chromatography-mass spectrometry determination of pesticide residue in fruits[J]. International Journal of Chemical Technology Research,2014, 6(1): 124-130.
[13] MATSUOKA T, AKIYAMA Y, MITSUHASHI T. Application of multiresidue analytical method for determination of 496 pesticides in frozen gyoza dumplings by GC-MS and LC-MS[J]. Journal of Pesticide Science, 2011, 36(4): 486-491.
[14] 于红卫, 曲青, 郝文. 食品中27 种农药残留量的高效液相色谱-串联质谱测定法[J]. 职业与健康, 2012, 27(23): 2704-2706.
[15] 于彦彬, 谭丕功, 刘宗兴, 等. 基质校正固相萃取液相色谱-串联质谱法测定食用菌中22 种农药残留[J]. 分析化学, 2013, 41(8):1259-1263.
[16] 寒梅, 侯雪. 气相色谱串联质谱法测定香菇中几种氨基甲酸酯农药残留量[J]. 中国测试, 2013, 9(1): 52-55.
[17] 孟晓萌, 宋烨, 潘少香, 等. GC-MS检测杏鲍菇中的有机氯农药残留[J].中国果菜, 2014, 34(10): 59-62.
[18] MIYAZAKI T, KADOKAMI K. Reproducibility of measurement results by automated identification and quantification system with database for GC/MS[J]. Bunseki Kagaku, 2011, 60(7): 543-556.
[19] KADOKAMI K, TANADA K, TANADA K Y, et al. Novel gas chromatography-mass spectrometry database for automatic identification and quantification of micropollutants[J]. Journal of Chromatography A, 2005, 1089(1/2): 219-226.
[20] KADOKAMI K, TANADA K, TANADA K Y, et al. Development of a novel GC/MS database for simultaneous determination of hazardous chemicals[J]. Bunseki Kagaku, 2004, 53(6): 581-588.
[21] KUDO K, ISHIDA T, HIKIJI W, et al. Construction of calibrationlocking databases for rapid and reliable drug scree ning by gas chromatography-mass spectrometry[J]. Forensic Toxicology, 2009,27(1): 21-31.
[22] NAKASHIMA S, JI H Z, YAMAGAMI T, et al. Development of a novel GC/MS database for the determination of additives for food packaging into the processed foods[J]. Japanese Journal of Food Chemistry, 2013, 20(1): 42-51.
[23] DU Xu, LI Xuehua, LUO Tianlie, et al. Occurrence and aquatic ecological risk assessment of typical organic pollutants in water of Yangtze River estuary[J]. Proce dia Environmental Sciences, 2013,18(4): 882-889.
[24] ISHIDA T, KUDO K, NAKA S, et al. Rapid diagnosis of drug intoxication using novel NAGINATA™ gas chromatography/mass spectrometry software[J]. Rapid Communications in Mass Spectrom,2007, 21(18): 29-38.
Screening of Multi-Pesticide Residues in Edible Fungi by SPE and GC-MS
HU Qiuhui1, ZHANG Changjuan1, ZHENG Huihua2, QIU Weifen1, YANG Wenjian1, ZHAO Liyan3
(1. College of Food Science and Engineering, Collaborative Innovation Center for Modern Grain Circulation and Safety, Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing University of Finance and Economics, Nanjing 210023, China;2. Jiangsu Alphay Bio-technology Co. Ltd., Nantong 226010, China;3. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
A gas chromatography-mass spectrometry (GC-MS) combined with NAGINATA™ software method was developed for screening multi-pesticide residues in edible fungi. The pesticide residues in samples were extracted with acetonitrile, cleaned up with Carbon-NH2solid-phase extractor, detected by GC-MS, and fi nally analyzed by NAGINATA™software. Based on the quality precision and retention time of each compound, the possible hazardous chemical compounds were screened out by matching mass spectra with mass spectral library. Under the optimal conditions, the limits of detection(LOD) of the established method were in the range of 0.001-0.050 mg/kg, and the average recovery rates for 18 pesticide residues spik ed in a blank sample were 77%-110% with relative standard deviations (RSDs) of 1.1%-6.9%. The method was applied on 35 edible fungi purchased from local markets, and two pesticides were detected. which were below the maximum residue limit (MRL) stipulated by the Chinese national standard GB 2763—2014. This method proved to be rapid, simple,effi cient and suitable for the fast screening of pesticide residues in edible fungi.
edible fungi; NAGINATA™ software; solid-phase extraction; gas chromatography-mass spectrometry (GC-MS);pesticide residues
O657
A
1002-6630(2015)14-0171-05
10.7506/spkx1002-6630-201514033
2015-05-08
“十二五”国家科技支撑计划项目(2012BAD36B02);农产品中化学风险物高速分析检测系统的引进及其创新应用项目(农业部948项目)(2015-Z47)
胡秋辉(1962—),男,教授,博士,研究方向为农产品加工与安全。E-mail:qiuhuihu@njue.edu.cn
