淫羊藿苷促进人牙周膜干细胞增殖及骨向分化的作用
2015-10-13秦子顺殷丽华王开娟刘琪程文晓高鹏孙可墨钟梅余占海
秦子顺 殷丽华 王开娟 刘琪 程文晓 高鹏 孙可墨 钟梅 余占海
兰州大学口腔医院修复科,兰州 730000
牙周病是一类发生在牙周组织的慢性感染性疾病,其治疗以实现牙周组织的完全再生,恢复牙龈、牙周膜、牙槽骨和牙骨质的正常生理功能为最终目标[1],但是目前牙周组织缺损一直未能得到完全有效的再生。近年来,组织工程技术迅猛发展,为牙周病的治疗带来了新的希望。牙周组织工程包括生长因子、支架材料及种子细胞[2]。
淫羊藿苷(Icariin,ICA)是小檗科淫羊藿属植物,又名仙灵脾,是从淫羊藿茎叶中提取的总黄酮中的有效成分之一。ICA在促进成骨细胞增殖和分化,调节免疫,甚至抗肿瘤等方面都有重要作用[3]。理想的组织工程支架材料应具备诸多特性,如良好的生物相容性,较佳的生物可降解性,适宜的表面活性,理想的多孔性结构和高孔隙率及生物可塑性等[4]。纳米羟磷灰石(nano-hydroxyapatite,nHAC)支架是一种仿生骨纳米尺寸材料,与天然骨在纳米结构上相当接近,其孔隙率高达80%~90%,孔径100~600 μm,6个月可降解80%以上,是较理想的支架材料。已有研究[5]证实,nHAC可促进并加快骨创伤的愈合,且作用较明显。人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)是来源于牙周组织的一类成体干细胞,能在一定条件下分化成为较成熟的成牙骨质细胞和牙周膜成纤维细胞,可在一定程度上促进牙周组织的自我更新,实现牙周组织缺损的再生[6]。本研究旨在探讨ICA对hPDLSCs增殖及骨向分化的影响,观察将ICA代替传统生长因子应用于牙周组织工程的可行性。
1 材料和方法
1.1 主要试剂与仪器
主要试剂:α-MEM培养基,胎牛血清,Ⅰ型胶原酶,胰蛋白酶,Dispase酶(Gibco公司,美国);ICA(中国药品生物制品检定所,批号:110737—200415);基质蛋白-1单克隆抗体STOR-1,人CD146-FITC单克隆抗体(Beckmen Coulter公司,美国);茜素红,地塞米松,β-甘油磷酸钠,维生素C,二甲基亚砜;nHAC材料(清华大学材料系研制)。主要仪器:CO2孵箱(Heraeau公司,德国),YJ-875型超静工作台(苏州净化设备厂);倒置相差显微镜及照相系统,扫描电子显微镜(scanning electron microscopy,SEM)(Olympus公司,日本)。
1.2 原代hPDLSCs的培养、分离和鉴定
1.2.1 细胞的分离培养 在兰州大学口腔医院口腔颌面外科选择并收集12~18岁因正畸减数需拔牙患者而拔除的牙周健康的前磨牙,要求牙体无龋坏、无缺损,拔除后4 h内送至实验室。在超净工作台内,于无菌培养皿中用PBS液反复冲洗牙体3~4遍,然后使用无菌手术刀片,小心刮取根中1/3处的牙周膜,边刮取边用PBS液冲洗,使用眼科剪将刮取的组织块剪至最小。将获取的牙周膜组织转移至离心管中,1 000 r·min-1条件下离心2 min;弃上清液,避光条件下分别加入1 mLⅠ型胶原酶和1 mL Dispase酶,37 ℃恒温水浴锅内消化40~50 min,每5 min轻轻振荡离心管1次,至组织消化为棉絮状;1 000 r·min-1离心5 min,弃上清液,加入完全培养液2 mL,重悬细胞,接种于六孔板中,于每孔中加入2 mL的完全培养液,置于5%CO2孵箱中37 ℃下培养,5 d后初次换液,以后每3 d换液1次,待细胞在六孔板中长满80%时进行细胞传代。
1.2.2 有限稀释法克隆纯化hPDLSCs 将收集的对数生长期hPDLSCs培养上清液在1 500 r·min-1下离心10 min,经0.22 μm直径的小滤器过滤后,与培养基以体积比1∶1混合作为适应性培养基。取对数生长期的第1代细胞,用适应性培养基倍比稀释,调整细胞密度至每毫升10~15个,吹打混匀,接种于96孔培养板中,每孔100 μL,培养12 h后标记单个细胞孔,并补液至每孔200 μL,5 d换液,待克隆长至孔底1/3~1/2后胰酶消化,扩大培养。
1.2.3 纯化后hPDLSCs的鉴定 取生长良好的克隆化培养的细胞制备细胞爬片;爬片用PBS冲洗3次,每次5 min,滴加0.3%TritonX-100作用15 min,以增加细胞通透性;滴加3%过氧化氢甲醇溶液作用15 min,以消除内源性过氧化物酶的影响;滴加正常山羊血清孵育30 min,以消除非特异性染色。用SABC法染色进行STOR-1和CD146免疫细胞化学染色,以检测细胞来源及表达情况,置于荧光显微镜下观察;阴性对照组用PBS替代一抗。
1.3 ICA对hPDLSCs作用的体外研究
1.3.1 体外四甲基偶氮唑盐(thiazolyl blue tetrazolium bromide,MTT)法检测ICA对hPDLSCs增殖的作用 将生长良好的第3代hPDLSCs经胰酶消化后以每毫升2×105个细胞的密度接种于5块96孔培养板中,每孔100 μL,培养24 h;待细胞贴壁后弃去上清液,分2组,分别加入含1×10-7mol·L-1ICA和不含ICA的α-MEM完全培养液,继续培养,每组设6个复孔。培养第1、2、3、4、5天分别取一块培养板,每孔加入质量浓度5 g·L-1的MTT 20 μL继续培养4 h,弃去上清液,每孔加二甲基亚砜150 μL,轻轻振荡使结晶溶解,用酶联免疫检测仪在570 nm处测定每孔的吸光度A值。取各孔均值,以A570值反映活细胞的数目。
1.3.2 体外碱性磷酸酶(alkaline phosphatase,ALP)法检测ICA对hPDLSCs骨向分化的作用 将生长良好的第3代hPDLSCs消化后以每毫升2×103个细胞的密度接种于3块96孔板,培养24 h,细胞贴壁后弃去上清液,分为2组,每组6个复孔。2组分别加入含1×10-7mol·L-1ICA和不含ICA的α-MEM矿化诱导液(10%胎牛血清,α-MEM培养液,10 nmol·L-1地塞米松,0.05 mmol·L-1维生素C,10 mmol·L-1β-甘油磷酸钠),继续培养;分别于第3、5、7天取1块培养板,弃去培养液,PBS洗涤3次,吸干;每孔加0.1%TritonX-100 100 μL,4 ℃冰箱内过夜;次日于显微镜下观察,无完整的细胞结构后,吹打,每孔吸取50 μL转移至另一块96孔板。按试剂盒说明,依次加入缓冲液、基质液、显色液,立即混匀,于酶联免疫检测仪520 nm处测定各孔ALP活性值,取其均值进行统计分析。
1.3.3 体外逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测ICA对hPDLSCs成骨基因的表达情况 将生长良好的第3代hPDLSCs消化后以每毫升2×103个细胞的密度接种于96孔板,培养24 h,细胞贴壁后弃去上清液,分为2组,每组6个复孔;分别加入含1×10-7mol·L-1ICA和不含ICA的α-MEM矿化诱导液,继续培养7 d;分别收集加药组和未加药组的细胞,提取细胞RNA,逆转录cDNA,行聚合酶链反应扩增,采用常规方法检测Runt相关转录因子2(Runt-related transcription factor-2,Runx2)、胶原蛋白Ⅰ(collagenⅠ,ColⅠ)、骨桥蛋白(osteopontin,OPN)、骨钙蛋白(osteocalcin,OCN)基因的表达量,以β-actin为内参对照。引物设计详见表1。

表1 RT-PCR引物序列Tab 1 Primer sequences of RT-PCR
1.3.4 茜素红染色检测ICA对hPDLSCs骨量表达的作用 将生长良好的第3代hPDLSCs消化后以每毫升2×105个细胞的密度接种于3块6孔板,培养24 h,细胞贴壁后弃去上清液,分为2组,每组3个复孔;分别加含1×10-7mol·L-1ICA和不含ICA的α-MEM矿化诱导液,继续培养,分别于第14、21、28天取1块培养板,吸弃培养液,PBS冲洗,95%乙醇固定10 min,PBS清洗2次,0.1%茜素红染色,光镜下观察。
1.4 hPDLSCs与nHAC结合能力的观察
将nHAC切割成直径2~3 mm的颗粒状材料,消毒灭菌,备用。将hPDLSCs细胞密度调整至每毫升5×105个,接种到nHAC上,负压抽吸使hPDLSCs悬液充分进入nHAC的多孔间隙中。小心将负载细胞的nHAC移至24孔板中,小心加入2 mL培养液进行培养,每24 h换液1次;培养72 h后,3%戊二醛固定,脱水,真空干燥,喷金镀膜后行SEM观察。
1.5 ICA对hPDLSCs作用的体内研究
1.5.1 hPDLSCs与nHAC复合 将nHAC切割成直径2~3 mm的颗粒状材料,消毒灭菌,备用。将hPDLSCs细胞密度调整至每毫升5×105个,接种到nHAC上,负压抽吸使hPDLSCs悬液充分进入nHAC的多孔间隙中。小心将负载细胞的nHAC移至24孔板中,分成2组,分别加入含1×10-7mol·L-1ICA和不含ICA的α-MEM矿化诱导液,继续培养72 h。
1.5.2 动物实验模型的准备及组织学观察 选择6~8周龄BALB免疫缺陷雌性小鼠6只,质量20~22 g,分两组,分别将两组复合材料等量植入小鼠背侧肌层,术后饲养30 d,处死实验动物,取出植入材料,以40 mol·L-1多聚甲醛固定,置于复合脱钙液中24 h,水洗,脱水,石蜡包埋,制成4 μm连续性切片,行苏木精-伊红(hematoxylin-eosin,HE)染色。
1.6 统计学处理
实验数据采用SPSS 13.0软件进行单因素方差分析,检验水准为双侧α=0.05。
2 结果
2.1 细胞生长状况
hPDLSCs原代培养3~7 d后,组织块周围开始有细胞爬出,细胞形态大多为长梭形或不规则形,有1~2个突起,约14 d开始汇合,呈放射状、螺旋状生长(图1)。约3周后,细胞长满孔底80%。生长的细胞以1∶2的比例传代。最初5代的细胞,培养5~7 d即可长满培养皿,细胞生长活跃,核分裂象多;6~12代细胞,培养10~14 d铺满培养皿,细胞增殖稳定。
2.2 细胞表面抗原检测
免疫细胞化学染色显示,STOR-1和CD146呈阳性表达(图2),提示培养的细胞为间充质来源并具有干细胞特性。
2.3 MTT法检测ICA对hPDLSCs增殖的影响
1×10-7mol·L-1ICA作用于hPDLSCs后,分别于第1、2、3、4、5天用MTT法检测hPDLSCs增殖情况,并与对照组比较,其结果见图3:第1天,ICA作用不明显,与对照组相比差异无统计学意义(P>0.05);第2天ICA的作用开始明显,随着培养天数的增加,细胞数量呈递增趋势。经检测,第2天ICA的作用最强,细胞数增加最多。
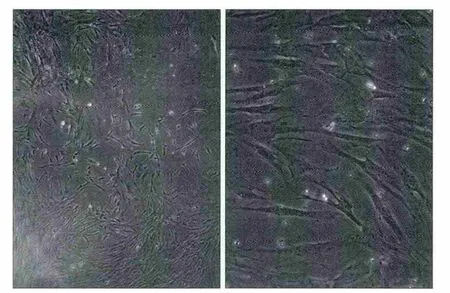
图1 hPDLSCs的生长状况 光学显微镜Fig 1 Growth condition of hPDLSCs optical microscope
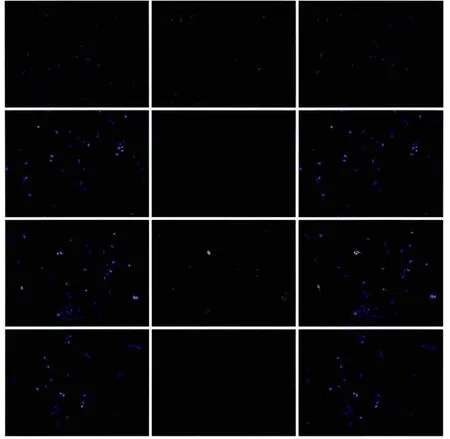
图2 细胞表面抗原检测 荧光显微镜Fig 2 Detection of cell surface antigens fl uorescence microscope

图3 hPDLSCs增殖情况Fig 3 Proliferation of hPDLSCs
2.4 ALP法检测ICA对hPDLSCs骨向分化的作用
1×10-7mol·L-1ICA作用于hPDLSCs,分别在培养第3、5、7天检测ALP活性,结果见图4:第3、5、7天时实验组ALP活性较对照组明显升高(P<0.05)。在ICA作用下,3~5 d时ALP活性增长幅度最大。
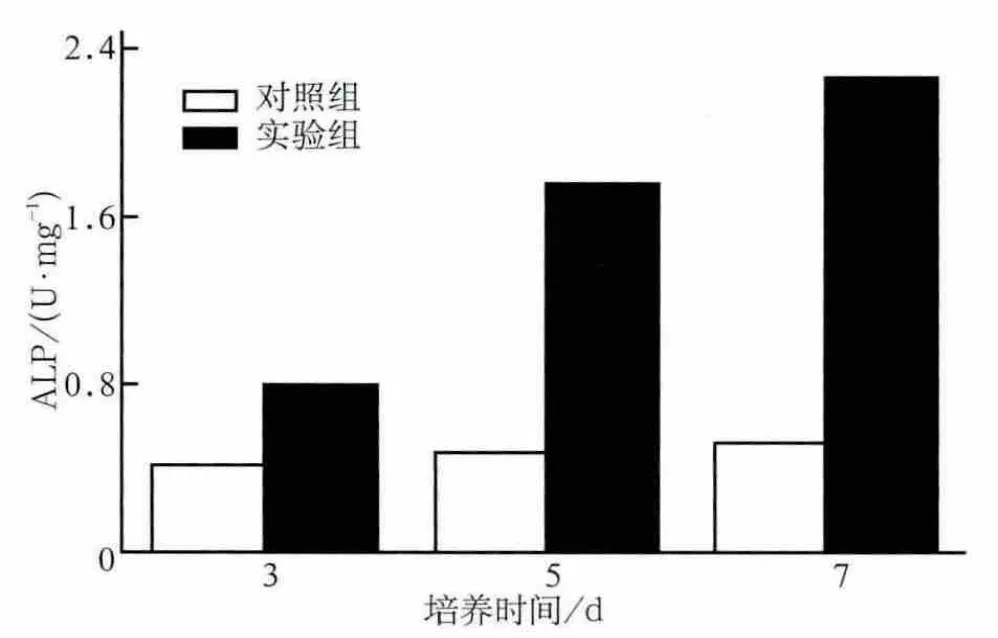
图4 hPDLSCs的ALP活性Fig 4 The expression of ALP in hPDLSCs
2.5 RT-PCR法检测ICA对hPDLSCs成骨基因表达的作用
1×10-7mol·L-1的ICA作用于hPDLSCs后培养7 d,采用RT-PCR法检测4种成骨基因的相对表达量,其结果见图5:实验组Runx2、ColⅠ、OPN、OCN的相对表达量较对照组明显升高(P<0.05),以ColⅠ的相对表达量最高。
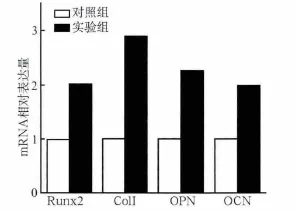
图5 RT-PCR法检测hPDLSCs成骨基因的表达Fig 5 RT-PCR for the detection of osteoblastic marker in hPDLSCs
2.6 茜素红染色法检测ICA对hPDLSCs骨量表达的影响作用
1×10-7mol·L-1的ICA作用于hPDLSCs后分别培养14、21、28 d,每次检测均可见明显的钙化结节,14~28 d的结节量呈增多趋势(图6)。由图6可见,实验组钙化结节的面积明显大于对照组。
2.7 hPDLSCs与nHAC结合能力的SEM观察
SEM观察可见,hPDLSCs在nHAC上贴附牢固,生长旺盛,伸展充分(图7)。

图6 钙化结节的形成 茜素红染色 × 100Fig 6 The formation of calci fi ed nodules alizarin red staining × 100
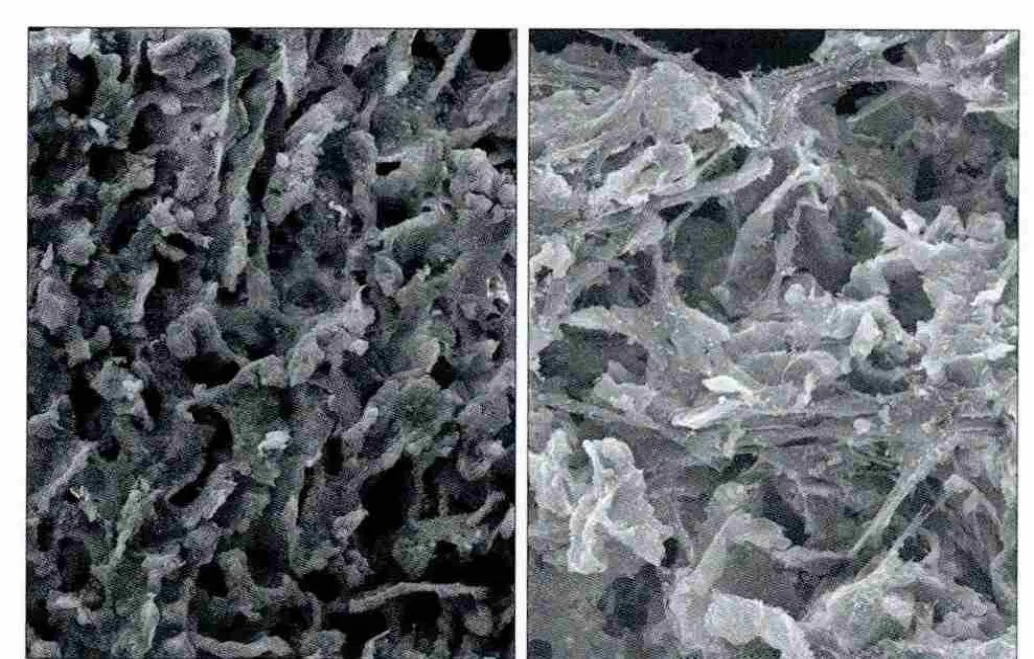
图7 hPDLSCs在nHAC上的形态学观察 SEMFig 7 Morphology of hPDLSCs on nHAC SEM
2.8 ICA对hPDLSCs作用体内研究的组织切片观察
术后30 d,对照组nHAC周围可见类骨质及少量编织骨(图8左);实验组nHAC周围出现大量编织骨,骨小梁表面可见覆以不规则形状的成骨细胞,网状骨小梁间可见新生骨组织和血管(图8右)。

左:对照组;右:实验组。
3 讨论
种子细胞的选择是牙周组织工程的首要问题。目前用于牙周组织工程的种子细胞有牙周膜干细胞、牙髓基质干细胞、胚胎干细胞和脂肪干细胞等[7]。在这些细胞中,牙周膜干细胞是存在于牙周组织中的一种成体干细胞,具有干细胞特性,具有高增殖能力、自我更新能力以及多向分化能力,在成骨的同时也可以分化形成类似于牙周膜样组织,被认为是牙周组织工程的首选种子细胞[8]。本实验将hPDLSCs作为种子细胞。在培养中观察可见,经原代培养3~7 d后,组织块周围开始有细胞爬出,约14 d开始汇合,呈放射状、螺旋状生长;约3周后细胞长满孔底80%;传代培养时,最初5代细胞生长活跃,核分裂象多,6~12代细胞增殖稳定。免疫细胞化学染色显示,STOR-1和CD146呈阳性表达,可见培养的细胞为间充质来源并具有干细胞特性。
本实验基于牙周病的治疗现状和组织工程技术的发展背景,研究ICA应用于组织工程领域治疗牙周病的可行性。有研究[5,9-14]已经证实,ICA在促进成骨细胞的功能方面具有重要的作用。ICA可显著促进大鼠成骨细胞的分化与成熟,促进人脐带间充质干细胞、羊骨髓间充质干细胞和大鼠骨髓间充质干细胞的骨向分化与增殖;能抑制大鼠破骨细胞的分化及细胞活性,降低其骨吸收能力,达到促进成骨细胞增殖和分化的作用;并具有促进人成骨细胞增殖和分化的功能,具有促进骨形成的生理活性。本实验中,以1×10-7mol·L-1ICA作用于hPDLSCs,观察ICA对hPDLSCs生长增殖的影响,结果发现:ICA从培养的第2天开始,可以明显促进hPDLSCs的增殖,随着培养天数的增加,细胞数量逐渐增多。ALP是成骨细胞、成牙骨质细胞等骨化细胞的标志性物质,在成骨细胞、成牙骨质细胞刚开始形成骨和牙骨质时,ALP活性显著增加,因此ALP可以作为细胞骨向分化的评价指标[15]。本实验中,1×10-7mol·L-1ICA作用于hPDLSCs后,ALP活性明显升高,提示ICA具有促进hPDLSCs的增殖和骨向分化的能力。Runx2、ColⅠ、OPN和OCN是一种指示骨新陈代谢变化过程的灵敏、准确和特异性的指标性物质,可以反映细胞的成骨活性[16]。本实验中,1×10-7mol·L-1ICA作用于hPDLSCs后,4种基因的表达均明显增高,说明ICA具有明确的促进hPDLSCs骨向分化的作用。
羟磷灰石具有良好的生物相容性和生物活性[17],是牙槽骨、牙骨质、牙齿的主要无机成分。nHAC作为一种典型的生物材料,是纳米微晶状态的细胞外基质材料,也是良好的牙周组织工程支架材料,植入人体后能在短时间内附着于人体组织,并最终与体内的软硬组织紧密结合,现已成为广泛应用的植骨代用品[18]。nHAC及其复合材料的构想源于天然组织,牙齿就是由nHAC晶体和有机高分子组成的纳米复合材料[19]。将nHAC及其复合材料应用于牙周组织工程,是将材料技术应用于建立牙齿新附着的尝试,是组织工程领域非常重要的研究课题[20]。本实验以nHAC作为支架材料,将hPDLSCs接种到nHAC三维支架上,经SEM观察发现,hPDLSCs可以在nHAC上牢固贴附,生长旺盛,伸展充分。本实验进一步将hPDLSCs与nHAC复合支架经ICA作用72 h后植入小鼠体内,术后30 d,经组织学观察,结果可见:经ICA作用的nHAC周围出现大量的编织骨,骨小梁表面可见覆以不规则形状的成骨细胞,网状骨小梁间可见新生骨组织和血管;未经ICA作用的对照组nHAC周围可见类骨质及少量编织骨。该结果证实ICA在体内对hPDLSCs的增殖及骨向分化也具有明显作用。
通过本实验的研究,证实ICA作为生长因子,hPDLSCs作为种子细胞在牙周组织工程中的应用是可行的,这为牙周组织工程的发展提供了新的思路。
[1]赵弼洲, 李欣, 田佳灵, 等. 淫羊藿苷对人牙周膜细胞增殖及骨向分化的影响[J]. 口腔医学研究, 2011, 27(11):967-970.
[2]高秦, 刘宏伟, 金岩, 等. 人牙周膜干细胞向神经细胞诱导分化的实验研究[J]. 临床口腔医学杂志, 2009, 25(7):387-390.
[3]鲁红, 田宇, 吴织芬. 珊瑚转化羟基磷灰石应用于牙周组织工程的细胞相容性和细胞毒性[J]. 中国组织工程研究,2012, 16(16):2955-2958.
[4]Ariani MD, Matsuura A, Hirata I, et al. New development of carbonate apatite-chitosan scaffold based on lyophilization technique for bone tissue engineering[J]. Dent Mater J, 2013,32(2):317-325.
[5]Ma HP, Ming LG, Ge BF, et al. Icariin is more potent than genistein in promoting osteoblast differentiation and mineralization in vitro[J]. J Cell Biochem, 2011, 112(3):916-923.
[6]Shuai C, Yang B, Peng S, et al. Development of composite porous scaffolds based on poly (lactide-co-glycolide)/nanohydroxyapatite via selective laser sintering[J]. Int J Adv Manuf Tech, 2013, 69(1/2/3/4):51-57.
[7]Park JC, Lee SM, Kim JC, et al. Effect of humoral factors from hPDLSCs on the biologic activity of hABCs[J]. Oral Dis, 2012, 18(6):537-547.
[8]Gardner OF, Archer CW, Alini M, et al. Chondrogenesis of mesenchymal stem cells for cartilage tissue engineering[J].Histol Histopathol, 2013, 28(1):23-42.
[9]Li GW, Xu Z, Chang SX, et al. Icariin prevents ovariectomyinduced bone loss and lowers marrow adipogenesis[J]. Menopause, 2014, 21(9):1007-1016.
[10]Hsieh TP, Sheu SY, Sun JS, et al. Icariin inhibits osteoclast differentiation and bone resorption by suppression of MAPKs/NF-κB regulated HIF-1α and PGE(2)synthesis[J]. Phytomedicine, 2011, 18(2/3):176-185.
[11]Wang R, Luo JG, Kong LY. An MC3T3-E1 cell line biomembrane extraction and HPLC-ESI-MSN method for simultaneous analysis of potential anti-osteoporosis components of epimedium koreanum[J]. Chromatographia, 2012, 75(11/12):607-615.
[12]Li YC, Ding XS, Li HM, et al. Icariin attenuates high glucoseinduced type Ⅳ collagen and fi bronectin accumulation in glomerular mesangial cells by inhibiting transforming growth factor-β production and signalling through G protein-coupled oestrogen receptor 1[J]. Clin Exp Pharmacol Physiol, 2013,40(9):635-643.
[13]Xu CQ, Liu BJ, Wu JF, et al. Icariin attenuates LPS-induced acute in fl ammatory responses: involvement of PI3K/Akt and NF-kappaB signaling pathway[J]. Eur J Pharmacol, 2010,642(1/2/3):146-153.
[14]Zhang WP, Bai XJ, Zheng XP, et al. Icariin attenuates the enhanced prothrombotic state in atherosclerotic rabbits independently of its lipid-lowering effects[J]. Planta medica,2013, 79(9):731-736.
[15]Wang F, Zhang YC, Zhou H, et al. Evaluation of in vitro and in vivo osteogenic differentiation of nano-hydroxyapatite/chitosan/poly(lactide-co-glycolide)scaffolds with human umbilical cord mesenchymal stem cells[J]. J Biomed Mater Res A, 2014, 102(3):760-768.
[16]Bhamidipati M, Scurto AM, Detamore MS. The future of carbon dioxide for polymer processing in tissue engineering[J]. Tissue Eng Part B Rev, 2013, 19(3):221-232.
[17]王岚, 夏佳佳, 刘琪, 等. 脂多糖对人牙周膜干细胞增殖及炎性因子表达的影响[J]. 华西口腔医学杂志, 2013, 32(3):286-290.
[18]孙传喜, 张淋坤, 封小霞, 等. 周期性张应力作用下人牙周膜干细胞Dlx5和Msx2表达的变化[J]. 四川大学学报:医学版, 2011, 42(6):823-826.
[19]Wei F, Qu C, Song T, et al. Vitamin C treatment promotes mesenchymal stem cell sheet formation and tissue regeneration by elevating telomerase activity[J]. J Cell Physiol,2012, 227(9):3216-3224.
[20]杨琨, 崔晓霞, 邓超, 等. 糖基化终末产物对人牙周膜干细胞和骨髓间充质干细胞骨向分化能力影响的比较研究[J]. 牙体牙髓牙周病学杂志, 2013, 23(6):366-370.
