黄芪治疗绝经后骨质疏松的抗氧化机制研究
2015-10-12崔红贾文斌杨奇冯亚非
崔红,贾文斌,杨奇,冯亚非
黄芪治疗绝经后骨质疏松的抗氧化机制研究
崔红,贾文斌,杨奇,冯亚非
目的:研究黄芪改善绝经后骨质疏松的具体机制。方法:选用32只3月龄SD雌性大鼠,随机分为假手术组、单纯去势组、黄芪治疗组和抗氧化剂组。后3组卵巢切除术后4周分别给予相应制剂灌胃,12周处死动物取材,检测血清和骨组织氧化应激水平[丙二醛(MDA)和超氧化物歧化酶(SOD)]、股骨骨密度和骨代谢指标[碱性磷酸酶(ALP)、血钙(Ca)、血磷(P)和骨钙素(OC)]。结果:单纯去势组的血清和骨组织中氧化应激水平比假手术组升高(P<0.01),而股骨骨密度降低(P<0.01)。与单纯去势组比较,黄芪治疗组和抗氧化剂组血清和骨组织中氧化应激水平降低(P<0.01),同时股骨骨密度升高(P<0.05),ALP和OC降低(P<0.05)。结论:黄芪水提液能够通过抗氧化效应有效改善去卵巢大鼠的骨量丢失和骨代谢。
黄芪;骨质疏松;骨密度;动物实验
(J Int Obstet Gynecol,2015,42:504-507)
骨质疏松(osteoporosis)是一种以骨量降低和骨组织显微结构破坏为特征,进而导致骨脆性增加及骨折易发的代谢性骨病[1]。据统计,中国每年有接近九千万骨质疏松患者。绝经后女性由于雌激素水平下降以及饮食、遗传、药物、运动等诸多原因,发病率明显较男性高[2-3]。随着当前社会人口的老龄化趋势加剧,绝经后骨质疏松(postmenopausal osteoporosis, PO)所致骨折的发病率也呈现几何级数的递增趋势,并由此带来了极大的家庭及社会负担[4]。多项研究证实中药在骨骼系统疾病的治疗中拥有良好的疗效和广阔的应用前景[5-7]。近期研究发现以黄芪为主药的各种复方制剂能够提高骨密度,改善骨代谢,同时提高性激素水平,从而有效缓解骨质疏松的临床症状[8]。但是,目前尚缺乏黄芪治疗骨质疏松具体机制的相关研究。考虑到近年来一系列报道均证实氧化应激(oxidative stress,OS)在骨质疏松的发病进程中起到了至关重要的作用[9-10],本实验观察黄芪对去卵巢大鼠骨密度及血液和骨组织中氧化应激水平,探索黄芪对骨量的影响及治疗骨质疏松的作用机制。
1 材料与方法
1.1实验动物及药物SPF级3个月龄雌性未育Sprague-Dawley(SD)大鼠32只,体质量(230±15)g,由第四军医大学实验动物中心提供。黄芪水提液由第四军医大学药学系从膜荚黄芪(astragalus membranaceus,AM)中提取,具体提取方法为:100 g黄芪,加蒸馏水至浸过药材,加热沸腾40 min后提取药液备用。药材再次加蒸馏水加热沸腾30 min后提取药液备用。药材第3次加蒸馏水加热沸腾20 min。然后将3次滤液合并,以3 000 r/min离心5 min,留取上清液。使用旋转蒸发仪在80℃,-0.08 MPa(1 MPa=7.5×103mmHg)条件下将上清液浓缩至60 mL。将浓缩液在100 mL容量瓶中定容,即配置成相当于1 g/mL的药材。戊巴比妥钠由科昊生物工程有限责任公司生产。抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)抗氧化机制主要有以下两个方面:①NAC作为小分子物质易于进入细胞,脱乙酰基后成为谷胱甘肽合成的前体,促进谷胱甘肽的合成,提高组织内谷胱甘肽含量,增强组织的抗自由基及抗药物、毒物损伤的能力。②NAC分子中的活性巯基(-SH)可对抗不同原因所致的组织氧化损伤。对体内氧自由基(超氧阴离子、过氧化氢、羟自由基等)具有明显的拮抗作用;由于NAC易进入细胞内,对能透过细胞膜与多种细胞成分(如蛋白质、DNA、氨基酸等)反应、导致肝细胞损伤坏死的氧自由基具有抑制、清除作用。NAC为美国Sigma公司生产,使用生理盐水将其配制成0.5 mg/mL水溶液。
1.2方法
1.2.1动物模型及给药将32只大鼠随机分为4组:假手术组、单纯去势组、黄芪治疗组和抗氧化剂组,每组8只。所有大鼠适应性喂养4周后以2%戊巴比妥钠30 mg/kg腹腔内注射麻醉,备皮、消毒铺单后背侧双切口入路切开腹膜,进入腹腔,暴露卵巢。假手术组仅在暴露卵巢后,切除其周围约1 cm3大小脂肪组织,不切除卵巢。其余3组用平镊将卵巢牵出,在输卵管与子宫角交界处结扎,摘除卵巢。术后4周开始假手术组和单纯去势组采用生理盐水10 mL/(kg·d)灌胃,黄芪治疗组灌胃给予200 mg/(kg·d)黄芪水提取液,抗氧化剂组灌胃给予5 mg/(kg·周)抗氧化剂溶液,共持续8周。4组动物在同一环境下饲养60 d,每周称动物体质量1次。术后12周麻醉大鼠,开胸,直视下左心室穿刺取血6 mL,2 500 r/min离心10 min分离血清,-80℃冷冻保存。剖取双侧股骨,剔除周围软组织,用生理盐水洗净。右侧股骨放入多聚甲醛保存,左侧股骨洗净后用液氮速冻后测定骨组织氧化应激水平。
1.2.2血清氧化应激水平测定解冻血清,硫代巴比妥酸法测定丙二醛(MDA);黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)。试剂盒均由南京建成生物工程公司提供,按使用说明书进行操作。
1.2.3骨组织氧化应激水平测定将液氮中的骨组织称重后,采用锤式组织粉碎器击打,迅速将骨组织转入装有液氮的研钵中,将骨组织碎块磨成粉末状。然后将粉末状骨组织收集到1.5 mL的离心管中,向EP管中加入蛋白裂解液,在冰上裂解骨组织30 min。4℃离心取上清即为含有总蛋白的提取液。用蛋白质印迹法(Western blot)检测抗氧化酶锰超氧化物歧化酶(MnSOD)和过氧化氢酶(Catalase)的表达,以β-actin作为内参蛋白。
1.2.4骨密度测定将多聚甲醛中的标本取出洗净,通过美国HOLOGIC公司双能X线吸收骨密度仪(DEXA)测量,用单位面积上的骨矿含量进行表示。股骨的X线扫描区域被等距离地分为3等份:近端、中端和远端,取3个区域的平均值作为股骨的骨密度数值。
1.2.5骨代谢生化指标的测定将血液标本送至第四军医大学西京医院检验科,测定血清中骨代谢生化指标的水平,包括碱性磷酸酶(ALP)、血钙(Ca)、血磷(P)和骨钙素(OC)。
1.3统计学方法采用Graphpad Prism 6.0.1统计分析软件处理实验结果。定量资料正态分布的数据用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey检验。多组间比较及组间两两比较均以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠血清氧化应激水平的比较单纯去势组大鼠较假手术组MDA水平升高,SOD降低(均P<0.01)。而与单纯去势组相比,黄芪治疗组和抗氧化剂组血清MDA降低,SOD增加(P<0.01)。见表1。
表1 各组大鼠血清氧化应激水平的比较(±s)
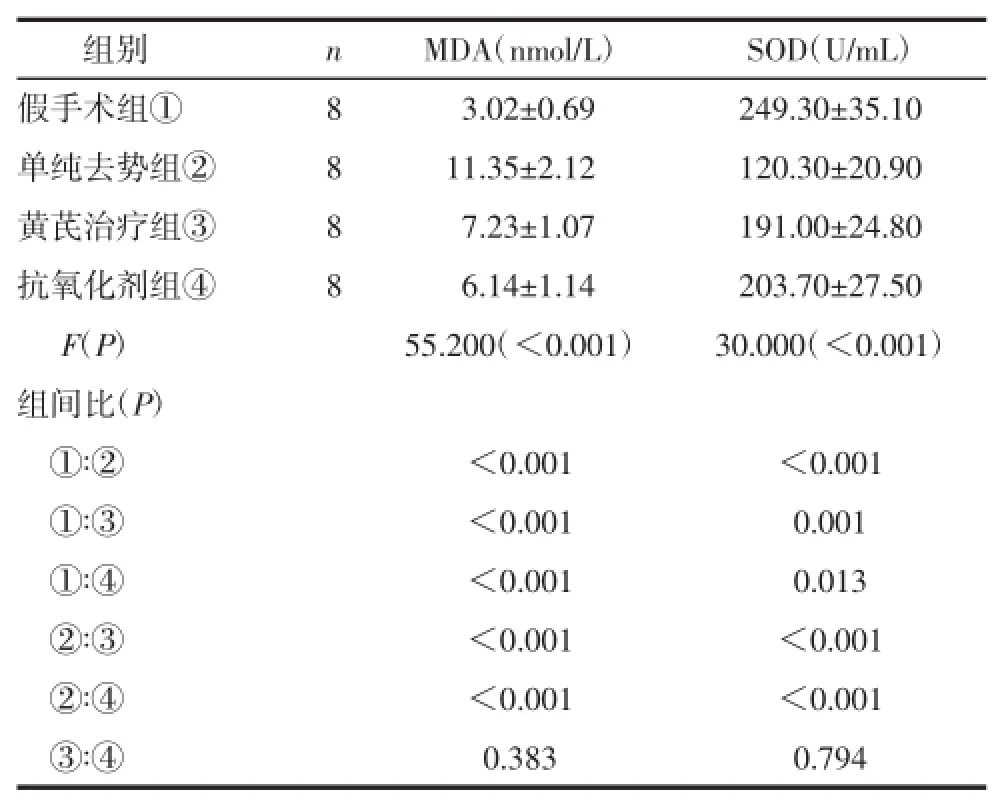
表1 各组大鼠血清氧化应激水平的比较(±s)
组别 n MDA(nmol/L) SOD(U/mL)假手术组① 8 03.02±0.69 249.30±35.10单纯去势组② 8 11.35±2.12 120.30±20.90黄芪治疗组③ 8 07.23±1.07 191.00±24.80抗氧化剂组④ 8 06.14±1.14 203.70±27.50 F(P) 55.200(<0.001) 30.000(<0.001)组间比(P)①∶② <0.001 <0.001①∶③ <0.001 0.001①∶④ <0.001 0.013②∶③ <0.001 <0.001②∶④ <0.001 <0.001③∶④ 0.383 0.794
2.2各组大鼠骨组织氧化应激水平和骨密度的比较各组大鼠骨组织中MnSOD和Catalase的电泳图,见图1。单纯去势组骨组织中的抗氧化酶MnSOD 和Catalase的表达较假手术组降低(P<0.01),而与单纯去势组相比,黄芪治疗组和抗氧化剂组增加了两种抗氧化酶的表达(P<0.01)。见表2。单纯去势组的股骨骨密度比假手术组降低(P<0.01),黄芪治疗组和抗氧化剂组骨密度较单纯去势组升高(P<0.05),但两组间差异无统计学意义(P>0.05)。见表2。2.3各组大鼠血清骨代谢生化指标的比较与假手术组比较,单纯去势组ALP和OC的测定值升高(P<0.01),与单纯去势组相比,黄芪治疗组和抗氧化剂组ALP和OC的测定值降低(P<0.05);4组间Ca和P差异无统计学意义(P>0.05)。见表3。
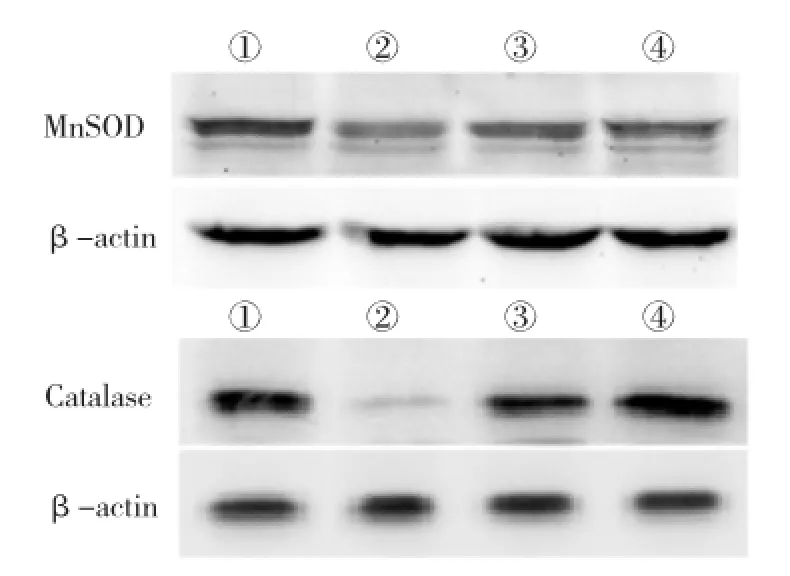
图1 各组大鼠骨组织中MnSOD和Catalase的电泳图
表2 各组大鼠骨组织氧化应激水平和骨密度的比较(±s)

表2 各组大鼠骨组织氧化应激水平和骨密度的比较(±s)
组别 n MnSOD Catalase 骨密度(g/cm2)假手术组① 8 0.97±0.11 1.12±0.06 0.21±0.03单纯去势组② 8 0.48±0.08 0.32±0.08 0.15±0.02黄芪治疗组③ 8 0.80±0.06 0.90±0.08 0.19±0.02抗氧化剂组④ 8 0.85±0.09 0.97±0.07 0.18±0.01 F(P) 35.000(<0.001)143.000(<0.001)11.110(<0.001)组间比(P)①∶② <0.001 <0.001 <0.001①∶③ 0.017 <0.001 0.257①∶④ 0.114 0.010 0.040②∶③ <0.001 <0.001 0.004②∶④ <0.001 <0.001 0.040③∶④ 0.785 0.354 0.782
表3 各组大鼠血清骨代谢生化指标的比较(±s)

表3 各组大鼠血清骨代谢生化指标的比较(±s)
组别 ALP(U/L) Ca(mmol/L) P(mmol/L) OC(ng/mL)假手术组① 80.90±13.30 2.44±0.50 1.90±0.26 8.21±2.62单纯去势组②124.80±18.10 2.40±0.36 1.98±0.30 12.93±2.06黄芪治疗组③102.10±15.20 2.31±0.44 2.06±0.32 9.49±2.60抗氧化剂组④100.50±15.00 2.38±0.41 2.02±0.35 9.85±2.54 F 10.700 0.128 0.390 143.000 P 0.001 0.943 0.761 <0.001组间比(P)①∶② <0.001 - - 0.003①∶③ 0.049 - - 0.729①∶④ 0.077 - - 0.552②∶③ 0.032 - - 0.044②∶④ 0.020 - - 0.042③∶④ 0.997 - - 0.991
3 讨论
中老年女性由于骨量峰值较低和绝经后雌激素水平显著下降,很容易发生绝经后骨质疏松,其并发症严重,资源消耗大,给患者本人及家庭和社会造成沉重负担,已成为全球性的健康问题。目前临床上应用的抗骨质疏松药物,虽然可以取得一定疗效,但是均属替代治疗,且费用昂贵。长期用药还会造成患者依从性差,药物不良反应的发生率增加[11-12]。中药在治疗骨质疏松方面,具有整体调节、不良反应小、价格低廉等优点,已引起国内外研究者的广泛关注。由于骨质疏松在中医辨证属骨痿范畴,病机为肾精亏虚、脾肾气虚。
黄芪作为一种传统中药,含有多糖、苷类、黄酮和微量元素等多种成分。记载中有补中健脾肾,以益气血生化之效。多项实验研究表明:黄芪水提液能减少骨吸收,增加骨形成,从而有效防止去卵巢大鼠的骨丢失[8,13];此外,还能够促进肠道对钙的吸收、减少肾对钙磷的排泄,改善骨代谢。临床研究方面,阳波等[14]用黄芪治疗绝经后骨质疏松,腰椎和股骨骨密度显著增高,肾虚症状评分显著降低,骨代谢指标显著改善,提示黄芪治疗可以有效阻止绝经后骨质疏松患者骨量丢失,改善肾虚症状。在本研究中使用黄芪水提液显著提高了去卵巢大鼠的骨密度,降低血清ALP和OC水平。尽管黄芪治疗骨质疏松的效果得到了多方面的验证,但其具体的改善机制尚不清楚。目前多认为可能与提高性激素水平、改善成骨细胞功能、提高机体微量元素含量有关,但是仍然缺乏更加深入的机制研究。
雌激素水平下降一直以来被认为是女性绝经后骨质疏松的主要机制[15]。因此补肾中药能提升和维持机体性激素水平,改善骨质疏松,这一理论得到多项研究的证实[16]。但是,近年来的研究证实:氧化应激中过量产生的活性氧簇(reactive oxygen species,ROS)可能才是最重要的致病因素,也由此产生了绝经后骨质疏松发病机制由“雌激素为中心”向“氧化应激为中心”转移的相关理论[9]。氧化应激会影响成骨细胞、破骨细胞以及骨细胞的产生及活性[17-18]。Almeida等[19]研究发现ROS的大量产生能阻断细胞内的β-catenin/Wnt信号通路,影响了成骨细胞的功能和活性。另外,抗氧化系统所提供的抗氧化能力也是维持骨骼稳态所必不可少的。而绝经后女性骨质中抗氧化应激能力的下降,诱发了急性期雌激素缺乏时骨吸收的发生。抗氧化治疗能有效改善成骨细胞的活性和骨密度,这就为改善骨质疏松提供了新的思路和策略。
黄芪能够抑制多种组织器官中的氧化应激水平[20-21]。本实验发现,加入黄芪降低了去卵巢大鼠血清和骨组织中的氧化应激指标,其效果与抗氧化剂组相似。另外,黄芪对骨密度及骨代谢的改善作用也与抗氧化剂干预后相似,这些证据提示黄芪可能是通过抑制氧化应激来改善骨质疏松的。另外,本研究发现黄芪促进了线粒体内的抗氧化酶MnSOD和Catalase的表达,表明黄芪是通过改善线粒体的功能来抑制氧化应激的。总之,由于中药成分非常复杂,一种中药就含有多种成分,其作用机制可能与多种因素有关。因此,探索黄芪对骨质疏松的详细改善机制,有利于更好地分析其中具体的作用成分,从而为该药物的提纯和产品化提供更好的理论和实验指导。
[1]NIH Consensus Development Panel on Osteoporosis Prevention,Diagnosis,and Therapy.Osteoporosis prevention,diagnosis,and therapy[J].JAMA,2001,285(6):785-795.
[2]Johnell O,Kanis JA.An estimate of the worldwide prevalence and disability associated with osteoporotic fractures[J].Osteoporos Int,2006,17(12):1726-1733.
[3]Sugerman DT.JAMA patient page.Osteoporosis[J].JAMA,2014,311(1):104.
[4]Omsland TK,Emaus N,Tell GS,et al.Mortality following the first hip fracture in Norwegian women and men(1999—2008).A NOREPOS study[J].Bone,2014,63:81-86.
[5]Qi W,Yan YB,Lei W,et al.Prevention of disuse osteoporosis in rats by Cordyceps sinensis extract[J].Osteoporos Int,2012,23(9):2347-2357.
[6]Zhao X,Wu ZX,Zhang Y,et al.Anti-osteoporosis activity of Cibotium barometz extract on ovariectomy-induced bone loss in rats[J].J Ethnopharmacol,2011,137(3):1083-1088.
[7]Cao PC,Xiao WX,Yan YB,et al.Preventive effect of crocin on osteoporosis in an ovariectomized rat model[J].Evid Based Complement Alternat Med,2014,2014:825181.
[8]韩秀文,王进.黄芪治疗骨质疏松症的实验研究进展[J].中外医学研究,2011,9(8):120-121.
[9]Manolagas SC.From estrogen-centric to aging and oxidative stress:a revised perspective of the pathogenesis of osteoporosis[J].Endocr Rev,2010,31(3):266-300.
[10]Alfadda AA,Sallam RM.Reactive oxygen species in health and disease[J].J Biomed Biotechnol,2012,2012:936486.
[11]Rossouw JE,Anderson GL,Prentice RL,et al.Risks and benefits of estrogen plus progestin in healthy postmenopausal women:principal results from the Women’s Health Initiative randomized controlled trial[J].JAMA,2002,288(3):321-333.
[12]Gray S.Breast cancer and hormone-replacement therapy:the Million Women Study[J].Lancet,2003,362(9392):1332.
[13]赵小梅,陈学习,彭成.补肾中药抗肾虚骨质疏松症作用机制的研究假说述评[J].中国现代医生,2008,46(4):32-33.
[14]阳波,杨静.黄芪对绝经后骨质疏松症患者影响的临床研究[J].四川医学,2007,28(3):291-293.
[15]潘静华,张海啸,李恩,等.黄芪对去卵巢大鼠骨组织的动态影响[J].中国中医基础医学杂志,2010,16(3):251-253.
[16]季华,李强,翟祥娟.雌激素在骨质疏松症中的生理作用及临床应用[J].中国妇幼保健,2012,27(21):3357-3359.
[17]Hamada Y,Fujii H,Fukagawa M.Role of oxidative stress in diabetic bone disorder[J].Bone,2009,45(Suppl 1):35-38.
[18]Yang YH,Li B,Zheng XF,et al.Oxidative damage to osteoblasts can be alleviated by early autophagy through the endoplasmic reticulum stress pathway--implications for the treatment of osteoporosis[J].Free Radic Biol Med,2014,77:10-20.
[19]Almeida M,Han L,Martin-Millan M,et al.Oxidative stress antagonizes Wnt signaling in osteoblast precursors by diverting betacatenin from T cell factor-to forkhead box O-mediated transcription[J].J Biol Chem,2007,282(37):27298-27305.
[20]夏丽君.黄芪在体内抗氧化作用的实验研究[J].辽宁中医药大学学报,2010,12(5):232-233.
[21]Li XT,Zhang YK,Xin XJ,et al.Mitochondrial protection and antiaging activity of Astragalus polysaccharides and their potential mechanism[J].Int J Mol Sci,2012,13(2):1747-1761.
The Anti-oxidative Effect of Astragalus Membranaceus on Postmenopausal Osteoporosis
CUI Hong,JIA Wen-bin,YANG Qi,FENG Ya-fei.
Department of Gynecology(CUI Hong),Department of Pharmacy(JIA Wen-bin),The First Sanatorium of Jinan Military Area Command,Qingdao 266071,Shandong Province,China;School of Pharmacy,The Fourth Military Medical University,Xi′an 710032,China(YANG Qi);Department of Orthopaedic Surgery,Xijing Hospital,The Fourth Military Medical University,Xi′an 710032,China(FENG Ya-fei)
FENG Ya-fei,E-mail:fengyafei2005@163.com
Objective:To study the specific mechanisms underlying the improvement of astragalus membranaceus(AM)on postmenopausal osteoporosis.Methods:A total of 40 three-month-old female SD rats were randomly divided into four groups: sham group,ovariectomized(OVX)group,the AM group,and the antioxidant group.Four weeks after surgery,each group was respectively given their treatment by gavage.Animals were sacrificed at 12 weeks,and levels of oxidative stress in serum and bone tissue,femur bone density and bone metabolism were analyzed.Results:Significantly higher oxidative stress level and lower bone mineral density were observed in the OVX group than that in the sham group(all P<0.01).Compared with the OVX group,AM group and antioxidant group showed significantly reduced oxidative stress level(P<0.01),while the femur bone density was significantly increased(P<0.05)and alkaline phosphatase and osteocalcin were significantly decreased(both P<0.05).Conclusions:AM extract can effectively improve bone loss and bone metabolism in ovariectomized rats,and this improvement was achieved by its antioxidant effect.
Astragalus membranaceus;Osteoporosis;Bone density;Animal experimentation
2015-02-09)
[本文编辑王琳]
国家自然科学基金(8140090146)
266071山东省青岛市,济南军区第一疗养院妇科(崔红),药剂科(贾文斌);第四军医大学药学系(杨奇);第四军医大学西京医院骨科(冯亚非)
冯亚非,E-mail:fengyafei2005@163.com
