ER与TrkB在子宫内膜异位症患者不同子宫内膜组织中的表达
2015-10-12雍敏婕李文倩王芳金伟刘波于晓辉
雍敏婕,李文倩,王芳,金伟,刘波,于晓辉
ER与TrkB在子宫内膜异位症患者不同子宫内膜组织中的表达
雍敏婕,李文倩,王芳,金伟,刘波,于晓辉
目的:检测雌激素受体(ER)和酪氨酸激酶受体B(TrkB)在子宫内膜异位症(EMs)患者在位和异位内膜组织中的表达,评价ER和TrkB在EMs发病中的作用。方法:选择18例卵巢EMs病例,其中在位内膜增殖期9例、分泌期9例。采用实时聚合酶链反应(real time PCR)、蛋白质印迹法(Western blotting)和免疫组织化学法检测ERα、ERβ、TrkB和脑源性神经营养因子(BDNF)mRNA和蛋白质的表达。结果:EMs患者在位内膜ERα mRNA和蛋白表达高于异位内膜组织,而ERβ、TrkB mRNA和蛋白的表达均低于异位内膜组织,差异有统计学意义(均P<0.05)。异位内膜组织中ERβ/ERα mRNA的比值高于在位内膜组。在EMs在位内膜中,ERα、ERβ、TrkB蛋白的表达在增殖期均高于分泌期(均P<0.05)。ERα主要表达于在位内膜细胞核内;ERβ主要表达于异位内膜细胞质中;ERα与ERβ在EMs在位内膜的增殖期着色比分泌期更加明显。EMs的在位内膜和异位内膜组织中TrkB与BDNF都有表达,且主要集中于细胞质。EMs在位内膜中TrkB蛋白质在增殖期表达更明显。结论:ERβ和TrkB可能在EMs的发病机制中发挥作用。
受体,雌激素;受体,trkB;子宫内膜异位症;子宫内膜
(J Int Obstet Gynecol,2015,42:500-503)
子宫内膜异位症(endometriosis,EMs)是生育期妇女的常见病,严重影响中青年妇女的身体健康和生活质量,但其发病机制仍不清楚。EMs虽然是良性病变,但临床上却表现为侵袭、转移性生长的类似恶性肿瘤的生物学行为[1]。EMs在位内膜这种类似癌细胞的特殊能力,可能源于局部的高雌激素环境[2]。正常人生殖系统中雌激素受体(estrogen receptor,ER)表达以ERα为主,而EMs中ER表达出现异常,ERβ表达明显高于ERα,两种受体平衡优势发生逆转[2-3]。近年来,国内外学者对EMs在位内膜和异位内膜凋亡的调控机制以及调节失常在EMs发病中的作用进行了许多研究,认为异位内膜的凋亡失调可能与EMs的发病机制有关[4]。酪氨酸激酶受体B(Tyrosine receptor kinase B,TrkB)是一种通过激活磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)信号通路抑制肿瘤细胞失巢凋亡(anoikis)和诱导转移的蛋白[5],最新研究发现,在神经系统17β雌二醇(17β-E2)与ER结合可通过几种可能机制促进脑源性神经营养因子(BDNF)/TrkB的高表达与活性增强[6-7]。
基于上述研究成果,笔者推测EMs可能的发生机制为异位内膜局部的高雌激素环境通过促进ERβ高表达,提高了异位内膜腺上皮细胞TrkB的活性,后者进一步激活了异位内膜腺上皮细胞的失巢凋亡抑制信号途径,从而赋予其高侵袭、生长能力。因此,本研究采用实时聚合酶链反应(real time PCR)、蛋白质印迹法(Western blotting) 和免疫组织化学(immunohistochemistry,IHC)方法,检测ERα、ERβ、TrkB、BDNF mRNA和蛋白质在EMs在位内膜和异位内膜组织中的表达,以探讨ERs和TrkB在EMs发病中的可能作用机制。
1 对象与方法
1.1研究对象选择2012年1月—2014年1月在大连医科大学附属妇产医院住院的卵巢EMs患者18例(EMs组),患者月经规律,无其他内分泌、免疫和代谢性疾病,手术前3个月未接受激素治疗,其中9例同时合并子宫腺肌病。18例患者均经腹腔镜或开腹手术并经病理学检查确诊,按照1997年美国生育学会(American Fertility Society,AFS)修订的EMs分期法进行分期。术前通过诊断性刮宫取在位子宫内膜组织(9例为增殖期内膜、9例为分泌期内膜);术中取卵巢异位内膜组织。
1.2方法
1.2.1主要试剂TRIzol RNA提取试剂盒为美国GIBCO公司产品。SYBR Premix Ex Taq(DRR041A),DNA Marker(DL2000)为大连宝生物工程有限公司产品;引物由上海生工生物工程技术服务有限公司合成;蛋白裂解液、BCA蛋白质定量试剂盒为美国Bio-Rad公司产品。兔抗人TrkB多克隆抗体、兔抗人BDNF多克隆抗体、兔抗人ERα多克隆抗体为美国Santa Cruz公司产品;兔抗人ERβ多克隆抗体为英国Abcom公司产品。化学发光底物为美国Pierce公司产品。
1.2.2Real time PCR检测按TRIzol抽提试剂盒说明提取组织标本及细胞总RNA,紫外分光光度计检测RNA纯度,放置-70℃冰箱保存。设计相应的上、下游引物序列(5′→3′)为:ERα(上游:TCTGCCAAGGAGACTCGCTA,下游:CTTTTCGTA TCCCACCTTTCAT,241 bp)、ERβ(上游:GATGAGGGGAAA TGCGTAGAAG,下游:GGCAATCACCCAAACCAAAG,234 bp)、TrkB(上游:TTACCCGAAACAAACTGACGA,下游:GTCTGGA CTGGATTTAGCCTCTT,146 bp)、BDNF(上游:TGGAGGCTA TGTGGAGTTGG,下游:GGGCATAAGTCGCTTGAGT,257 bp),内参GAPDH(上游:GGGA AACTGTGGCGTGAT,下游:GAGTGGGTGTCGCTGTTGA,299bp)。逆转录反应条件为50℃30 min,逆转录反应酶失活94℃3 min。PCR反应条件为95℃,5 min;40个PCR循环[95℃,10 s;59℃,15 s;72℃,20 s;84℃(收集荧光),5 s]。为建立PCR产物的溶解曲线,扩增反应结束后继续从72℃缓慢加热到99℃(每5 s升高1℃)管家基因GAPDH(不同样品间表达量基本恒定)作为内参,以样品待测基因得值除以此样品内参得值,最终得到的比值为样品的待测基因相对含量。
1.2.3免疫组织化学法石蜡切片5 μm,常规脱蜡和水化后,3%过氧化氢灭活内源性酶15 min,山羊血清封闭1 h,一抗(1∶80)4℃孵育过夜,生物素标记二抗孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)试剂盒显色后再行苏木素复染、脱水并封片。磷酸盐缓冲液(PBS)代替一抗作为阴性对照。结果判定:以免疫染色深浅判定目标蛋白的表达强度,TrkB为胞质与胞膜均着色,BDNF及ERβ为胞质着色,ERα为胞核着色。
1.2.4Western blotting检测目标蛋白的表达用Laemmli裂解液进行裂解,BCA蛋白质定量试剂盒测定蛋白浓度,十二烷基硫酸钠-聚丙烯酞胺凝胶电泳(SDS-PAGE),采用6%分离胶,聚偏二氟乙烯(PVDF)膜电转移。封闭后,一抗4℃过夜,辣根过氧化物酶标记的二抗室温孵育1 h,化学发光底物曝光显色。Total Lab软件进行半定量分析,用(目标蛋白的灰度值/内参蛋白的灰度值)×100%表示目标蛋白的相对表达水平。
1.3统计学方法采用SPSS 11.0软件进行统计学处理,定量资料符合正态分布的数据用均数±标准差(x±s)表示,组间比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1EMs患者在位内膜和异位内膜组织中ERα、ERβ、TrkB和BDNF mRNA的表达EMs患者在位内膜ERα mRNA的表达高于异位内膜组织,而ERβ、TrkB和BDNF mRNA的表达则低于异位内膜组织,差异均有统计学意义(均P<0.05),见表1。
表1 EMs患者在位内膜和异位内膜组织中ERα、ERβ、TrkB和BDNF mRNA的表达(±s)

表1 EMs患者在位内膜和异位内膜组织中ERα、ERβ、TrkB和BDNF mRNA的表达(±s)
组别 n ERα ERβ TrkB BDNF在位内膜组 18 1190.056±107.741 0.071±0.003 6.989±0.049 0.090±0.005异位内膜组 18 249.222±12.927 14.939±0.424 189.056±21.145 20.911±0.357 t 038.922 -3.724 -3.732 -248.426 P 000.013 00.002 00.024 0000.001
2.2EMs患者在位内膜和异位内膜组织中ERα、ERβ、TrkB蛋白的表达EMs患者在位内膜ERα蛋白表达高于异位内膜组织,而ERβ、TrkB蛋白的表达低于异位内膜组织,差异有统计学意义(均P<0.05),见表2,图1A、2A。在EMs在位内膜中,ERα、ERβ、TrkB蛋白的表达在增殖期均高于分泌期,差异有统计学意义(均P<0.05),见表3,图1B、2B。
表2 EMs患者在位内膜和异位内膜组织中ERα、ERβ、TrkB蛋白的表达(±s)

表2 EMs患者在位内膜和异位内膜组织中ERα、ERβ、TrkB蛋白的表达(±s)
组别 n ERα ERβ TrkB在位内膜组 18 3.054±0.435 5.278±0.190 3.367±0.236异位内膜组 18 1.476±0.096 8.339±0.715 6.216±0.454 t 13.648 -16.497 -21.739 P 00.001 000.002 000.002
表3 在位内膜组织中增殖期、分泌期ERα、ERβ、TrkB蛋白的表达(±s)

表3 在位内膜组织中增殖期、分泌期ERα、ERβ、TrkB蛋白的表达(±s)
组别 n ERα ERβ TrkB增殖期内膜 9 0.518±0.046 0.173±0.051 0.236±0.093分泌期内膜 9 0.232±0.056 0.079±0.020 0.089±0.029 t 15.569 5.690 5.808 P 0.002 0.001 0.001
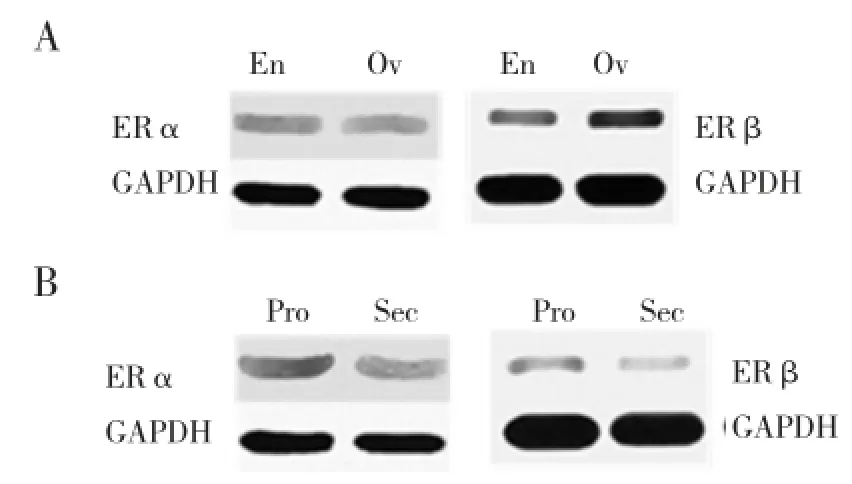
图1 Western blotting检测EMs患者ERα、ERβ蛋白的表达
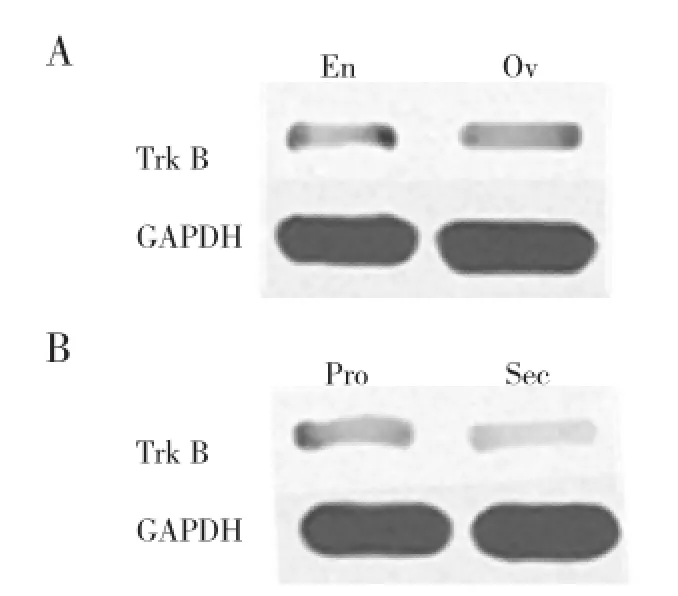
图2 Western blotting检测EMs患者TrkB蛋白的表达
2.3免疫组织化学结果ERα主要表达于在位内膜细胞核内;ERβ主要表达于异位内膜细胞质中;ERα与ERβ在EMs在位内膜的增殖期着色比分泌期更加明显。见图3。EMs的在位内膜和异位内膜组织中TrkB与BDNF都有表达,且主要集中于细胞质。EMs在位内膜中TrkB蛋白质在增殖期表达更明显。见图4。

图3 ERα、ERβ在EMs在位内膜和异位内膜的表达(免疫组织化学染色×400)
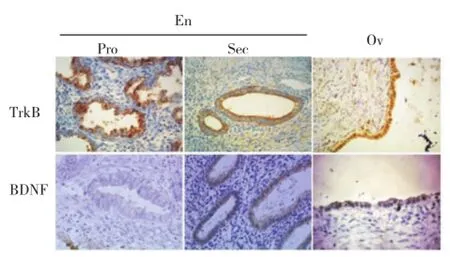
图4 TrkB、BDNF在EMs在位内膜和异位内膜的表达(免疫组织化学染色×400)
3 讨论
目前公认的EMs发病的种植学说认为异位内膜来源于子宫内膜组织,这些组织转移到宫腔以外的部位,并种植和生长。传播途径有经血逆流、淋巴传播、血管播散和医源性种植等。已有研究表明,EMs与非EMs患者的在位内膜存在基因表达等方面的差异[8]。本研究结果显示,EMs的在位内膜ERα mRNA表达高于异位内膜,ERβ、TrkB和BDNF mRNA的表达低于异位内膜,ERα主要表达于在位内膜组织中,而ERβ、BDNF和TrkB主要表达于异位内膜组织中,并且在位内膜组织中ERβ、ERα和TrkB蛋白主要表达于增殖期。这些发现与国外学者的研究结果基本一致[1,9-11],说明在逆流到腹腔之前,在位内膜已具备有别于正常内膜的生物学特性,这种差异可能是EMs发病的基础。
TrkB是原癌基因Trk编码神经营养酪氨酸激酶受体的家族成员之一,属于受体型酪氨酸激酶,与其配体BDNF相互作用,在细胞凋亡过程中起着重要的信号调控作用。已有很多研究发现,TrkB在神经母细胞瘤、胰腺癌、乳腺癌、肺癌、前列腺癌、骨髓瘤以及卵巢癌甚至EMs相关卵巢癌等人类高侵袭性恶性肿瘤中都有过度表达[12-17],既往研究也显示,TrkB的过度表达和激活能诱导卵巢癌细胞发生失巢凋亡抑制[18]。本研究结果发现,在位内膜中TrkB和BDNF的表达增殖期高于分泌期,说明TrkB/BDNF信号途径与EMs的发病有直接关系,应当参与了异位内膜细胞的失巢凋亡抑制以及细胞迁移的调控。
EMs也是一种雌激素依赖性疾病。雌激素可通过传统的核效应,即作用于细胞核目的基因的雌激素反应元件调控基因表达;也可通过非核效应,即细胞膜上的ER经钙离子、一氧化氮(NO)、酪氨酸蛋白激酶(protein tyrosine kinase,PTK)激活丝裂源活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、细胞外信号调节激酶1(extracellular signal-regulated kinase-1,ERK-1)等信号蛋白而快速发挥生物学效能[19-20]。本研究结果显示ERβ主要表达于细胞质,不同于ERα的细胞核表达;同时,TrkB/BDNF也表达于细胞质而非细胞核,ERβ与TrkB表达在空间上具备高度一致性,说明E2/ERβ通路可能通过雌激素的非核效应直接上调了TrkB的表达及激活,最终通过PI3K等信号通路调控EMs异位内膜腺上皮细胞抗凋亡能力增强,从而赋予EMs这种良性疾病表现出恶性肿瘤的能力,相关机制有待于深入研究。
[1]谢辛,苟文丽.妇产科学[J].8版.北京:人民卫生出版社,2013:268.
[2]Shao R,Cao S,Wang X,et al.The elusive and controversial roles of estrogen and progesterone receptors in human endometriosis[J].Am J Transl Res,2014,6(2):104-113.
[3]Bulun SE,Monsavais D,Pavone ME,et al.Role of estrogen receptorβ in endometriosis[J].Semin Reprod Med,2012,30(1):39-45.
[4]Reis FM,Petraglia F,Taylor RN.Endometriosis:hormone regulation and clinical consequences of chemotaxis and apoptosis[J].Hum Reprod Update,2013,19(4):406-418.
[5]于晓辉,刘玲,万小平.酪氨酸激酶受体B介导的信号传导通路与肿瘤的失巢凋亡抑制[J].中华妇产科杂志,2007,42(4):280-282.
[6]Harte-Hargrove LC,Maclusky NJ,Scharfman HE.Brain-derived neurotrophic factor-estrogen interactions in the hippocampal mossy fiber pathway:implications for normal brain function and disease[J].Neuroscience,2013,239:46-66.
[7]Spencer-Segal JL,Tsuda MC,Mattei L,et al.Estradiol acts via estrogen receptors alpha and beta on pathways important for synaptic plasticity in the mouse hippocampal formation[J].Neuroscience,2012,202:131-146.
[8]Grechukhina O,Petracco R,Popkhadze S,et al.A polymorphism in a let-7 microRNA binding site of KRAS in women with endometriosis[J].EMBO Mol Med,2012,4(3):206-217.
[9]Anger DL,Zhang B,Boutross-Tadross O,et al.Tyrosine receptor kinase B(TrkB)protein expression in the human endometrium[J].Endocrine,2007,31(2):167-173.
[10]Matsuzaki S,Canis M,Pouly JL,et al.Both GnRH agonist and continuous oral progestin treatments reduce the expression of the tyrosine kinase receptor B and mu-opioid receptor in deep infiltrating endometriosis[J].Hum Reprod,2007,22(1):124-128.
[11]Matsuzaki S,Canis M,Pouly JL,et al.Differential expression of genes in eutopic and ectopic endometrium from patients with ovarian endometriosis[J].Fertil Steril,2006,86(3):548-553.
[12]Bao W,Qiu H,Yang T,et al.Upregulation of TrkB promotes epithelial-mesenchymaltransitionandanoikisresistancein endometrial carcinoma[J].PLoS One,2013,8(7):e70616.
[13]Cittelly DM,Dimitrova I,Howe EN,et al.Restoration of miR-200c to ovarian cancer reduces tumor burden and increases sensitivity to paclitaxel[J].Mol Cancer Ther,2012,11(12):2556-2565.
[14]FosterWG,EliasR,FaghihM,etal.Immunohistochemical localization of tyrosine receptor kinases A and B in endometriosisassociated ovarian cancer[J].Histopathology,2009,54(7):907-912.
[15]Fujikawa H,Tanaka K,Toiyama Y,et al.High TrkB expression levels are associated with poor prognosis and EMT induction in colorectal cancer cells[J].J Gastroenterol,2012,47(7):775-784.
[16]Okugawa Y,Tanaka K,Inoue Y,et al.Brain-derived neurotrophic factor/tropomyosin-related kinase B pathway in gastric cancer[J].Br J Cancer,2013,108(1):121-130.
[17]Yu X,Liu L,Cai B,et al.Suppression of anoikis by the neurotrophic receptor TrkB in human ovarian cancer[J].Cancer Sci,2008,99(3):543-552.
[18]Huang Y,Zheng W,Mu L,et al.Expression of tyrosine kinase receptor B in eutopic endometrium of women with adenomyosis[J].Arch Gynecol Obstet,2011,283(4):775-780.
[19]RevankarCM,CiminoDF,SklarLA,etal.Atransmembrane intracellular estrogen receptor mediates rapid cell signaling[J].Science,2005,307(5715):1625-1630.
[20]Welch KM,Brandes JL,Berman NE.Mismatch in how oestrogen modulates molecular and neuronal function may explain menstrual migraine[J].Neurol Sci,2006,27(Suppl 2):190-192.
Expression of ER and TrkB in Endometriosis
YONG Min-jie,LI Wen-qian,WANG Fang,JIN Wei,LIU Bo,YU Xiao-hui.
Department of Gynecology,Dalian Obstetrics and Gynecology Hospital Affiliated to Dalian Medical University,Dalian 116033,Liaoning Province,China(YONG Min-jie,LI Wen-qian,WANG Fang,YU Xiao-hui);Department of Pharmacy,Dalian Friendship Hospital Affiliated to Dalian Medical University,Dalian 116001,Liaoning Province,China(JIN Wei);Department of Biomedical Engineering,Dalian University of Technology,Dalian 116024,Liaoning Province,China(LIU Bo)
YU Xiao-hui,E-mail:yuxiaohui369@163.com
Objective:To detect the expression of estrogen receptor(ER)and TrkB in eutopic endometrium and ectopic endometrium in patients with endometriosis,and explore the potential effect of ER and TrkB in the pathogenesis of EMs.Methods:The expressions of ERα,ERβ,TrkB and BDNF in 18 cases with EMs(include 9 proliferating phase cases and 9 secretory phase of eutopic endometrium)were examined using real-time PCR,Western blotting and immunohistochemistry.Results:At mRNA and protein levels,the expression of ERα in eutopic endometrium was higher than ectopic endometrium with endometriosis,while the expression of ERβ and TrkB in eutopic endometrium were lower than ectopic endometrium with endometriosis,all of that difference have statistically significant(P<0.05).Higher ratio of ERβ/ERα mRNA was found in ectopic endometriosis than eutopic endometrium.In eutopic endometrium,ERα,ERβ and TrkB proteins were mainly expressed in proliferative phase than that in secretory phase(P<0.05).ERα expression was mainly found in cell nucleus of eutopic endometrium,while ERβ was mainly found in cytoplasm of ectopic endometrium.The expression of ERα and ERβ were more obvious in EMs eutopic endometrium proliferative phase than that in secretory phase.TrkB and BDNF were expressed in both eutopic and ectopic endometrium with EMs,and were mainly expressed in cytoplasm.TrkB was more obvious in proliferative phase eutopic endometrium of EMs.Conclusions:ERβ and TrkB may mediate the pathogenesy of EMs.
Receptors,estrogen;Receptor,trkB;Endometriosis;Endometrium
2015-01-31)
[本文编辑王琳]
大连市科委立项课题(2009E12SF144)
116033大连市妇幼保健院暨大连医科大学附属妇产医院妇科(雍敏婕,李文倩,王芳,于晓辉);大连市友谊医院药剂科(金伟);大连理工大学生物医学工程系(刘波)
于晓辉,E-mail:yuxiaohui369@163.com
