利用啤酒废酵母扩培物制备富含谷胱甘肽酵母抽提物
2015-09-29陈志颖张子健焦瑞杰江建梅徐婷婷唐山拓普生物科技有限公司河北唐山063000
陈志颖,张子健*,焦瑞杰,江建梅,舒 媛,徐婷婷,吴 振(唐山拓普生物科技有限公司,河北唐山063000)
利用啤酒废酵母扩培物制备富含谷胱甘肽酵母抽提物
陈志颖,张子健*,焦瑞杰,江建梅,舒媛,徐婷婷,吴振
(唐山拓普生物科技有限公司,河北唐山063000)
该研究利用啤酒废酵母制备富含谷胱甘肽的酵母抽提物,旨在开发酵母利用的新途径。以啤酒废酵母为原料,经单因素试验和响应面分析法,得到了谷胱甘肽提取的最佳工艺条件:料液比1∶4(g∶mL)、提取温度85℃、提取时间20 min、pH 1.86,在此条件下谷胱甘肽的提取率可达到35.06%;最后确定了谷胱甘肽提取液的最佳浓缩温度为50℃,最佳浓缩时间为40 min,制备得到的酵母抽提物中谷胱甘肽含量为4.11%,固形物含量达到61.87%。
谷胱甘肽;酵母抽提物;啤酒废酵母
谷胱甘肽,即γ-L-谷氨酰-L-半胱氨酰甘氨酸(glutathione,GSH),是由L-谷氨酸、L-半胱氨酸和甘氨酸经肽键缩合而成的一种同时具有γ-谷氨酰基和巯基的生物活性三肽化合物[1-3],由于其在生物体内具有清除自由基、解毒、促进铁质吸收及维持红细胞膜的完整性、维持脱氧核糖核酸(deoxyribonucleic acid,DNA)的生物合成、细胞的正常生长及细胞免疫等多种生理功能[4-6],因此被广泛应用于食品、医药、保健品、化妆品工业中[7-8]。谷胱甘肽的提取方式主要有热水抽提法、乙醇萃取法、酶法、超声波法、微波处理法、高压脉冲法等[9-10]。其中热水抽提法分离时间相对较短,减少了生产过程中GSH的氧化损失,溶剂为水,不需要其它溶剂,可以节省费用,用于工业化生产设备投资要小。鉴于后期工业化生产的可行性,本实验中采用热水抽提法对谷胱甘肽进行提取。
啤酒废酵母是啤酒酿造中的副产物,细胞中含有大量的GSH,目前的研究均以提纯酵母细胞中的GSH为主,而制备富含GSH酵母抽提物的研究甚少报道[11-15]。本研究首先对啤酒废酵母进行扩培以富集GSH,然后以啤酒废酵母扩培物为原料,以GSH提取率为评价指标,采用单因素试验结合响应面分析法对GSH的提取工艺进行优化,并确定了最佳的过滤方式——陶瓷膜法,改善了传统离心分离方式的诸多缺点,提高了GSH提取率,最后将最优工艺条件下所得的GSH提取液浓缩获得富GSH的酵母抽提物,为富GSH酵母抽提物的工业化生产提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1材料
啤酒废酵母泥:由唐山拓普生物科技有限公司提供。
盐酸(36%~38%):天津市凯信化学工业有限公司;磷酸二氢钠(分析纯):天津市致远化学试剂有限公司;辛烷磺酸钠(纯度≥99.0%)、还原型谷胱甘肽标准品(纯度≥98.0%):美国Sigma公司;乙腈(纯度99.9%):德国默克股份有限公司;磷酸(分析纯):天津市北方天医化学试剂厂。
1.1.2培养基
扩培培养基:蔗糖2%,酵母膏1%,硫酸铵1%,硫酸镁0.5%,磷酸氢二钾0.1%,磷酸二氢钾0.1%,丙酸钙0.1%,乳酸链球菌肽(Nisin)0.03%,pH 4.5,6 h后添加10 mmol/L L-半胱氨酸。
1.2仪器与设备
BXM-30R立式压力蒸汽灭菌器、SW-CJ-2D双人单面净化工作台:上海博讯实业有限公司;CF16RN高速冷冻离心机:天美(中国)科学仪器有限公司;ZWY-1102C恒温振荡培养箱:上海智诚科技投资有限公司;DZKW-4数显恒温水浴锅:北京中兴伟业仪器有限公司;SFG-02.500数显鼓风干燥箱:黄石市恒丰医疗器械有限公司;80目标准筛(φ200 mm×50 mm):浙江道墟化工厂;UV-9600紫外可见分光光度计:北京北分瑞利分析仪器(集团)有限责任公司;AL204电子天平:梅特勒-托利多仪器(上海)有限公司;VDRTEX-5旋涡混合器:其林贝尔仪器制造有限公司;UltiMate 3000高效液相色谱(high performance liquid chromatography,HLPC):河北鼎恒商贸有限公司。
1.3试验方法
1.3.1啤酒废酵母扩增培养
将啤酒废酵母泥在3000r/min下高速冷冻离心10min,得到废酵母菌体,以8%接种量接种于装液量为60 mL/250 mL扩培培养基中,于26℃下,180 r/min振荡培养26 h,得到酵母扩培液。将其过80目标准筛,在3 000 r/min下高速冷冻离心10 min,得沉淀,用纯水清洗2遍,得到洁净酵母菌体。
1.3.2谷胱甘肽提取工艺优化
GSH抽提液制备:采用热水抽提法对谷胱甘肽进行提取。称取一定量的洁净酵母菌体,加入2~6倍纯水,调节pH值为1~5,于75~95℃的热水中提取10~30 min,至于冰水浴中迅速冷却,分离得清液即为GSH抽提液。
单因素试验:探讨料液比(1∶1、1∶2、1∶3、1∶4、1∶5(g∶mL))、提取时间(10 min、15 min、20 min、25 min、30 min)、提取温度(75℃、80℃、85℃、90℃、95℃)和pH值(自然、1.0、2.0、3.0、4.0)等因素对GSH提取率的影响。
响应面分析法:综合单因素试验结果,根据Box-Benhnken中心组合试验设计原则,选取影响较大的3个因素提取温度、提取时间和pH值,以谷胱甘肽提取率为评价指标,采用3因素3水平的响应面分析方法对啤酒废酵母中谷胱甘肽的提取进行优化,各因素及水平编码如表1所示。
1.3.3富含GSH酵母抽提物的制备
将最优提取工艺条件下获得的GSH抽提液在40~60℃下进行浓缩,最终得到固形物含量>60%的酵母抽提物,采用高效液相色谱法检测其谷胱甘肽的含量。该研究考察了浓缩温度和浓缩时间对GSH的损失率的影响。
1.3.4高效液相色谱法测定GSH含量[16-17]
色谱条件:Symmetry C18色谱柱(5 μm,319 mm× 150 mm);流动相:磷酸二氢钠和辛烷磺酸钠混合溶液(磷酸二氢钠310 g,辛烷磺酸钠110 g,加水溶解并定容至500 mL,用磷酸调节pH为3.0)∶乙腈=96∶4(V∶V);检测波长:210 nm;流速:110 mL/min;柱温:30℃;进样量:10 μL。
样品处理和检测:将样品进行适当稀释或浓缩,过0.45 μm滤膜作为样品分析液。分别取已制备好的样品分析液和标准对照溶液10 μL,在相同色谱条件下,以保留时间定性,峰面积定量。根据样品峰的峰面积,在标准曲线上查含量,得样品中谷胱甘肽的含量。谷胱甘肽提取率及损失率计算公式如下:

1.3.5数据统计分析
每次试验重复3次,单因素试验数据采用Excel 2003处理,响应面试验数据采用Design Expert 8.0软件进行回归和方差分析。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1单因素试验
2.1.1料液比对GSH提取率影响

图1 料液比对GSH提取率的影响Fig.1 Effect of solid-liquid ratio on the extraction rate of GSH
由图1可知,在提取温度90℃,提取时间15 min,pH 3.0条件下,随料液比的增加,GSH提取率不断提高,料液比为1∶4(g∶mL)时,GSH提取率为24.87%,之后增幅不明显,料液比对GSH提取率影响较大,因此选取料液比1∶4(g∶mL)进行后续试验。
2.1.2提取温度对GSH提取率影响
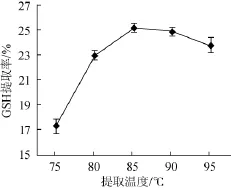
图2 提取温度对GSH提取率的影响Fig.2 Effect of extraction temperature on the extraction rate of GSH
由图2可知,在料液比1∶4(g∶mL),提取时间15 min,pH 3.0条件下,随提取温度的提高,GSH提取率不断提高,提取温度为85℃时,GSH提取率达到25.25%,之后逐渐下降,因此,GSH提取最优温度为85℃。
2.1.3提取时间对GSH提取率影响
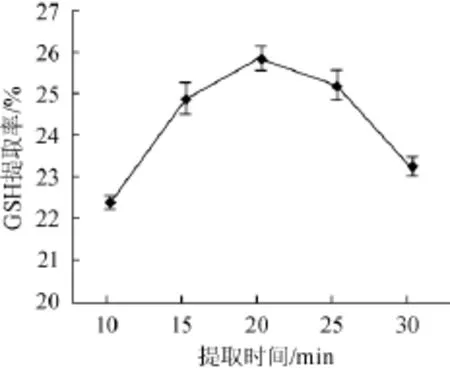
图3 提取时间对GSH提取率的影响Fig.3 Effect of extraction time on the extraction rate of GSH
由图3可知,在料液比1∶4(g∶mL),提取温度85℃,pH 3.0条件下,随提取时间的延长,GSH提取率不断提高,20min时,GSH提取率为25.86%,之后逐渐下降,因此,GSH提取最优时间为20 min。
2.1.4 pH值对GSH提取率影响
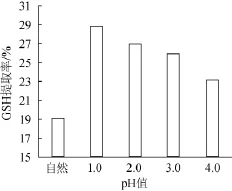
图4 pH值对GSH提取率的影响Fig.4 Effect of pH value on the extraction rate of GSH
由图4可知,在料液比1∶4(g∶mL),提取温度85℃,提取时间20 min条件下,pH值自然时(一般pH为5~6),GSH提取率最低,pH为1.0时,GSH提取率最高为28.78%,随pH值的增大,GSH提取率越来越低,这与文献[9]中所述GSH在酸性环境下较为稳定相符合。因此,GSH提取最优pH值为1.0。
2.2响应面分析
利用Design Expert 8.0软件,采用中心组合试验Box-Behnken设计方案,以GSH提取率(Y)为响应值进行3因素3水平的响应面试验,因素水平编码表见表1。试验共设17个试验点,包括12个析因点和5个中心点,结果如表2所示。
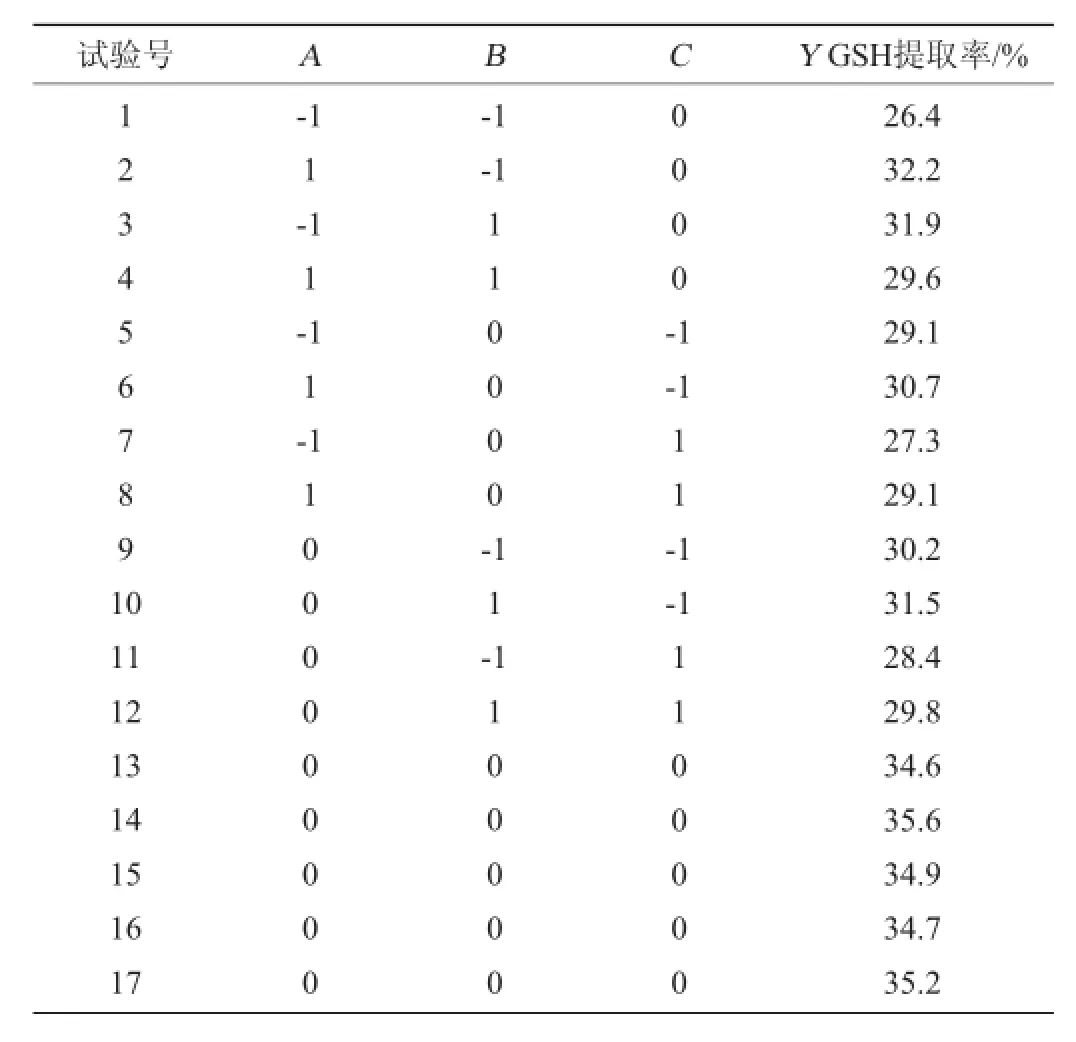
表2 Box-Behnken中心组合试验设计及结果Table 2 Design and results of Box-Behnken central composite experiment
利用Design Expert 8.0软件对表2试验数据进行回归分析,经回归拟合后,各因素与响应值的回归方程为:
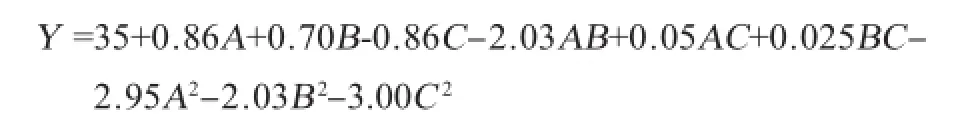
为了检验回归方程的有效性,对该模型进行回归方差分析显著性检验,结果见表3。
由表3可知,模型的F值为156.62、P<0.000 1,说明模型极显著,失拟项F值为0.015、P值为0.997 0,差异不显著,说明未知因素对试验结果影响小。该模型的复相关系数R2=0.995 1,修正相关系数R2adj=0.988 7,这说明该试验模型的拟合程度良好,能够很好地描述试验的结果,自变量和响应值之间呈现显著的线性关系,试验误差较小,模型方程可以很好地反映真实的工艺结果。由方差分析表3可知,各因素对响应值影响的主次顺序为C(pH值)>A(提取温度)>B(提取时间)。
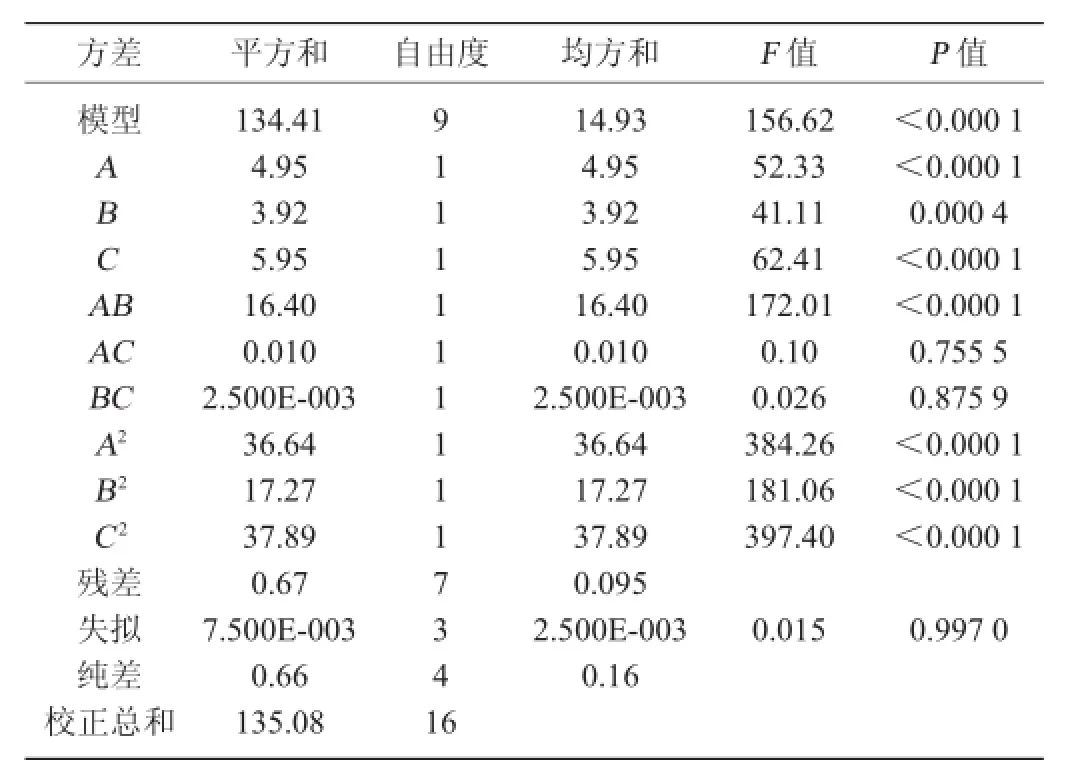
表3 回归方程方差分析Table 3 Variance analysis of regression equation
根据回归模型预测出GSH提取率的最高值。即当提取温度85.52℃,提取时间20.60min,pH 1.86时,预测出GSH提取率的最大值为35.15%。为了验证响应面模型的有效性,实际操作过程选择提取温度85℃,提取时间20 min,pH 1.86,经3次验证试验,在此最优提取工艺条件下,GSH平均提取率为35.06%,实际值比预测值误差为±0.26%,可见模型很好的预测了试验结果。
根据方差分析和回归方程,得到三维响应曲面图及等高线见图5,考察所拟合的响应曲面的形状,分析提取温度、提取时间和pH对GSH提取率的影响。由图5可直观反映各因素间交互作用对响应值的影响,其中等高线的形状可反映出交互作用的强弱,椭圆形表示两因素之间交互作用显著,圆形则与之相反。

图5 提取温度、提取时间和pH值交互作用对GSH提取率的影响的响应面及等高线Fig.5 Response surface plots and countour line of effect of interaction between extraction temperature,extraction time and pH on the extraction rate of GSH
2.3富GSH酵母抽提物的制备
2.3.1浓缩条件的优化
对GSH提取液进行真空浓缩可得到富GSH酵母抽提物,但由于在浓缩环节GSH会有一定的损失,对浓缩温度进行了考察。每次浓缩抽提液的体积为200 mL,以国标GB/T 23530—2009《酵母抽提物》中方法检测固形物含量(国标要求≥60%),结果见表4。由表4可知,在浓缩温度50℃时浓缩40 min,GSH损失率最低(6.78%)。因此,最佳的浓缩温度为50℃,时间为40 min,最终固形物含量为61.87%[18]。
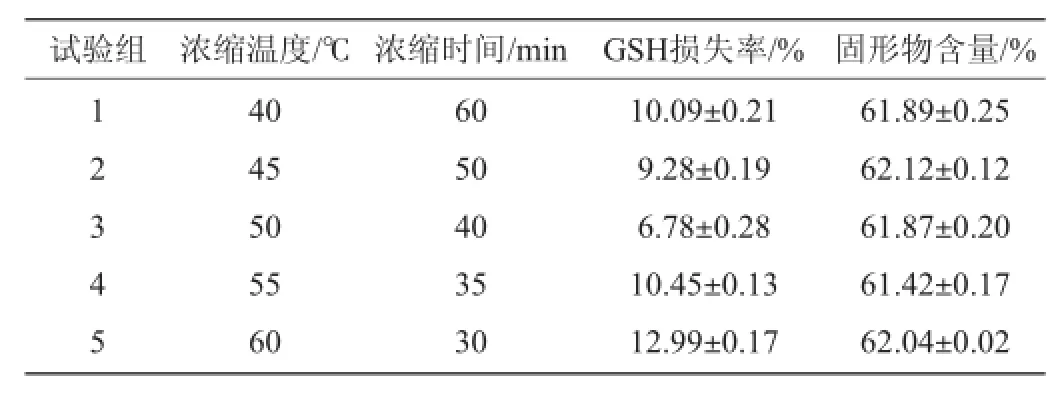
表4 浓缩条件对GSH损失率的影响Table 4 Effect of concentrating conditions on the loss rate of GSH
2.3.2酵母抽提物中谷胱甘肽含量的检测
高效液相色谱检测酵母抽提物中谷胱甘肽含量结果见图6。结果表明,最终酵母抽提物产品中GSH含量为4.11%。
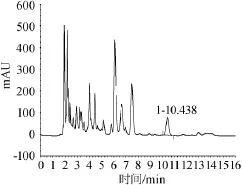
图6 酵母抽提物中谷胱甘肽含量检测HPLC色谱图Fig.6 HPLC chromatogram of the contents of GSH in yeast extract
3 结论
本研究首先对啤酒废酵母进行扩培,使其酵母细胞内富集GSH,然后通过单因素试验和Box-Behnken中心组合设计原理以及响应面分析法对啤酒废酵母中提取GSH的工艺进行了优化,拟合了提取温度、提取时间和pH值3个因素对GSH提取率的回归模型,经检验证明该模型合理可靠,能较好的预测GSH提取率,由该模型确定的最佳工艺条件为提取温度85℃、提取时间20 min和pH 1.86,经3次验证试验,GSH平均提取率可达到35%以上。最后考察了浓缩温度和浓缩时间对成品中GSH的影响,得到50℃浓缩40minGSH损失率最低,经高效液相色谱检测,成品中GSH含量平均为4.11%,固形物含量达到61.87%。本研究利用啤酒废酵母制备获得富含GSH的酵母抽提物,可广泛应用于食品、保健品和宠物饲料中,不仅提高了酵母类产品的附加值,还达到了节约资源、减少污染的目的,对酵母深加工行业的发展有着深远意义。
[1]PENNINCKX M J.An overview on glutathione inSaccharomyces versus non XMLLINK_XYZ conventional yeasts[J].FEMS Yeast Res,2002,2(3):295-305.
[2]ZHANG J Y,HU Z D,CHEN X G.Quantification of glutathione and glutathione disulfide in human plasma and tobacco leaves by capillary electrophoresis with laser-induced fluorescence detection[J].Talanta,2005,65:986-990.
[3]曹秀虹,庞惠,赵民生.谷胱甘肽的临床应用进展[J].中国综合临床,2002,18(9):782-783.
[4]PASTORE A,FEDERICI G,BERTINI E,et al.Analysis of glutathione:implication in redox and detoxification[J].Clinica Chimica Acta,2003,333(1):19-39.
[5]张玉臣,杜永丽,聂翠芳,等.还原型谷胱甘肽的临床应用进展[J].社区医学杂志,2005,3(4):26-27.
[6]汤亚杰,徐小玲.发酵法生产谷胱甘肽的研究进展[J].食品与发酵工业,2007,229(1):75-79.
[7]JAHOOR F,JACKSON A,GAZZARD B,et al.Erythrocyte glutathione deficiency in symptom-free HIV infection is associated with decreased synthesis rate[J].Am J Physio,1999,276(1):E205-E211.
[8]邱雁临,胡静,陈靓,等.从酵母中分离纯化谷胱甘肽(GSH)的新方法[J].食品工业科技,2007,28(3):134-136.
[9]苏晓晋.功能性食品添加剂——谷胱甘肽分离纯化工艺的研究[D].无锡:江南大学硕士论文,2006.
[10]邵伟,乐超银,唐明,等.啤酒废酵母中谷胱甘肽提取工艺条件优化研究[J].食品科学,2008,29(5):173-176.
[11]杜静玲.功能性微胶囊的制备及谷胱甘肽分离纯化工艺的研究[D].北京:北京化工大学硕士论文,2007.
[12]梅乐和.啤酒废酵母中谷胱甘肽和核糖核酸的高效提取:中国,104371000 A[P].2013-08-14.
[13]张琴.利用啤酒废酵母生物合成谷胱甘肽及其分离过程的研究[D].杭州:浙江大学硕士论文,2001.
[14]范崇东,王淼,徐榕榕.热水提取酵母中谷胱甘肽的条件优化[J].食品工业科技,2004,25(2):132-134,145.
[15]马德功,崔文文.啤酒废酵母中还原型谷胱甘肽提取[J].中国食品添加剂,2008(4):139-142.
[16]陆文蔚,闫军,唐立伟.保健品中谷胱甘肽的快速测定[J].食品与发酵工业,2012,38(2):186-189.
[17]王爱月,解魁,李发生.高效液相色谱法测定保健食品中谷胱甘肽含量的方法研究[J].中国卫生检验杂志,2007,17(7):1181-1182.
[18]湖北安琪酵母股份有限公司,广东一品鲜生物科技有限公司,中国食品发酵工业研究院.GB/T 23530—2009酵母抽提物[S].北京:中国标准出版社,2009.
Preparation of yeast extracts rich in glutathione using the propagated culture of waste beer yeast
CHEN Zhiying,ZHANG Zijian*,JIAO Ruijie,JIANG Jianmei,SHU Yuan,XU Tingting,WU Zhen
(Tangshan TOP Bio-Technology Co.,Ltd.,Tangshan 063000,China)
In order to develop a new way of yeast usage,yeast extract rich in glutathione(GSH)was made by waste beer yeast.Using waste beer yeast as raw material,the optimum conditions of GSH extraction were determined by single factor experiments and response surface analysis method.The results showed that the optimum conditions were solid-liquid ratio 1∶4(g∶mL),extraction temperature 85℃,extraction time 20 min,pH 1.86.Under this condition,the extraction rate of GSH could reach 35.06%.Finally,the optimum concentration temperature of GSH extraction solution was 50℃,and the optimum concentration time was 40 min.GSH content in yeast extract was 4.11%,and the solid content was 61.87%.
glutathione;yeast extract;waste beer yeast
R284.2
A
0254-5071(2015)11-0061-05
10.11882/j.issn.0254-5071.2015.11.014
2015-09-14
唐山市科技计划项目(No.13110205A)
陈志颖(1972-),女,高级工程师,博士,研究方向为酵母及酵母衍生品。
张子健(1984-),女,工程师,硕士,研究方向为食品微生物。
