UPLC-MS/MS法测定苦楝皮、川楝子及其制品中川楝素含量
2015-09-25郝刚王亚琼俞蕴莉朱佳慧
郝刚,王亚琼,俞蕴莉,朱佳慧
(1.苏州市食品药品检验所,江苏 苏州 215104;2.苏州大学 附属第二医院,江苏 苏州 215004;3.苏州大学,江苏 苏州 215123)
·基础研究·
UPLC-MS/MS法测定苦楝皮、川楝子及其制品中川楝素含量
郝刚1*,王亚琼1,俞蕴莉2,朱佳慧3
(1.苏州市食品药品检验所,江苏 苏州215104;2.苏州大学 附属第二医院,江苏 苏州215004;3.苏州大学,江苏 苏州215123)
目的:基于UPLC-MS/MS方法建立苦楝皮、川楝子、炒川楝子中川楝素的定性鉴别及含量测定方法。方法:供试样品经甲醇加热回流后,采用超高效液相色谱-串联质谱法(UPLC-MS/MS),以BEH-C18为分析柱,流动相为0.1%甲酸水-乙腈(60∶40),电喷雾电离(ESI-),采用一级、二级扫描及多重反应监测(MRM)模式,对川楝子、炒川楝子、苦楝皮中川楝素进行快速定性定量检测。结果:所建方法能快速定性、定量检测川楝素,定性离子对为m/z573→531和m/z573→425,川楝素在50~1000ng·mL-1线性良好,平均加样回收率为97.6%,方法检出限为60μg·g-1。结论:所建方法快速、灵敏,适用于川楝子、炒川楝子、苦楝皮中川楝素的快速定性鉴别及含量测定。
川楝素;超高效液相色谱-串联质谱法;定性定量分析
川楝素(Isotoosendanin)是从楝属植物的根茎及川楝果实中提取的一种三萜化合物,其结构式如图1所示。传统中医药理论认为川楝素具有杀虫、驱蛔等作用,近年来研究表明,川楝素还具有抑制离子通道、抑制呼吸中枢、抗肿瘤等多种生物活性[1-3]。由于川楝素具有生物毒性,《中华人民共和国药典》(2010年版)对川楝素的含量做了严格规定:川楝子中含川楝素为0.06%~0.20%;炒川楝子中含川楝素为0.04%~0.20%;苦楝皮中含川楝素为0.01%~0.20%[4]。目前文献报道多采用HPLC-UV法、LC-MS法对川楝素进行含量测定,但这些方法分析时间长、灵敏度低、且不能提供定性依据[5-7],本实验基于UPLC-MS/MS法对川楝子、炒川楝子、苦楝皮中川楝素进行快速定性、定量分析。
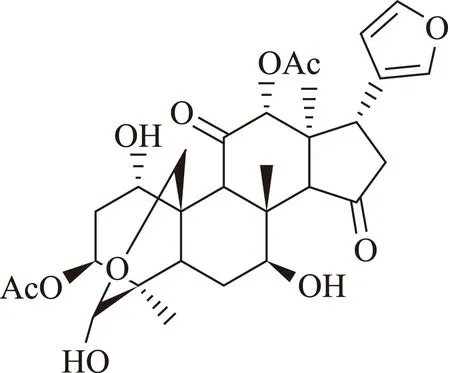
图1 川楝素(Isotoosendanin)化学结构式
1 材料
1.1仪器
ACQUITYUPLCXevoTQ-S三重四级杆液质联用仪(美国Waters公司);电喷雾离子源(ESI),Masslynx4.1数据处理系统(Waters);Thermo低温离心机;KQ-300DA型数控型超声波清洗器;MILLIPORE纯水仪。
1.2样品与试剂
川楝素对照品(中国食品药品检定研究院,批号:111842-201102,纯度:94.5%);实验用水为超纯水,其他试剂均为色谱纯。
川楝子(批号:14081502)、炒川楝子(批号:13050201)、苦楝皮(批号:12121604)购于吴江上海蔡同德堂中药饮片有限公司,并由苏州市食品药品检验所吴银生(主任中药师)鉴定均为楝科植物川楝MeliatoosendanSieb.et Zucc的干燥成熟果实。由苏州市食品药品检验所王亚琼主管中药师按 《中华人民共和国药典》(2010版)鉴别项对上述3种中药予以鉴定[4],结果均符合《中华人民共和国药典》规定。
2 方法与结果
2.1UPLC色谱条件
色谱柱:BEH-C18色谱柱(2.1mm×50mm,1.7μm);流动相:0.1%甲酸水溶液-乙腈(60∶40);柱温:30℃;进样器温度:15℃;流速:0.3mL·min-1;进样量:1μL。
2.2质谱条件
电喷雾离子源(ESI);负离子扫描;毛细管电压3.0kV;脱溶剂气温度:400℃;脱溶剂气体流量:600L·h-1;锥孔气流量:150L·h-1;碰撞气体为氩气;采用一级扫描、二级扫描及多反应检测模式(MRM)监测。
2.3对照品储备液制备
精密称取川楝素对照品10mg,置10mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为对照品储备液(1mg·mL-1)。
2.4样品溶液制备
取样品粉末0.25g,精密称定,置具塞锥形瓶中,精密加入甲醇50mL,称定重量,加热回流1h,冷却,用甲醇补足减失的重量,取1mL样品溶液,用甲醇稀释100倍,再取1mL溶液,12000r·min-1离心5min,取上清液进样分析。
2.5质谱方法
将川楝素对照品储备液用甲醇稀释成100ng·mL-1的对照品溶液,采用ESI-离子化模式,直接进样法优化质谱条件。川楝素分子量为574,本实验采用一级质谱扫描测得川楝素准分子离子峰[M-H]-为m/z573(见图2)。DaughterScan扫描模式测得川楝素的主要二级碎片离子为m/z531和425(见图3),采用这两个特征碎片离子作为川楝素定性依据,并建立多重反应监测(MRM)定量方法,川楝素对照品溶液TIC图如图4所示,由于川楝素存在互变异构体异川楝素,故TIC图出现双峰[8-9],保留时间分别为1.01min和1.16min。
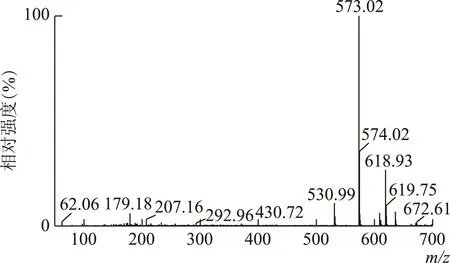
图2 川楝素对照品溶液一级扫描图

图3 川楝素对照品溶液二级扫描图
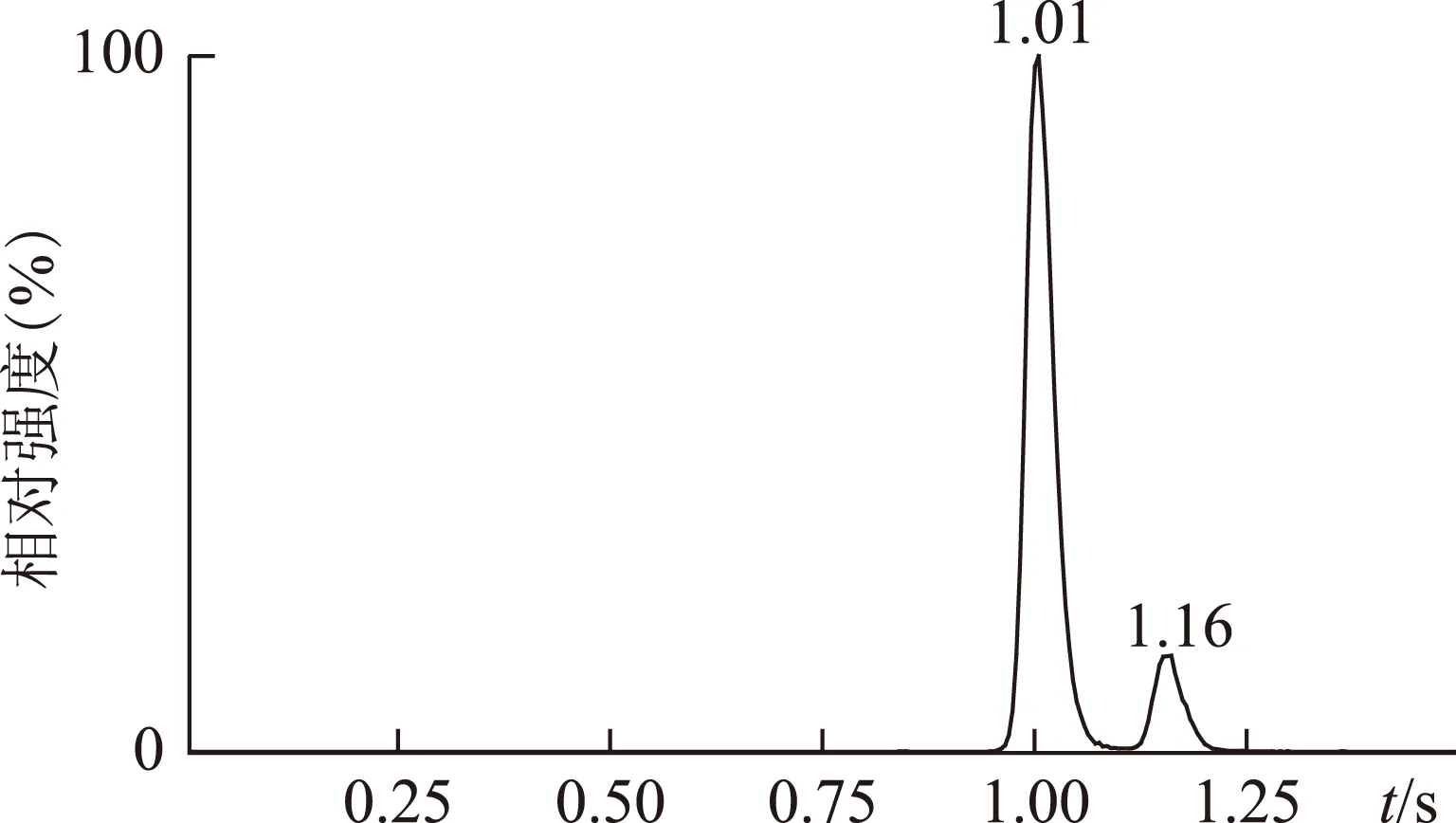
图4 川楝素对照品溶液TIC图
2.6线性范围
对照品储备液用甲醇逐级稀释成质量浓度分别为1000、500、250、100、50ng·mL-1的标准对照品溶液,取1μL进样分析,以TIC图两峰面积总和为纵坐标(Y),各对照品质量浓度为横坐标(X),进行线性回归,得回归方程为:Y=464.6X+142.8,r=0.9995,川楝素质量浓度在50~1000ng·mL-1与峰面积呈良好的线性关系。
2.7检出限与定量限
仪器检出限与定量限:用甲醇稀释成质量浓度为3ng·mL-1和10ng·mL-1的川楝素对照品溶液,进样分析,3ng·mL-1的川楝素对照品溶液TIC图以小峰计,信噪比为7.67,该浓度作为仪器检出限(S/N>3)(见图5A)。10ng·mL-1的川楝素对照品溶液TIC图以小峰计,信噪比为17.84,该浓度作为仪器定量限(S/N>10)(见图5B)。
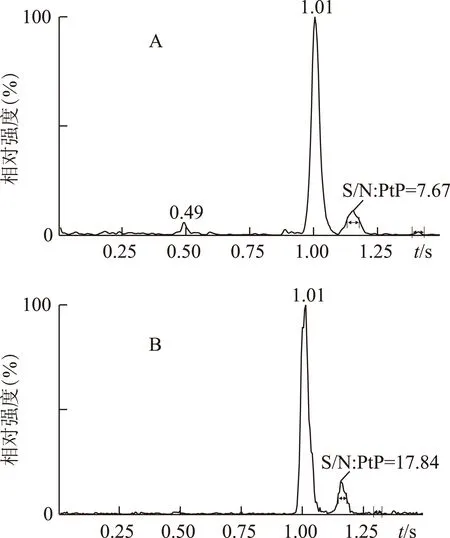
注:A.检出限;B.定量限。图5 川楝素检出限和定量限结果
方法检出限与定量限:根据样品溶液制备方法,样品实际稀释倍数为5000,计算该方法下川楝素检出限为60μg·g-1,方法定量限为200μg·g-1。
2.8精密度试验
取100ng·mL-1的川楝素对照品溶液分别进样6次,记录TIC图峰面积,结果川楝素两峰面积之和RSD=1.5%(n=6),表明精密度良好。
2.9稳定性试验
取0.25g川楝子样品,按2.4项下方法进行样品前处理,按2.1和2.2测定,分别于0、1、2、4、8、12、24h测定峰面积。结果川楝素两峰面积之和的RSD=2.07%,表明样品在24h内稳定。
2.10加样回收率试验
称取已知含量的川楝子供试品0.125g,精密称定,分别精密加入一定量的川楝素对照品溶液,按样品溶液制备方法进行样品前处理,按2.1和2.2条件测定回收率,结果见表1。
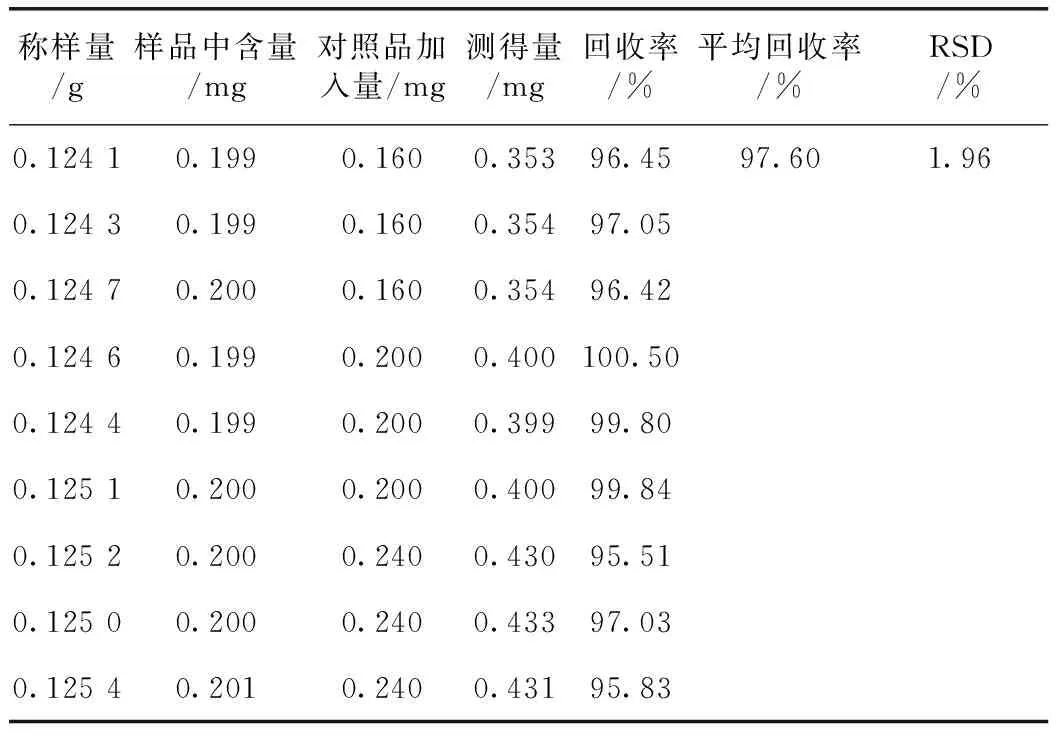
表1 川楝素回收率试验
2.11样品测定
取川楝子、炒川楝子、苦楝皮各5份,按样品溶液制备方法进行样品前处理,按2.1和2.2条件测定,3种中药质谱图均出现m/z573→531和m/z573→425两个特征离子对,证实3种中药均含有川楝素。以川楝素两个峰面积之和定量,代入线性回归方程,计算各药中川楝素含量,结果川楝子供试品中川楝素含量为0.16%;炒川楝子供试品中川楝素含量为0.17%,苦楝皮供试品中川楝素含量为0.17%,均符合《中华人民共和国药典》(2010年版)的含量规定[4]。
3 讨论
液质联用技术以其高效、快速、灵敏的特点已广泛应用于各类检测领域,尤其针对中药来源广泛、成分复杂、分离困难等特点更具有独特优势,并越来越多地应用于中药成分分析与质量控制[10]。《中华人民共和国药典》(2010年版)采用HPLC-MS法对川楝子、苦楝皮等药材中的川楝素进行含量测定,并基于川楝素的生物毒性,对这类中药中川楝素的含量做了严格规定。《中华人民共和国药典》方法采用普通HPLC和单四级杆检测器进行定量,该方法分析时间长,灵敏度低,且无法提供川楝素的化学结构信息,不能用于川楝素的定性鉴别[4]。本实验基于UPLC-MS/MS法,通过一级、二级质谱扫描确立了川楝素的两个特征离子对:m/z573→531和m/z573→425,其中m/z531是川楝素在负离子条件下通过丢失乙酰基团形成的碎片离子[M-CH3CO]-,而m/z425可能是川楝素丢失CH3CO、H2O、CO等多个基团后形成的碎片离子[M-2CH3CO-CO-2H2O]-。将上述两个离子对用于中药中川楝素的定性鉴别,并进一步通过MRM模式,建立了川楝素的定量检测方法,方法学验证表明,所建方法专属性强、稳定性好、灵敏度高、分析时间短,用于川楝子、苦楝皮、炒川楝子中川楝素的定性鉴别及含量测定,方法快速、准确。本研究为川楝子、苦楝皮等中药中川楝素的质量控制提供了实验依据。
[1] 舒国欣,梁晓天.关于川楝素的化学结果的修正[J].化学学报,1980,38(2):196-198.
[2] 王小娟,刘妍如,肖炳坤,等.川楝素抗肿瘤作用机制研究进展[J].科学技术与工程,2011,11(2):281-285.
[3] 程蕾,雷勇,梁媛媛,等.川楝素各提取部分药效及毒性的比较研究[J].中药材,2007,30(10):1276-1279.
[4] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:39-40.
[5] 李杰玉,沈力,周浓,等.HPLC测定不同来源川楝子中川楝素[J].光谱实验室,2013,30(1):294-297.
[6] 周乐华,李迎春,窦志英,等.川楝子及其炮制品中川楝素含量测定研究[J].天津药学,2011,23(1):20-22.
[7] 罗文汇,毕晓黎,孙冬梅.LC-MS法测定川楝子中川楝素[J].中成药,2014,36(7):1556-1558.
[8] 聂映,李志裕,姚卫峰.基于液相色谱飞行时间质谱的炒川楝子化学成分分析[J].安徽医药,2013,17(6):943-945.
[9] 刘亚红,崔红梅,周绚.RP-HPLC法测定川楝子药材中川楝素的含量[J].世界科学技术—中医药现代化,2008,10(3):52-54.
[10] 李晓东,林琳,丁丽霞.液质联用技术在药品质量控制中的应用[J].中国药师,2010,13(5):645-650.
DeterminationofToosendaninwithUPLC-MS/MS
HAOGang1*,WANGYaqiong1,YUYunli2,ZHUJiahui
(1.SuzhouInstituteforFoodandDrugControl,Suzhou215104,China;2.TheSecondAffiliatedHospitalofSoochowUniversity,Suzhou215004,China;3.SoochowUniversity,Suzhou215123,China)
Objective:To develop a specific,sensitive and rapid UPLC-MS/MS method for qualitative and quantitative analysis of toosendanin.Methods:Samples were heated with methanol under reflux and further detected by the ultra performance liquid chromatography-electrospray ion(ESI-)trap mass spectrometry method. The separation was performed on Waters UPLC using BEH-C18column with a isocratic elution(0.1% acetic acid∶methanol=60∶40).The qualitative and quantitative analysis of toosendanin was conducted in the MS scan,Daughter scan and MRM mode by UPLC-MS/MS.Results:Them/z573→531m/z573→425were two qualitative ion pairs of toosendanin. The calibration curves showed good linear relationship in the range of50~1000ng·mL-1for the component.The determination limits was60μg·g-1,and the average recovery rate was97.6%.Conclusion:The method was proved to be specific,rapid and sensitive,which can be used to qualitative and quantitative analysis of toosendanin
Toosendanin;UPLC-MS/MS;qualitative and quantitative
*
郝刚,主管药师,博士,研究方向:食品药品质量与安全监控;Tel:(0512)67079940,E-mail:haogang531@163.com
10.13313/j.issn.1673-4890.2015.12.012
2015-03-19)
