乳铁蛋白与牛乳中其他蛋白质相互作用机制研究进展
2015-09-22周英爽樊凤娇张兰威
周英爽,樊凤娇,刘 猛,杨 戬,王 韫,杜 明*,张兰威
(哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
乳铁蛋白与牛乳中其他蛋白质相互作用机制研究进展
周英爽,樊凤娇,刘 猛,杨 戬,王 韫,杜 明*,张兰威
(哈尔滨工业大学食品科学与工程学院,黑龙江哈尔滨150090)
牛乳蛋白分为酪蛋白和乳清蛋白,其中乳铁蛋白是乳清蛋白中的一种,具有多种生物学功能,被广泛应用于食品、医药、化妆品工业等领域。在牛乳中,乳铁蛋白带正电荷,会与一些带负电荷的蛋白质,如酪蛋白、骨桥蛋白、β-乳球蛋白、血清白蛋白、免疫球蛋白等发生相互作用。这种相互作用影响着这些蛋白的生物化学功能或者分离制备特性,尤其是后者更是工业化生产中需要关注的问题。本文阐述了乳铁蛋白与牛乳中其他蛋白质之间的相互作用机制及其应用现状,对于开发乳铁蛋白的工业化制备方法、以及系统理解牛乳中各种活性蛋白间的协同生物作用等方面都具有重要意义,为乳铁蛋白生物学特性的深入研究和工业化生产技术开发提供一定依据。
乳铁蛋白;生物学功能;相互作用;机制;应用
乳蛋白主要分为两大类:酪蛋白(casein,CN)和乳清蛋白,乳铁蛋白(lactoferrin,LF)是乳清蛋白中的一种,在乳中含量约为0.02~0.35 g/L。随着生物工程技术的不断发展,乳铁蛋白因其具有多种生物学性质,被广泛应用于食品、医药等领域[1-2]。在牛乳体系中,乳铁蛋白是以两种形式存在,一种是自由乳铁蛋白,另一种是与其他蛋白质结合,形成复合物,即以固定乳铁蛋白形式存在。阐明乳铁蛋白与其他蛋白质形成复合物的结合机制,将固定乳铁蛋白释放并提取出来,对于开发高效提取乳铁蛋白技术具有重要意义。本文介绍了乳铁蛋白与酪蛋白、免疫球蛋白G、骨桥蛋白、β-乳球蛋白之间的相互作用,以期为乳铁蛋白的低成本、高效率工业化提取新技术奠定一定的理论基础。
1 牛乳蛋白的主要成分
牛乳蛋白中酪蛋白含量约为80%,乳清蛋白含量约为20%。酪蛋白胶体(casein micelles,CM)主要由四部分组成:αs1-、αs2-、β-、κ-CN,质量之比约为4∶1∶4∶1,平均等电点在4.8[3-4]。乳清蛋白包含α-乳清蛋白(α-lactalbumine)、β-乳球蛋白(β-lactoglobuline)、乳血清白蛋白(bovine serum albumin,BSA)、乳铁蛋白、乳过氧化物酶(lactoperoxydase)、免疫球蛋白(immunoglobuline,Ig)等[5]。各种主要蛋白组分的基本特性见表1。
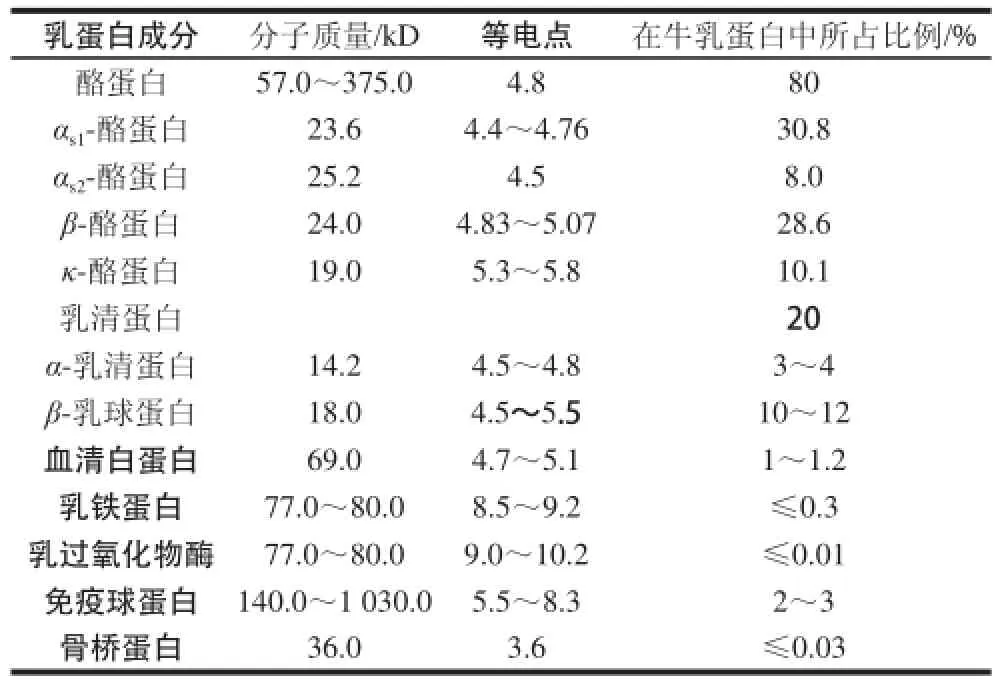
表1 牛乳蛋白主要组成成分Table1Main composition of bovine milk proteinotein
2 乳铁蛋白与其他牛乳蛋白相互作用及应用
乳铁蛋白等电点为8.5~9.2,是一种碱性蛋白,在牛乳体系中带正电荷[6],会与一些在牛乳中带负电荷的蛋白发生可逆性结合,如酪蛋白、骨桥蛋白、β-乳球蛋白、血清白蛋白、免疫球蛋白等,通过静电力作用相互结合形成大的复合物存在于牛乳中。
2.1乳铁蛋白的分子结构
LF分子质量约为80 kD,由一条含689 个氨基酸的多肽链组成。不同种属来源的LF氨基酸序列不同,但其同源性约达70%。不同来源的LF氨基酸序列都含有一个双重内部重复序列,如N末端序列与C末端序列有40%的一致性。此外,这些LF都能紧密可逆地结合两个Fe3+和两个LF的二级结构主要由α-螺旋和β-折叠组成,中间由一段螺旋肽链连接,呈“二枚银杏叶型”结构。
LF的三级结构如图1A[8]所示,LF蛋白分子折叠成两个叶片,即N叶和C叶,这两个叶片代表着LF多肽链的N末端和C末端。每一个叶片又分为两个结构域,即N-1、N-2、C-1、C-2,而每一个叶片的两个区域中间的球形是铁离子的结合位点[8-9]。氨基酸组成了4 个结构域,N-1由1~90和251~333序列组成;N-2由91~250序列组成;C-1由345~431和593~676序列组成;C-2由432~592序列组成。LF的N叶和C叶由3 个翻转的螺旋连接,氨基酸残基为334~344[8-9]。与图1A方向一致的LF电荷分布情况如图1B[10]所示。在图的左上角主要分布着中性和负电荷,左下角主要分布着正电荷,右上角主要是中性电荷,右下角主要是中性及负电荷,少量的正电荷。这说明LF强阳离子特性N端在其左下角[10]。由图1B可知,LF分子的N-1结构域是极强的正电荷富集区,这可能成为LF与其他分子进行相互作用的重要结构和特性基础。

图1 LF的三维结构和电荷分布图Fig.1Three-dimensional structure and charge distribution of lactoferrin
2.2乳铁蛋白和酪蛋白胶体间的相互作用
2.2.1酪蛋白胶体结构
在牛乳中,酪蛋白的4 种单体组成成分:αs1-、αs2-、β-、κ-CN会进行自我组装成双嵌段复合物[11],通过在水相中疏水作用和静电排斥作用的平衡形成酪蛋白胶束[12-13]。关于酪蛋白胶体模型有多种猜测,主要包括“套核”结构模型、内部结构模型、亚单元模型和微簇结构模型。其中在LF与CM的相互作用机制研究中,使用较多的“套核”结构模型和亚单元模型。
2.2.1.1“套核”结构模型(coat core models)
“套核”结构模型如图2所示,αs-CN分子和β-CN分子构成了胶粒的核,表面分布着κ-酪蛋白,磷酸钙在内外部都存在[14]。2.2.1.2亚单元模型(subunit models)

图2Payens的“套核”结构模型Fig.2Coat core model of casein micelles structure by Payens
Morr[15]最早提出了亚单元模型,Slattery等[16]提出了由不同组成亚单元构成胶体粒子的模型。Schmidt[17]在以上研究的基础上提出次级胶体分子模型(图3)。就目前研究而言,Slattery和Schmidt等提出的模型是最被认可的酪蛋白胶体的结构模型。研究表明:酪蛋白胶体形成的原因是磷酸钙相和亚单元之间的疏水相互作用,κ-CN位于酪蛋白胶粒的表面,对于酪蛋白胶体的稳定性有很大作用[18],而αs1-、αs2-、β-CN均匀分布于整个酪蛋白胶粒。
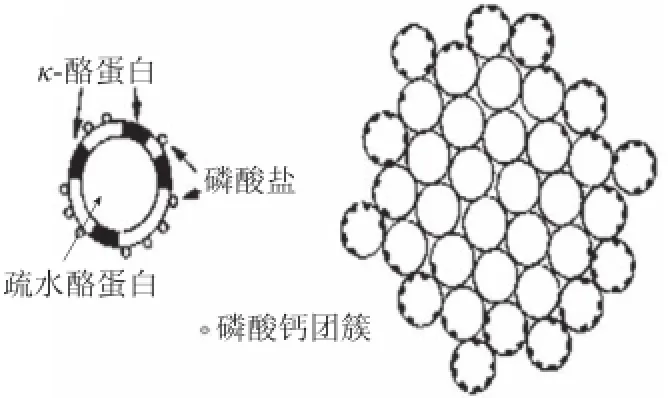
图3Schmidt的“亚单元”结构模型[17]17Fig.3Subunit model of casein micelles structure by Schmidt[17]
2.2.2乳铁蛋白与酪蛋白胶体间的动态包裹与释放机制
研究发现,在pH 4.7条件下,LF结合在酪蛋白胶体上而沉淀[19]。根据Croguennec等[20]研究发现,LF在牛乳自然条件下(pH 6.8),带有正电荷,而酪蛋白胶体(pI 4.6)带负电荷,两者会通过静电作用相互结合[21]。根据上述研究结果,乳铁蛋白与酪蛋白胶束在牛乳体系中的相互作用机制如图4所示。

图4乳铁蛋白与酪蛋白可逆结合机制Fig.4Reversible combination between lactoferrin and caseins
Anema等[22]通过滴定法,向酪蛋白溶液中滴加乳铁蛋白溶液以及反向滴定的方式,同时测定体系的光散射强度、表面电荷数量以及pH值变化情况,发现酪蛋白的几种类型α-CN(ACN)、β-CN(BCN)和κ-CN(KCN)以不同的比例与乳铁蛋白结合。随着滴定的进行,体系颗粒表面粒径逐渐变大。通过表面电荷和pH值的变化,Anama推测出LF与ACN、BCN和KCN相互作用的分子比例分别为2∶1、1∶1和1∶4,乳铁蛋白与不同类型酪蛋白相互作用模型,如图5所示。

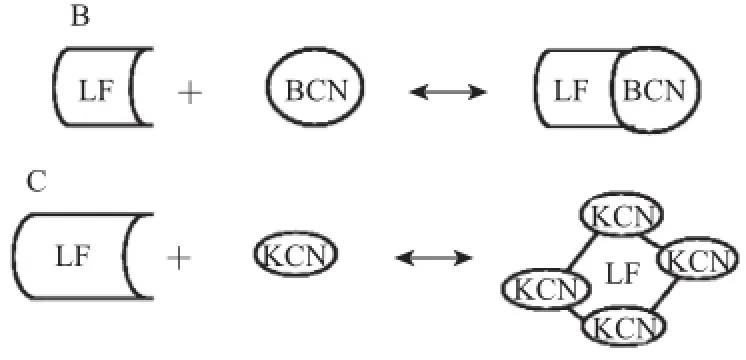
图5乳铁蛋白与α--CNN(AA)、β-CNN(BB)、k-CCNN(CC)相互作用模型Fig.5Interaction between LF and either ACN(A),BCN(B)or KCN(C)
2.2.3乳铁蛋白与酪蛋白胶体复合物(LF-CM)在工业生产中的应用
近年来,已有学者研究从酪蛋白中释放乳铁蛋白。Anema等[22-23]研究了从奶酪加工凝块中释放LF,发现酸化或者盐处理能增加LF的释放量,同时发现,牛乳中添加的LF能够自发地和酪蛋白胶体相互作用。当大量的LF(20 g/L)添加到牛乳中时,会使LF结合到酪蛋白胶体中的酪蛋白上,伴随着酪蛋白胶体的膨胀,然后慢慢地有部分分解现象出现[16]。乳铁蛋白与酪蛋白在牛乳中通过静电力形成胶体复合物,这一可逆反应在工业生产中有很重要的应用。目前LF的提取技术存在生产流量低,成本高等缺点,又因LF与CM形成LF-CM胶体复合物。研究发现通过改变温度、离子强度、pH值[24]等物理化学条件,能有效地促进二者之间的解离,同时通过适宜规格的滤膜进行有效的分离LF和LF-CM复合物,进而应用于LF的工业提取生产中,更高效、高产地生产LF。但是目前研究温度、pH值、离子强度、离子种类对二者结合的影响还不是很全面,研究多采用相对比较纯的样品进行滴定反应[20-21],对于牛奶中乳糖、脂肪等成分的影响还没有阐述,这为我们未来的研究提供了方向。
2.3乳铁蛋白和骨桥蛋白的相互作用及其应用
骨桥蛋白(osteopontin,OPN)是一种分泌型的磷酸化糖蛋白(secreted phosphoprotein,SPP)。其分子质量为36 kD,等电点pH 3.6左右,在牛乳体系中带负电荷,是一种酸性蛋白,可与带正电荷的碱性蛋白发生反应[25]。通过等温滴定量热法(isothermal titration calorimetry,ITC),将LF溶液与OPN溶液相互滴定,发现在牛乳体系中,因LF与OPN带有相反的电荷,二者通过静电相互结合形成LF-OPN复合物。研究中发现,当向OPN溶液中滴定LF时,LF优先结合在OPN结合位点A处,随着LF的增加,会再结合在B、C两处。虽然A点吸热量比B、C处少,但是其亲和力要比B、C强,如图6A所示[25]。相反的,当向LF溶液中滴定OPN溶液时,发现LF很自然地结合在OPN的A、B、C三点处。但是随着OPN的继续添加,LF从B、C两处解离,结合在A处,如图6B[25]所示。在溶液中,LF与OPN以分子比例3∶1结合,形成大的LF-OPN胶体复合物[25]。通过差示扫描量热法(differential scanning calorimetry ,DSC)可以观察到,LF与OPN结合后,总体上其热熔温度(Tm)都会变大。综上研究表明,LF与OPN的结合会改变其热熔温度,此外,不同滴定顺序结合图都表明LF与OPN存在相互作用,且在OPN上有3 个LF结合位点。
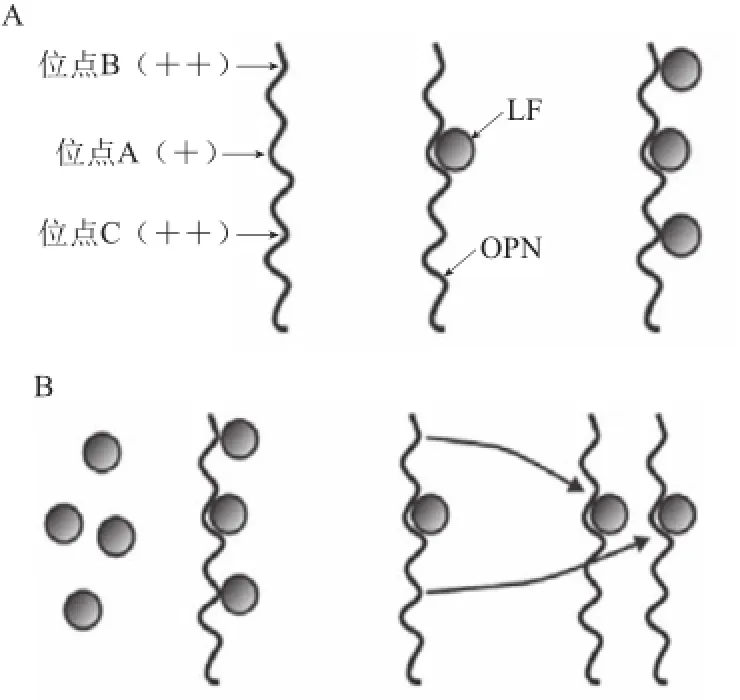
图6乳铁蛋白与骨桥蛋白等温滴定量热实验模型Fig.6Schematic model depicting the interaction between apo-OPN and apo-LF du ring ITC titration experiments
研究发现LF可以通过促进成骨细胞和抑制破骨细胞调节骨再生,LF和OPN能够在促进成骨细胞增殖中起到协同作用[26]。在LF结构中的N端由K18、R20、R21、R25、K27、K28、R39、R38和周围残基组成的区域是OPN结合位点,而这一区域正是LF水解成生物活性乳铁素肽的部分。OPN能够有效地保护LF在吸收过程中不被水解,通过潜在地调节乳铁素肽的释放,继而调节其生物活性[27]。LF与OPN的相互作用机制的深入研究,可否为乳铁蛋白成骨作用机制的阐明,以及新型乳铁蛋白和骨桥蛋白的新型制备方法的开发提供新的思路,是值得广大研究人员思考的问题。
2.4乳铁蛋白和β-乳球蛋白(β-lactoglobulin,β-Lg)的相互作用及其应用
β-Lg是牛乳中一种重要乳清蛋白,分子质量为18~20 kD,其等电点pI值为4.5~5.5,在牛乳体系中,β-Lg带有负电荷。通常情况下,β-Lg会形成非共价二聚体,存在于牛乳中[28]。研究发现,通过向稳定的β-Lg体系中添加LF,通过纳米粒度扫描仪和Zeta电位仪可以测定出β-Lg体系电势负电位逐渐降低,二者达到结合饱和时,电势为零,继续添加LF,电势为正。向稳定的LF体系中添加β-Lg,同样得到电势由正变为负的结果[29]。进而表明,在牛乳体系中,LF与β-Lg因带有相反电荷而发生静电结合,形成β-乳球蛋白-乳铁蛋白(β-lactoglobulin-lactoferrin,BLG-LF)复合物。通常在牛乳中存在两种形式的BLG-LF复合物,即LF(BLG2)、LF(BLG2)2。在牛乳中,β-Lg形成二聚体(BLG2)2后与LF相互结合,所以复合物主要是以LF(BLG2)2形式存在,复合物模型如图7[30]所示。通过热力计量学研究,可以计算出LF与β-Lg结合分子比例为2∶1[30-31]。LF与β-Lg相互吸附在表面,可以使LF吸附在黏膜表层,进而保护黏膜不受病原的侵害。

图7乳铁蛋白与乳球蛋白相互作用模型Fig.7Interaction between LF and BLG in bovine milk
在牛乳体系中LF与β-Lg因所带电荷相反,会发生静电力结合形成LF-β-Lg复合物。研究LF与β-Lg异种蛋白的可逆性相互作用研究发现,只有在有限的pH值、离子强度、总蛋白质浓度、LF与β-Lg化学计量比条件下,才会形成复合物[30]。LF与β-Lg均具有多种生物学功能。所以,通过研究二者的结合机制,改变体系环境条件,进而有效地促进或者抑制BLG-LF复合物的形成,从而为LF与β-Lg功能性作用发挥提供帮助。可以应用这种可逆性结合机制,进行分离LF和β-Lg,从而提高LF提取率。对于LF和β-Lg复合物的功能还没有相关报道,所以未来可以从二者复合物功能性展开研究。
2.5乳铁蛋白和血清白蛋白间的相互作用及其应用
牛血清白蛋白是乳清蛋白中的一种,等电点pI值为4.7左右,在牛乳体系中带有负电荷。Lampreave等[32]研究发现,BSA与LF因带有相反的电荷而结合成聚合物存在于牛乳中。通过凝胶色谱法分离干奶期牛奶中铁饱和乳铁蛋白,乳铁蛋白有两个洗脱峰,其中一个分子质量约为200 kD,另一个分子质量约为150 kD。然而,纯化的铁饱和LF的洗脱峰只有一个,且其分子质量约为67 kD。在200 kD峰和150 kD峰组分中检测到β-乳球蛋白,在150 kD峰里面检测到乳白蛋白的存在,而α-乳白蛋白不存在任何峰里。而纯化的β-乳球蛋白和乳白蛋白的洗脱峰都在这两个蛋白峰之后。分子质量以及蛋白检测结果,都表明LF与乳白蛋白相互作用,且其相互作用物质的量比约为1∶1。
LF-BSA复合物的稳定性会因体系物理化学条件的变化而变化。LF具有多种生物学功能,同样BSA对酶类活性有保护作用,一般用作稳定剂。通过LF与BSA形成复合物的结合机制阐明,可以通过改变体系条件有效地促进或者抑制二者的结合,进而应用在LF的提取,发挥LF与BSA功能作用中。同时也为LF与BSA在生化研究、遗传工程和医药研究等方面提供帮助。
2.6乳铁蛋白和免疫球蛋白G(IgG)间的相互作用及其应用
免疫球蛋白(Ig)是牛乳清蛋白中的一种,其等电点pI值为5.5~8.3。Ig分为3 种类型,即IgG、IgM、IgA。其中IgG分为IgG1、IgG2、IgG3和IgG4 4 个亚类。Watanabe等[33]在研究在人乳中LF可以与IgA发生静电力结合。在牛乳体系中,Butler[34]通过凝DEAE胶色谱方法发现了LF-IgG2复合物,继而阐明在牛乳中,LF与IgG2因带有相反电荷而发生静电结合。LF-IgG2复合物的形成是可逆性的。通过改变体系环境条件,能够改变LF-IgG2复合物的稳定性。LF与IgG均具有多种生物学功能,LF具有抗菌、调节免疫力、抗微生物等功能[35],免疫球蛋白具有抑菌、免疫和生理调节作用,能够完整地进入近端小肠,起到保护小肠黏膜的功能[36],而这一复合物形成机制的研究,可以通过改变体系因素有效地促进或者抑制二者的结合,进而二者有效地发挥各自的功能作用。同时也可以为LF分离提取提供理论基础。对于LF-IgG2复合物的功能特性和热力学特性还需要进一步研究,进而应用在医学、食品等领域。
3 牛乳蛋白质间相互作用的应用展望
随着对乳清蛋白研究的不断深入,其应用越来越广泛。每年由于制作干酪而产生的乳清在全世界高达11 000万 t,但是不足50%的乳清得到进一步的加工[37]。乳清蛋白包括乳铁蛋白、免疫球蛋白、β-乳球蛋白及血清白蛋白等,并且每种蛋白都具有其独特的生物学功能。LF在牛乳中含量低,但因其具有多种生物功能被广泛研究[38-39]。目前LF的提取技术还存在生产成本高、提取率低等缺点,工业化生产成本较高,造成LF市场价格居高不下。阐明牛乳体系中LF与其他蛋白质的相互作用机制,研究影响两种蛋白质分子相互作用的因素,如温度、pH值、离子强度等条件,可逆地促进和抑制LF与其他蛋白质相互作用,我们就可以有针对性地控制这些分子间的相互作用,进而向着所需要的方向进行反应,应用膜技术工业化提取LF,进而开发新型的乳铁蛋白的工业化制备方法,降低生产成本,从而为在乳制品尤其是婴幼儿配方乳粉中的应用奠定理论基础。这对于改变我国乳铁蛋白长期依赖进口的局面,提高我国乳品工业的国际竞争力具有重要意义。与此同时,阐明这些生物活性蛋白之间的相互作用机制,可以深入理解这些活性蛋白发挥生物学功能的活性机制、它们之间的协同(或抑制)作用,这也是值得我们乳品科学与技术研究者们关注的重要问题。
综上所述,阐明和理解乳铁蛋白与牛乳中其他蛋白质的相互作用无论是从科学研究的角度,还是从工业化生产的角度均具有重要意义,值得我们在未来的研究工作中给予重视。
[1]BAKER E N,BAKER H M.A structural framework for understanding th e multifunctional character of lactoferrin[J].Biochimie,2009,91(1):3-10.
[2]TOMITA M,WAKABAYASHI H,SHIN K,et al.Twenty-five years of research on bovine lactoferrin applications[J].Biochimie,2009,91(1):52-57.
[3]NARAMBUENA C F,AUSAR F S,BIANCO I D,et al.Aggregation of casein micelles by interactions with chitosans:a study by monte carlo simulations[J].Journal of Agricultural and Food Chemistry,2005,53(2):459-463.
[4]HORNE D S.Casein micelle structure:models and muddles[J].Current Opinion in Colloid and Interface Science,2006,11(2/3):148-153.
[5]HOLT C.Molecular basis of whey protein food functionalities[J].Australian Journal of Dairy Technology,2000,55(2):53-55.
[6] GONZÁLEZ-CHÁVEZ S A, ARÉVALO-GALLEGOS S, RASCÓNCRUZ Q. Lactoferrin: structure, function and applications[J/OL]. International Journal of Antimicrobial Agents, 2009, 33(4): 301. e1-8. e8.http://dx.doi.org/10.1016/j.ijantimicag.2008.07.020.
[7] BAKER E N, BAKER H M, KIDD R D. Lactoferrin and transferrin: functional variations on a common structural frame work[J]. Biochemistry and Cell Biology, 2002, 80(1): 27-34.
[8] BAKER E N, BAKER H M. A structural framework for understanding the multifunctional character of lactoferrin[J]. Biochimie, 2009, 91(1): 3-10.
[9] MOORE S A, ANDERSON B F, GROOM C R, et al. Threedimensional structure of diferric bovine lactoferrin at 2.8 Å resolution[J]. Journal of Molecular Biology, 1997, 274(2): 222-236.
[10] JENSSEN H, HANCOCK R E W. Antimicrobial properties of lactoferrin[J]. Biochimie, 2009, 91(1): 19-29.
[11] VOETS I K, de KEIZER A, COHEN STUART M A. Complex coacervate core micelles[J]. Advances in Colloid and Interface Science, 2009, 147/148: 300-318.
[12] LIU Yan, GUO Rong. Interaction between casein and sodium dodecyl sulfate[J]. Journal of Colloid and Interface Science, 2007, 315(2): 685-692.
[13] DOATO L, GUYOMARC H F. Formation and properties of the whey protein/κ-casein complexes in heated skim milk: a review[J]. Dairy Science and Technology, 2009, 89(1): 3-29.
[14] 方海田, 德力格尔桑, 刘慧燕. 牛乳中酪蛋白胶束结构理论模型的研究进展[J]. 农业科学研究, 2006, 27(3): 86-89.
[15]MORR C V.Effect of oxalate and urea upon ultracentrifugation properties of raw and heated skimmilk casein micelles[J].Journal of Dairy Science,1967,50(11):1744-1751.
[16]SLATTERY C W,EVARD R.A model for the formation and structure of casein micelles from subunits of variable composition[J].Biochimica et Biophysica Acta-Protein Str ucture,1973,317(2):529-538.
[17]SCHMIDT D G.Association of caseins and casein micelle structure.Developments in dairy chemistry[M].London:Applied Science Publishers,1982:61-85.
[18]de KRUIF C G,HUPPERTZ T,URBAN V S,et al.Casein micelles and their internal structure[J].Advances in Colloid and Interface Science,2012,171/172:36-52.
[19]NAGASAWA T,KIYOSAWA I,TAKASE M.Lactoferrin and serum albumin of human casein in colostrum and milk[J].Journal of Dairy Science,1974,57(10):1159-1163.
[20]CROGUENNEC T,LI Na,PHELEBON L,et al.Interaction between lactoferrin and casein micelles in skimmed milk[J].International Dairy Journal,2012,27(1/2):34-39.
[21]ANEMA S G,de KRUIF C G.Interaction of lactoferrin and lysozyme with casein micelles[J].Biomacromolecules,2011,12(11):3970-3976.
[22]ANEMA S G,de KRUIF C G.Co-acervates of lactoferrin and caseins[J].Soft Matter,2012,8:4471-4478.
[23]ANEMA S G,de KRUIF C G K.Lactoferrin binding to transglutaminase cross-linked casein micelles[J].International Dairy Journal,2012,26(1):83-87.
[24]MCCARTHY N A,KELLY A L,FENELON M A,et al.Sensitivity of emulsions stabilised by bovine β-casein and lactoferrin to heat and CaCl2[J].Food Hydrocolloids,2014,35:420-428.
[25]YAMNIUK A P,BURLING H,VOGEL H J.Thermodynamic characterization of the interactions between the immunoregulatory proteins osteopontin and lactoferrin[J].Molecular Immunology,2009,46(11/12):2395-2402.
[26]CORNISH J,PALMANO K,CALLON K E,et al.Lactoferrin and bone;structure-activity relationships[J].Biochemistry and Cell Biology,2006,84(3):297-302.
[27]CHATTERTON D E W,RASMUSSEN J T,HEEGAARD C W,et al. in vitro digestion of novel milk protein ingredients for use in infant formulas:research on biological functions[J].Trends Food Science and Technology,2004,15(7/8):373-383.
[28]SAWYER L.β-Lactoglobulin.Adv anced dairy c hemistry[M].New York:Springer Science Business Media,2013:211-259.
[29]YE A,SINGH H.Formation of multilayers at the interface of oil-in-water emulsion via interactions between lactoferrin andβ-lactoglobulin[J].Food Biophysics,2007,2(4):125-132.
[30]KIZILAY E,SEEMAN D,DUBIN P L,et al.Heteroprotein complex coacervation:bovineβ-lactoglobulin and lactoferrin[J].Langmuir,2013,29(50):15614-15623.
[31]EDWARDS P B,CREAMER L K,JAMESON G B,et al.Structure and stability of whey proteins[M]//BOLAND M,SINGH H.Milk proteins:from expression to food.San Diego:Academic Press,2009:163-203.
[32]LAMPREAVE F,BROCK J H,CASTILLO H,et al.Interaction of bovine lactoferrin with other proteins of milk whey[J].International Dairy Journal Biology Macromol,1990,12(1):2-5.
[33]WATANABE T,NAGURA H,WATANABE K,et al.The binding of human milk lactoferrin to immunoglobulin A[J].Elsevier Science,1984,168(2):203-207.
[34]BUTLER J E.The occurrence of immunoglobulin fragments,two types of lactoferrin and a lactoferrin-Ig G2complex in bovine colostral and milk whey[J].Biochimica et Biophysica Acta-Protein Structure,1973,295(1):341-351.
[35]LEGRAND D,PIERCE A,ELASS E,et al.L actoferrin structure and functions[J].Bioactive Components of Milk,2008,606:163-194.
[36]SCHROEDER H W,CAVACINI L.Structure and function of immunoglobulins[J].Journal of Allergy and Clinical Immunology,2010,125(2):41-52.
[37]BRICZINSKI E P,ROBERTS R F.Production of an exopolysaccharide containing whey protein conce ntrate by fermentation of whey[J].Journal of Dairy Science,2002,85(12):3189-3197.
[38]BOKKHIM H,BANSAL N,GR☒NDAHL L,et al.Physico-chemical properties of different forms of bovine lactoferrin[J].Food Chemistry,2013,141(3):3007-3013.
[39] 孔莹莹, 杜明, 刘猛, 等. 乳铁蛋白理化性质及其成骨作用研究进展[J].食品科学, 2012, 33(21): 318-322.
Interaction Mechanism between Lactoferrin and Other Proteins in Bovine Milk
ZHOU Yingshuang,FAN Fengjiao,LIU Meng,YANG Jian,WANG Yun,DU Ming*,ZHANG Lanwei
(School of Food Science and Engineering,Harbin Institute of Technology,Harbin150090,China)
The bovine milk proteins include casein and whey protein. Lactoferrin (LF) is a whey protein that has a variety of biological functions. Lactoferrin is widely used in food additive, medical and cosmetic industries. In bovine milk, lactoferrin is positive to interact with some negatively charged proteins, such as casein and osteopontin, β-lactoglobulin, immunoglobulin and bovine serum albumin. These interactions can affect the biological functions and purification characteristics of these proteins; especially the latter has attracted more and more attentions. In the present review, the mechanism of interactions between lactoferrin and other bovine proteins are clarifi ed, which is important for developing industrial preparation procedures of LF and understanding the synergistic biological activities of these proteins. This review will provide some theoretical references for the development of industrial extraction methods of lactoferrin.
lactoferrin; biological function; interaction; mechanism; application
TS252.1
A
1002-6630(2015)05-0244-06
10.7506/spkx1002-6630-201505045
2014-05-04
“十二五”国家科技支撑计划项目(2013BAD18B06-03);国家自然科学基金青年科学基金项目(31101316);国家自然科学基金面上项目(31371805);教育部“新世纪优秀人才支持计划”项目(NCET-11-0796);黑龙江省博士后研究人员落户黑龙江科研启动资金项目;中央高校基本科研业务费专项资金项目(HIT.BRETⅢ.201231)
周英爽(1989—),女,硕士研究生,研究方向为食品科学。E-mail:zyshuang8910@163.com
杜明(1977—),男,教授,博士,研究方向为食品科学。E-mail:duming121@163.com
