三种髓腔穿孔修复材料对人牙周膜成纤维细胞黏附及形态影响的体外研究
2015-09-20钟素兰尹仕海
汪 莉,钟素兰,尹仕海
(1.双流县第一人民医院口腔科,四川成都610200;2.广东省口腔医院南方医科大学附属口腔医院,广东广州510280;3.四川大学华西口腔医院牙体牙髓病科,四川成都610041)
髓腔穿孔(perforation)是病理性或医源性导致的髓腔与牙周组织非生理性的通道,极易导致牙周组织炎症,如穿孔处牙槽骨吸收、肉芽组织形成和窦道;如果不及时修复或修复方法及材料使用不当,可显著影响根管治疗效果,最终可能导致患牙的拔除。因此,及时、有效地修复髓腔穿孔是根管治疗术过程中的重要环节。
用于髓腔穿孔修复的材料种类较多。传统修复材料有银汞合金[1]、复合树脂[2]、玻璃离子[3]等;颇受口腔医生欢迎的生物性穿孔修复材料有,上世纪九十年代末推出的三氧化矿物凝聚体(Mineral Trioxide Aggregate,MTA),以及近年应用于临床的iRoot生物陶瓷材料[4]。
髓腔穿孔修复材料应具有良好的生物相容性,对牙周组织无刺激性和无毒性,能诱导骨或牙骨质形成,能促进牙周组织的修复再生。生物安全性是髓腔穿孔修复材料的最重要性能,研究细胞在材料表面的黏附状况和形态变化是观察细胞生物相容性的基本手段。本课题组前期实验采用荧光定量PCR法研究了银汞合金、FiltekTMZ350纳米复合树脂、MTA等3种常用的髓腔穿孔修复材料对人牙周膜成纤维细胞碱性磷酸酶和骨钙素mRNA表达的影响[5],本研究在倒置相差显微镜下观察这3种材料对人牙周膜成纤维细胞形态的影响,并在扫描电镜下观察3种材料表面人牙周膜成纤维细胞的附着及伸展情况,为临床选择提供参考。
1 材料和方法
1.1 试件制备
根据穿孔修复材料的不同将实验分为4组,A组:MTA(Densply,美国);B组:Z350(3M,美国);C组:银汞合金(上海齿科材料厂);D组:(空白对照)载玻片。A、B、C、D组分别按使用说明将穿孔修复材料制备成直径为5.0 mm,高为2.5 mm的圆柱体,表面不经过打磨抛光程序。将4组试件用紫外线消毒30 min备用。
1.2 人牙周膜成纤维细胞的体外培养
将临床上因正畸减数拔除的前磨牙(牙周健康,无龋损及根尖周炎)即刻放入无血清的DMEM培养基中,用含有抗生素(青霉素100 μg/mL、链霉素100 μg/mL)的PBS反复冲洗;刮取根中1/3牙周膜组织均匀铺在6孔板的底面,覆盖玻片,加入含200 mL/L FCS的DMEM培养基。待原代细胞铺满培养板底70%左右后,用2.5 g/L胰蛋白酶消化传代。取第6代细胞用于实验。
1.3 方法
1.3.1 倒置相差显微镜观察
取对数生长期的第6代人牙周膜成纤维细胞,2.5 g/L胰蛋白酶消化,加入用含200 mL/L的DMEM培养基,充分吹打,使之成为单细胞悬液,计数并调整细胞浓度至1×105/mL。取4组标本各4个放入6孔板中,每孔加入1×105/mL的细胞悬液 2 mL,37 ℃、50 mL/L CO2、950 mL/L O2、100%湿度培养24 h后,于倒置相差显微镜下观察材料周边及载玻片上细胞形态的变化,倒置显微镜照相(Leica DMI 6000B,德国)。
评价方法:①计算材料和细胞之间无细胞带的面积[6],数据以表示,②细胞形态评价标准[6]:1级,少量细胞皱缩(<10%);2级,部分细胞皱缩(<50%);3级,大量细胞皱缩(<90%);4级,大量细胞死亡(<10%细胞存活)。
1.3.2 扫描电镜观察
将上述细胞培养24 h后的材料在30 mL/L的戊二醛中固定2 h,乙醇梯度脱水各15 min,醋酸异戊酯室温置换15 min。临界点干燥、喷金,JSE-5900LV扫描电镜观察。
细胞形态评价标准同1.3.1。
1.4 统计学处理
应用SPSS 12.0统计软件对不同材料和细胞之间的无细胞带结果进行单因素方差分析,检验水准α=0.05。
2 结果
2.1 倒置相差显微镜观察结果
3种材料与人牙周膜成纤维细胞共同培养24 h后,牙周膜成纤维细胞成梭形,增殖并贴附于载玻片。倒置相差显微镜下可见MTA组无细胞带面积最小(0.75±0.15)mm2,材料周围细胞形态好,细胞形态评为1级;Z350组无细胞带面积略大(3.58±0.36)mm2,材料周围少量细胞皱缩,细胞分级形态为2级;银汞合金组材料周围有明显的无细胞带,且面积最大(8.88±0.90)mm2,细胞多为圆形,细胞形态分级为4级。3组两两相比,无细胞带面积有统计学差异(P<0.05)(图1)。
2.2 扫描电镜结果
3种材料与人牙周膜成纤维细胞共同培养24 h后,扫描电镜下观察材料表面细胞形态可以发现,MTA表面细胞黏附较多,形态良好,细胞分级为1级;Z350表面细胞黏附较少,细胞分级为2级;银汞合金表面细胞黏附最少,细胞分级为4级(图2)。
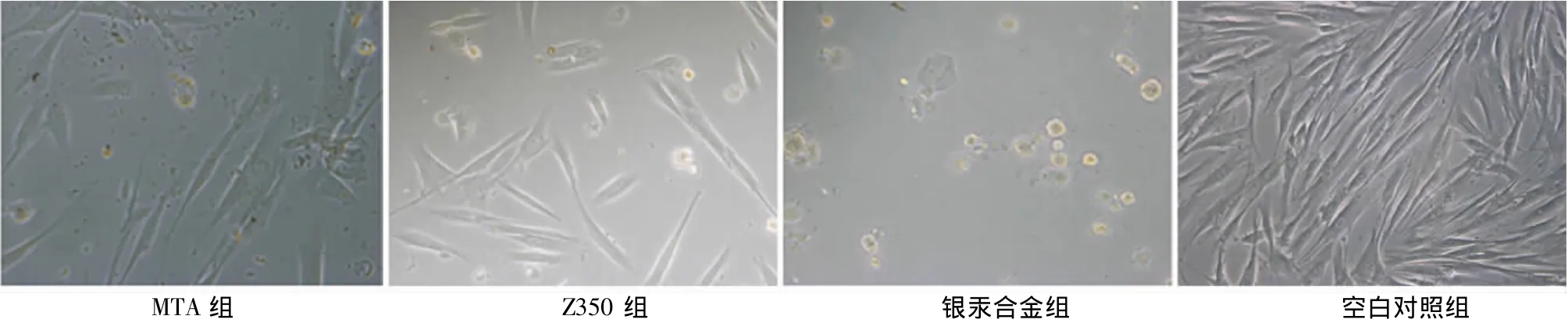
图1 24 h后3种材料周围的细胞形态(PM,×200)

图2 培养24 h后不同材料表面细胞形态(SEM)
3 讨论
细胞的形态结构与功能有着重要联系。细胞形态完整除了有利于细胞的支持和保护外,还是整个细胞的行为、生理活动、相互识别、粘着、物质运输、信息传导、生长分化的基础。形态学观察是研究材料与细胞相互关系最基本的内容,研究材料对细胞形态的影响是评价材料生物相容性的方法之一[7-8]。
观察细胞形态的变化多采用直接接触法,即将细胞直接放在生物材料上进行培养。当有毒性物质释放时,细胞可发生形态变化和数量增减,以此来检测细胞毒性程度,同时可以直接观察到细胞在材料表面黏附情况。
本结果显示,3种材料对牙周膜成纤维细胞的形态都有一定影响。倒置相差显微镜下观察,正常牙周膜成纤维细胞贴壁后开始伸展,多数细胞形态呈长梭形或星形,胞体丰满,胞浆均匀,核圆形或卵圆,核仁清晰,可见核分裂相。3种髓腔穿孔修复材料与人牙周膜成纤维细胞共同培养1 d后,相差显微镜下观察,银汞合金组材料周围有明显的无细胞带,低倍镜下见90%以上的细胞皱缩成圆形,细胞极少保留梭形;高倍镜下见大部分细胞为不规则圆形,胞浆少,未见明显核仁及核分裂相,显示为较大材料毒性作用后的细胞特征[9]。Z350组无细胞带面积低于银汞合金,且低于50%细胞皱缩。而MTA组无细胞带面积最小,与前两组相比有显著差异,且细胞皱缩小于10%,对细胞形态影响较小。扫描电镜下观察,银汞合金表面附着细胞少,且多为皱缩,细胞伸展少;Z350表面附着的细胞增多,细胞铺展,多个伪足样突起紧密黏附在材料表面,但是有少量细胞胞体较正常者小,有少量细胞皱缩;MTA表面细胞附着多,形态良好,大量细胞铺展,排列成网状,细胞突起相互连接,细胞上附大量微小囊泡。
本结果表明,银汞合金对牙周膜成纤维细胞形态的影响最大。Zhu等[6]研究了几种材料对牙周膜成纤维细胞形态的影响,发现银汞合金周围的无细胞带比IRM(Intermediate Restorative Material,中间修补材料))及Super-EBA(Super-EBA(Super Ethoxybenzoic Acid,超级苯乙基安息香酸)大;Mitchell等[10-11]发现MTA对MG63细胞株形态的影响较小,与本结果一致。本实验中,MTA对细胞形态的影响最小,材料周围的无细胞带面积最小,材料表面黏附细胞多,形态良好。细胞在MTA表面黏附较好,继而增殖,并形成新的牙骨质、牙槽骨,才能达到真正意义上的牙周组织再生[12]。
MTA是由硅酸三钙、铝酸三钙、氢氧化钙等无机物组成,具有良好的生物相容性,但是,因其操作性能较差、放置材料费时、不利于提高临床工作效率等缺点,在一定程度上限制了其在临床上的使用。近年来,临床上又出现了多种可用于髓腔穿孔修复的新材料,如 BioAggregate(BA)[13]、iRoot BP等[14]。BA在MTA基础上合成,主要含有硅酸三钙、硅酸二钙、氢氧化钙等无机物,与MTA相似。BA中不含有铝元素,可进一步降低对人体的毒害,对人牙周膜成纤维细胞的毒性较MTA低[15],具有良好的生物相容性。BA与MTA都能诱导细胞碱性磷酸酶及骨钙素的表达,具有相似的生物活性,但BA的黏结性差于MTA。生物陶瓷材料iRoot BP具有良好的生物相容性,化学性能稳定,易于操作,且微渗漏小于MTA,具有良好的封闭效果,但是其对细胞的分化及成骨性能的影响还有待研究。目前尚缺乏临床髓腔穿孔修复材料修复后长期的效果评价,如材料的封闭能力如何,是否会发生微生物再感染,牙齿强度及抗折性能如何等等。
本结果显示,MTA对人牙周膜成纤维细胞形态的影响最小,最易于细胞黏附,同时具有良好的生物相容性,是目前修复髓腔穿孔材料的较好选择。
[1]樊明文.牙体牙髓病学[M].北京:人民卫生出版社,2001:279-280.
[2]Chandra IK.Textbook of Endodontics[M].2rd ed.India:Jaypee Brothers,2003:290-291.
[3]Souza NJ,Justo GZ,Oliveira CR,et al.Cytotoxicity of materials used in perforation repair tested using the V79 fibroblast cell line and the granulocyte-macrophage progenitor cells[J].Int Endod J,2006,39(1):40-47.
[4]Lee SJ,Mansef M,Torabinejad M.Sealing ability of a mineral trioxide aggregate for repair of lateral root perforation [J].J Endod,1993,19(11):541-544.
[5]汪莉,尹仕海,钟素兰,等.3种髓腔穿孔修复材料对人牙周膜成纤维细胞毒性的体外研究[J].华西口腔医学杂志,2009,27(5):479-482.
[6]Zhu Q,Safavi KE,Spanqberq LS,et al.Cytotoxicity evaluation of root-end filling materials in cultures of human osteoblast-like cells and periodontal ligament cells[J].J Endod,1999,25(6):410-412.
[7]Balto HA.Attachment and morphological behavior of human periodontal ligament fibroblasts to mineral trioxide aggregate:a scanning electron microscope study [J].J Endod,2004,30(1):25-29.
[8]Camilleri J,Montesin FE,Papaioannou F,et al.Biocompatibility of two commercial forms of mineral trioxide aggregate[J].Int Endod,2004,37(6):699-704.
[9]Zmener O,Cabrini RL.Adhesion of human blood monocytes and lymphocytes to different endodontic cements:a methodological in vitro study[J].J Enodon,1986,4(2):150-155.
[10]Thomson TS,Janice E,Berry BS,et al.Cementoblasts maintain expression of osteocalcin in the presence of mineral trioxide aggregate[J].J Endod,2003,29(6):407-412.
[11]Mitchell PJ,Pitt Ford TR,Torabinejad M,et al.Osteoblast biocompatibility of mineral trioxide aggregate[J].Biomaterials,1999,20(2):167-173.
[12]Bartold PM,McCulloch CA,Narayanan AS,et al.Tissue engineering:a new paradigm for periodontal regeneration based on molecular and cell biology[J].Periodontal,2000,24:253-269.
[13]曾畅.新型材料BioAggregate的研究进展[J].牙体牙髓牙周病学杂志,2014,24(10):611-614.
[14]王密,尹世海,王奇,等.iRoot BP等修复磨牙髓室底穿孔的研究[J].华西口腔医学杂志,2013,31(3):257-259.
[15]Yan P,Yuan Z,Peng B,et al.Effect of bioaggregate on differentiation of human periodontal ligament fibroblasts[J].Int Endod J,2010,43(12):1116-1121.
