苯妥英钠对内毒素作用下人牙周膜成纤维细胞增殖和表达TNF-α的影响
2015-09-20余方方
余方方,叶 新,陈 栋,范 云,李 玮
(河南郑州:1.郑州大学口腔医学院,450052;2.郑州颐和医院口腔科,450008)
苯妥英钠(Phenytoin,PHT)是传统的抗癫痫药物,因发现其有导致牙龈增生的不良反应,一直进行其对创面愈合促进作用的实验及临床研究。抗感染和创面愈合相辅相成,都是创面治疗要解决的关键问题。研究表明,苯妥英钠对体外培养的人牙周膜成纤维细胞的增殖有促进作用[1]。PHT局部用药在创伤愈合中的积极作用也被许多临床病例所验证,例如糖尿病足溃疡、创伤、褥疮性溃疡、静脉淤积性溃疡等[2]。类毒素(lipopolysaccharide,LPS)是牙周病的主要致病物质,能抑制牙周膜成纤维细胞增殖,诱导牙周膜成纤维细胞分泌IL-6、TNF-α等炎性因子[3-4]。本实验通过观察PTH对LPS作用下人牙周膜成纤维细胞(hPDLFs)增殖和表达TNF-α的影响,以探讨其对牙周炎症的作用。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清(杭州四季青);DMEM培养基(Hyclone,美国);PHT(阿拉丁,上海晶纯);E.coli LPS、MTT(北京鼎国昌盛生物技术有限公司);鼠抗人波形丝蛋白单克隆抗体、鼠抗人角蛋白单克隆抗体(北京中杉金桥);TNF-α单克隆抗体(武汉博士德);SP免疫组化染色试剂盒、DAB显色试剂盒(北京博奥森);倒置相差显微镜(OLYMPUS,日本);酶标仪(BIO-RAD,美国)。
1.2 hPDLFs的培养和鉴定
牙周膜组织取材于河南省口腔医院收治的12~18岁因正畸需要而拔除的牙周健康、无龋损的新鲜前磨牙(均知情同意),并采用酶消化组织块法原代培养hPDLFs;待细胞铺满培养瓶底80%后,常规传代培养。培养至第3代时,用免疫细胞化学SP法进行波形丝蛋白和角蛋白单克隆抗体染色,确定其为中胚层间充质来源的细胞后,取第5代细胞用于实验。
1.3 LPS溶液和PHT溶液的配制
PHT溶液的配制:将0.125 g分析纯苯妥英钠溶于50 mL含20 mL/L FBS的DMEM培养基中,制成浓度为2 500 mg/L的储存液,经0.22 μm的滤膜过滤除菌后,再用含20 mL/L FBS的DMEM培养基稀释成5、20 mg/L浓度,4℃保存备用。LPS溶液配制:取 10 mg LPS溶于 50 mL含20 mL/L FBS的 DMEM培养基中,制成为200 mg/L的储存液。经0.22 μm滤膜过滤除菌后,再用含20 mL/L FBS的DMEM培养基稀释成100 mg/L,4℃保存备用。
1.4 MTT法检测细胞增殖
取生长状态良好的第5代hPDLFs,以1×104/孔接种于96孔板(每孔100 μL),常规条件下培养24 h至细胞贴壁后吸弃原培养液和未贴壁细胞,并将细胞随机分为6组(每组复6孔):正常对照组(含 20 mL/L FBS的 DMEM培养基基)、100 mg/L LPS组、5 mg/L PHT组、20 mg/L PHT组、100 mg/L LPS+5 mg/L PHT组、100 mg/L LPS+20 mg/L PHT;然后按上述分组分别加入含不同药物的培养基继续培养。培养24 h后每孔加入20 μL MTT继续培养4 h,并用倒置显微镜观察结晶形成情况;然后小心吸弃孔内上清液,并于每孔中各加入150 μL DMSO,置于恒温振荡器上震荡10 min后,用酶标仪测定各孔的吸光度值(A值)。
1.5 TNF-α的免疫细胞化学SP法检测
取生长状态良好的第5代细胞以1×105/mL接种于4块有盖玻片的6孔板,常规条件下培养24 h至细胞贴壁后吸弃原培养液和未贴壁细胞,并将细胞随机分为4组:正常对照组、20 mg/L PHT组、100 mg/L LPS组、100 mg/L LPS+20 mg/L PHT组(每组复6孔);然后按上述分别加入相应的含不同药物的培养基继续培养。培养24 h后,采用免疫细胞化学SP法检测各组细胞中TNF-α的表达情况(以PBS代替一抗作为空白对照)并拍照;然后用ImageJ软件对各组图片的灰度值进行检测,每张图片各测6个不同的区域取平均值。
1.6 统计学分析
2 结果
2.1 hPDLFs的形态学观察和免疫细胞化学鉴定
原代培养的hPDLFs呈长梭形或纺锤形,胞核圆或卵圆,胞质均匀,有2~3个细长形突起,放射状或旋涡状排列生长,呈典型的成纤维细胞样。免疫细胞化学染色显示,抗波形丝蛋白抗体呈阳性(胞质呈棕黄色),抗角蛋白抗体呈阴性(胞质不着色),证明所培养细胞属于间充质来源(图1)。
2.2 细胞增殖活性的检测结果
MTT法检测结果显示:与正常对照组相比,20 mg/L PHT可明显促进hPDLFs的增殖(P<0.05),100 mg/L LPS可明显抑制hPDLFs的增殖(P<0.05);而100 mg/L LPS+20 mg/L PHT时则可明显逆转LPS对hPDLFs增殖的抑制作用(P<0.05);5 mg/L PHT组分别与正常对照组和20 mg/L PHT组相比差异均无统计学意义(P>0.05);100 mg/L LPS+5 mg/L PHT组与单纯100 mg/L LPS组相比差异亦无统计学意义(P>0.05)(表1)。
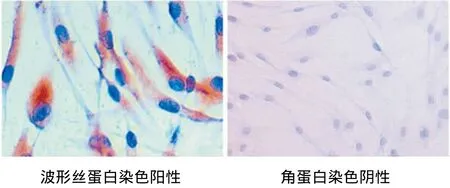
图1 hPDLFs的鉴定结果(SP,×400)
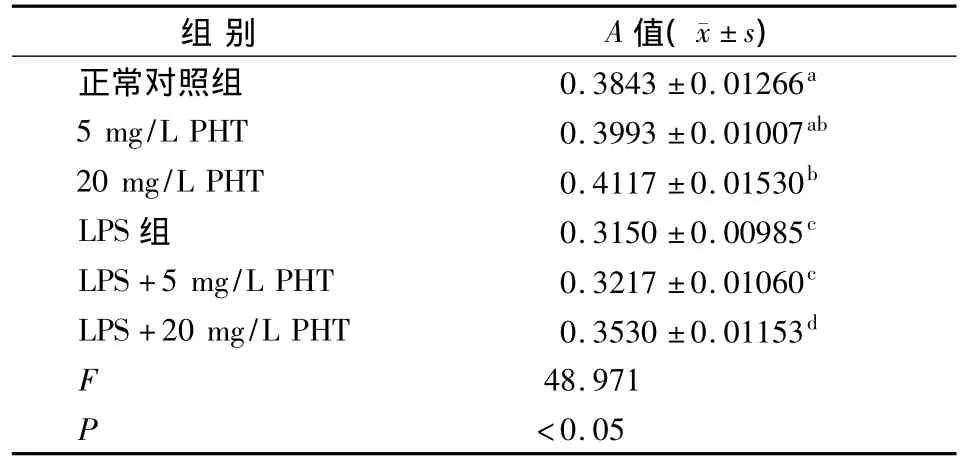
表1 不同浓度PHT对LPS作用下hPDLFs增殖活性的影响 (n=6)
2.3 TNF-α的免疫细胞化学法检测
各组hPDLFs中TNF-a的免疫细胞化学染色结果均表现为胞质内棕黄色着色,胞核无着色,但不同药物组的染色强度不尽相同:正常对照组和20 mg/L PHT组的细胞质呈浅黄色,100 mg/L LPS组和100 mg/L LPS+20 mg/L PHT组的细胞质呈深棕色。采用Imaget图像分析软件对各组的灰度值进行分析显示,灰度值由高到低依次为:20 mg/L PHT组>正常对照组>100 mg/L LPS+20 mg/L PHT组>100 mg/L LPS组;各组间两两相比差异均有统计学意义(P<0.05)。灰度值越大,说明其TNF-α蛋白的表达程度越弱;灰度值越小,说明其TNF-α蛋白的表达程度越强(表2,图2)。
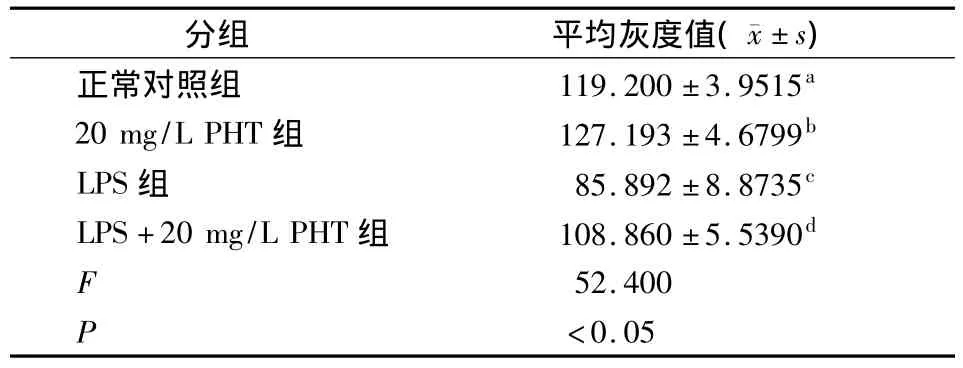
表2 不同浓度PHT对LPS作用下hPDLFs中TNF-α表达的影响 (n=6)
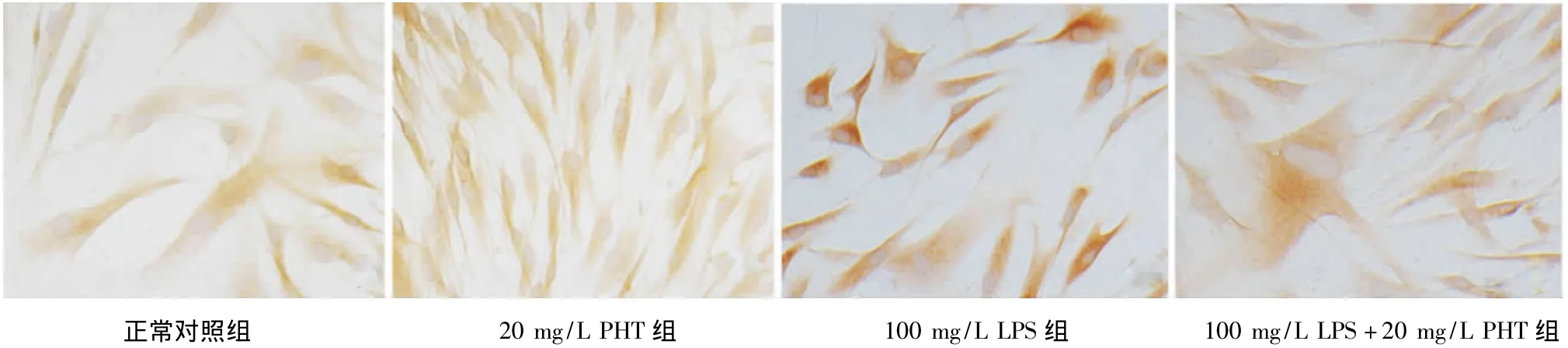
图2 各组hPDLFs中TNF-α的表达(SP,×400)
3 讨论
LPS是G-厌氧菌所独有的一种致病物质,具有高度生物学活性和免疫学特性,对牙周组织具有很强的毒性和抗原作用。高浓度LPS能够损伤牙周膜细胞超微结构,抑制成纤维细胞的生长和增殖[5]。张 凤 秋 等[3-4]研 究 表 明,LPS 浓 度 为10 mg/L、100 mg/L时可明显抑制牙周膜细胞的生长,并刺激牙周膜细胞分泌TNF-α;100 mg/L的LPS作用于牙周膜细胞24 h即可明显抑制牙周膜细胞增殖,有效刺激牙周膜细胞分泌TNF-α。鉴于各种不同种属G-菌的主要活性成分类脂A极为相似,故本实验选用具有代表性的大肠杆菌LPS用于实验,并以100 mg/L的浓度作用24 h。
TNF-α是成纤维细胞、淋巴细胞和单核细胞等产生的一种具有广泛生物学作用的多功能细胞因子,在复杂的细胞因子网络中起关键作用。张凤秋等[4]研究发现,人PDLC在受到LPS刺激时能分泌IL-6、IL-1β、IL-8和TNF-α等炎症因子。其中TNF-α与牙槽骨吸收密切相关,因此,抑制TNF-α的分泌对牙周炎的防治具有重要意义。
Shapiro等[6](1958)临床试验发现,口服 PHT的牙周病患者接受牙周手术后,其手术创口很少有炎症和疼痛感,且愈合速度较对照组明显加快,说明PHT有明显的促愈合作用。有学者认为,PHT促进创面愈合的机制可能与其刺激成纤维细胞增殖、加快创面肉芽组织形成、减少胶原酶活性、减轻创面的细菌感染有关[7]。
Craner等[8]报道,PHT可以减轻小鼠的实验性自身免疫性脑脊髓炎的炎症反应。Serra等[9]通过检测PHT及其代谢产物对LPS激发巨噬细胞产生MMP、TIMP、TNF-α、IL-6的影响时发现,PHT 及其代谢产物5-(p-hydroxyphenyl-)、5-phenylhydantoin(HPPH)均可阻止炎性介质的产生,说明PHT具有抗炎作用。除此之外,于美娇、杨丕山等[1]还发现,5 ~100 mg/L PHT 可以促进 hPDLFs的增殖。故本实验选取PHT质量浓度分别为5、20 mg/L的PHT作用于 hPDLFs,以探讨其对 LPS作用下hPDLFs增殖和炎性因子TNF-α表达的影响,以期为PHT用于消除牙周炎症提供一定的实验室依据。
本实验分别采用MTT法和免疫细胞化学SP法检测PHT对LPS作用下hPDLFs增殖和TNF-α表达的影响。MTT检测结果显示:与正常对照组相比,20 mg/L的PHT可以明显促进 hPDLFs增殖,并可明显逆转LPS对 hPDLFs增殖的抑制作用。因此,选择质量浓度为20 mg/L的PHT用于后续实验。免疫细胞化学SP法检测结果显示:20 mg/L的PHT不仅具有直接抑制hPDLFs表达TNF-α的作用,还具有阻止LPS介导hPDLFs表达TNF-α的作用。
PHT不仅具有抗癫癎、抗心律失常等作用,还可以影响Na+和Ca2+的代谢。有研究发现,Na+通道与激活巨噬细胞和小神经胶质细胞相关[8]。更进一步的研究表明,Na+通道阻滞剂可以有助于调节免疫功能[10]。在小神经胶质细胞内,用PHT阻断Na+通道可以明显减少 LPS诱导的IL-1α、IL-1β和TNF-α的释放,表明Na+通道参与细胞因子的释放过程[11]。本实验也发现,一定浓度的PHT可以影响LPS作用下 hPDLFs内炎症因子TNF-α的表达,说明Na+通道阻滞剂PHT可能与细胞内炎症因子的释放有相关性。
综上所述,PHT具有促进细胞增殖和抗炎作用,但由于细胞因子之间是通过复杂的细胞网络而发挥作用的,关于PHT在牙周病治疗中的应用前景尚需继续深入的研究。
[1]于美娇,杨丕山,葛少华.苯妥英钠对人牙周膜成纤维细胞生物学活性影响的实验研究[J].华西口腔医学杂志,2008,26(2):215-217.
[2]Bhatia A,Prakash S.Topical phenytoin for wound healing[J].Dermatol Online J,2004,10(1):5.
[3]张凤秋,吴织芬,万玲,等.牙龈卟啉菌和大肠杆菌内毒素对人牙周膜细胞分泌IL-6,TNF-α的影响[J].牙体牙髓牙周病学杂志,2002,12(2):76-78.
[4]张凤秋,吴织芬,万玲,等.牙周优势菌内毒素对人牙周膜细胞增殖和碱性磷酸酶活性的影响[J].牙体牙髓牙周病学杂志,2003,13(1):27-29.
[5]Kim YS,Shin SI,Kang KL,et al.Nicotine and lipopolysaccharide stimulate the production of MMPs and prostaglandin E2 by hypoxia-inducible factor-1α up-regulation in human periodontal ligament cells[J].J Periodontal Res,2012,47(6);719-728.
[6]Shapiro M.Acceleration of gingival wound healing in non-epileptic patients receiving diphenylhydantoin sodium[J].Exp Med Surg,1958,16(1):41-53.
[7]Kaptanoglu E,Solaroglu I,Surucu HS,et al.Blockade of sodium channels by phenytoin protects ultrastructure and attenuates lipid peroxidation in experimental spinal cord injury[J].Acta Neurochir(Wien),2005,147(4):405-412.
[8]Craner MJ,Damarjian TG,Liu S,et al.Waxman SG:Sodium channels contribute microglia/macrophage activation and function in EAE and MS[J].Glia,2005,49:220-229.
[9]Serra R,Al-Saidi AG,Angelov N,et al.Suppression of LPS-induced matrix-metalloproteinase responses in macrophages exposed to pheny-toin and its metabolite,5-(p-hydroxyphenyl-),5-phenylhydantoin[J].J Inflamm,2010,48(7):469-478.
[10]Roselli F,Livrea P,Jirillo E.Voltage-gated sodium channel blockers as immunomodulators[J].Recent Pat CNS Drug Discov,2006,1(1):83-91.
[11]Black JA,Liu S,Waxman SG.Sodium channel activity modulates multiple functions in microglia[J].Glia,2009,57(10):1072-1081.
