肿瘤坏死因子-α诱导骨髓间充质干细胞凋亡作用的研究
2015-09-20张欣然张玉成郭希民郭红延
张欣然,刘 翠,朱 彪,张玉成,郭希民,郭红延
(北京:1.北京武警总医院口腔医学中心,100039;2.军事医学科学院基础医学研究所全军细胞与再生医学重点实验室,100850)
组织工程和再生医学的发展,为牙周组织的再生提供了新的思路。种子细胞是其关键因素之一,其中骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)因其具有多项分化潜能,且来源丰富、易于获得,越来越受到重视[1]。肿瘤坏死因子 -α(tumor necrosis factor-α,TNF-α)作为牙周病发病过程中造成组织破坏的主要炎症因子[2-3],可刺激成骨细胞的凋亡[4],并抑制其骨形成作用。然而TNF-α是否因为可诱导BMSCs的凋亡,从而影响其移植后的增殖及分化目前尚未见报道。本实验旨在探讨不同浓度TNF-α刺激条件下,大鼠BMSCs发生凋亡的情况及其凋亡相关蛋白Bax和Bcl-2的表达变化。
1 材料和方法
1.1 主要材料、试剂和仪器
SPF级SD大鼠(军事医学科学院实验动物中心提供);α-MEM培养基、胎牛血清(Gibco,美国);地塞米松、β-磷酸甘油、抗坏血酸、异丁基甲基黄嘌呤(IBMX)、吲哚美辛、胰岛素(西南药业公司);20 mL/L硝酸银、50 mL/L硫代硫酸钠水溶液、油红 O/异丙醇饱和液、四甲基偶氮唑蓝盐(MTT)(重庆化学试剂总厂);TNF-α(Sigma,美国);Bcl-2、Bax、β-actin 一抗(Santa Cruz,美国);辣根过氧化物酶标记的二抗(北京中杉金桥);BCA蛋白定量试剂盒、Tunel检测试剂盒(北京碧云天);PVDF膜(millipore,美国);ECL发光试剂盒(北京普利莱);电泳仪、半干转膜仪(Bio-Red,美国);倒置显微镜(Olympus,日本)。
1.2 大鼠BMSCs的培养和鉴定
1.2.1 大鼠BMSCs的分离和培养[5]
取3~4周龄雄性SD大鼠,脱颈处死后置于750 mL/L的乙醇中浸泡消毒10 min;无菌条件下分离取出股骨、胫骨,分别剪去其两端骨组织后,用α-MEM基础培养基冲出骨髓,并将其转移至含α-MEM培养液(含100 mL/L的胎牛血清以及100 U/mL青霉素、链霉素)的培养皿中;反复吹打至无肉眼可见的细胞团块后,置于37℃、50 mL/L CO2培养箱中培养。第3天首次换液,而后每两天半量换液,并用倒置显微镜观察细胞形态及生长情况。待细胞生长达80% ~90%融合时,吸弃培养基,PBS冲洗2次后,用2.5 g/L胰酶消化3 min;加入等体积α-MEM培养液终止消化后,按1∶2的比例进行传代,传至第3代时即可得到较纯的大鼠BMSCs。
1.2.2 大鼠BMSCs的鉴定
取生长状态良好的第3代BMSCs分别向成骨细胞和成脂肪细胞诱导分化[6],并进行染色鉴定[7]。成骨诱导:常规条件下培养至细胞贴壁达70%以上时,换用成骨诱导液(含0.1 μmol/L地塞米松,10 mmol/L β-磷酸甘油、50 mg/L抗坏血酸、100 mL/L FBS的α-MEM)进行诱导培养,每3 d换液1次。诱导培养14 d后行碱性磷酸酶染色,诱导培养21 d后行茜素红染色,并分别在倒置显微镜下进行观察和拍照。成脂诱导:常规条件下培养至细胞贴壁达70%以上时,换用成脂诱导液(含 0.25 μmol/L 地塞米松、50 μmol/L 吲哚美辛、0.5 mmol/L IBMX、10 mg/L 胰岛素、100 mL/L FBS的α-MEM)进行诱导培养,每3 d换液1次,诱导培养14 d后行油红O染色,倒置显微镜下观察脂滴形成情况并拍照。
1.3 TNF-α诱导BMSCs凋亡的实验观察
1.3.1 实验分组和处理
取第3代BMSCs传代后以1×105/mL的密度接种于置有盖玻片的6孔板中,常规条件下培养至细胞铺满孔底70% ~80%时,弃原培养液,并将细胞随机分为 A、B、C 3组;分别加入含鼠源性TNF-α 终浓度为 0 μg/L(A 组)、20 μg/L(B 组)、40 μg/L(C组)的α-MEM继续培养。培养24 h后,胰酶消化并收集各组细胞,分别进行以下检测。
1.3.2 细胞活性检测
取上述培养24 h后的各组细胞,用4 mL/L台盼蓝进行染色(9滴细胞悬液加1滴台盼蓝)后,用细胞计数仪分别计各组的活细胞数(未着色细胞)和死细胞数(着色细胞),并按以下公式计算各组细胞活力。

1.3.3 Tunel染色观察
取上述培养24 h后的各组细胞,用PBS洗涤2次后每孔中各加入2 mL 40 g/L的多聚甲醛,室温下固定30 min;PBS洗涤3次(每次3 min),用1 g/L的Triton-X100处理细胞,并进行Tunel标记;PBS冲洗2次后,每孔滴加50 μL/L Tunel反应混合液,37℃避光孵育1 h;PBS洗涤3次,用抗荧光猝灭封片液封片后荧光显微镜下观察并拍照。染色后呈红色荧光者为阳性细胞,即凋亡细胞,分别计数各组的凋亡细胞数和总细胞数,并按以下公式计算其凋亡指数。

1.3.4 Western blot检测Bcl-2、Bax的蛋白表达水平
取上述培养24 h后的各组细胞,PBS冲洗两遍后,每孔中各加入150 μL浓度为 10 mL/L的PMSF的细胞裂解液裂解细胞,并提取总蛋白。用BCA试剂盒对各组总蛋白进行定量检测后,取等量样品以120 mL/L十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质。电泳结束后将蛋白转移至PVDF膜上,用50 g/L的脱脂奶粉室温封闭2 h,分别滴加Bcl-2,Bax,β-actin一抗封闭过夜后,再以辣根过氧化酶标记的二抗封闭2 h;ECL发光试剂盒显色,扫描并分析实验结果。
1.4 统计学分析
2 结果
2.1 BMSCs细胞培养和鉴定
倒置显微镜观察可见,原代培养的大鼠BMSCs呈梭形或不规则的多边形,可贴壁生长,并有若干集落形成(生长形态类似于旋涡状)。第3代BMSCs经成骨诱导14、21 d后,分别进行碱性磷酸酶染色及茜素红染色,其结果均为阳性(图1a、b);经成脂诱导14 d后,可见脂滴形成(图1c),油红O染色结果为阳性(图1d)。

图1 BMSCs成骨、成脂诱导分化鉴定结果(×100)
2.2 细胞活性检测结果
台盼蓝可穿透变性的细胞膜,并通过与解体的DNA结合而使其着色(蓝染);而活细胞因能阻止台盼蓝进入细胞内,故不着色。本实验结果显示,20、40 μg/L的 TNF-α 均能明显降低 BMSCs的细胞活性,分别与0 μg/L相比,差异均有统计学意义(P<0.05);其中以40 μg/L组的细胞活性降低最明显,与20 μg/L组相比,差异亦有统计学意义(P<0.05)(图2)。
2.3 Tunel染色观察结果
荧光显微镜下可见,凋亡细胞呈红色荧光,并随着TNF-α浓度的升高,红色荧光率逐渐增加(图3)。各组细胞的凋亡率以40 μg/L组最高,0 μg/L组最低,各组间两两相比,差异均有统计学意义(P<0.05)(图4)。

图2 不同浓度TNF-α对BMSCs细胞活力影响的比较

图3 各组BMSCs经Tunel染色后荧光显微镜观察(箭头示凋亡细胞)(×200)
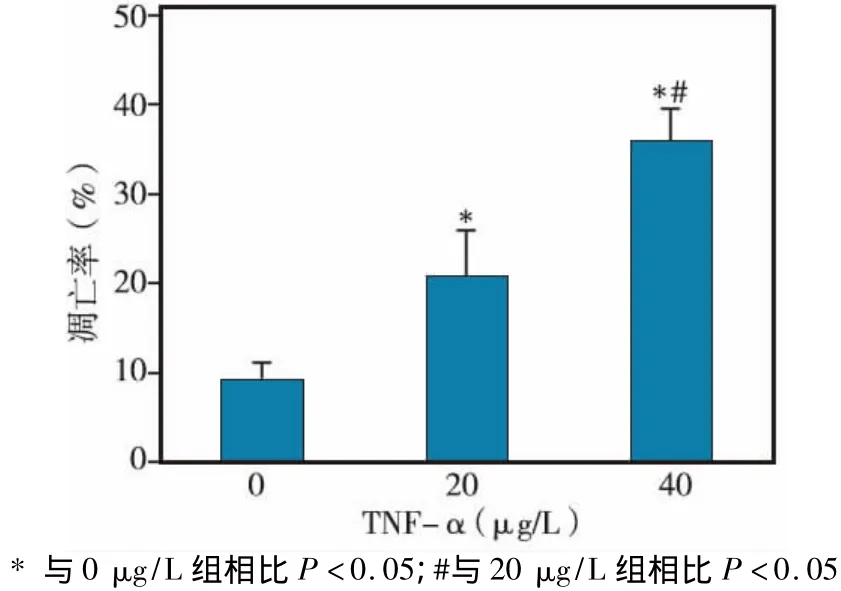
图4 各组BMSCs的凋亡率比较
2.4 各组BMSCs中Bcl-2、Bax的蛋白表达变化
Western Blot结果显示,随TNF-α浓度的升高,BMSCs中的Bax蛋白表达量逐渐增加,Bcl-2蛋白表达逐渐减少;各组间两两相比,差异均有统计学意义(P<0.05)(图5~6)。

图5 蛋白印迹法检测结果

图6 各组BMSCs中Bax、Bcl-2蛋白相对表达的比较
3 讨论
当下,组织工程与再生医学发展迅速,基于间充质干细胞(mesenchymal stem cells,MSCs)的多项分化潜能,各种组织来源的MSCs都可以作为组织工程的种子细胞[8];特别是骨髓来源的 MSCs,因其来源丰富、取材简单、分化潜能好,且具有较好的免疫原性,临床应用前景非常广阔[9]。在牙周组织再生的过程中,BMSCs位于其特定的微环境中,这种微环境可能会影响细胞的存活,从而使细胞治疗的效果大大降低并限制其应用。
牙周病是造成牙周组织破坏的主要疾病,而TNF-α则是牙周病发生过程中重要的介导因子。TNF-α可通过刺激其他炎症介质和黏附分子、趋化因子的产生,促进IL-6、前列腺素E、胶原酶等的合成,从而促进结缔组织的破坏[10],促进破骨细胞的活性、抑制成骨细胞活性、促进成骨细胞凋亡,最终促进骨吸收[4]。研究发现,在牙周病患者的龈沟液及牙龈组织中存在着大量的TNF-α,移植后的BMSCs处于此种微环境中,其活性可能也会受到影响。鉴于此,本实验通过体外研究不同浓度的TNF-α对BMSCs的活性、凋亡状况的影响及其凋亡过程中凋亡相关基因的表达变化,为日后BMSCs在牙周组织再生中的更好应用提供理论基础。
本实验培养的大鼠BMSCs经成骨、成脂鉴定,结合其形态学观察和贴壁生长特性[11],均提示其具有较高的纯度和多项分化潜能。以 0、20、40 μg/L的TNF-α分别作用于大鼠BMSCs 24 h后,台盼蓝染色和Tunel染色结果显示,随着TNF-α浓度的增加,BMSCs的活性逐渐下降、凋亡率逐渐增加,说明该实验浓度范围内的TNF-α均可诱导BMSCs的凋亡。
细胞凋亡的发生是一个多因素参与的复杂过程,各种凋亡刺激因素均可通过外源性的途径与细胞表面的凋亡受体结合,或通过内源性途径使线粒体释放氧自由基,从而引起细胞凋亡[12]。Bcl-2主要通过抑制线粒体释放促凋亡蛋白,而抑制细胞凋亡、延长细胞的寿命[13];在细胞接受凋亡刺激后,Bcl-2可通过调节线粒体膜的通透性转换孔来改变线粒体膜的通透性,并阻止Cyt-c的释放,从而发挥其抗凋亡的作用[14]。Bax是Bcl-2家族中促进细胞凋亡的成员,当细胞接受凋亡刺激时,Bax从胞液迁移到线粒体膜和核膜上,并在线粒体外膜上形成通道介导Cyt-c的释放,从而启动细胞凋亡[15]。Western blot检测结果显示,随 TNF-α 浓度的增加,抗凋亡基因Bcl-2的蛋白表达量逐渐下降,Bax的蛋白表达量逐渐上升,且细胞凋亡增加。以上结果提示,TNF-α引起的细胞凋亡与Bcl-2表达量降低和Bax表达增高有关。
在牙周病的治疗中,BMSCs的再生能力虽为其开辟了新的途径,但由于上述组织破坏中会产生包括TNF-α在内的大量炎性因子,从而会造成移植细胞的凋亡,并阻止其增殖分化,最终影响组织的再生。因此,要实现牙周组织的成功再生,必须阻止这些炎性分子的作用,从而提高BMSCs用于移植时的细胞存活率。
[1]Liu Y,Wang L,Kikuiri T,et al.Mesenchymal stem cell-based tissue regeneration is governed by recipient T lymphocytes via IFN-gamma and TNF-alpha [J].Nat Med,2011,17(12):1594-1601.
[2]Gumus P,Nizam N,Lappin DF,et al.Saliva and serum levels of B-cell activating factors and tumor necrosis factor-alpha in patients with periodontitis[J].J Periodontol,2014,85(2):270-280.
[3]Bastos MF,Lima JA,Vieira PM,et al.TNF-alpha and IL-4 levels in generalized aggressive periodontitis subjects[J].Oral Dis,2009,15(1):82-87.
[4]Hill PA,Tumber A,Meikle MC.Extracellular signals promote osteoblast survival and apoptosis [J].Endocrinol,1997,138(9):3849-3858.
[5]Yang Y,Tao C,Zhao D,et al.EMF acts on rat bone marrow mesenchymal stem cells to promote differentiation to osteoblasts and to inhibit differentiation to adipocytes[J].Bioelectromagetics,2010,31(4):277-285.
[6]Shibata T,Naruse K,Kamiya H,et al.Transplantation of bone marrow-derived mesenchymal stem cells improves diabetic polyneuropathy in rats[J].Diabetes,2008,57(11):3099-3107.
[7]Rajalin AM,Pollock H,Aarnisalo P.ERR-alpha regulates osteoblastic and adipogenic differentiation of mouse bone marrow mesenchumal stem cells[J].Biochem Biophys Res Commun,2010,396(2):477-482.
[8]Lee SK,Kim Y,Kim SS,et al.Differential expression of cell surface proteins in human bone marrow mesenchymal stem cells cultured with or without basic fibroblast growth factor containing medium [J].Proteomics,2009,9(18):4389-4405.
[9]Bianco P,Robey PG,Simmons PJ.Mesenchymal stem cells:revisiting history,concepts,and assays[J].Stem Cell,2008,2(4):313-319.
[10]Izawa A,Ishihara Y,Mizutani H,et al.Inflammatory bone loss in experimental periodontitis induced by Aggregatibacter actinomycetemcomitans in interleukin-1 receptor antagonist knockout mice[J].Infect Immun,2014,82(5):1904-1913.
[11]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[12]Hua P,Liu LB,Liu JL,et al.Inhibition of apoptosis by knockdown of caspase-3 with siRNA in rat bone marrow mesenchymal stem cells[J].Exp Biol Med,2013,238(9):991-998.
[13]Di Paola R,Mazzon E,Crisafulli C,et al.Effects of etanercept,a tumour necrosis factor-alpha antagonist,in an experimental model of periodontitis in rats [J].Br J Pharmacol,2007,15(3):286-297.
[14]Kang J,de Brito Bezerra B,Pacios S,et al.Aggregatibacter actinomycetemcomitans infection enhances apoptosis in vivo through a caspase-3-dependent mechanism in experimental periodontitis[J].Infect Immun,2012,80(6):2247-2256.
[15]Degenhardt K,Sundararajan R,Lindsten T,et al.Bax and Bak indenpendently promote cytochrome C release from mitochondria[J].J Biol Chem,2002,277(16):14127-14134.
