直接与间接接触共培养对诱导骨髓间充质干细胞向心肌样细胞分化的影响
2015-09-12谢盈彧方子寒张梦迪范英昌天津中医药大学天津30093
谢盈彧 曹 杨 方子寒 张梦迪 薛 亮 范英昌 (天津中医药大学,天津 30093)
骨髓间充质干细胞(BMSCs)是一类存在于骨髓中的具有多种分化潜能的非造血多能干细胞,在不同的诱导条件下,BMSCs可以分化为心肌细胞、成骨细胞、软骨细胞、脂肪细胞以及神经细胞等多种类型的组织细胞〔1,2〕,因其容易获得,不存在免疫排斥等优点而被看作组织工程的“种子细胞”〔3〕。研究提示微环境在诱导BMSCs向心肌细胞分化中的重要作用,其中采用的共培养技术提供了一个非常好的研究影响细胞生长和分化的各种体内因素的模型〔4〕。本实验以大鼠BMSCs与新生大鼠心肌细胞共培养模拟心肌内环境,研究心肌直接接触、transwell小室建立的间接接触培养对BMSCs分化的影响,获取BMSCs向心肌细胞分化的最佳条件。
1 材料与方法
1.1 实验动物、仪器及试剂 清洁级Wistar雄性大鼠,(200±20)g,中国医学科学院放射医学研究所实验动物中心,动物许可证号:scxk2005-0001)5%二氧化碳(CO2)恒温培养箱(Thermo);倒置相差显微镜(XD-10198010);凝胶图像分析仪(Pramega公司);PCR仪为PE29600DNA热循环仪(Perkin2ElmerCetus)。L-DMEM培养基(美国GIBCO公司);特级胎牛血清(FBS,美国Hyclone公司);胰蛋白酶(1∶250,美国Hyclone公司);Percoll(Parmacia);乙二胺四乙酸(EDTA,天象人生物技术研究所 );青、链霉素(Hyclone);D-Hank液(南京化学试剂厂);CD44兔多克隆抗体(HCAM),CD34兔多克隆抗体(Rabbit Anti-CD34),即用型SABC免疫组化染色试剂盒,DAB显色试剂盒AR1025,均由武汉博士德生物工程有限公司提供;磷酸盐缓冲液(PBS),95%乙醇,Triton-X-100(AMRESCO),山羊血清,兔抗大鼠心肌肌钙蛋白T(cTnT)单克隆抗体,FITC标记的山羊抗兔IgG;PCR引物(Takara公司),Cpn PCR试剂盒(批号980316,广东老年医学研究所中心实验室)。
1.2 BMSCs的分离与培养 采用贴壁培养和密度梯度离心结合法,取雄性Wistar大鼠,颈椎脱臼处死,无菌条件下取双侧股骨、胫骨,适量D-Hank液冲洗骨髓,100目筛网过滤,采用Percoll分离液(密度1.073 g/ml),行密度梯度离心法分离骨髓单个核细胞,用L-DMEM离心洗涤2次(800 r/min,5 min)。以3.0×105个/cm2的密度接种于完全培养液,置于37℃、5%CO2饱和湿度的培养箱中继续培养,48 h后首次换液,以后每3天更换一次培养液。2 w后,细胞80%长满瓶底。待细胞融合至80%~90%,加入0.25%的胰蛋白酶和0.02%的EDTA消化细胞,按1∶3传代接种于75 cm2培养瓶内,待细胞铺满瓶底后依上法传代。
1.3 BMSCs的鉴定与标记 选用第三代MSCs,用链霉亲和素-生物素-过氧化物酶复合物(SABC)法检测细胞表面抗原CD44和CD34。将第5~6代的 MSCs用4,6-二脒基-2-苯基吲哚(DAPI)(1 μg/ml)标记2 h,用D-Hank液漂洗10次后,在荧光显微镜下用紫外光激发(激发波长340~380 nm),观察标记效果。
1.4 心肌细胞的分离与培养 于无菌操作下,开胸取出雄性Wistar大鼠心脏(留心尖部),于4℃的D-Hank液中漂洗3~4次,将心尖部组织剪成1 mm3碎块,加入4 ml的0.0625%胰蛋白酶液,于37℃恒温水浴箱中消化3 min,弃上清。向剩余沉淀中加入混合消化液5 ml(0.0625%胰蛋白酶+0.1%Ⅱ型胶原酶),置37℃水浴消化8~10 min,其间振荡2~3次,静置后将上清液移入离心管中,加含10%胎牛血清预冷的DMEM/F12培养液终止消化。重复上述方法消化7~8次,至组织块基本消化完毕。收集各次上清液并终止消化后,用200目的尼龙网筛过滤去除残留组织块,以1000 r/min速度离心8 min,将所得的细胞与培养液混悬后,采用差速贴壁分离法去除心肌成纤维细胞每次2 h,吸出心肌细胞悬液,调整细胞密度接种于培养板中。培养前3 d加入0.1 mmol/L BrdU抑制成纤维细胞生长。48 h首次换液,以后根据情况2~3 d换液。
1.5 实验分组 直接接触共培养组:把心肌细胞和DAPIMSCs以40∶1比例混合后,按适当密度接种于含胎牛血清的DMEM培养液的培养板内。间接接触共培养组:应用transwell培养板建立细胞间接共培养体系,上层接种原代培养的心肌细胞心肌细胞,下层接种DAPI-MSCs。两种细胞以与直接接触共培养组相同密度加入此体系中培养。两组间分开培养,待各自贴壁后更换新的含血清DMEM培养基置于37℃,5%CO2及饱和湿度的培养箱中进行间接接触共培养。
1.6 测定指标
1.6.1 免疫荧光检测 培养2 w后将培养板底部的盖玻片取出,PBS清洗,用95%的乙醇固定20 min,PBS清洗3次后,0.3%Triton室温下细胞膜打孔20 min,用山羊血清封闭,滴加一抗(兔抗大鼠心肌肌钙蛋白T单克隆抗体),4℃过夜后,滴加二抗(FITC标记的山羊抗兔IgG)于室温1~3 h行TroponinT免疫荧光染色,以检测BMSCs分化为心肌样细胞时cTnT在胞质中的表达。采用免疫荧光双染色技术MSCs的细胞核经DAPI标记后的MSCs在紫外光激发下胞核呈蓝色荧光,用共聚焦显微镜将“DAPI”与“FTIC”图像合成。若观察到双阳性细胞即胞核呈蓝色荧光、胞质呈绿色荧光,则提示BMSCs向CM发生了定向分化。
1.6.2 心肌细胞转化率计算 观察干预后MSCs的定向诱导情况,用免疫荧光方法标记cTnT。倒置相差显微镜,视野(×200)随机取4个视野,直接接触组计算cTnT绿色荧光蛋白双阳性细胞数占绿色荧光蛋白阳性的比例;间接接触组计算cTnT阳性细胞数占总细胞数的比率。
1.6.3实时荧光定量(RT-PCR)检测细胞cTnTmRNA表达采用Trizol试剂提取细胞总RNA测定OD值,计算总RNA纯度,按RT-PCR试剂盒进行逆转录制备cDNA。反转录反应条件:70℃5min,42℃60min,70℃10min,终止反应。反应参数为94℃30s,60℃30s,72℃30s,共32个循环后,再于72℃延伸7min。cTnT上游引物:5'-GGCAGCGGAAGAGGATGCTGAA-3';下游引物:5'-GAGGCACCAAGTTGGGCATGAACGA-3';GAPDH上游引物:5'GTCTTCTGAGTGGCAGTGAT-3';下游引物:5'-TGCTGAGTATGTCGTGGAG-3'。β-actin反应条件为:94℃5min预变性后,94℃30s,55℃30s,72℃30s,共28个循环后,再于72℃延伸7min。总反应体系为50μl,包括cDNA3μl,1mmol/LdNTPs10μl,10×Taq聚合酶缓冲液5μl,目的基因和β-actin上下游引物各2μl(10pmol/L),Mg2+3μl,去离子水24μl,Taq酶1μl。所得CT值经转换后以2-△△CT相对定量法获得每个样本各目的基因相对表达量数值。
1.7 统计学方法 采用SPSS11.5软件进行单因素方差分析,两者比较方差齐者采用LSD检验,方差不齐者采用Dunnett T3检验。
2 结果
2.1 BMSCs的形态学观察及鉴定 BMSCs原代培养24 h后出现贴壁细胞,呈纺锤状的成纤维细胞样外观。3 d后,细始呈集落样生长,增殖明显,呈现多种形态,主要为成纤维细胞样,细胞呈梭形或星形,体积较小,随着继续培养,细胞体积增大,约14 d后可铺满瓶底。经传代的BMSCs在24 h内完全贴壁,呈长梭形;3 d后,细胞体积较原代细胞明显增大,多呈扁平状、多角形,胞核清晰呈卵圆形,可见较多双核细胞存在,提示细胞处于分裂状态。7 d后细胞基本铺满瓶底,细胞间隙变小,细胞排列无明显方向性。随着传代,细胞得到纯化,梭形细胞达到95%以上(图1)。经DAPI标记后,细胞核在荧光激发下通过显微镜观察发蓝光,计数细胞阳性率为100%。BMSCs免疫细胞化学染色结果显示CD44呈阳性表达,CD34呈阴性表达,阳性细胞胞质内含棕黄色、颗粒状物质(图2)。
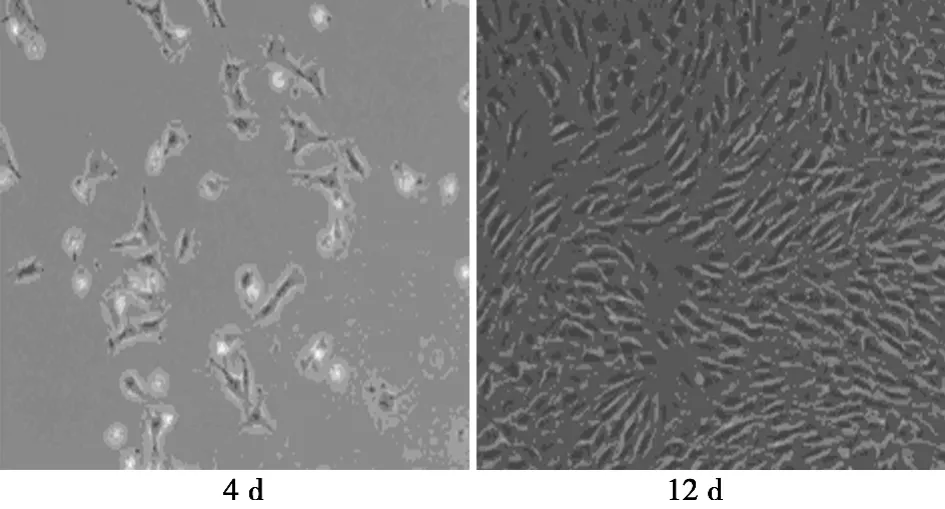
图1 BMSCs原代培养形态学观察(×100)
2.2 心肌细胞的形态学观察及鉴定 刚分离的心肌细胞呈圆形,培养2 h后成纤维细胞基本完全贴壁,而少数心肌细胞8 h左右开始贴壁,少数贴壁的单个心肌细胞出现了自发性搏动,搏动的频率、节律各不同。24 h后搏动的心肌细胞百分率大约为50%,搏动频率较分散,约30~50次/min。至48 h视野下细胞呈梭形,板形,三角形或扁平不规则形,折光度较高,细胞中隐约可见细胞核,搏动的心肌细胞百分率大于90%,搏动频率多集中在50~80次/min,72 h后细胞充分铺展,贴壁牢固,少数局部呈均一搏动频率,可达80~100次/min(图3)。在免疫荧光染色时一抗选用羊抗大鼠心肌特异性cTnT的单克隆抗体,二抗选用FITC标记的山羊抗小鼠IgG,观察到心肌细胞中胞质呈绿色荧光,即显示心肌cTnT在胞质中已表达(图3)。
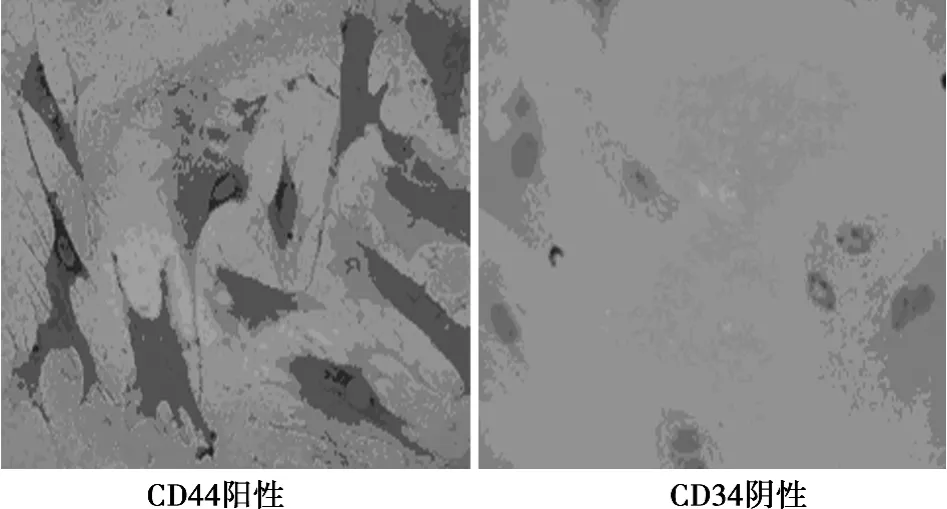
图2 BMSCs CD34、CD44表达(×400)
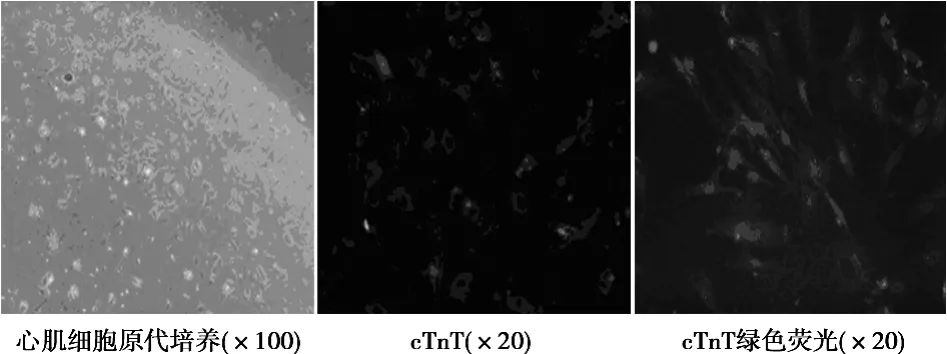
图3 心肌细胞形态学观察及鉴定
2.3 共培养后BMSCs形态学观察 BMSCs与心肌细胞直接接触共培养后,形态发生明显变化,倒置相差显微镜下观察可见与心肌细胞直接接触的梭形BMSCs逐渐缩短,胞体稍增粗。BMSCs与心肌细胞间接接触共培养后,BMSCs体积增大,梭形形态逐渐变短变粗,近似棒状或椭圆形,细胞之间彼此靠近并出现连接,排列方向趋于一致。
2.4 共培养后BMSCs免疫荧光检测及分化率计算 BMSCs分化为心肌样细胞时心肌cTnT免疫荧光染色呈阳性,细胞分化率分析显示,直接接触共培养组与间接接触共培养组中cTnT均表达,直接接触共培养组分化率为22.42%±9.97%,间接接触组分化率为4.81%±2.52%,其中间接接触共培养组的分化率明显低于直接接触共培养组。RT-PCR检测细胞cTnT mRNA的表达,OD260/OD280比值在1.8~2.0范围内,RNA纯度较高。观察电泳结果出现28S、18S和5S三条带,确定RNA有较好的完整性。
3 讨论
BMSCs以强大的自我更新能力和分化潜能成为多系统疾病细胞替代治疗研究热点,成为心肌梗死治疗较为理想的细胞来源,为进行细胞移植治疗心肌梗死疾病开辟全新的治疗策略。以往实验中单纯药物刺激难以模拟体内微环境,体内移植实验又很难区分细胞融合还是细胞分化,因此近年来许多研究工作者采用共培(co-culture)的方法模拟体内微环境,研究BMSCs的分化可塑性〔5,6〕。BMSCs向特定细胞分化的能力受局部微环境的调控,在体外通过成体干细胞目的细胞共培养能在一定程度上“再现”体内微环境并成功诱导干细胞定向分化〔7〕。
本实验直接培养组中,将BMSCs与心肌细胞混匀直接培养;间接培养组中,利用Transwell小室建立体外微环境诱导BMSCs向心肌样细胞分化。Transwell小室,是一个可放置在孔板里的小杯子,杯底层有一张通透性的半透膜,此膜能够阻隔细胞,允许培养液及细胞代谢物自由通过。实验利用免疫荧光和自动化程度高且特异性更强的RT-PCR技术检测BMSCs分化为心肌样细胞时cTnT在胞质中的表达,cTnT是心肌细胞中特异性的结构蛋白,仅在心肌细胞中表现,是用来鉴定心肌细胞的重要指标〔8,9〕。本实验结果显示,直接接触组的cTnT表达率明显优于间接接触组,直接接触共培养BMSCs向心肌细胞的分化率优于间接接触组。
本实验两个实验组的区别是构建的心肌微环境的不同,出现不同结果的原因是模拟心肌微环境对于BMSCs的分化作用的影响不同。目前研究显示,细胞间接触及通话是器官发生、胚胎发生的关键因素,微环境对干细胞分化成其他细胞发挥着重要作用。干细胞进入体内不同器官能在不同的环境及生长因子作用下发生定向分化,微环境是诱导干细胞分化的关键因素。在体外通过成体干细胞与目的细胞共培养能在一定程度上“再现”体内微环境并成功诱导干细胞定向分化。共同培养的微环境中存在着很多影响因素,机械因素和化学因素(心肌细胞分泌的一些细胞因子和可溶性的化学物质)〔10〕,BMSCs修复受损心肌的能力可能是多途径共同作用的结果,而不是通过单一途径实现的。
虽然体外微环境对于BMSCs心肌样分化的影响因素可归结为化学和物理刺激,但这些因素及其作用机制错综复杂,目前尚未有定论,极大地限制了心肌微环境对干细胞向心肌细胞分化的影响的研究发展。未来,将近一步深入与完善心肌微环境对BMSCs向心肌细胞分化的影响及其机制的研究。
1 Gojo S,Gojo N,Takeda Y,et al.In vivo cardiovasculogenesis by direct injection of isolated adult mesenchymal stem cells〔J〕.Exp Cell Res,2003;288(1):51-9.
2 张 平,张本恕.间充质干细胞的特性及临床应用前景〔J〕.中国老年学杂志,2013;33(2):726-30.
3 Hatzistergos KE,Quevedo H,Oskouei BN,et al.Bone marrow mesenchymal stem cells stimulate cardiac stem cell proliferation and differentiation〔J〕.Circ Res,2010;107(3):913-22.
4 Hattan N,Kawaguchi H,Ando K,et al.Purified cardiomyocytes from bone marrow mesenchymal stem cells produce stable intracardiac grafts inmice〔J〕.Cardiovasc Res,2005;65(1):334.
5 罗 云,孙桂波,秦 蒙,等.细胞共培养技术在医药研究中的应用〔J〕.中国中药杂志,2012;37(22):3345-9.
6 Moscoso I,Centrno A,Lopez E,et al.Differentiation“invitro”of primary and immortalized porcinemesen chymalstem cells in to cardiomyocytes for cell transplantation〔J〕.Transplant Proc,2005;37(1):481-2.
7 高羽亭,范洪学.骨髓间充质干细胞的研究进展〔J〕.国外医学·老年医学分册,2006;27(3):109-12.
8 Henga BC,Haiderb HK,Simb EK,et al.Strategies for direct-ing the differentiation of stem cells into the cardiomyogenic lineage in vitro〔J〕.Cardiovasc Res,2004;62(1):34-42.
9 李 琳,王龙安,朱 娟,等.快速检测心肌肌钙蛋白T在急性心肌梗死诊断中的应用研究〔J〕.现代预防医学,2013;40(3):538-40.
10 赵艳梅,钟国强,柯红红,等.体外不同诱导条件对大鼠骨髓间充质干细胞分化为心肌细胞的影响〔J〕.基础医学与临床,2010;30(6):561-5.
〔2013-12-09修回〕
