不同甜酒曲中可培养真菌的多样性分析
2015-09-09姚淑敏闫华文曲阜师范大学生命科学学院山东曲阜273165
姚淑敏,闫华文,陈 璐(曲阜师范大学 生命科学学院,山东 曲阜 273165)
不同甜酒曲中可培养真菌的多样性分析
姚淑敏,闫华文,陈璐
(曲阜师范大学 生命科学学院,山东 曲阜 273165)
用可培养的方法对6种甜酒曲中的真菌进行分离筛选,共分离得到25株酵母菌和13株霉菌,利用26S rDNA序列分析对酵母菌进行鉴定,结果表明,其分属于酿酒酵母(Saccharomyces cerevisiae)、扣囊复膜酵母(Saccharomycopsis fibu1igera)、东方伊萨酵母(Issatchenkia orienta1is)和克鲁维毕赤酵母(Pichia k1uyveri)。利用ITS rDNA序列分析对霉菌菌株进行鉴定,结果表明,13株霉菌分别为米根霉(Rhizopus oryzae)、小孢根霉(Rhizopus microsporus)、小孢根霉华变种(Rhizopus microsporusvar.chinesis)、小孢根霉须状变种(Rhizopus microsporusvar.rhizopodiformis)、印度毛霉(Mucor indicus)和卷枝毛霉(Mucor circine11oides)。
可培养真菌;26S rDNA;ITS rDNA;甜酒曲
甜酒曲(甜酒药)是发酵甜酒酿的发酵剂。我国用曲制酒工艺由来已久,并且影响深远,日本学者坂口谨一郎先生将用曲制酒这一工艺与我国古代的四大发明相媲美[1]。最原始的甜酒曲一般以蒸煮的谷物以及各种辅料为主,添加辣蓼草,接种环境中的霉菌和酵母菌等多种微生物自然发酵而成[2-3]。随着科技的进步,制曲工艺也进一步提升,可以人为的控制接种的菌种类别进而制得不同风味的甜酒酿。由于纯种根霉曲和现代工业制曲菌种比较单一,因此性质稳定,制得酒酿质量稳定、口感单一;民间曲微生物种类繁多且不稳定,发酵的甜酒酿口感醇厚,风味独特,酒味较为浓厚,但是由于性质不稳定,发酵工艺不便于控制,大批量发酵生产因此受到限制[4]。正是由于酒曲的种类不同进而导致了不同甜酒酿风味的差异,因此酒曲又被誉为“酒之骨”[5]。
在亚洲许多地区,用发酵剂来发酵酒精类饮料和相关食物已经具有多年历史[6-7],只是发酵剂的名称因地而异,如印度的“Hamei”就是一种天然的起始发酵物,以糯米为原料,拌入“Hamei”发酵制得的酒精饮料酒类似于中国的米酒。除此之外,印度尼西亚的“Ragi”、锡金的“Macha”、韩国的“Nuruk”、菲律宾的“Budob”、坦桑尼亚的“Togwa”都与中国的甜酒曲类似[8]。
甜酒酿发酵不是一种微生物单独起作用,实际上是多种菌群的混合发酵,发酵过程中存在菌相的变化。大量研究表明,酒曲中主要有三大类微生物:酵母菌,霉菌和细菌。其中霉菌主要包括根霉和毛霉两个属,霉菌主要产生淀粉酶和蛋白酶。甜酒曲中酵母菌包括酿酒酵母和非酿酒酵母,其中酿酒酵母是甜酒酿发酵过程中的优势菌[9],主要是利用糖进行酒精发酵[10],此外扣囊复膜酵母、毕赤酵母、异常汉逊酵母以及其他的产酯酵母也起到了相当重要的作用。
宁浩等[11]对华中地区的发酵米酒进行研究,从中分离得到2株水解淀粉能力较强的霉菌和3株产酒精能力较强的酵母菌,并对其发酵能力及产酒精方面进行了初步研究。王艳萍等[12]对湖北荆州的甜酒曲中的微生物进行分离纯化,得到1株霉菌,1株酵母菌和2株细菌,其中霉菌属于毛霉科,毛霉属。越南学者[13]从酒中分离鉴定出5株酵母菌和鲁氏毛霉(Amy1omyces rouxii)、少孢根霉(Rhizopus o1igosporus)、米根霉(Rhizopus oryzae)等霉菌,而根霉在淀粉糖化过程中还可以产生淀粉葡萄糖苷酶。YANG S等[14]从韩国的39种Nuruk样品进行研究,从中分离得到174株丝状真菌。
本实验通过对不同产地的酒曲中可培养真菌多样性的研究来了解不同地区甜酒酿风味迥异的原因,对甜酒酿品质的进一步提高以及甜酒酿的深加工提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1样品采集
6种中国不同地区(湖南韶山、湖南湘潭、湖南祁东、福建、浙江丽水和浙江兰溪)的甜酒曲样品,分别标记为1#、2#、3#、4#、5#、6#。
1.1.2培养基[15]
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:葡萄糖1 g,酵母粉0.5 g,蛋白胨1 g,琼脂粉2 g,加蒸馏水定容至100 mL,自然pH;
YPD液体培养基:葡萄糖1 g,酵母粉0.5 g,蛋白胨1 g,加蒸馏水定容至100 mL,自然pH;
沙氏固体培养基:葡萄糖(或麦芽糖)4 g,蛋白胨1 g,琼脂粉2 g,加蒸馏水,定容至100 mL,自然pH;
沙氏液体培养基:葡萄糖(或麦芽糖)4 g,蛋白胨1 g,加蒸馏水,定容至100 mL,自然pH。
1.2仪器与设备
HNY-1102C恒温培养振荡器:天津市欧诺仪器仪表有限公司;DNP-9082型电热恒温培养箱:上海精宏实验设备有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;A300型ArtGeneTM基因扩增仪:杭州朗基科学仪器有限公司;DYY-6C琼脂糖水平电泳板:北京六一仪器厂;Tanon 2500凝胶成像系统:上海天能科技有限公司。
1.3方法
1.3.1酒曲中可培养真菌的分离纯化方法
梯度稀释:取1g酒曲样品,放入装有99 mL无菌蒸馏水的锥形瓶中,振荡20~30 min,即得菌悬液,利用10倍稀释法,获得不同梯度浓度的稀释菌悬液,用移液枪分别移取0.1 mL菌悬液于不同的YPD固体培养基和沙氏固体培养基上,用无菌涂布棒将其涂布均匀,分别做好标记,30℃培养,3~4 d后观察并记录结果。
1.3.2酵母菌和霉菌基因组DNA的提取方法
参考《分子克隆实验指南》介绍的方法提取基因组DNA[16]。
1.3.3酵母菌26S rDNA片段扩增
以26S rRNA基因通用引物NL1和NL4为上下游引物,以提取的酵母菌基因组DNA为模板,进行26S rDNA片段聚合酶链式反应(po1ymerase chain reaction,PCR)。引物序列如下所示:
NL1:5′-GCATATCAATAAGCGGAGGAAAAG-3′NL4:5′-GGTCCGTGTTTCAAGACGG-3′
1.3.4霉菌ITS1-5.8S rDNA-ITS2扩增
以真菌rDNA-ITS的通用引物ITS1和ITS4作为序列扩增的上下游引物,以上述提取的霉菌基因组DNA为扩增模板,进行PCR扩增。通用引物序列如下所示:
ITS1:5′-TCCGTAGGTGAACCTGCGG-3′ITS4:5′-TCCTCCGCTTATTGATATGC-3′
1.3.5PCR扩增产物的检测及测序
取5μLPCR扩增产物,通过琼脂糖凝胶电泳进行检测。琼脂糖凝胶浓度1%;电泳缓冲液:1×TAE;电泳条件:100V、40 min。通过凝胶成像系统观察电泳结果,选取条带较亮的样品送至上海生物工程公司进行测序,将测序结果在美国国家生物技术信息中心(nationa1centerof biotechno1ogy information,NCBI)数据库上进行比对分析,然后利用Mega5构建系统进化树。
2 结果与分析
2.1可培养真菌的分离纯化结果
经过稀释涂布平板法对甜酒曲中的样品进行分离纯化,根据菌落特征不同和显微镜观察结果,总共从6种样品中分离得到25株酵母菌菌株和13株霉菌菌株。结果见表1、表2。光学显微镜观察其生长形态,结果见图1、图2。

表1 酵母菌分离菌株来源及名称Table 1 Source and name of yeast isolates

表2 霉菌分离菌株来源及名称Table 2 Source and name of mould isolates

图1 酵母菌细胞形态Fig.1 Cell morphology of yeasts
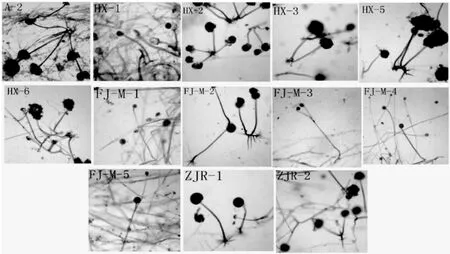
图2 霉菌菌丝体形态Fig.2 Mycelium morphology of moulds
由图1可知,所分离的25株酵母菌中A细胞球形,单细胞,个体较大;C细胞卵球形,单细胞,个体较大;P、FJ-J-2细胞卵球形,单细胞,个体较小;I、ZJL-6、ZJL-11细胞球形,个体较大,分散;L、ZJL-4细胞球形,个体较大,几个聚在一起;M、ZJL-3细胞球形,个体较小,几个聚在一起。N、O、ZJL-2、ZJL-9、ZJL-12、ZJL-13细胞球形,个体较小,分散;R细胞丝状,个体较细,分散;FJ-J-1、ZJL-10细胞卵球形,个体较大,几个聚在一起;FJ-J-3细胞短杆状,个体较大,几个聚在一起;FJ-J-4、ZJL-8卵球形,个体较大,分散;FJ-J-5、ZJL-5细胞卵球形,个体较小,分散。
由图2可知,A-2菌丝灰褐色,粗壮,有假根,有孢囊,产孢囊孢子,孢子椭圆形;HX-1菌丝灰褐色,纤细,有孢囊,有假根和匍匐菌丝,孢囊孢子繁殖,孢子近球形;HX-2菌丝灰色,纤细,有假根和匍匐菌丝,孢囊孢子繁殖,孢子近球形;HX-3菌丝褐色,较粗壮,有孢囊、假根和匍匐菌丝,孢子椭圆形,小;HX-5菌丝灰褐色,菌丝粗壮,有假根和匍匐菌丝,孢囊孢子繁殖,孢子小,椭圆形;HX-6菌丝粗壮,灰褐色,有假根和匍匐菌丝,孢囊孢子繁殖,孢子大,近球形;FJ-M-1菌丝白色,纤细,无假根和匍匐菌丝,有孢囊,孢子小,球形;FJ-M-2菌丝灰褐色,纤细,有假根和匍匐菌丝,有孢囊,孢囊孢子椭球形;FJ-M-3菌丝灰白色,纤细,无假根和匍匐菌丝,有孢囊,孢囊孢子椭球形;FJ-M-4菌丝灰褐色,菌丝纤细,有假根,有孢囊,孢囊孢子近球形;FJ-M-5菌丝白色,较粗壮,无假根和匍匐菌丝,有孢囊,孢囊孢子小,椭球形;ZJR-1菌丝灰褐色,粗壮,有假根和匍匐菌丝,有孢囊,孢囊孢子球形;ZJR-2菌丝褐色,纤细,有假根和匍匐菌丝,有孢囊,孢囊孢子椭球形。
2.2酵母菌分子生物学鉴定结果
2.2.1酵母菌26S rDNA片段PCR扩增结果
以提取的酵母菌DNA为模板,以NL1和NL4为上、下游引物扩增26S rDNA片段,片段长度为600 bp左右,电泳图如图3~图5。

图3 1#、2#、3#甜酒曲酵母菌26S rDNA片段PCR扩增结果Fig.3 PCR amplification results of the 26S rDNA segment of yeast strains isolated from samples 1#,2#,3#
由图3可知,1#、2#、3#甜酒曲中分离得到的9株酵母菌,通过26SrDNA通用引物扩增,在600bp左右各有一条亮带,证明PCR扩增成功。由图4可知,4#甜酒曲酵母菌26SrDNA片段PCR扩增结果,在600 bp左右各有一条亮带,证明PCR扩增成功。由图5可知,5#甜酒曲酵母菌26S rDNA片段PCR扩增结果,在600bp左右各有一条亮带,证明PCR扩增成功。

图4 4#甜酒曲酵母菌26S rDNA片段PCR扩增结果Fig.4 PCR amplification results of the 26S rDNA segment of yeast strains isolated from sample 4#

图5 5#甜酒曲酵母菌26S rDNA片段PCR扩增结果Fig.5 PCR amplification results of the 26S rDNA segment of yeast strains isolated from sample 5#
2.2.2目的片段测序、结果比对及系统进化树的构建
PCR扩增片段送至上海生工生物工程有限公司进行测序,将测序结果与NCBI数据库中的序列进行B1ast比对分析,获得的序列提交至NCBI的GenBank数据库,获得登录号。比对结果及获得的登录号见表3。
由表3可知,1#甜酒曲中分离得到的菌株A与克鲁维毕赤酵母LY9:AB499014.1相似度高达99%。从2#甜酒曲中分离得到的6株酵母菌中,菌株R和M分别与克鲁维毕赤酵母CEC RCS-0-9:JX103190.1和LY9:AB499014.1达到高相似度>98%,而菌株I、L、N、O分别与酿酒酵母属的不同菌株相似度>97%。3#甜酒曲中的菌株C和P分别与酿酒酵母JN7N-19:KC715802.1和克鲁维毕赤酵母菌株LY9:AB499014.1相似度达99%和97%,利用软件Mega5对这9株酵母菌构建的系统进化树(图6)。通过以上分析可知,从1#、2#、3#甜酒曲中分离得到的9株酵母菌分属于酿酒酵母和克鲁维毕赤酵母两个类群,其中菌株A、P、R、M鉴定为克鲁维毕赤酵母(Pichia k1uyveri),而菌株C、I、L、N、O鉴定为酿酒酵母(Saccharomyces cerevisisiae)。

表3 酵母菌序列比对结果Table 3 Sequence alignment results of yeast

图6 1#、2#、3#甜酒曲中9株酵母菌的系统进化树Fig.6 Phylogenetic tree of nine yeasts isolated from samples 1#,2#,3#
4#甜酒曲中总共分离得到5株酵母菌,其中菌株FJ-J-1 和FJ-J-2分别与扣囊复膜酵母s-5b-2:HM107787.1和3-1Y: KF717372.1相似度达到99%,菌株FJ-J-3与东方伊萨酵母QDA2:EU585765.1相似度达99%,而菌株FJ-J-4和FJ-J-5与不同的酿酒酵母菌株达到高相似度。利用软件Mega5对4#甜酒曲的酵母菌构建的系统进化树(图7)。因此可以看出通过可培养的方法进行菌株筛选,从4#甜酒曲中分离到的5株酵母菌分属于扣囊复膜酵母、东方伊萨酵母和酿酒酵母三个类群。

图7 4#甜酒曲中5株酵母菌的系统进化树Fig.7 Phylogenetic tree of five yeasts isolated from sample 4#
5#甜酒曲中分离得到的11株酵母菌通过B1ast比对发现,11株酵母分离菌株与不同的酿酒酵母菌株的相似度达到97%以上,其中菌株ZJL-11与菌株JM2:JX867131.1相似度达100%,利用软件Mega5对5#甜酒曲的酵母菌构建系统进化树(图8),结果表明,5#甜酒曲中的优势菌群为酿酒酵母。

图8 5#甜酒曲11株酵母菌的系统进化树Fig.8 Phylogenetic tree of 11 yeasts isolated from sample 5#
2.3霉菌分子生物学鉴定结果
2.3.1霉菌ITS片段PCR扩增结果
以霉菌DNA基因组DNA为模板,ITS1和ITS4为上、下游引物扩增霉菌ITS基因片段,片段长度为650 bp左右,电泳图如图9所示。

图9 霉菌ITS PCR扩增电泳图Fig.9 Amplification electrophoresis figure of mould ITS rDNA
由图9可知,所分离的霉菌的ITS PCR扩增结果,在650 bp左右各有一条亮带,证明PCR扩增成功。
2.3.2目的片段测序、结果比对及系统进化树的构建
PCR扩增片段送至上海生物工程有限公司进行测序,将测序结果与NCBI数据库中的已知序列进行B1ast比对分析,挑选与之相似度≥97%的菌株,获得的序列提交至NCBI的GenBank数据库,获得登录号。序列比对结果及获得的登录号如表4。
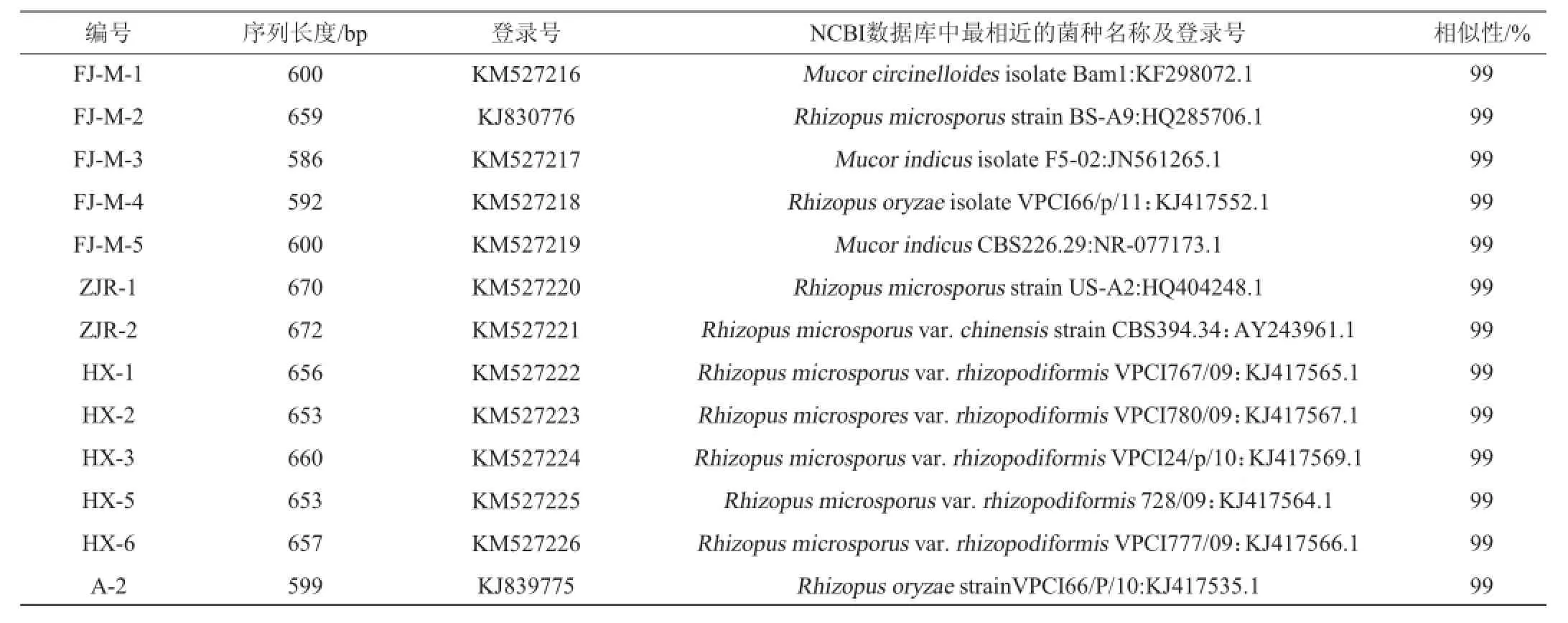
表4 霉菌ITS序列比对结果Table 4 Comparison results of mould ITS rDNA sequence
通过序列比对结果发现,分离得到的13株霉菌为根霉属和毛霉属,属于6个不同的种,分别为:卷枝毛霉(Mucor circine11oides)、小孢根霉(Rhizopus microsporus)、小孢根霉华变种(Rhizopus microsporusvar.chinensis)、小孢根霉须状变种(Rhizopus microsporusvar.rhizopodiformis)、米根霉(Rhizopus oryzae)和印度毛霉(Mucor indicus),其中1#甜酒曲中分离得到的A-2与米根霉菌株VPCI66/P/10相似度达到99%。3#甜酒曲分离得到的5株霉菌经过序列比对分析发现均与小孢根霉须状变种的不同菌株相似度高达99%。从4#甜酒曲样品中分离得到的霉菌种类最多,FJ-M-1与卷枝毛霉菌株Bam1相似度达99%,FJ-M-2与小孢根霉菌株BS-A9相似度较高,FJ-M-3和FJ-M-5分别与印度毛霉的不同菌株相似度达到99%,FJ-M-4则与米根霉菌株VPCI66/p/11相似度达到99%。5#甜酒曲中分离得到的两株霉菌均为根霉属,ZJR-1和ZJR-2分别与小孢根霉菌株US-A2和小孢根霉华变种相似度达到99%。挑选相似度较高的已知菌株序列构建系统进化树,结果见图10。

图10 霉菌ITS片段构建系统进化树Fig.10 Phylogenetic tree of mould isolates based on ITS fragment
通过以上分析结果可以得出,得到的13株霉菌中,菌株A-2和FJ-M-4为米根霉,菌株HX-1、HX-2、HX-3、HX-5、HX-6为小孢根霉须状变种,菌株ZJR-2为小孢根霉华变种,ZJR-1和FJ-M-2为小孢根霉,菌株FJ-M-3和FJ-M-5为印度毛霉,而菌株FJ-M-1鉴定为卷枝毛霉。
3 结论
实验利用传统的稀释涂布法成功完成了甜酒曲中可培养真菌的分离纯化,并利用26S rDNA序列分析对酵母菌分离株进行鉴定,利用ITS序列对分离霉菌进行了鉴定,从结果可以看出,在不同的甜酒曲中含有的酵母菌和霉菌有相同的菌株也有不同的菌株,这些不同的菌株在不同种类的甜酒曲样品中,用于发酵产乙醇和有机酸及芳香物质等其他营养物质的不同,从而导致了甜酒酿的风味和营养成分存在差异,这也是不同地区甜酒酿的风味迥异的根本原因所在。对甜酒曲中的分离菌株进行条件优化,从而得到性能良好的菌株是提高甜酒酿品质的一条有效途径。在接下来的实验中,将对不同酒酿中的以营养成分进行进一步的研究。
[1]傅金泉.中国酒曲技术的发展与展望[J].酿酒,2002(2):7-9.
[2]侯召华,宁浩然,聂帅,等.国内外酒曲研究进展[J].特产研究,2013 (3):72-76.
[3]臧威,谢广发,孙剑秋,等.绍兴黄酒酒药中酵母菌的物种资源[J].菌物学报,2015(6):1078-1084.
[4]朱海泉,鲁海波,王龙祥.甜酒曲的开发与研究进展[J].山东食品发酵,2012(2):49-52.
[5]刘婧竟,乔发东.国内外甜酒曲研究进展[J].中国酿造,2010,29(9):21-25.
[6]HESSELTINE C W.Microbio1ogy of orienta1 fermented foods[J].Ann Rev Microbiol,1983,37:575-601.
[7]THANH V N,MAI L T,TUAN D A.Microbia1 diversity of traditiona1Vietnamese a1coho1 fermentation starters(banhmen)as determined byPCR-mediated DGGE[J].Int J Food Microbiol,2008,124(2):268-273.
[8]JEYARAM K,SINGH W M,COPECE A,et a1.Mo1ecu1ar identification of yeast species associated with'Hamei'-A traditiona1 starter used for rice wine production in Manipur,India[J].Int J Food Microbiol,2008,124(2):115-125.
[9]闫华文,陈璐,姚淑敏.湖南民间酒酿中酵母菌多样性的研究[J].中国酿造,2014,33(5):81-84.
[10]HYERYUN K,SEUNGHEE B,MINJAE S,et a1.Feasibi1ity of Cheonghju brewing with wi1d type yeast strains from Nuruks[J].Korean J Microbiol Biotechnol,2006,34(3):244-249.
[11]宁洁,赵新淮.发酵米酒中一些霉菌和酵母的性质与应用研究[J].食品科技,2008(10):5-9.
[12]王艳萍,程巧玲,张阳,等.米酒醪中优势微生物菌相组成的初步研究[J].中国酿造,2008,27(5):12-14.
[13]DUNG N T P,ROMBOUTS F M,NOUT M J R.Functiona1ity of se-1ect-ed strains of mou1ds and yeasts from Vietnamese rice wine starters [J].Food Microbiol,2006,23(4):331-340.
[14]YANG S,LEE J,KWAK J,et a1.Fungi associated with the traditiona1 starter cu1tures used for rice wine in Korea[J].J Korean Soc Appl Biol Chem,2011,54(6):933-943.
[15]杨革.微生物学实验教程[M].北京:科学出版社,2009.
[16]朱旭芬.基因工程实验指导[M].北京:高等教育出版社,2006.
Diversity of cu1turab1e fungi in different sweet a1coho1ic drink's starters
YAO Shumin,YAN Huawen,CHEN Lu (Co11ege of Life Science,Qu Fu Norma1 University,Qufu 273165,China)
The 25 yeast strains and 13 mou1d strains were screened and iso1ated from the six kinds of sweet a1coho1ic drink's starters by cu1ture media methods,and the yeast strains were identified by 26S rDNA sequence.The resu1ts showed that the yeast strains be1ong to four groups:Saccharomyces cerevisiae,Saccharomyces fibu1igera,Issatchenkia orienta1isandPichia k1uyveri.The mou1d strains were identified by the ITS rDNA sequence,and resu1ts indicated that the 13 mou1d strains were identified asRhizopus oryzae,Rhizopus microsporus,Rhizopus microsporusvar.chinesis,Rhizopus microsporusvar.rhizopodiformis,Mucor indicusandMucor circine11oides.
cu1turab1e fungi;26S rDNA;ITS rDNA;sweet a1coho1ic drink's starters
TS261.1
A
0254-5071(2015)12-0048-07
10.11882/j.issn.0254-5071.2015.12.011
2015-10-01
山东省青年基金资助项目(ZR2013EEQ009),曲阜师范大学实验室开放基金项目(sk201407)
姚淑敏(1967-),女,副教授,博士,研究方向为微生物资源和利用。
