乳腺实性乳头状癌16例临床病理分析
2015-09-09马杰邓再兴浙江省人民医院浙江杭州3004湖州市妇幼保健院浙江湖州33000
马杰,邓再兴(.浙江省人民医院,浙江 杭州3004;.湖州市妇幼保健院,浙江 湖州33000)
乳腺实性乳头状癌16例临床病理分析
马杰1,邓再兴2
(1.浙江省人民医院,浙江 杭州310014;2.湖州市妇幼保健院,浙江 湖州313000)
目的探讨乳腺实性乳头状癌(SPC)的临床病理特点、免疫表型及鉴别诊断。方法回顾性分析16例乳腺实性乳头状癌的临床表现、组织形态、免疫组化结果,并结合相关文献进行讨论。结果患者年龄48~81岁,平均(65.1±9.1)岁。发生于左侧10例,右侧6例。长径0.5~5.5cm。终末导管小叶单位的导管上皮实性片状生长,实性生长区域中有纤细的纤维血管轴心形成。增生的导管上皮细胞形态较温和,通常仅为轻到中度异型,核分裂像少见。实性结构的周边经常可见微腺样腔隙,腔隙内常见黏液积聚。瘤细胞ER、PR均呈弥漫性强阳性表达。肌上皮标记物均阴性,神经内分泌标记物常阳性。预后良好。结论乳腺SPC常见于老年女性,组织学形态结构独特,神经内分泌标记物常阳性。复发转移率较低,预后良好。
乳腺肿瘤;实性乳头状癌;病理特点;鉴别诊断
乳腺实性乳头状癌 (solid papillary carcinoma,SPC)是一种相对少见的乳腺肿瘤,由Maluf和Koerner于1995年首先描述[1],被认为是一种具有神经内分泌分化的特殊类型导管原位癌,组织学上特征性地表现为实性乳头状生长方式、瘤细胞异型性小,患者年龄大于其他普通类型乳腺癌,预后相对较好。尽管近年来人们对其认识逐渐增加,但尚存在一定的误诊和漏诊。本文收集了16例乳腺实性乳头状癌,结合文献分析其临床病理特点与鉴别诊断,以进一步提高对该肿瘤的认识。
1 资料与方法
1.1一般资料收集2010年1月~2014年12月浙江省人民医院6例及湖州市妇幼保健院10例乳腺SPC患者,由两名高级职称病理医师分别重新复片,部分补做免疫组化。16例均为女性,年龄48~81岁,平均(65.1±9.1)岁。临床表现为乳头溢液或溢血7例,乳房疼痛3例,自行发现乳房肿块4例,体检发现乳房肿块2例。病程3天~3个月。发生于左侧10例,右侧6例。11例乳腺钼靶摄片及乳腺B超术前考虑乳腺癌,5例考虑良性肿瘤。
1.2方法标本经10%中性福尔马林固定,常规脱水,石蜡包埋,4μm厚切片,HE染色,光镜观察肿瘤组织形态。免疫组织化学检测采用MaxVision一步法,一抗为ER(雌激素受体)、PR(孕激素受体)、P53、HER-2(类表皮生长因子受体2),CK5/6(细胞角蛋白)、Calponin(肌上皮标记物)、P63(肌上皮标记物)、SMA(肌上皮标记物)、CgA(神经内分泌标记物)、Syn(神经内分泌标记物)、E-cadherin、Ki-67。所有抗体和实验试剂盒均购自福州迈新生物技术开发公司,操作按说明书进行。
2 结果
2.1病理检查
2.1.1巨检乳腺癌改良根治标本11例,单纯切除标本3例,2例因年龄较大仅行乳腺肿块单纯切除。肿物大小不一,长径0.5~5.5cm,平均2.1cm;13例肿块境界清楚,似有包膜,1例肿块境界不清,2例乳头状囊型,囊内含有暗褐色液体。肿块切面呈灰粉或灰褐色,质地偏软,无明显出血、坏死。
2.1.2镜检肿瘤组织的终末导管小叶单位的导管上皮实性片状生长,呈膨胀性生长,充填整个导管腔,形成实性片状结构,实性生长区域中有纤细的纤维血管轴心形成,轴心周围细胞呈栅栏状排列或围绕纤维血管轴心形成假菊形团样结构 (图1~2)。增生的导管上皮细胞形态较温和,呈卵圆形、多边形或梭形,印戒样,通常仅为轻到中度异型,核分裂像少见。胞质丰富,呈嗜酸性细颗粒状,核细致淡染,呈卵圆形,也可呈典型的浆细胞样细胞。实性结构的周边经常可见微腺样腔隙,腔隙内常见黏液积聚(图3)。
2.2免疫组化检查16例肿瘤细胞ER、PR均呈弥漫性强阳性表达(图4~5)。HER2除1例判定为(+)外,其余均阴性。E-cadherin均强阳性表达。11 例CgA阳性,14例Syn均阳性(图6)。肌上皮标记物P63,SMA,Calponin均阴性。高分子角蛋白CK5/ 6阴性。Ki-67阳性指数1%~25%,平均10%。
2.3手术及预后16例中行改良根治术11例,单纯切除标本3例,行肿块切除术2例。术后有随访资料12例,随访时间3~45个月,平均(12.6±7.4)个月,均无复发,预后良好。
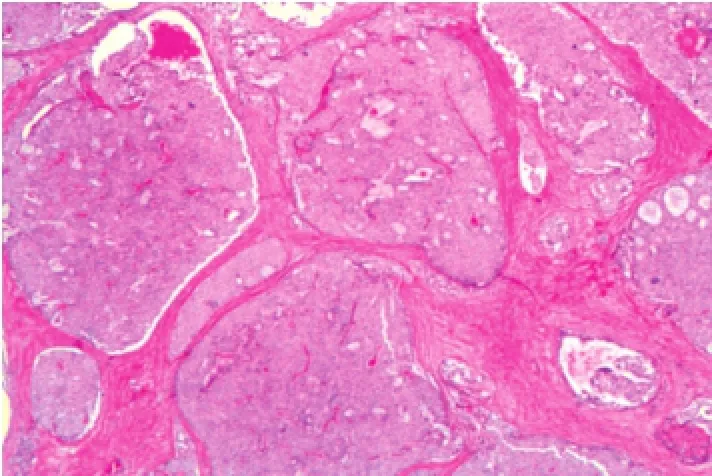
图1 终末导管小叶单位的导管上皮实性片状生长,呈膨胀性生长,充填整个导管腔,形成实性片状结构。(×100)
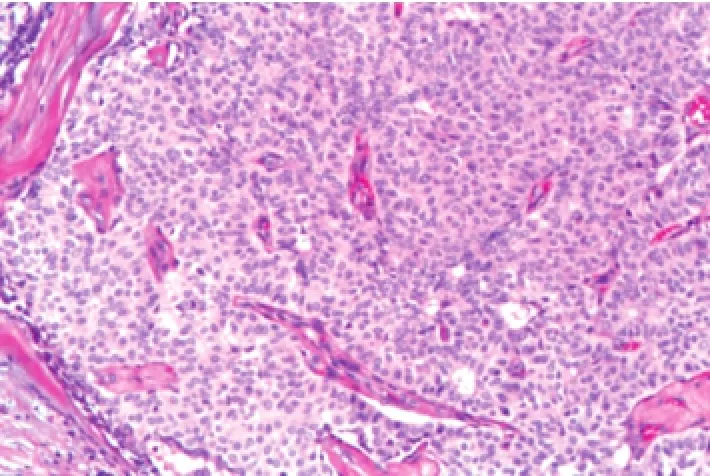
图2 实性生长区域中有纤细的纤维血管轴心形成(×100)

图3 实性结构的周边可见微腺样腔隙,腔隙内黏液积聚。(×100)

图4 肿瘤细胞ER弥漫强阳性(×100)

图5 肿瘤细胞PR弥漫强阳性(×100)
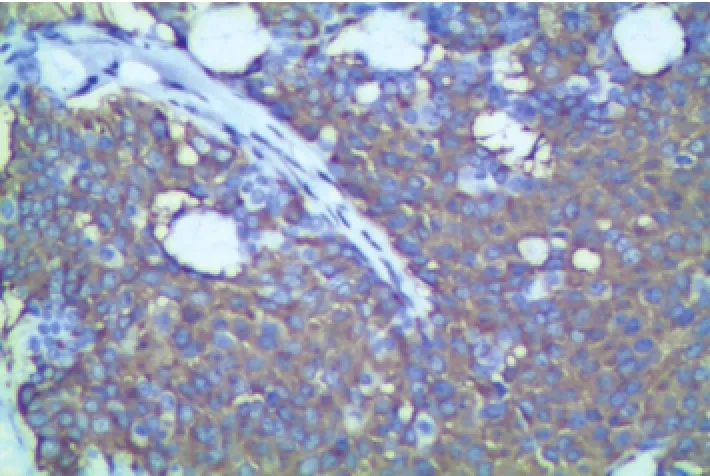
图6 肿瘤细胞Syn弥漫强阳性(×100)
3 讨论
乳腺SPC在2003年WHO《乳腺和女性生殖系统肿瘤病理学和遗传学》[2]分类中被称为“导管内乳头状癌的实体变型”,在导管内乳头状癌中加以描述,在2012年的WHO《乳腺肿瘤病理学和遗传学》[3]分类中增加“实性乳头状癌”这一新的肿瘤实体,并单独加以描述。
3.1临床表现乳腺SPC好发于60岁以上老年人,本组16例年龄最大者81岁,平均65.1岁,小于50岁者仅2例。乳头溢液是非常突出的临床表现[2],本组有7例表现为乳头溢液或溢血,但部分病例无症状。本组病例肿物大小不一,境界大部分清楚,无明显特异性。术前乳腺钼靶摄片及乳腺B超有一定诊断参考价值,确诊必须依靠病理学检查。
3.2病理学特点下列特点有助于该肿瘤的诊断[2-7]:(1)镜下终末导管小叶单位呈膨胀性生长,低倍镜下这类肿瘤表现为实性生长,肿瘤表现为排列紧密的、膨胀的、富于细胞的多结节病灶其中可见纤细的纤维血管间隔,而此种纤维血管间隔也是命名其为乳头状癌的理由;(2)肿瘤细胞呈卵圆形、梭形或多边形,胞质丰富颗粒状;(3)细胞内或细胞外可含有黏液,部分病例可与黏液腺癌合并存在;(4)常可见到肿瘤细胞向邻近导管的派杰样扩散;(5)免疫组织化学染色常显示神经内分泌标志物阳性是重要特征。本组病例中肿瘤细胞CgA,Syn等神经内分泌标志物均阳性。
3.3鉴别诊断[4](1)呈实片状改变的小叶原位癌:特别是印戒细胞型,由于缺乏纤维血管轴心和细胞外黏液、不表达E-cadherin及CgA、Syn可鉴别;(2)乳腺肌上皮肿瘤:瘤细胞可呈梭型、透明细胞型和浆细胞样型,往往产生细胞外基质,缺乏细胞外黏液,肿瘤细胞P63、CD10、S-100和SMA等阳性,而SPC则为阴性;(3)黏液表皮样癌:均可出现细胞内外的黏液,且中间细胞与该瘤非常相似,但乳腺的黏液表皮样癌极其罕见,且其ER、PR和E-cadherin(阴性);(4)神经内分泌癌:典型神经内分泌肿瘤HE切片组织学表现缺乏血管周黏液和乳头状结构,呈团巢状结构,瘤细胞相对一致性而不像SPC瘤细胞呈卵圆形、多边形或梭形,表达内分泌标记物只能说明其有神经内分泌分化;(5)乳腺导管内非乳头性增生性病变:特别是良性普通型增生和非典型导管上皮增生,缺乏细胞外黏液分泌和神经内分泌标记并且CK5/6标记阳性;(6)黏液癌:由于SPC经常合并黏液癌且黏液癌发病率远远高于SPC,因此合并存在时SPC成分往往被忽略。但黏液癌可发生在各个年龄段,大体观察切面浸润且有反光现象,镜下表现为黏液湖中漂浮不规则腺管或小的实性细胞岛(一种特殊的浸润方式)。
3.4治疗与预后已有文献报道SPC患者的预后较好[4],属于低度恶性的导管内癌,若无浸润性病变,可行患侧乳房单纯切除,若提示为浸润性病变,须行改良根治术。本组12例随访病例中,均预后良好,未出现复发、转移。
[1]Maluf HM,Koemer FC.Solid papillary carcinoma of the breast.A form of intraductal carcinoma with endocrine differentiation frequently associated with munous carcinoma.Am J Surg Pathol,1995,19(11):1237
[2]Tavassoli FA,Devilee P.World Health Organization classification of tumours.Pathology and genetics of tumours of breast and female genital organs.Lyon:IARC Press,2006:35
[3]Lakhani SR,Ellis IO,Schnitt SJ,et a1.WHO classification of tumours of the breast.World Health Organization classification of tumours.4th ed.Lyon:IARC Press,2012:71
[4]钟定荣,孙萍萍,梁智勇.乳腺实性乳头状癌22例临床病理分析.诊断病理学杂志,2010,17(3):165
[5]魏兵,步宏,陈卉娇,等.乳腺实体型乳头状癌的临床病理研究.中华病理学杂志,2006,35(l0):589
[6]李香丹,杨文涛,孙抒,等.乳腺实性乳头状癌73例临床病理诊断.临床与实验病理学杂志,2010,26(1):35
[7] 倪韵碧,谢文杰.乳腺乳头状病变.中华病理学杂志,2013,42(11):721
