尿激酶型纤溶酶原激活物生物传感器的构建及鉴定
2015-09-05崔钢华曹薇薇王维山史晨辉
崔钢华, 饶 烽, 王 琰, 曹薇薇, 刘 伟,王维山,史晨辉
(1.石河子大学医学院第一附属医院骨一科,新疆 石河子832000;2.石河子大学 新疆地方民族与地方病教育部重点实验室,新疆 石河子 832000)
尿激酶型纤溶酶原激活物生物传感器的构建及鉴定
崔钢华1,2, 饶烽1,2, 王琰1,2, 曹薇薇2, 刘伟2,王维山1,2,史晨辉1,2
(1.石河子大学医学院第一附属医院骨一科,新疆 石河子832000;2.石河子大学 新疆地方民族与地方病教育部重点实验室,新疆 石河子 832000)
目的:构建含有增强型青色荧光蛋白-尿激酶型纤溶酶原激活物(uPA)作用底物(substrate)-黄色荧光蛋白变体(YPet)融合蛋白的真核表达载体(ECFP-uPA substrate-linker-YPet),即uPA的生物传感器。方法:以Src-biosensor为模板,Primer Premier 5.0软件设计YPet引物,设计时5′端引入uPA底物序列及Linker,两端连接酶切位点及保护碱基。以pMDTM-18T为中间载体,通过基因工程方法构建含有ECFP-uPA substrate-linker-YPet的真核表达载体。然后转染293T细胞,24 h后观察转染效率和融合蛋白表达情况,在荧光显微镜下,应用MetaFlour FRET 4.6软件观察并测量uPA生物传感器荧光共振能量转移(FRET)。结果:经过PCR和双酶切鉴定,克隆片段和酶切片段均与uPA substrate分子大小相符。细胞转染后转染效率达40%。免疫荧光检测,uPA生物传感器在293T细胞膜表达,用重组人uPA(rhuPA)刺激转染细胞可以检测到FRET现象。结论:成功构建uPA生物传感器,该生物传感器能够作为活细胞分子探针用于研究uPA的时空变化。
尿激酶型纤溶酶原激活物;生物传感器;荧光共振能量转移;骨性关节炎
尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,uPA)是丝氨酸蛋白水解酶家族的主要成员,uPA家族包括尿激酶型纤溶酶原激活物(uPA)、尿激酶型纤溶酶原激活剂受体(urokinase-type plasminogen activator receptors,uPAR)和纤溶酶原激活剂抑制剂(plasminogen activator inhibitor,PAIs)[1]。uPA可以在生理和病理条件下与uPAR结合,从而影响组织修复和细胞迁移、介导细胞外基质蛋白的水解、裂解胶原蛋白酶及激活其他蛋白水解酶,同时还可以直接降解细胞外基质及基底膜[2]。uPA也被证明与肿瘤的侵袭转移有高度关联[3]。最近一项研究[4]结果表明:uPA在基质金属蛋白酶(matrix metalloproteinases, MMPs)介导的骨性关节炎(osteoarthritis,OA)软组织降解过程中起着关键作用,但uPA在OA病变的各类信号传导通路中起何种作用仍未见相关研究报道。荧光共振能量转移(fluorescence resonance energy transfer,FRET)是指2个荧光发色基团足够靠近时,能量从一种受激发的荧光基团以非辐射的方式转移到另一个荧光基团的物理现象[5]。FRET技术可以实现在体、原位条件下,对蛋白质之间相互作用进行实时动态检测,真实反映生理条件下细胞内蛋白质之间的相互联系。因此FRET技术已经成为亚细胞领域敏感、快速、有效地追踪细胞内信号分子(蛋白)等相互作用的有效方法[6]。FRET技术用于分子探针即作为生物传感器(biosensor)已被用于监测有机化合物的浓度[7]、鸟苷三磷酸酶的活化[8]、蛋白质磷酸化[9]和细胞内机械应力的研究[10]等多个领域。本研究通过基因工程的相关方法和FRET技术构建uPA biosensor,这将有助于研究uPA在OA病变的信号传导通路中的作用,为实现OA基因的靶点治疗提供可靠的理论依据。
1 材料与方法
1.1质粒、菌株、细胞和主要试剂Src biosensor由美国霍普金斯大学曹旭教授惠赠,pMDTM-18T购自宝生物工程有限公司,人胚肾293T细胞、大肠杆菌DH5α为本实验室保存。T4DNA连接酶、DNA聚合酶购自美国Thermo公司,核酸相对分子质量Marker、相关限制性内切酶等购自日本Takara公司,细胞转染试剂Liopfectamine 2000购自美国Invitrogen公司,所用质粒小提试剂盒购自天根生化科技有限公司,细胞培养试剂(DMEM、胎牛血清)购自美国Gibco公司,抗绿色荧光蛋白抗体(一抗)和TRITC标记的山羊抗鼠IgG(二抗)购置中杉金桥公司,其他试剂均为国产分析纯。
1.2荧光成像系统Zeiss Axiovert 200M 倒置荧光显微镜(德国Zeiss公司),配备有CFP(BP436/25、FT455、BP480/40)、YFP(BP500/25、FT515、BP535/30)和CFP-YFP-FRET(BP436/25、FT455、BP535/30)3个滤光片,安装有MetaFlour软件。
1.3PCR引物根据Src-biosensor 中YPet的DNA序列,应用Primer Premier 5.0软件设计引物。在上游引物5′端引入合适的酶切位点和保护碱基备用,并添加uPA作用底物碱基序列,P1:ACATGCATGCATAGCGGCAGGAGCGCCAAC-GCCGGCGGCAGCGGCGGCACCATGTCTAAA-
GGTGAAGAATTATTC;P2:GGAATTCTTA-
CTATTTGTACAATTCATTC[单下划线分别表示SphⅠ和EcoRⅠ酶切位点,双下划线表示uPA作用底物的碱基序列,波浪线表示Linker(一段无意义的DNA序列)],委托上海生工生物技术公司合成。
1.4YPet基因的合成PCR反应采用25 μL体系,包含PCR Master Mix(2×) 12.5 μL,20 μmol·L-1引物P1和P2各0.5 μL,5 mmol·L-1的Taq酶0.5 μL,模板DNA 2 μL和ddH2O 9 μL。反应条件:94℃、5 min,94℃、0.5 min,55℃、0.5 min,72℃、0.5 min,72℃、10 min,34个循环。
1.5产物的克隆、鉴定与载体的构建将Src biosensor(含有pcDNA 3.1)和通用载体pMDTM-18T进行Hind Ⅲ和EcoRⅠ双酶切处理,将酶切产物ECFP-Linker-Substrate(Src作用底物)-YPet片段插入pMDTM-18T相应的位点,获得中间重组子Src-pMDTM-18T,再用SphⅠ和EcoRⅠ双酶切中间重组子Src-pMDTM-18T和PCR产物,并将YPet的PCR产物插入相应酶切位点,获得另一个中间重组子uPA-pMDTM-18T,最后通过Hind Ⅲ和EcoRⅠ双酶切处理uPA-pMDTM-18T,将ECFP-substrate(uPA作用底物)-Linker-YPet片段插入pcDNA 3.1载体中,获得uPA biosensor真核表达质粒。uPA biosensor重建质粒流程图见图1。
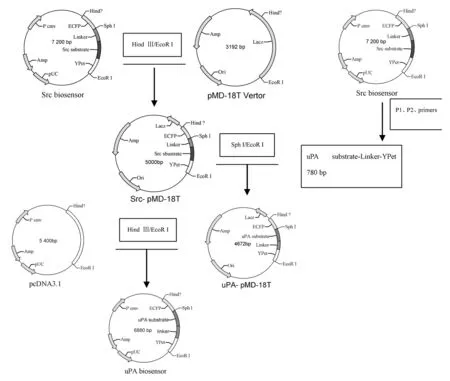
图1 uPA biosensor重组质粒构建流程图
Fig.1Flow chart of construction of uPA biosensor
1.6细胞培养和转染采用10% FBS的DMEM培养基,在37℃、5% CO2培养箱中培养293T细胞。转染前1 d,细胞用0.05%胰蛋白酶消化,铺入Petri皿中,每皿密度为2×104个细胞。待细胞生长融合至60%~70%时,根据Lipofectamine 2000转染试剂盒操作说明,uPA载体质粒和Lipofectamine 2000按比例4 μg∶7 μL进行转染,24 h后用Zeiss Axiovert 200M 倒置荧光显微镜观察荧光蛋白表达情况。
1.7免疫组织化学将上述转染细胞在37℃、5%CO2培养箱中培养16 h,PBS(温浴)洗2次,每次1 min,加入1 mL 4%多聚甲醛(冰浴),4℃放置30 min,然后用冰浴的PBS洗3次,加入山羊血清封闭室温放置30 min,加一抗(1∶50)后37℃、5%CO2培养箱中放置2 h,洗一抗,再上二抗(1∶100),37℃、5%CO2培养箱中放置2 h后避光,PBS洗3次后荧光显微镜下观察。
1.8荧光成像及TRET检测①校正因子计算:Zeiss Axiovert 200M 倒置荧光显微镜,采用100倍油镜。分别选取CFP (BP436/25,FT455,BP480/40)、YPet (BP500/25,FT515,BP535/30)和CFP-YPet-FRET (BP436/25,FT455,BP535/30)3个滤光片分别作为供体、受体和FRET3个通道的滤光片。分别采用单独转染并表达pCFP和pYPet的细胞来检测并计算供体的校正因子A和B,MetaFlour FRET软件计算供体及受体串色常数,得到校正后的FRET。②FRET检测:将滤光片转到CFP通道,镜下确定视野,选定待测细胞,将滤光片转到FRET通道,拍照获取单张细胞图片,对待测细胞圈定几个感兴趣的区域,同时选定1个无细胞的背景区域,用以扣除背景信号,连续采集CFP、YPet和FRET 3个通道的图片;将前面计算出的供体校正因子A和受体校正因子B输入MetaFlour FRET 4.6软件自带公式,运用校正的方法计算出校正FRET,显示FRET效率。
2 结 果
2.1PCR基因的克隆以引物P1和P2利用高保真PCR技术扩增含酶切位点和保护碱基的YPet产物,产物基因全长780 bp。见图2。

M1:DNA marker Ⅱ 1 200 bp;M2:DNA marker Ⅲ 4 500 bp;Lane 1:PCR product.
图2YPet的PCR产物
Fig.2PCR product of YPet
2.2uPA biosensor的构建及鉴定以Src-biosensor为起点,通过中间载体pMDTM-18T,依次获得Src-pMDTM-18T和uPA-pMDTM-18T2个中间重组子,最后获得重组质粒pcDNA3.1-ECFP-substrate-linker-YPet(uPA biosensor),主要部分结构示意图见图3。PCR鉴定(PCR 产物substrate-linker-YPet约为780 bp)和双酶切鉴定(pMDTM-18T-ECFP载体约为3 892 bp,substrate-linker-YFP约为780 bp)电泳见图4和图5,送上海生工生物技术公司测序验证。
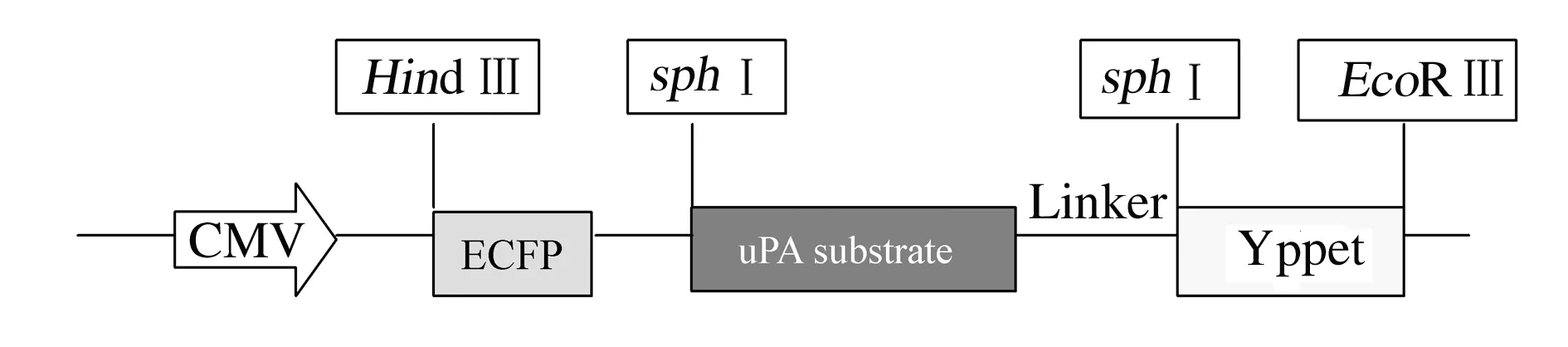
CMV:CMV promoter; ECFP:Enhanced cyan fluorescent protein; Linker:A nonsense DNA sequence; YPet:Yellow fluorescent protein variant.
图3uPA biosensor主要部分结构示意图
Fig.3Domain structure of uPA biosensor
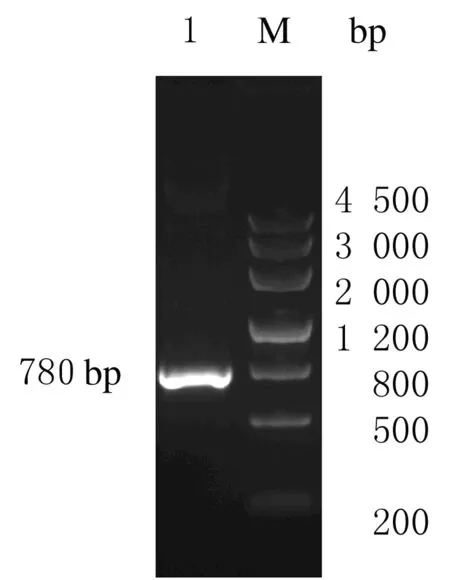
Lane 1:uPA biosensor vector PCR product;M:DNA marker Ⅲ 4 500 bp.
图4uPA biosensor载体PCR鉴定图
Fig.4Identification of conducted uPA biosensor vector by PCR
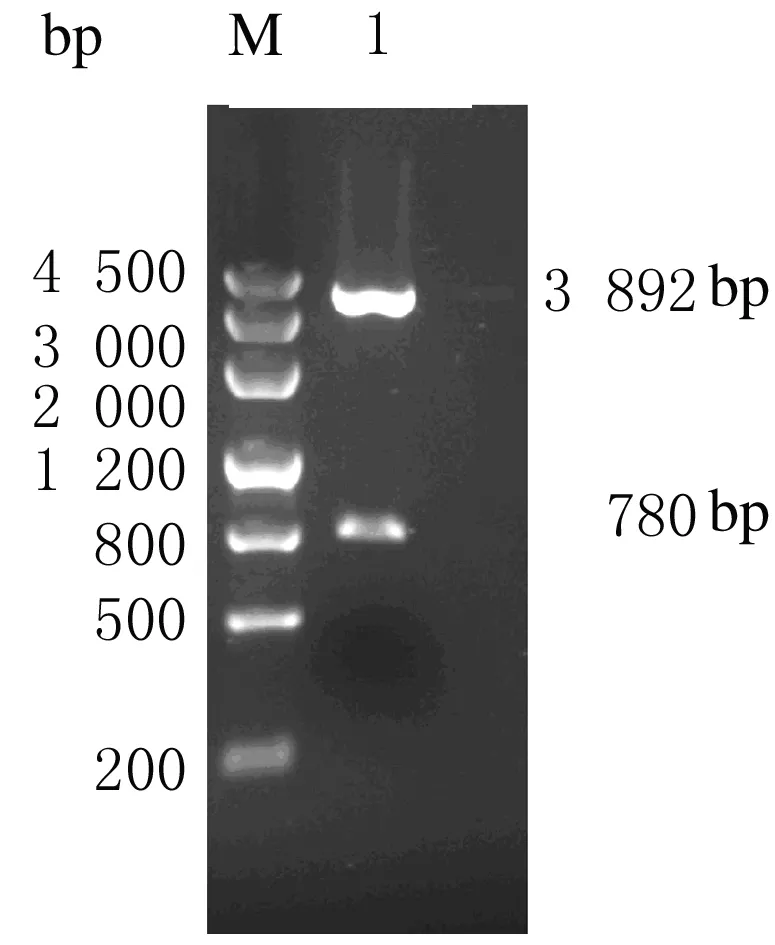
M:DNA marker Ⅲ 4 500 bp;Lane 1:uPA-pMDTM-18T digested bySphⅠandEcoRⅠ.
图5uPA-pMDTM-18T 中间重组子双酶切鉴定
Fig.5Identification of conducted uPA-pMDTM-18T by double restriction enzyme
2.3293T细胞中uPA biosensor的表达和FRET值检测在488 nm激光转染 uPA biosensor的293T细胞,采用515 nm的GFP通道观察:细胞可以发出较强的绿色荧光,整体转染效率达到40%(图6,见插页二)。免疫荧光证实293T细胞膜表达uPA biosensor(图7,见插页二)。另外除了能在ECFP通道和YPet通道看到均匀分布的青色和黄色荧光外,还可以在FRET通道看到明显的黄色荧光即FRET现象(图8,见插页二)。
2.4重组人uPA(rhuPA)诱导uPA biosensor融合蛋白的动力学研究将uPA biosensor质粒转染到293T细胞,表达24 h后,观察uPA诱导处理前后uPA biosensor融合蛋白FRET现象的变化情况。细胞分为对照组(n=5)和实验组(n=5),对照组加入PBS液,实验组加入rhuPA(0.1 ng·L-1)。对照组在实验记录内,YPet和ECFP的荧光强度无任何变化;实验组在rhuPA处理前20 min,ECFP和YPet的荧光强度无变化,在添加rhuPA处理后,出现了ECFP荧光强度明显增强而YPet的荧光强度明显减弱的现象,YPet/ECFP的强度也明显减弱,变化持续时间40 min,之后YPet/ECFP的强度逐渐趋于稳定。见图9(插页二)和图10。基于ECFP和YPet荧光强度随时间变化的比率,证实uPA biosensor被rhuPA激活并发生了空间构象的变化。

图10Excel分析转染uPA biosensor的293T细胞在rhuPA刺激下的FRET
Fig.10 FRET in 293T cells transfected with uPA biosensor after incubation with rhuPA with Excel analysis
3 讨 论
本研究构建uPA bisonsor时,选择了2种质粒,即Src biosensor和中间载体pMDTM-18T,且两者均有合适的酶切位点,便于用基因工程的方法构建uPA biosensor。在uPA作用底物两端分别添加供体和受体荧光蛋白,即ECFP和YPet,两者与CFP和YFP相比不仅荧光强度有所增加而且有更好的光谱重叠,极大地提高了FRET效率,根据uPA被激活后作用于其底物(substrate),使ECFP和YPet空间构象变化改变了供、受体荧光蛋白的方向和距离,产生FRET现象。通过检测FRET变化数据可以跟踪观察uPA被激活的时间和空间信息。
本研究将uPA biosensor转染入293T细胞中,转染效率达40%,并在FRET通道观察到了FRET现象,说明uPA biosensor融合蛋白在活细胞中得到表达,能够产生FRET现象,即在活细胞中证明了uPA biosensor构建成功,并且采用免疫组织化学方法证明了uPA biosensor的膜表达。本研究尝试采用rhuPA与293T细胞共孵育,rhuPA处理前20 min,可以看到ECFP和YPet荧光强度无变化,在添加rhuPA处理后,出现了ECFP荧光强度明显增强而YPet荧光强度明显减弱的现象,YPet/ECFP的强度也明显减弱,且rhuPA处理20 min后变化最明显,之后YPet/ECFP的强度逐渐趋于稳定,上述结果进一步验证了uPA可以作用于uPA biosensor产生FRET现象。
近年来大量研究证实了各种因素导致关节软骨降解与合成之间的代谢失衡是OA软骨退变的主要原因,uPA和MMPs是最为重要的降解酶[11-12]。uPA不仅可以影响软骨代谢的过程,还可以直接降解软骨细胞外基质,更为重要的是uPA激活MMPs酶原,与活化的MMPs共同促进软骨组织的降解[13-14],而且本课题组的前期研究[15-16]结果表明:OA滑膜衬里层细胞可见大量uPA/uPA RNA表达现象,在OA患者血清及关节液中uPA和MMP-3的表达水平均明显升高,与关节退变程度一致。应用MMPs抑制剂——强力霉素进行干预后,兔OA模型中软骨退变的进程明显降低,而且可逆转早期软骨退变[17]。本课题组成功构建了高效靶向uPA-siRNA慢病毒载体,已经证实其可稳定转染软骨细胞并高效抑制uPA基因表达并促进软骨细胞增殖[18]。上述研究结果证实了uPA在软骨退变中发挥着始动因子的作用。另外学者[19-21]发现:Wnt/β-catenin信号通路在OA的发生发展中起着极其重要的作用,但uPA与该信号途径的关系未见文献报道。本课题组在后续实验中,将uPA biosensor转染到关节软骨细胞,用于探讨uPA与Wnt/β-catenin信号通路以及MMPs的调控关系,这将有助于更深入地了解OA的病因和发病机制,为OA基因的靶点治疗提供可靠的理论依据。
[1]Noh H,Hong S,Huang S.Role of urokinase receptor in tumor progress and development[J].Theranostics,2013,3(7):487-495.
[2]Mekkawy AH,Pourgholami H,Morris DL.Involvement of urokinase-type plasminogen activator system in cancer:an overview[J].Med Res Rev,2014,34(5):918-956.
[3]Fuessel S,Erdmann K,Taubet H,et al.Prognostic impact of urokinase-type plasminogen activator system components in clear cell renal cell carcinoma patients without distant metastasis[J].BMC Cancer,2014,14(1):974-977.
[4]Kim KS,Lee YA,Choi HM,et al.Implication of MMP-9 and urokinase plasminogen activator (uPA) in the activation of pro-matrix metalloproteinase (MMP)-13[J].Rheumatol Int,2012,32(10):3069-3075.
[5]Sekar RB,Periasamy A.Fluorescence resonance energy transfer (FRET) microscopy imaging of live cell protein localizations[J].Cell Biol,2003,160(5):629-633.
[6]Day RN,Schaufele F.Imaging molecular interactions in living cells[J].Mol Endocrinol,2005,19(7):1675-1686.
[7]Gruenwald K,Holland JT,Stromberg V,et al.Visualization of glutamine transporter activities in living cells using genetically encoded glutamine sensors [J].PLoS One,2012,7(6):385-391.
[8]Kaláb P,Soderholm J.The design of Förster (fluorescence) resonance energy transfer (FRET)-based molecular sensors for Ran GTPase[J].Methods,2010,51(2): 220-232.
[9]Violin JD,Zhang J,Tsien RY,et al.A genetically encoded fluorescent reporter reveals oscillatory phosphorylation by protein kinase C [J].J Cell Biol,2003,161(5):899-909.
[10]Meng F,Sachs F.Visualizing dynamic cytoplasmic forces with a compliance-matched FRET sensor[J].J Cell Sci,2011,124(2):261-269.
[11]Hashimoto M,Nakasa T,Hikata T,et al.Molecular network of cartilage homeostasis and osteoarthritis[J].Med Res Rev,2008,28(3):464-481.
[12]Li H,Feng F,Bingham CO,et al.Matrix metalloproteinases and inhibitors in cartilage tissue engineering[J].J Tissue Eng Regen Med,2012,6(2):144-154.
[13]Kim KS,Lee YA,Choi HM,et al.Implication of MMP-9 and urokinase plasminogen activator(uPAR)in the activation of pro-matrix metalloproteinase(MMP)-13 [J].Rheumatol Int,2012,32(10):3069-3075.
[14]Aida Y,Honda K,Tanigawa S,et al.IL-6 and soluble IL-6 receptor stimulate the production of MMPs and their inhibtors via JAK-STAT and ERK-MAPK signalling in human chondrocytes[J].Cell Biol Int,2012,36(4):367-376.
[15]何斌,史晨辉,王永明,等.关节软骨破坏与尿激酶型纤溶酶原激活物的影响[J].中国组织工程研究与临床康复,2007,11(6):15-18.
[16]王维山,史晨辉,周卓浩,等.一侧兔膝关节注射外源性尿激酶型纤溶酶原激活物引起双侧膝关节软骨降解的实验[J].中国组织工程研究与临床康复,2007,11(19):3738-3741.
[17]张尚普,史晨辉,赵瑾.强力霉素对兔制动骨关节炎模型的治疗作用[J].中国矫形外科杂志,2009,17(12):935-937.
[18]Wang WS,Guo FJ,Shi CH,et al.Construction and verification of the targeted uPA-shRNA lentiviral vector and evaluation of the transfection and silencing rate[J].Exp Ther Med,2014,8(2):435-441.
[19]Olex Al,Turkett WH,Fetrow JS,et al.Integration of gene expression date with network-based analysis to identify signaling and metabolic pathways regulated during the development of osteoarthritis[J].Gene,2014,542(1):38-45.
[20]Zhu M,Tang D,Wu Q,et al.Activation of beta-catenin signaling in articular chondrocytes leads to osteoarthritis like phenotype in adult beta-catenin conditional activation mice[J].Bone Miner Res,2009,24(1):12-21.
[21]Zhang Y,Pizzute T,Pei M.A review of crosstalk between MAPK an Wnt signals and its impact on cartilage[J].Cell Tissue Res,2014,358(3):633-649.
Construction and identification of urokinase-type plasminogen activator biosensor plasmid
CUI Ganghua1,2,RAO Feng1,2,WANG Yan1,2,CAO Weiwei2,LIU Wei2,WANG Weishan1,2,SHI Chenhui1,2
(1.Department of Orthopedics,First Affiliated Hospital,School of Medical Sciences,Shihezi University,Shihezi 832000,China; 2.Key Laboratory of Xinjiang Endemic and Ethnic Diseases,Ministry of Education,Shihezi University,Shihezi 832000,China)
ObjectiveTo construct the eukaryotic expression vector urokinase-type plasminogen activator (uPA) biosensor which was the composition of the fusion protein enhanced cyan fluorescent protein -uPA (substrate)-yellow fluorescent protein variant (ECFP-uPA substrate-linker-YPet).Methods By the template Src-biosensor,the YPet primers were designed by Primer Premier 5.0 software,and the restriction enzyme sites,uPA substrate gene sequence and linker were added in its 5′ end.With the intermediate vector pDMTM-18T,an eukaryotic expression vector which contained a fusion protein of ECFP-uPA substrate-linker-YPet was constructed by genetic engineering.Then the uPA biosensor was transfected into 293T cells.The transfection efficiency and expression of fusion proteins were observed after 24 h.Fluorescence resonance energy transfer (FRET) was observed by the inversion fluorescence microscope and measured by the MetaFlour FRET 4.6 software.ResultsThe uPA biosensor vector was confirmed by the fragment of PCR and double restriction enzyme digestion.The transfection efficiency was nearly 40%.The immunofluorescence detection results displayed that uPA biosensor fusion protein expressed in the 293T cells membrane and the FRET of uPA biosensor in the living 293T cells was observed after incubation with the recombinant human uPA(rhuPA).ConclusionuPA biosensor is successfully constructed and it could be used as a molecular probe to study the temporal and spatial variation of uPA in living cells.
urokinase-type plasminogen activator; biosensor; fluorescence resonance energy transfer; osteoarthritis
1671-587Ⅹ(2015)06-1124-06
10.13481/j.1671-587x.20150605
2015-02-02
国家自然科学基金资助课题(81160225,81260453,81360451);新疆兵团医药卫生专项基金资助课题(2013BA020);新疆兵团国际交流与合作专项基金资助课题(2012BC002,2011BC004);新疆兵团科技创新团队专项基金资助课题(2014CC002)
崔钢华(1988-),男,河南省漯河市人,在读医学硕士,主要从事关节外科学方面的研究。
王维山,副教授,副主任医师,硕士研究生导师 (Tel:0993-2859427,E-mail:wwsmc2002@sina.com);
史晨辉,教授,硕士研究生导师(Tel:0993-2859427,E-mail:sch7890@yahoo.com)
R34
A
