TTF1-NP诱导人肝癌 HepG-2细胞凋亡的内质网应激作用
2015-09-05刘荣荣刘炳彤张学武
肖 斌,刘荣荣,刘炳彤,张学武
(延边大学医学院生物化学与分子生物学教研室,吉林 延吉133000)
TTF1-NP诱导人肝癌 HepG-2细胞凋亡的内质网应激作用
肖斌,刘荣荣,刘炳彤,张学武
(延边大学医学院生物化学与分子生物学教研室,吉林 延吉133000)
目的:通过不同剂量长白山珍珠梅黄酮纳米粒(TTF1-NP)分别诱导不同种人肝癌细胞和人正常肝细胞凋亡,探讨TTF1-NP对不同细胞的作用及涉及的内质网应激作用机制。方法:以体外培养的不同种人肝癌细胞(Hep3B、HepG-2和PLC/PRF/5)和人肝细胞(Chang Liver)为模型,实验分为阴性对照组、阳性对照组(5-Fu)和TTF1-NP实验组,TTF1-NP处理浓度分别为50、100和200 μmol·L-1。采用MTT法检测TTF1-NP对不同种细胞的生长抑制作用,选择最佳抑制效果细胞(HepG-2)为主要研究细胞株;利用流式细胞术检测细胞凋亡率;应用Western blotting和免疫细胞化学染色技术检测内质网应激关键蛋白表达情况;通过内质网应激抑制剂4-苯丁酸(4-PBA)作用,再次检测相关蛋白的表达情况。 结果:与阴性对照组比较,不同浓度的TTF1-NP组4种细胞生长抑制率升高(P<0.05或P<0.01),且呈一定的浓度和时间依赖关系。细胞凋亡检测,与阴性对照组比较,TTF1-NP实验组随药物浓度增加其细胞凋亡率逐渐上升(P<0.05或P<0.01);内质网应激关键蛋白GRP78和caspase-4 随着TTF1-NP浓度增加,表达水平逐渐升高(P<0.05或P<0.01)。4-PBA有效抑制GRP78和caspase-4表达,与TTF1-NP组比较差异有统计学意义(P<0.05或P<0.01)。 结论: TTF1-NP可诱导人肝癌 HepG-2 细胞凋亡;内质网应激途径是 TTF1-NP 诱导人肝癌 HepG-2 细胞凋亡的主要作用机制之一。
珍珠梅黄酮纳米粒;内质网应激;细胞凋亡;肝肿瘤
内质网应激(endoplasmic reticulum stress,ERS)反应是真核生物体内一个复杂的、多功能的信号转导途径,参与生物体内的细胞凋亡、自噬和氧化应激等多种生物现象[1-2]。研究[3-4]表明:ERS 参与多种肿瘤的发生、发展过程。ERS 通过活化未折叠蛋白反应、介导自噬、诱导细胞凋亡和调节氧化应激等发挥调节肿瘤生长的作用,ERS 与肝癌的发生、发展也密切相关。长白山珍珠梅(Sorbaria Sorbifolia) 属蔷薇科植物,被《抗癌中药大辞典》收录为长白山抗癌药。本课题组前期研究[5-6]发现:珍珠梅发挥抗癌作用的主要成分为5,2′,4′- 三羟基- 6,7,5′- 三甲氧基黄酮(TTF1),TTF1可以抑制小鼠S180肉瘤及人肝癌HepG-2细胞生长,其主要作用机制与抑制肿瘤血管生成及活化线粒体途径诱导细胞凋亡有关。珍珠梅黄酮纳米粒(TTF1-NP)是以生物体内可降解材料硬脂酸为载体,采用乳化-低温固化法制备生物体,可降解吸收的直径为150~200 nm的新剂型。本实验探讨TTF1-NP诱导人肝癌HepG-2 细胞凋亡过程中内质网应激作用机制,为在天然植物中筛选新的抗肝癌药物提供实验依据。
1 材料与方法
1.1细胞、主要试剂和仪器人肝癌细胞(HepG-2、Hep3B和PLC/PRF/5)和人正常肝细胞(Chang Liver)为本教研室冻存。TTF1由延边大学药学院关丽萍老师惠赠,小牛血清和DMEM培养基为美国Gibco公司产品,Annexin V-FITC凋亡试剂盒为美国BD公司产品,caspase-4、GRP78和β-actin抗体为英国Abcom公司产品,蛋白检测试剂盒由南京建成生物工程研究所提供。DYY-7C电泳仪为北京市六一仪器厂产品,BioSpectrum 300凝胶成像系统为美国UVP公司产品,RT-6000雷杜酶标仪为深圳雷杜生命科学股份有限公司产品。
1.2TTF1-NP的制备依据参考文献[7],分别称取处方量的Poloxamer 188、TTF1、脂酸和卵磷脂置于100 mL具塞锥形瓶中,加入适量的双蒸水,于(74 ±3)℃ 水浴下,磁力搅拌溶解,分别构成水相及有机相。用注射器将有机相缓慢注入搅拌(1 000 r·min-1) 的水相中,得到半透明纳米乳剂。将纳米乳剂迅速加入至一定体积的搅拌的水相中( 0~2 )℃,继续搅拌1 h,即得到TTF1- SLN混悬液。然后进行TTF1-SLN表征确定、包封率及体外释放度的测定。
1.3细胞及培养HepG-2、Hep3B、PLC/PRF/5和Chang Liver分别用含有10%小牛血清和1×105U·L-1DMEM培养基,置于37℃、5% CO2培养箱中全湿常规培养。取对数生长期细胞用于下一步实验。
1.4MTT法检测TTF1-NP对多种细胞的生长抑制作用取对数生长期的HepG-2、Hep3B、PLC/PRF/5和Chang Liver细胞,接种于96孔板中(6×103/孔)。培养24 h细胞贴壁后,分为50、100和200 μmol·L-1TTF1-NP实验组,阴性对照组(DMEM常规培养)及阳性对照组(5-Fu 10 μmol·L-1)。分别培养24、48和72 h,加入5 g·L-1MTT溶液20 μL,培养4 h,加入180 μL二甲基亚砜(DMSO),测定570 nm处各孔内吸光度(A)值。细胞生长抑制率=(1-样本平均A值/阴性对照组平均A值)×100%。
1.5流式细胞术检测细胞凋亡按1.3实验分组后,将各组细胞收集到15 mL离心管内,1 000 r·min-1离心5 min,冰PBS制成细胞悬液。细胞计数(保证每个样本数大约1×106个细胞)。1 000 r·min-1离心5 min,弃去离心管内液体,用200 μL结合缓冲液重悬细胞,避光孵育室温20 min,加入 Annexin V 10 μL,避光室温静止10 min。1 000 r·min-1离心5 min,弃去液体,重新加入结合缓冲液重悬细胞,每个样本加入5 μL PI,避光孵育。上机检测。采用FACSDiva 4.1 软件对结果进行分析,结果以凋亡细胞百分率表示。
1.6Western blotting法检测样品GRP78和caspase-4蛋白表达提取1.4各实验组全蛋白。阴性对照组和100 μmol·L-1TTF1-NP实验组分别加入ERS 抑制剂4-PBA作用48 h后,提取阴性对照组、阴性对照加4-PBA组、100 μmol·L-1TTF1-NP实验组和100 μmol·L-1TTF1-NP实验组加4-PBA组的全蛋白。按照考马斯亮蓝蛋白检测试剂盒说明书操作,计算各蛋白样品浓度。制备相关分子质量的凝胶,加样,电泳(80 V, 60 ~90 min),转膜(100 V,30~60 min)。取出膜浸泡在5% 脱脂奶粉中,室温封闭2 h。加入抗体caspase-4 (1∶1 000) 和 GRP78 (1∶1 000) 4℃,过夜,PBS 清洗细胞,滴加二抗 (1∶5 000),室温2 h,PBS 清洗细胞。曝光,拍照。 应用Image J软件对所得条带进行灰度分析。
1.7免疫细胞化学法检测样品GRP78和caspase-4表达将各实验组细胞清洗后,4% 多聚甲醛固定20 min,山羊血清室温封闭30 min。湿盒内孵育一抗 caspase-4(1∶100)、GRP78 (1∶100) 4℃ 孵育过夜,PBS 清洗后加二抗(1∶1 000)37℃ 孵育2 h。适量 A 液与 B液等体积混合,细胞爬片内加入约100 μL 混合液,避光孵育 20 min。PBS 清洗细胞,二甲苯内浸泡 15 min,晾干,中性树胶封片。
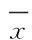
2 结 果
2.1TTF1-NP 制备长白山珍珠梅在乙酸乙酯回流多次提取、减压浓缩、反复分离及氯仿-甲醇的梯度洗脱作用下,得到TTF1单体化合物。见图 1。以硬脂酸为载体,采用乳化-低温固化法最终制成平均粒径为(195.2±35.2)nm和平均包封率为64.57%的TTF1-NP。
2.2MTT法检测细胞生长抑制率不同浓度的TTF1-NP处理不同时间后,4种细胞生长均受到不同程度的抑制,且呈一定的浓度和时间依赖关系。人肝癌HepG-2细胞在相同作用时间内抑制率最高,达到72.6%,与阴性对照组比较差异有统计学意义(P<0.01);人正常肝细胞Chang Liver 细胞抑制较弱,与阴性对照组比较差异无统计学意义(P>0.05)。见表1。以下实验选取人肝癌 HepG-2细胞为实验对象。
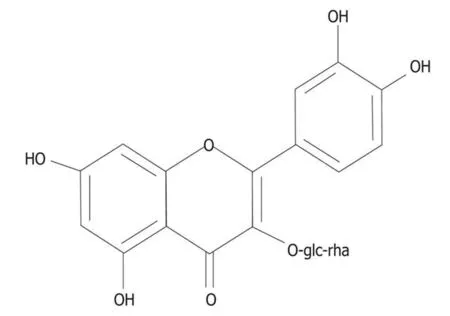
图15,2′,4′-三羟基-6,7,5′-三甲氧基黄酮单体化合物化学结构式
Fig.1Chemical structure of TTF1
2.3流式细胞术检测细胞凋亡率阴性对照组细胞存活率为91.3%,凋亡率仅为4.9%。TTF1-NP实验组和5-Fu组细胞的存活率逐渐下降、凋亡率逐渐上升。50、100和200 μmol·L-1TTF1-NP实验组和阳性对照组凋亡率依次为:50.0%、86.2%、89.6%和90.1%,与阴性对照组(4.9%)比较,差异有统计学意义(P<0.05)。见图2A和B。
2.4免疫细胞化学染色检测ERS关键蛋白表达 经免疫细胞化学染色检测,ERS起始反应信号蛋白GRP78及ERS特异性促凋亡蛋白caspase-4阴性对照组细胞呈多角形,结构正常,胞质棕色淡染,50 μmol·L-1TTF1-NP组细胞形态略有改变,100 μmol·L-1TTF1-NP组细胞变圆;200 μmol·L-1TTF1-NP组细胞数减少明显,且核边移,深染,固缩,细胞变小,胞质棕色深染。见图 3(插页二)。
2.5TTF1-NP 对 ERS 关键因子表达阴性对照组ERS反应起始蛋白GRP78和凋亡蛋白caspase-4均有表达,但表达量较低,随着TTF1-NP剂量增加,GRP78和caspase-4表达水平显著升高,与阴性对照组比较,差异有统计学意义(P<0.05)。见图4A和B。
2.6TTF1-NP 与 ERS 抑制剂对ERS关键因子表达阴性对照组GRP78、caspase-4蛋白与加入4-PBA后蛋白表达无明显变化,TTF1-NP 实验组GRP78、caspase-4 蛋白表达量增加,加入4-PBA后表达量明显下降(P<0.05),定性分析结果见图5A,定量分析结果见图5B。
表1TTF1-NP作用下人肝癌HepG-2、Hep3B、PLC/PRF/5和Chang Liver细胞的生长抑制率


*P<0.05,**P<0.01vsvehicle group.
3 讨 论
通过不同浓度(50、100和200 μmol·L-1)TTF1-NP分别处理人肝癌HepG-2、Hep3B、PLC/PRF/5和人正常肝Chang Liver细胞24、48和72 h结果显示:TTF1-NP对4种细胞均有不同程度的抑制作用,有时间和浓度依赖性,对正常肝细胞Chang Liver抑制作用弱,对3种人肝癌细胞抑制作用均较强。流式细胞仪检测结果:TTF1-NP可以诱导细胞凋亡,而且有一定的剂量依赖性,说明研究TTF1-NP抗肿瘤作用有一定的科学意义。
当ERS发生时,GRP78首先感知内质网腔内的压力,并与内质网膜上的三大跨膜感受器蛋白PERK、ATF6和IRE-1解离、活化并大量表达[8-11]。caspase-12是ERS反应的特异性凋亡蛋白,只在ERS反应中被活化,当ERS强度过强或持续时间过长时,可以引起IRE1活化并募集内质网膜上的TRAF2,剪切无活性的caspase-12前体,生成活性caspase-12片断,激活下游相关caspase家族成员,启动caspase 家族级联反应,促进凋亡。人体中caspase-12基因以其同源因子caspase-4形式表达,功能与鼠科类动物体内的caspase-12相同。Wang等[12]和Afrin等[13]研究发现:caspase-12/4可以作为ERS关键凋亡因子诱导细胞凋亡。Western blotting 和免疫细胞化学染色结果显示:TTF1-NP导致人肝癌HepG-2细胞GRP78、caspase-4蛋白表达水平逐渐升高,表明ERS参与了 TTF1-NP诱导细胞凋亡过程。
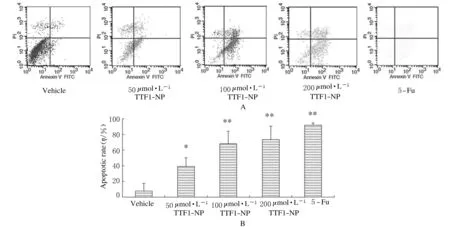
A:Annexin-Ⅴ FITC/PI double-staining method;B:Apoptotic rate.
图2Annexin-Ⅴ FITC/PI双染流式细胞术检测细胞凋亡
Fig.2Apoptosis detected by Annexin-Ⅴ FITC/PI double-staining method
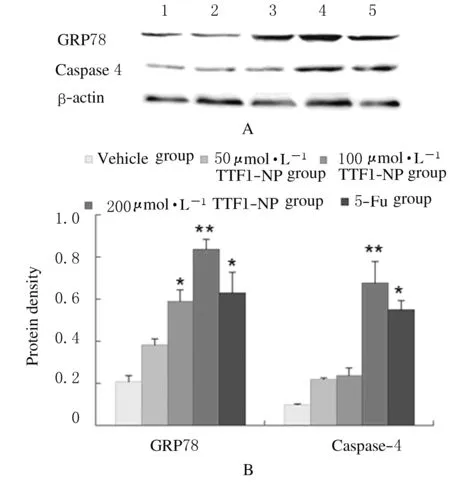
A:Western blotting method;Lane 1:Vehiche group;Lane 2-4:50,100 and 200 μmol·L-1TTF1-NP groups;Lane 4:5-Fu group.B:Expression levels of GRP78 and caspase-4 proteins.
图4Western blotting法检测ERS关键蛋白表达
Fig.4Expressions of ERS key proteins detected by Western blotting method
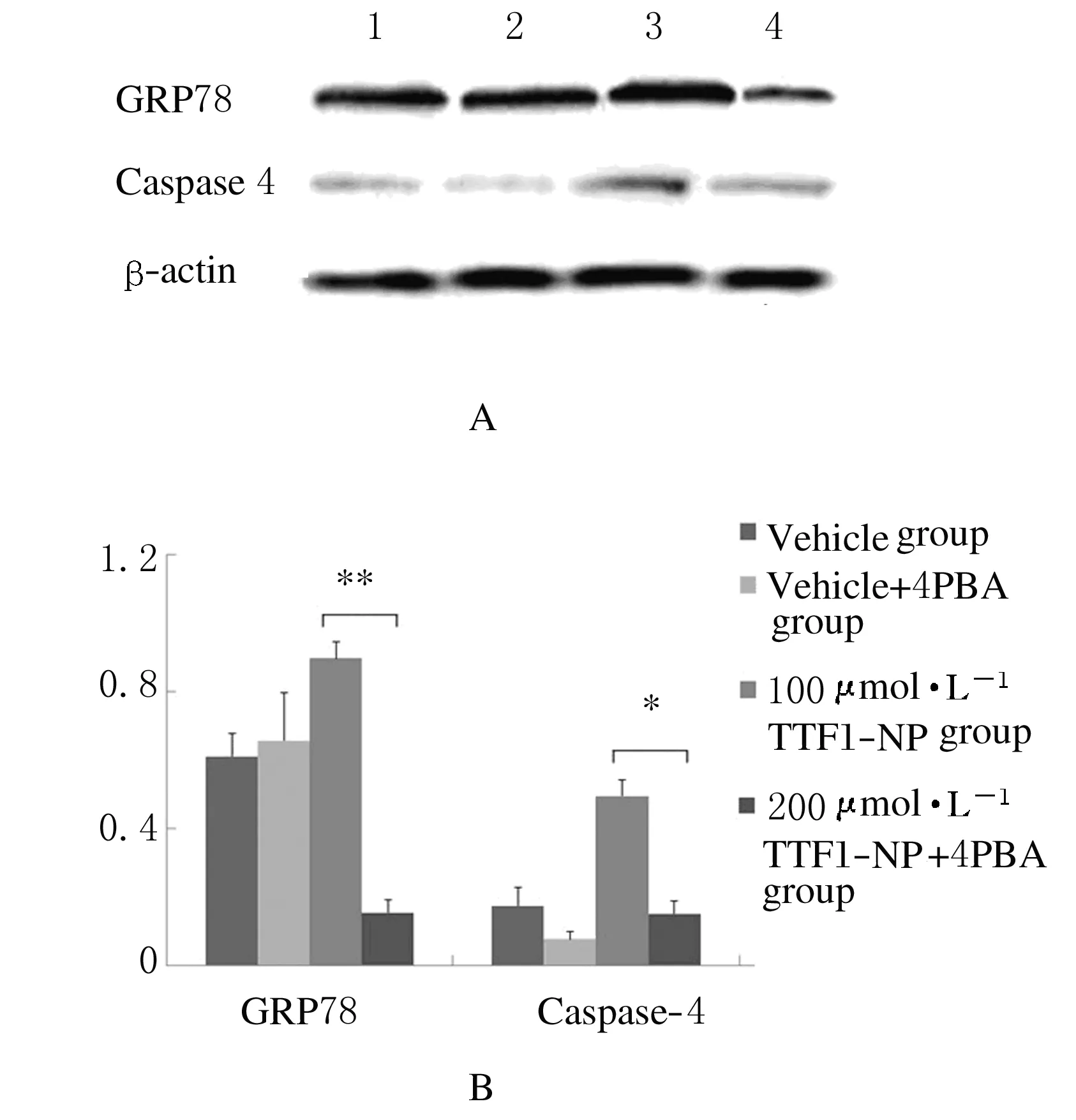
A:Western blotting method;Lane 1:Vehiche group;Lane 2-4:50,100 and 200 μmol·L-1TTF1-NP groups;Lane 4:5-Fu group.B:Expression levels of GRP78 and Caspase 4 proteins.
图5Western blotting法检测4-PBA作用后ERS关键蛋白表达
Fig.5Expressions of ERS key proteins after treated with 4-PBA detected by Western blotting method
加入ERS抑制剂4-PBA后,4-PBA可以抑制TTF1-NP诱导活化的GRP78和caspase-4蛋白的表达,进一步证实了TTF1-NP可以通过活化ERS诱导人肝癌HepG-2细胞凋亡。
本实验通过检测TTF1-NP诱导人肝癌HepG-2细胞凋亡及ERS关键蛋白表达变化表明:TTF1-NP可以抑制人肝癌HepG-2细胞生长,ERS的活化是其作用机制之一。本课题组将针对TTF1-NP抗肿瘤作用机制进行深入研究。
[致谢:本文得到延边大学医学院郑益星教授的大力帮助,在此致以谢意!]
[1]Chiu HW,Xia T,Lee YH,et al. Cationic polystyrene nanospheres induce autophagic cell death through the induction of endoplasmic reticulum stress[J].Nanoscale,2015,7(2):736-746.
[2]Maiese K.Programming apoptosis and autophagy with novel approaches for diabetes mellitus[J].Curr Neurovasc Res,2015,12(2):173-188.
[3]Xiao B,Cui LM,Ma DJ,et al.Endoplasmic reticulum stress in diethylnitrosamine induced rat liver cancer[J].Oncol Lett, 2014,7(1):23-27.
[4]金学英,汪步海.内质网应激与肿瘤[J].东南大学学报:医学版,2013,32(1):110-114.
[5]Li Y,Cui FD,Bian L,et al.TTF1-induced apoptosis of HepG-2 cells through a mitochondrial pathway[J].Oncol Rep,2011,26(3):651-657.
[6]Liu C,Li XW,Cui LM,et al.Inhibition of tumor angiogenesis by TTF1 from extract of herbal medicine[J].World J Gastroenterol,2011,17(44):4875-4882.
[7]李妍,崔逢德,张学武.珍珠梅黄酮固体脂质纳米粒的制备工艺[J].时珍国医国药,2012, 23(10):2549-2550.
[8]Jiang X,Kanda T,Nakamoto S,et al.Knockdown of glucose-regulated protein 78 enhances poly(ADP-ribose) polymerase cleavage in human pancreatic cancer cells exposed to endoplasmic reticulum stress[J].Oncol Rep,2014,32(6):2343-2348.
[9]Li K,Han X.Endoplasmic reticulum stress is involved in the lidocaine-induced apoptosis in SH-SY5Y neuroblastoma cells[J].J Mol Neurosci,2015,56(1):12-130.
[10]韩英,朱疆依.肝硬化并发肝癌危险因素筛查及综合治疗[J].中国实用内科杂志,2013,33(9):694-697.
[11]李鹏,丁惠国.肝癌危险因素及早诊断与筛查[J].中国实用内科杂志,2015,35(3):193-195.
[12]Wang M,Meng XB,Yu YL,et al.Elatoside C protects against hypoxia/reoxygenation-induced apoptosis in H9c2 cardiomyocytes through the reduction of endoplasmic reticulum stress partially depending on STAT3 activation[J].Apoptosis,2014,19(12):1727-1735.
[13]Afrin MR,Arumugam S,Soetikno V,et al.Curcumin ameliorates streptozotocin-induced liver damage through modulation of endoplasmic reticulum stress-mediated apoptosis in diabetic rats[J].Free Radical Res,2014,49(3):1-31.
Induction effect of TTF1-NP on human hepatoma cell apoptosis through ERS-mediated pathway
XIAO Bin,LIU Rongrong,LIU Bingtong,ZHANG Xuewu
(Department of Biochemistry and Molecular Biology,College of Medical Sciences,Yanbian University,Yanji 133000,China)
Objective To explore the effects of different doses of 5,2′,4′-trihydroxy-6,7,5′-trimethoxyflavone nanoparticles (TTF1-NP) on the apoptosis of human hepatoma cells and human normal hepatocytes, and to explore their mechanisms through endoplasmic reticulum stress (ERS)-meditated apoptosis pathway. MethodsThe human hepatoma cell lines (HepG2,Hep3B and PLC/PRF/5) and human hepatocytes (Chang Liver) were used as cell model,and divided into vehicle,5-Fu and TTF1-NP treated groups with the concentrations of 50,100 and 200 μmol·L-1respectively. The inhibitory effects of TTF1-NP on the cell growth were assessed using MTT assay and the best inhibitory one (HepG-2) was selected as the main research cell lines.Flow cytometry was used to detect the TTF1-NP-induced apoptosis; Western blotting and immunocytochemistry were used to determine the expressions of ERS key proteins.Finally,the expressions of key proteins were detected by Western blotting after using the ERS inhibitor 4-PBA.ResultsCompared with vehicle group,the inhibitory rates of growth of 4 kinds of human hepatoma cells in different concentrations of TTF1-NP groups were increased(P<0.05 orP<0.01); moreover,the inhibitory effects of TTF1-NP were in a time- and dose-dependent manner.Compared with vehicle group,the apoptotic rates of the cells in TTF1-NP groups were increased in a dose-dependent manner(P<0.05 orP<0.01); the expression levels of ERS key proteins GRP78 and caspase-4 were increased with the increasing of the concentration of TTF1-NP(P<0.05 orP<0.01).The expression levels of ERS key proteins GRP78 and caspase-4 induced by TTF1-NP were inhibited by ERS inhibitor 4-PBA(P<0.05 orP<0.01).ConclusionTTF1-NP can induce the apoptosis of HepG2 cells; ERS pathway plays a central role in TTF1-NP-induced apoptosis of HepG-2 cells.
5,2′,4′-trihydroxy-6,7,5′-trimethoxyflavone nanoparticles; endoplasmic reticulum stress; apoptosis;liver neoplasms
1671-587Ⅹ(2015)06-1118-06
10.13481/j.1671-587x.20150604
2015-04-14
国家自然科学基金资助课题(81260655);吉林省科技厅科技发展计划项目资助课题(201215242)
肖斌(1988-),女,吉林省大安市人,在读医学博士,主要从事分子肿瘤学方面的研究。
张学武,教授,博士研究生导师(Tel:0433-2435102,E-mail:zhangxuewu@ybu.edu.cn)
R735.7
A
