膜反应器中环己烷脱氢反应的热力学分析
2015-09-03佘笑梅朱建华
佘笑梅,朱建华
(中国石油大学(北京)化学工程学院,北京 102249)
膜反应器中环己烷脱氢反应的热力学分析
佘笑梅,朱建华
(中国石油大学(北京)化学工程学院,北京 102249)
对膜反应器的指标反应——环己烷脱氢生成苯进行了热力学分析,计算了反应体系在不同温度条件下的吉布斯自由能变、平衡常数及不同H2移出率时环己烷的平衡转化率,据此比较了膜反应器相对于固定床反应器在提高环己烷平衡转化率方面的潜力,并进一步分析了膜反应器内不同H2移出率时环己烷平衡转化率相对于固定床反应器增加的幅度及不同H2移出率对反应苛刻度的影响。结果表明,膜反应器可有效地提高环己烷的平衡转化率,并可降低反应的苛刻度,具有良好的工业应用前景。
热力学分析 环己烷脱氢 膜反应器 转化率
环己烷选择性催化脱氢或氧化脱氢是石油工业一个非常重要的精炼和重整过程[1],是高度可逆的强吸热反应。目前工业上主要采用固定床反应器,但由于膜反应器具有良好的热稳定性、机械稳定性并可提高反应转化率,近年来得到了广泛关注,已在实验室中利用膜反应器进行了大量的加氢、脱氢、分解和氧化反应,有些小规模的膜反应器已实现了工业化应用[2]。膜反应器的常见结构如图1所示。

图1 膜反应器结构示意1—原料气进口; 2—密封环; 3—吹扫气; 4—复合膜; 5—Pt-Ag合金; 6—多孔底膜; 7—产物气出口; 8—吹扫气出口; 9—催化剂
膜反应器的结构类似于换热器中的套管结构,管壁为具有通透性的薄膜,将催化剂固定在膜内部或表面,当原料气在反应器内部流过时,在管壁薄膜上催化剂的作用下发生反应[3-5],并将反应产物通过薄膜进行分离,使分离和催化反应两个单元操作集成在同一装置中[2,6],从而简化了工艺流程,并可节省装置投资,降低操作能耗。对那些受热力学平衡限制的可逆化学反应,通过膜反应器将反应产物有选择地从反应体系中不断分离出来,可打破热力学平衡的限制,进而大幅度提高反应物的转化率[5,7],并可降低反应的苛刻度,提高催化剂的选择性[8],延长催化剂的使用寿命[9]。目前环己烷脱氢膜反应器大部分采用无机膜中的无孔膜,无孔膜的透过性与透过物质在膜内的扩散系数有关,但环己烷脱氢反应使用的钯膜或钯合金膜[5,10]具有仅让H2透过的性能,其透过机理是H2分子首先呈原子态吸附在钯膜的表面,并进一步离子化成质子和电子,然后向对面扩散而移出反应侧,即H2以H+的形式透过[3-4],而其它分子仍留在反应侧,从而实现反应产物的选择性移出。
环己烷脱氢制苯被认为是膜催化的指标反应[6,10],环己烷在一定的温度、压力、临氢和催化剂存在的条件下进行烃类分子结构重排生成苯,并副产大量氢气[11]。
从环己烷脱氢生成苯的反应方程式可以看出,该反应是分子数量增加的可逆反应,在一定的温度、压力和催化剂条件下,该反应可迅速达到平衡[6,12]。随着反应的进行,环己烷的平衡转化率受到热力学平衡的限制,采用传统的固定床反应器时环己烷的平衡转化率较低,且后续的分离、提纯处理成本较高[11]。因此,为了打破热力学平衡的限制,提高环己烷的平衡转化率,利用膜的选择渗透性[5]有选择地将反应生成的H2移出反应器,促使平衡向生成反应产物苯的方向移动,从而达到“超平衡”,提高环己烷的平衡转化率。为了研究H2的移出对环己烷平衡转化率的影响,本课题对不同温度条件下膜反应器中环己烷脱氢反应体系进行热力学分析,以确定不同H2移出率时环己烷平衡转化率的变化及其变化规律。
1 反应体系的热力学分析
1.1 反应体系的Gibbs自由能变计算
对于可逆反应的恒温、恒压过程,如果非体积功为零,系统内的反应能否向正反应方向进行,可根据其Gibbs函数判据ΔG的符号进行判定[13]:

环己烷和苯的沸点分别为80.74 ℃和80.10 ℃,无论在固定床反应器还是在膜反应器中,根据环己烷脱氢反应的温度及压力条件可知,反应涉及的各组分不会发生相变。由于反应体系为分子数增大的吸热反应,根据反应过程高温低压的特点,可将反应体系各组分视为理想气体。现根据热力学知识说明具体的计算过程[13-14]。
由热力学性质间的关系可知:
ΔG=ΔH-TΔS
(1)
式中:ΔG为反应的Gibbs自由能变,kJ/mol;ΔH为反应的焓变,kJ/mol;ΔS为反应的熵变,J/(mol·K)。由于反应的ΔH和ΔS为状态函数,故根据反应在标准状态下的ΔH和ΔS设计路径,计算在一定反应温度和压力条件下的ΔH和ΔS,设计的具体路径为:

根据热力学性质间的关系可知:
ΔH=ΔH1+ΔH2+ΔH3
(2)
ΔS=ΔS1+ΔS2+ΔS3
(3)
故有
ΔH2=ΔH-ΔH1-ΔH3
(4)
ΔS2=ΔS-ΔS1-ΔS3
(5)
其中
(6)
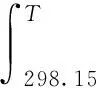
(7)

(8)
(9)
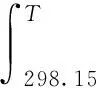
(10)

(11)
Cp,C6H12=aC6H12+bC6H12T+cC6H12T2+dC6H12T3
(12)
Cp,C6H6=aC6H6+bC6H6T+cC6H6T2+dC6H6T3
(13)
Cp,H2=aH2+bH2T+cH2T2+dH2T3
(14)
式中:Cp为恒压摩尔热容,J/(mol·K);T为温度,K;a,b,c,d为系数。计算所需的热力学数据取自文献[15-16],由上述公式可计算出不同温度条件下环己烷脱氢生成苯反应的Gibbs自由能变ΔG。
1.2 反应体系的平衡常数及环己烷平衡转化率的计算
当反应达到平衡状态时,由平衡常数的热力学定义式ΔG=-RTlnK,通过ΔG计算反应的平衡常数K,进而计算反应体系的平衡组成,并求得环己烷的平衡转化率[13]。
(15)
式中:R为摩尔气体常数,8.314 J/(mol·K);K为反应的平衡常数;pi为气体组分i的气相分压,kPa;p为反应系统总压,kPa;p为标准压力,100 kPa;vi为组分i的化学计量系数。pi与反应达到平衡时环己烷的转化率有关,在膜反应器中,可以利用膜的选择透过性将反应生成的H2移出,使平衡向右移动,控制吹扫气流量调节H2移出的比例,计算不同H2移出率时环己烷平衡转化率的变化。
根据反应式进行物料衡算,设初始进料为纯净环己烷,物质的量为1 mol,平衡时环己烷转化率为X,H2的移出率为α。

∑ni=1+3X-3X α,∑vi=3K==
(16)
式中,ni为组分i的物质的量,mol。在等压条件下,平衡常数K只是反应温度的函数,当温度一定时,平衡常数一定,因此移出H2后反应体系的平衡常数不变。由式(16),当H2的移出率α=0时,计算得出未移出H2时的环己烷平衡转化率,即采用传统固定床反应器时环己烷的平衡转化率;当H2的移出率α≠0时,计算得出不同H2移出率条件下环己烷的平衡转化率,即采用膜反应器时环己烷的平衡转化率。
2 结果与讨论
2.1 反应的Gibbs自由能变
通过热力学分析计算得到在100 kPa条件下,环己烷脱氢生成苯反应在不同温度条件下的焓变及Gibbs自由能变,结果见表1。

表1 环己烷脱氢生成苯反应的热力学计算结果
由表1可见,环己烷脱氢生成苯反应的焓变大于零,即环己烷脱氢生成苯为强吸热的可逆反应,升高温度有利于反应向生成苯的方向进行。对于可逆反应的恒温、恒压过程,如果非体积功为零,可根据其Gibbs函数判据ΔG的符号判定系统内反应能否向正反应方向进行,随温度的升高,环己烷脱氢生成苯反应的ΔG减小,T=552 K时,ΔG=0,此时反应达到平衡,T<552 K时,ΔG>0,说明反应向逆反应方向进行,T>552 K时,ΔG<0,说明反应向正反应方向进行。
2.2 反应的平衡常数及环己烷的平衡转化率
根据不同温度条件下环己烷脱氢生成苯反应的ΔG数值,依据式ΔG=-RTlnK可计算得到该反应在不同温度条件下的平衡常数K,结果见表2。

表2 不同温度条件下的反应平衡常数
由式(16)可计算得出不同温度及不同H2移出率条件下环己烷的平衡转化率,结果见图2。由图2可见:在470~570 K的温度范围内,无论是否有H2移出,环己烷的平衡转化率均随反应温度的升高而增大。这是因为环己烷脱氢反应为强吸热反应,反应温度升高将导致平衡向正反应方向移动,故使反应物环己烷的平衡转化率增大;但随反应温度的升高,环己烷平衡转化率增加的幅度减小,这是因为在H2移出率一定的情况下,随温度的升高,环己烷平衡转化率增大,反应转化率逐渐接近100%,因此在较高温度条件下,环己烷平衡转化率的增幅变小。


对比图2中同一温度条件下不同H2移出率时环己烷的平衡转化率可知,在膜反应器中,随H2移出率的增大,环己烷的平衡转化率提高,且提高的幅度逐步增大,当H2的移出率达到99.9%时,反应大幅度地向正反应方向移动,环己烷的平衡转化率接近100%,此时提高反应温度,环己烷转化率继续增大,在500 K时环己烷转化率几乎达到100%。膜反应器中H2的移出打破了反应平衡的热力学限制,实现了反应的“超平衡”,有效地提高了环己烷的平衡转化率,计算膜反应器中不同H2移出率时环己烷平衡转化率相对于固定床反应器无H2移出时的平衡转化率增加的幅度(以百分点表示),结果见图3。


由图3可见,在膜反应器中同一温度条件下,相对于固定床反应器无H2移出时,随H2移出率的增加,环己烷平衡转化率提高的幅度也逐渐增大。由此可见,膜反应器中H2的移出有效地促进了反应平衡的移动,H2移出率越大,环己烷平衡转化率增加的幅度也越大。在510 K条件下,当H2的移出率为50%时,环己烷的平衡转化率仅比未移出H2时提高10.7百分点,而当H2移出率为80%时,环己烷的平衡转化率提高31.9百分点,与H2移出率50%时相比,H2的移出率提高了30百分点,但环己烷的平衡转化率提高了21.3百分点;当H2移出率达到90%时,环己烷的平衡转化率比未移出H2时提高52.0百分点,与移出80%H2相比,H2移出率仅增加了10百分点,但环己烷的平衡转化率却提高了20.1百分点,也即H2的移出率越高,越有利于反应平衡向正反应方向进行,环己烷的平衡转化率提高的幅度越大。
从图3还可以看出,当H2移出率为80%时,随反应温度的升高,与无H2移出时相比,环己烷平衡转化率的增幅先逐步增大,在530 K时增幅达到最大值,然后随温度的继续提高,环己烷平衡转化率的增幅又逐步降低。这可能是由于环己烷脱氢生成苯的反应为强吸热反应,其反应平衡受温度的影响较大,随反应温度的提高,环己烷的平衡转化率大幅增加,但在较高的温度下,环己烷的平衡转化率已较高或接近100%,因此H2的移出虽然使环己烷平衡转化率提高,但增大的幅度逐渐减小。
此外,由计算得到的数据可知,随H2移出率的增大,环己烷平衡转化率增加的幅度最大值对应的温度降低,其中的几组计算结果如表3所示。

表3 不同H2移出率时环己烷转化率增加的幅度 百分点
由表3可见:当H2移出率为80%时,环己烷平衡转化率增加的最大幅度对应的温度为530 K;当H2移出率为90%时,环己烷平衡转化率增加的最大幅度对应的温度为520 K;而当H2移出率为99.9%时,环己烷平衡转化率增加的最大幅度对应的温度仅为480 K。因此,将反应体系中生成的H2尽可能多地移出反应系统,将有利于降低反应温度,也即反应的苛刻度。
3 结 论
(1) 通过对环己烷脱氢生成苯反应的热力学分析可知,利用膜反应器移出H2的方法提高环己烷的转化率是可行的。
(2) 在膜反应器中,与固定床反应器无H2移出时相比,随H2移出率的增加,环己烷平衡转化率增加的幅度逐渐增大;且H2的移出率越大,越有利于反应平衡向生成苯的方向进行,环己烷平衡转化率提高的幅度越大,当H2移出率为99.9%时,由于此时反应体系中生成的H2几乎被全部移出,反应平衡向生成苯的方向大幅移动,此时环己烷的平衡转化率接近100%。
(3) 当H2移出率一定时,随反应温度的升高,与无H2移出时相比,环己烷平衡转化率的增幅先增大后减小。
(4) 随H2移出率的增大,与无H2移出时相比,环己烷平衡转化率增加的幅度最高时对应的温度降低,表明将反应体系中生成的H2尽可能多地移出反应系统,将有利于降低该反应进行的温度,也即反应的苛刻度。
[1] 林晓琴.固定床反应器上环已烷氧化脱氢和苯酚与甲醇烷基化的研究[D].湖南:湖南师范大学,2007
[2] 李发永,李阳初,孔瑛,等.无机膜及无机膜反应器研究进展[J].膜科学与技术,2002,22(6):48-53
[3] 方永成,江桂秀.膜反应与膜反应器技术[J].石油炼制与化工,1994,25(3):35-40
[4] 于晓东,许勇,汪仁.膜反应器在催化反应中的研究进展[J].天然气化工:C1化学与化工,1994,19(1):37-43
[5] Farniaei M,Abbasi M,Rasoolzadeh A,et al.Performance enhancement of thermally coupling of methanol synthesis,DME synthesis and cyclohexane dehydrogenation processes:Employment of water and hydrogen perm-selective membranes via different recycle streams[J].Chemical Engineering and Processing:Process Intensification,2014,85:24-37
[6] 李安武,李玉珊,王公慰,等.膜反应器中环己烷的脱氢[J].石油化工,1996,25(9):608-611
[7] Jeong B,Sotowa K,Kusakabe K,et al.Catalytic dehydrogenation of cyclohexane in an FAU-type zeolite membrane reactor[J].Journal of Membrane Science,2003,224(1/2):151-158
[8] 陈庆龄.膜反应器催化技术及膜催化材料的进展与展望[J].化工进展,1992(2):5-11
[9] 童淮荣.无机膜催化反应的研究进展[J].化学反应工程与工艺,2005,21(4):345-352
[10]Koel B E,Blank D A,Carter E A.Thermochemistry of the selective dehydrogenation of cyclohexane to benzene on Pt surfaces[J].Journal of Molecular Catalysis A:Chemical,1998,131(1/2/3):39-53
[11]马爱增.中国催化重整技术进展[J].中国科学:化学,2014,44(1):25-39
[12]Koutsonikolas D,Kaldis S,Zaspalis V T,et al.Potential application of a microporous silica membrane reactor for cyclohexane dehydrogenation[J].International Journal of Hydrogen Energy,2012,37(21):16302-16307
[13]李松林,周亚平,刘俊吉.物理化学[M].北京:高等教育出版社,2009:160-162
[14]黎小辉,朱建华,郝代军.液化石油气芳构化反应体系的热力学分析[J].石油与天然气化工,2010,39(6):465-469
[15]Yaws C L.Matheson Gas Data Sheet[M].北京:化学工业出版社,2004:1-5
[16]伊赫桑·巴伦.纯物质热化学数据手册(上卷)[M].程乃良,牛四通,徐桂英,等,译.北京:科学出版社,2001:297-783
THERMODYNAMIC ANALYSIS OF CYCLOHEXANE DEHYDROGENATION IN MEMBRANE REACTOR
She Xiaomei, Zhu Jianhua
(Chemical Engineering Institute, China University of Petroleum (Beijing), Beijing 102249)
The cyclohexane dehydrogenation is a model reaction of membrane reactor. The thermodynamic analysis was used to calculate the change of Gibbs free energy, equilibrium constant at different temperatures, and the cyclohexane equilibrium conversion with different removal rates of hydrogen of the reaction system. And the influence of different removal rates of hydrogen on cyclohexane equilibrium conversion was investigated. Further the severity of the reaction and the increasing percentages of equilibrium conversion of cyclohexane with different removal rate of hydrogen were investigated and compared with that of the conventional fixed bed reactor. The potential use of membrane reactor in improving cyclohexane equilibrium conversion of the reversible dehydrogenation reaction was described. It is found that the cyclohexane equilibrium conversion achieved in membrane reactor is higher than that in conventional fixed bed reactor. The results show that membrane reactor can effectively improve the equilibrium conversion of cyclohexane, and reduce the severity of the reaction, indicating its good prospect for industrial applications.
thermodynamic analysis; cyclohexane dehydrogenation; membrane reactor; conversion
2015-01-12; 修改稿收到日期: 2015-03-26。
佘笑梅,硕士研究生,从事环己烷脱氢的研究以及便携型汽车玻璃清洗剂的开发工作。
朱建华,E-mail:rdcas@cup.edu.cn。
