灵芝抗肿瘤作用的免疫学机制及其临床应用
2015-08-31林志彬北京大学医学部基础医学院药理学系北京100191
林志彬(北京大学医学部基础医学院药理学系,北京 100191)
前沿论坛
灵芝抗肿瘤作用的免疫学机制及其临床应用
林志彬
(北京大学医学部基础医学院药理学系,北京 100191)
灵芝的抗肿瘤作用与其免疫调节作用密切相关。本文在我们的研究工作的基础上,结合国内外文献论述灵芝抗肿瘤作用的免疫学机制,包括灵芝促进单核巨噬细胞和自然杀伤细胞功能;促进树突状细胞成熟、分化和抗原提呈功能;活化淋巴细胞、增强细胞毒T细胞的功能及促进细胞因子的生成;抑制肿瘤细胞的免疫逃逸反应;以及灵芝免疫治疗的基础研究等。涉及免疫学指标的灵芝的临床研究结果也一并介绍。
灵芝属;多糖类;抗肿瘤药,植物;免疫调节;肿瘤逃逸;治疗应用

林志彬,教授,博士生导师。历任北京医科大学基础医学院副院长兼基础医学研究所所长和药理学系主任,北京医科大学副校长。先后在美国芝加哥伊利诺斯大学做访问学者、俄罗斯彼尔姆药学院任名誉教授和香港大学访问教授。历任国际药理学联合会执委会委员和提名委员会委员、国际灵芝研究学会主席、中国科学技术协会全国委员会委员、中国药理学会理事长和名誉理事长、国家新药研究与开发专家委员会委员、国家药典委员会委员和国家药品审评专家等。任《北京医科大学学报》主编和Acta Pharmacol Sin等杂志副主编。长期从事抗炎、免疫调节、内分泌和抗肿瘤药物研究,是国内外著名的灵芝研究学者。曾获国家教委科技进步二等奖和三等奖,北京市科技进步二等奖和三等奖,教育部提名国家科技进步奖二等奖及微生物文教基金会(台北)卓越成就奖等。1992年享受国务院政府特殊津贴。
灵芝是国内外久负盛名的中药。2000多年前出版的《神农本草经》中,将灵芝列为有效无毒的“上药”并列出灵芝(赤芝、青芝、白芝、黄芝、黑芝和紫芝)的性味归经与功效。2000年开始,《中华人民共和国药典》一部收载灵芝〔赤芝,Ganoderma lucidum(Leyss.ex Fr.)Karst.〕和紫芝(Ganoderma sinensis Zhao,Xu et Zhang)子实体作为法定中药材。现代植物化学、药理学、毒理学和临床研究表明,灵芝含有多糖、三萜、甾醇和小分子蛋白等多种有效成分,具有广泛的药理作用,毒性极低,临床用于治疗多种疾病[1]。
笔者所在研究室自20世纪70年代开始研究灵芝及其有效成分的药理作用,近20年来,着重研究灵芝的免疫调节作用和抗肿瘤作用及其机制。大量研究结果表明,灵芝的抗肿瘤作用与其免疫调节作用密切相关[2]。本文在我们的研究工作基础上,结合国内外文献论述灵芝抗肿瘤作用的免疫学机制及其临床应用。
1 灵芝抗肿瘤作用的发现
Ito等[3]、Kin等[4]、Miyazaki等[5]、Mizuno等[6-7]、Lee等[8]、Sone等[9]、Maruyama等[10]、Furusawa等[11]及Ma[12]先后报道,灵芝(G.lucidum)子实体提取物及其所含多糖腹腔注射或灌胃给药,可显著抑制小鼠移植性肿瘤的生长,并认为灵芝的体内抗肿瘤作用可能是“宿主中介性的”,即通过增强机体的免疫功能而实现的。为了证明这一假设,从20世纪90年代起,我们重复了灵芝的体内抗肿瘤实验。结果发现,灵芝子实体水提取物(G.lucidum extract,GLE)及其灵芝多糖B(G.lucidum polysaccharide B,GL-B)和多糖肽(G.lucidum polysaccharide peptide,GLPP)、破壁孢子多糖(G.lucidum broken spore polysaccharides,GL-BSP)灌胃可明显抑制小鼠移植性肿瘤S180肉瘤、人肺癌(PG)和Lewis肺癌的生长,但直接加到体外培养的S180肉瘤、人白血病HL-60细胞和PG细胞的培养液中,不能直接抑制肿瘤细胞生长,也不能促进肿瘤细胞凋亡,提示灵芝提取物和多糖在体内的抑制肿瘤生长并非直接细胞毒作用,而增强机体的抗肿瘤免疫力可能是其中重要的一环[13-18]。
2 灵芝抗肿瘤作用的免疫学机制
2.1 血清药理学研究灵芝的宿主中介性抗肿瘤作用
血清药理学实验是中药药理研究的一种方法,即给实验动物灌服中药提取物或组分后,取其血清(含药血清)进行体外药理实验。含药血清中可能含所服中药或其活性代谢产物,也可能含有在中药作用下产生的内源性活性物质,并因此产生药理作用。据此,我们给小鼠灌胃不同剂量的GLE 5,10和20 g(相当生药)·kg-1或GL-B 50,100和200 mg·kg-1,共10 d,最后一次给药后1 h取血,无菌分离血清,经56℃,30 min灭活处理后,用微孔滤膜过滤除菌。将此含药血清加至体外培养的S180细胞或HL-60细胞培养基中,则可明显抑制两种肿瘤细胞生长,并可诱导其凋亡[13-15]。
由于未能在含药血清中检出灵芝的多糖成分,我们推测小鼠灌服GLE或GL-B后,血清中可能出现了一种内源性抗肿瘤活性物质。于是采用生物法和ELISA法检测含GLE或GL-B血清的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和干扰素γ (interferon-γ,IFN-γ)的含量。结果显示,不同剂量GLE或GL-B灌胃小鼠,血清中TNF-α的活性和IFN-γ的水平增加,并呈现明显的剂量依赖关系[13-15]。已知TNF-α和IFN-γ对肿瘤细胞均具有细胞毒作用,能杀灭肿瘤细胞,TNF-α在体外可诱导多种肿瘤细胞凋亡,而IFN-γ还可与TNF-α协同作用,增强TNF-α诱导肿瘤细胞凋亡的作用。因此,含GLE或GL-B血清在体外抑制肿瘤细胞生长和促进肿瘤细胞凋亡的作用至少与其中所含TNF-α和IFN-γ有关,而后二者是在GLE或GL-B作用下由体内生成的。
为了在体外模拟血清药理学的实验结果,又分别在小鼠腹腔巨噬细胞或脾细胞培养液中,加入GL-B(50,100和200 mg·L-1)共同培养24 h,然后分别取GL-B与巨噬细胞或脾细胞共培养上清液,加至HL-60细胞培养基中,结果这两种共培养上清液可显著抑制HL-60细胞增殖和促进其凋亡[14-15]。同样,灵芝菌丝体多糖与小鼠腹腔巨噬细胞共培养上清液也可显著抑制HL-60细胞增殖,并促其凋亡[16]。进一步的研究结果表明,GL-B能使小鼠腹腔巨噬细胞培养上清液中TNF-α mRNA表达和TNF-α水平增加,也能使小鼠脾细胞培养上清液中IFN-γ mRNA表达和IFN-γ水平增加[19]。同样,灵芝菌丝体多糖与小鼠腹腔巨噬细胞共培养上清液中TNF-α的水平亦明显增加[20]。这些结果均说明灵芝多糖确能直接作用于巨噬细胞和脾细胞,促其产生TNFα和IFNγ,抑制肿瘤细胞生长。
给小鼠灌胃GLE 5,10和20 g(相当生药)·kg-1,共10 d,也可显著增加小鼠腹腔巨噬细胞TNF-α mRNA表达和脾细胞IFNγ mRNA表达[13]。
Wang等[21]研究也证明,将灵芝子实体多糖(PS-G)直接加到人白血病细胞HL-60和U937细胞培养液中,对此两种细胞增殖均无抑制作用,也不能诱导其凋亡。但在健康人外周血单核-巨噬细胞或T淋巴细胞培养中加入PS-G,可明显促进巨噬细胞生成白细胞介素1β(interleukin-1β,IL-1β),TNF-α和IL-6,促进T淋巴细胞生成IFN-γ。当PS-G浓度为100 mg·L-1时,IL-1β,TNF-α和IL-6分别较对照增加5.1,9.8和29倍。加入20%PS-G与人外周血单核细胞(peripheral blood mononuclear cells,MNC-CM)共培养,则可显著抑制HL-60和U937细胞增殖,并促进其凋亡。此外,在HL-60和U937细胞培养液中加入20%PS-G与MNC-CM培养液(PS-G-MNC-CM)可诱导HL-60和U937细胞分化为成熟的可表达CD14和CD18表面抗原的单核-巨噬细胞,分化率分别为40%和45%。
Li等[22]亦发现,灵芝多糖GLB7(5,10,20和40 mg·L-1)能浓度依赖性地诱发小鼠腹腔巨噬细胞IL-1α和TNF-α mRNA的表达,并增强巨噬细胞培养上清中IL-1α和TNF-α活性。
最近我们发现,GL-BSP(50,100和200mg·kg-1)灌胃给药,可显著抑制小鼠S180肉瘤生长,但对体外培养的S180或PG细胞增殖无直接抑制作用。将灌胃上述剂量GL-BSP的小鼠血清加到体外培养的S180或PG细胞中,则可剂量依赖性地抑制肿瘤细胞增殖。研究还发现,与正常对照血清比较,含GL-BSP血清中IL-2,TNF-α,IFN-γ和一氧化氮(nitrogen monoxide,NO)水平显著增加,表明含GL-BSP血清抑制S180和PG细胞增殖与IL-2,TNF-α和IFN-γ等免疫细胞因子有关。为了进一步证实含GL-BSP血清中TNF-α和IFN-γ的抗肿瘤活性,我们把经过TNF-α和(或)IFN-γ中和抗体预处理过的含GL-BSP血清加入S180或PG细胞培养液中,结果其抑制肿瘤细胞增殖的作用显著减弱,尤以同时加入TNF-α和IFN-γ中和抗体的含GL-BSP血清减弱作用更为明显。进一步研究发现,S180荷瘤小鼠与正常小鼠比较,其自然杀伤细胞(natural killer cells,NK)细胞的细胞毒活性、巨噬细胞吞噬活性、辅酶A和脂多糖诱导的脾淋巴细胞增殖功能明显降低,CD4+/CD8+比值显著升高,灌胃GL-BSP则可使这些改变恢复至接近正常或完全正常水平。
这些研究结果有力证明,GL-BSP的体内抗肿瘤作用与其促进免疫细胞因子产生,增强NK细胞、巨噬细胞和淋巴细胞的功能有关[18]。
2.2 灵芝促进树突状细胞的成熟和分化,增强其功能
树突状细胞(dendritic cells,DC)是一种抗原递呈细胞(antigen presenting cells,APC),能高效地摄取、加工处理和提呈抗原。成熟的DC高表达主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅰ-抗原肽复合物和MHC-Ⅱ-抗原肽复合物以及B7-1/CD80,B7-2/CD86,CD40和LFA-3/CD58等共刺激分子,这些分子与T淋巴细胞结合并激活T淋巴细胞。此外,DC高表达细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)/CD54和ICAM-3/CD50等黏附分子,有利于与T淋巴细胞的进一步结合。抗原提呈是一个双向过程,一方面,DC可诱导T淋巴细胞活化;另一方面,DC可接受已活化T淋巴细胞反馈回来的活化信号如CD40L而活化,表达共刺激分子并分泌其他活化因子如IL-12,诱导Th1型应答的生成。DC作为激发T淋巴细胞免疫反应的重要辅助细胞,在初次抗体反应、混合淋巴细胞培养、促有丝分裂反应及抗肿瘤免疫应答中均具有重要作用。
2002年,我们首先发现在小鼠骨髓源性DC体外培养体系中,加入0.8,3.2或12.8 mg·L-1的灵芝多糖(GL-PS,系从赤芝子实体中提取的含17种氨基酸的多糖,相对分子质量为584.9×103,多糖∶肽=93.51∶6.49。多糖部分是由葡萄糖、半乳糖、木糖、阿拉伯糖和甘露糖组成),可明显促进DC表面DC11c及I-A/I-E分子的共表达、明显增加IL-12 40亚基mRNA和蛋白表达、促进DC诱导的混合淋巴反应,表明灵芝多糖能促进DC的成熟、分化并增强其功能。在DC诱导P815肿瘤细胞裂解物冲击致敏小鼠产生的特异性细胞毒T淋巴细胞(cytotoxicity T lymphocyte,CTL)模型中,于冲击致敏阶段,加入不同浓度的GL-PS共培养,收集CTL及细胞培养上清液,以释放入CTL与P815肿瘤细胞共培养体系细胞培养上清液中的乳酸脱氢酶(lactic dehydrogenase,LDH)的活性代表CTL的特异性杀伤活性;同时用RT-PCR法检测CTL中IFN-γ及颗粒酶B(granzyme B)的mRNA表达;用ELISA法检测细胞培养上清液中IFN-γ蛋白含量;用Western蛋白印迹法检测CTL表达的颗粒酶B蛋白含量。结果显示,当DC经P815肿瘤细胞冻融抗原冲击致敏后,其诱导产生的CTL对P815肿瘤细胞具有杀伤作用,GL-PS(0.8,3.2和12.8 mg·L-1)可增强此作用,表现为释放入培养上清液中的LDH活性显著增强。进一步研究发现,同上浓度的灵芝多糖可明显增加DC诱导CTL的IFN-γ mRNA表达,并使培养上清液中IFN-γ蛋白含量增加。我们还发现,上述浓度的灵芝多糖可明显增加DC诱导的CTL的颗粒酶B mRNA及蛋白表达。这些结果提示,灵芝多糖在DC成熟阶段,增强DC对肿瘤抗原的捕获、处理、提呈能力,增强DC诱导的特异性CTL的细胞毒活性。而灵芝多糖促进活化CTL的IFN-γ mRNA转录及蛋白表达,使IFN-γ生成增加,后者通过其直接和间接作用发挥抑瘤作用。颗粒酶为淋巴细胞丝氨酸蛋白酶类,通常以非活化的酶原形式贮存于CTL和NK胞质内的细胞毒颗粒中,并于脱颗粒时释出,促进CTL及NK细胞介导的细胞凋亡。颗粒酶家族中,以颗粒酶B功能最强。灵芝多糖促进CTL的颗粒酶B mRNA和蛋白质表达,与其增强CTL的细胞毒活性有关[23-24]。
Lin等[25]报道,具有(1→6)-β-D-葡聚糖分支结构的灵芝多糖(PS-G)(10 mg·L-1)能促进人单核细胞来源的DC表达CD80,CD86,CD83,CD40,CD54和人白细胞抗原(human leucocyte antigen,HLA)-DR,以及IL-12和IL-10 mRNA及其蛋白表达,抑制DC的内吞活性。PS-G还增强DC刺激T细胞的活性,促进T细胞分泌IFN-γ和IL-10。由于抗Toll样受体4(Toll-like receptor 4,TLR4)抗体可抑制PS-G诱导的IL-12和IL-10的分泌,提示TLR4参与PS-G对DC的上述作用。进一步研究显示,PS-G能增加κB抑制剂(inhibitor of κB,IκB)激酶和NF-κB活性,以及IκBa和P38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)的磷酸化。而helenalin(NF-κB的抑制剂)以及SB98059(P38 MAPK的抑制剂)可不同程度地阻断PS-G对DC表达CD80,CD86,CD83,CD40,CD54和HLA-DR,以及IL-12和IL-10生成的作用。提示PS-G是通过NF-κB和P38 MAPK信号通路,诱导人DC的活化和成熟。
Lin等[26]进一步研究发现,重组灵芝菌丝体中提取的免疫调节蛋白(rLZ-8;由110个氨基酸残基组成,相对分子质量为12.4×103)处理人单核细胞,衍生的DC细胞表面表达的CD80,CD86,CD83和HLA-DR增加,IL-12 p40,IL-10和IL-23生成亦增加,DC细胞的内吞减少,TLR4抗体能阻断IL-12 p40和 IL-10生成的增加。同时rLZ-8能刺激TLR4或TLR4/MD2-转染的HEK293细胞表达IL-8。进一步研究提示,rLZ-8能升高IKK和NF-κB的活性,增加IκBα和MAPK的磷酸化,NF-κB抑制剂菊内酯能不同程度地阻断CD80,CD86,CD83 和HLA-DR的表达以及IL-12 p40和IL-10的生成。体内实验表明rLZ-8增加BALB/c小鼠IgG2a,IFN-γ和IL-2的生成。表明LZ-8促进DC细胞成熟和活化,增强Th1反应。Zhou等[27]还发现,在环磷酰胺致白血病模型中,rLZ-8增强中性粒细胞、淋巴细胞和单核细胞活性,也增加CD4+T细胞百分率以及IL-3和IL-4的生成。
Chan等[28]的研究证明,GL-PS也能刺激单核细胞源性DC成熟。GL-PS和GM-CSF/IL-4共同作用诱导THP-1细胞转化为典型的DC细胞形态,而GL-PS单独作用只能诱导THP-1细胞增殖。此外,THP-1转化为DC引起HLA-DR,CD40,CD80 和CD86表达显著增高,抗原摄取能力亦增加。然而,它诱导同种异体T细胞增殖的能力较弱。
Meng等[29]发现,灵芝多糖GLP能增加小鼠DC表达CD86,CD40以及MHC-Ⅱ,促进DC细胞表型成熟。GLP下调DC内的酸性磷酸酶活性,减少吞噬,增强抗原提呈,IL-12生成也显著增加。
Yoshida等[30]报道,灵芝水溶性提取物(0.01,0.1和1.0 g·L-1)能活化DC,促进前炎症细胞因子TNF-α和IL-23大量生成,增强IL-23p19转录以及细胞外信号调节激酶(extracellular signal-regulated kinase,ERK1/2)磷酸化。IL-23p19启动子活性检测和MEK抑制剂U0126反向抑制实验结果指出,MEK-ERK信号通路参与灵芝提取物活化DC。灵芝提取物活化的DC能促进CD4+T细胞增殖,在混合淋巴细胞反应中灵芝提取物活化Th17细胞,生成大量IL-17,同时亦分泌较多IL-4,提示灵芝提取物不仅促进Th17细胞分化,还促进Th2细胞的分化。进一步对灵芝提取物的主要组分β-葡聚糖(curdlan)和肽聚糖(peptidoglycan,PGN)的研究发现,β-葡聚糖激活的DC细胞分泌大量IL-23和IL-10;而PGN诱导TNF-α和IL-23的活性较弱,生成较多的IL-1β。体内实验表明,给小鼠连续口服灵芝提取物(每只鼠10 mg),每2日1次,共4周,与对照组相比,各种消化道相关淋巴组织中的Th17细胞百分率均不同程度地增加,Foxp3+调节T细胞也增加。灵芝提取物还增加小肠的IL-17下游分子IL-17A和IL-17F及其诱导的防御素(defensin)生成。结果表明,灵芝提取物及其所含β-葡聚糖在体内外活化DC,生成大量IL-23,诱导Th17细胞分化。这一作用可能与其在肠道的抗微生物活性有关。
Yue等[31]发现,紫芝热水提取物400 mg·L-1能明显刺激人外周血单核细胞增殖。紫芝子实体的菌柄多糖(50~400 mg·L-1)能浓度依赖性地激活外周血单核细胞。TNF-α,IL-10和转化生长因子β(transforming growth factor-β,TGF-β)生成增加,CD14+单核细胞百分比增加,单核细胞源性DC IL-10和IL-12生成增加。
2.3 灵芝增强免疫细胞杀伤肿瘤细胞的活性
2.3.1 灵芝增强单核巨噬细胞活性
单核吞噬细胞系统(mononuclear phagocyte system,MPS)是体内具有强烈吞噬及防御功能的细胞系统,也是一类抗原提呈细胞,在特异性免疫应答的诱导与调节中发挥重要作用。它们共同起源于造血干细胞,在骨髓中分化发育,经幼稚单核细胞发育成为单核细胞,随循环血流进入结缔组织和其他器官,转变成巨噬细胞。除了吞噬细菌等外来病原,还可吞噬自身细胞(如枯否细胞吞噬红细胞)、肿瘤细胞、抗原抗体复合物、蓄积的脂质等,并可在吞噬外来抗原后与辅助T细胞进行抗原提呈,释放刺激免疫系统其他细胞或其他抗原提呈细胞的物质,活化特异性免疫反应。
早在20世纪80年代初,我们即发现从灵芝子实体中提取的灵芝液和灵芝多糖D6均能提高小鼠腹腔巨噬细胞吞噬鸡红细胞的能力,吞噬百分率和吞噬指数均较对照组显著增高[32]。随后,高斌和杨贵贞[33]、顾立刚等[34]、Cao等[35]及唐庆九等[36]均报道,平盖灵芝(树舌,Ganoderma applanatum)多糖、薄盖灵芝(Ganoderma capense)液、GL-PS和灵芝孢子粉碱提多糖均能促进小鼠巨噬细胞的吞噬功能和IL-1的生成。
Hsu等[37-38]的体外实验发现,灵芝多糖促进人中性粒细胞吞噬和迁移活性,通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)/Akt信号通路,抑制自发性Fas介导的中性粒细胞凋亡;时间依赖性地增强人中性粒细胞蛋白激酶C (protein kinase C,PKC)、P38 MAPK以及酪氨酸激酶Lyn活性,这些作用可能与其促进非特异性免疫功能有关。
Chien等[39]报道,灵芝水提取物中分离得到的含岩藻糖的多糖肽组分(F3)(10~100 mg·L-1)体外作用于人脐血单核细胞(mononuclear cells,MNC)培养7 d后,用流式细胞仪进行细胞表型分析表明,CD14+CD26+单核/巨噬细胞、CD83+CD1a+DC和CD16+CD56+NK细胞较对照组分别增加了2.9,2.3和1.5倍,并且NK细胞的细胞毒活性(效应细胞∶靶细胞=20∶1)提高了31.7%,而B细胞则无明显变化。
唐庆九等[40]报道,灵芝活性多糖(GLIS)能显著刺激巨噬细胞分泌TNF-α和IL-1β,并产生大量的NO,增强小鼠巨噬细胞对乳胶颗粒的吞噬功能。对荷瘤小鼠的巨噬细胞的上述作用强于正常小鼠。GLIS是一种糖蛋白,其中,碳水化合物>90%,由8种单糖组成,主要为半乳糖、葡萄糖和甘露糖,比例为2∶4∶1.5,相对分子质量约2×106。
Zhang等[41]报道,给BALB/c小鼠接种S180肉瘤细胞,从脾和胫骨/股骨分别分离淋巴细胞和骨髓衍生的巨噬细胞,检测GLIS对这些细胞的影响以及抗肿瘤效果。结果GLIS能活化荷瘤小鼠脾分离的B淋巴细胞,促进其增殖和生成IgG。同样GLIS也能活化荷瘤小鼠的骨髓源性巨噬细胞,并且生成IL-1β,TNF-α和活性氮中间体,如NO。GLIS显着增强巨噬细胞吞噬功能,显著提高巨噬细胞介导的肿瘤细胞毒性。GLIS可使小鼠肉瘤S180生长抑制60%。
Wei等[42]发现,GLPS不仅增强了巨噬细胞J774A.1表面的TLR4和CD14表达,以及脂多糖结合和细胞内吞作用,而且也降低了黏附时间常数,提高了结合相互作用的力常数。
Watanabe等[43]报道,在体外THP-1单核细胞培养中,加入富含赤芝酸(lucidenic acid)的鹿角状灵芝(antlered form of G.lucidum)提取物(AF)可促进TNF-α生成,并可协同脂多糖诱导TNF-α生成。它还可促进脂多糖诱导的P38 MAPK磷酸化,抑制脂多糖诱导的c-Jun N端激酶(N-kinase,JNK)MAPK磷酸化。从AF中纯化的赤芝酸-A和赤芝酸-F分别可调节JNK和P38 MAPK活性,从而增强脂多糖诱导的免疫应答。
Zhang等[44]发现,黑灵芝多糖(G.atrum polysaccharides,PSG-1)不能直接杀伤结肠癌CT26细胞,而是通过激活腹腔巨噬细胞而抑制其增殖。同时观察到荷瘤小鼠的脾质量指数和胸腺指数增加,TNF-α,IL-1β和NO生成增加,并发现PSG-1作用于TLR-4,并通过P38 MAPK信号途径,激活NF-κB,从而刺激TNF-α的生成。
Huang等[45]从荷S180肉瘤小鼠分离出腹腔巨噬细胞,并在体外培养,RT-PCR法和ELISA法检测巨噬细胞TNF-α mRNA表达和生成,在培养液中加入PSG-1可浓度依赖性地促进巨噬细胞的TNF-α mRNA表达和生成。实验还证明,PSG-1的这一作用由NF-kB,PI3K/Akt和MAPK信号通路介导,并被NF-kB,PI3K/Akt和MAPK特异性抑制剂明显抑制。
李明春等[46]采用激光扫描共聚焦显微镜技术动态监测小鼠腹腔巨噬细胞胞浆游离Ca2+浓度([Ca2+]i)的变化,发现灵芝多糖组分GLB7(20mg·L-1)引起巨噬细胞中[Ca2+]i明显升高。用EGTA螯合细胞外钙,并用维拉帕米阻断细胞钙通道,然后以GLB7 20 mg·L-1刺激巨噬细胞,仍可见[Ca2+]i明显升高,但升高幅度明显低于未用EGTA和维拉帕米处理。在外液无钙介质中,相同浓度的GLB7刺激巨噬细胞,亦能引起[Ca2+]i升高,而后维持在高峰平台期。于此期再加入含钙的缓冲液,可见[Ca2+]i明显升高,并出现另一更高的平台。这些均说明,GLB7引起的小鼠腹腔巨噬细胞[Ca2+]i升高是由细胞外钙内流和细胞内钙释放共同作用的结果,并进一步证明此作用是通过IP3受体和兰尼碱(ryamodine)受体两种机制升高[Ca2+]i。GLB7引起巨噬细胞中[Ca2+]i升高可能与GLB7增强巨噬细胞功能有关。他们还采用反相离子对高效液相色谱法测定小鼠腹腔巨噬细胞中PKC活性,GLB7(40 mg·L-1)能引起小鼠腹腔巨噬细胞中PKC活性明显升高。它还可引起巨噬细胞中PKC发生质膜转位,并拮抗PKC抑制剂星状孢子素对PKC的抑制作用,表明灵芝多糖的免疫增强作用与其增强PKC活性有关[47]。
我们发现,GLPP在体内外对叔丁基氢过氧化物(ter-butylhydroperoxide,tBOOH)和四氧嘧啶所致小鼠腹腔巨噬细胞氧化损伤有保护作用。光镜和电镜结果可见,注射GLPP可提高细胞存活率,明显改善氧化损伤引起的巨噬细胞形态学改变,如抑制巨噬细胞膜样变性和坏死,保护细胞膜微绒毛和细胞器(如线粒体)免遭tBOOH损伤,并使因自由基损伤而降低的巨噬细胞线粒体膜电位恢复[48]。另外,我们用四氧嘧啶和tBOOH为氧化剂,分别在小鼠体内体外损伤小鼠腹腔巨噬细胞,以DCHF-DA为荧光指示剂,用共聚焦显微镜观察巨噬细胞的荧光变化,并用共聚焦显微镜作时间系列扫描,观察巨噬细胞荧光的动态变化,研究GLPP对小鼠腹腔巨噬细胞氧自由基的清除作用。结果发现,静脉注射四氧嘧啶(75 mg·kg-1)或体外加入tBOOH (7.76×10-5mol·L-1)均可造成小鼠腹腔巨噬细胞的氧化损伤,使巨噬细胞的荧光密度增加。给小鼠灌胃GLPP或将其加入体外培养的巨噬细胞中,均可使巨噬细胞荧光密度减少,损伤减轻[49]。共聚焦显微镜时间系列扫描显示,随时间改变,GLPP可减少静息状态下小鼠腹腔巨噬细胞荧光密度,也可减少12-肉豆蔻酸-13-乙酸佛波醇酯(50 nmol·L-1)诱导的呼吸爆发状态下小鼠腹腔巨噬细胞荧光密度。结果表明,GLPP具有抗氧化作用,对氧化剂损伤小鼠腹腔巨噬细胞产生的自由基有清除作用[50]。
Cheng等[51]应用基因芯片技术比较了赤芝和紫芝的乙醇提取物对人单核细胞基因表达的影响。0.2%赤芝和紫芝提取物与人单核细胞培养24 h后,引起差异表达的基因数分别为:紫芝提取物1189个,赤芝醇提物629个,二者共有的差异表达的基因167个。这些基因影响广泛,主要包括参与细胞生长发育(21%)细胞过程中的负调控(≈16%)细胞蛋白代谢过程(≈16%)信号转导(≈14%)以及转录(≈14%)。紫芝主要作用于与炎症和免疫反应有关的基因,赤芝则适度地增加了参与大分子代谢的基因表达。此外,这两种灵芝的醇提物都不抑制单核细胞增殖。表1所示为两种灵芝共同影响的10个上调和10个下调的常见基因,其中已知功能的基因多数与介导炎症和免疫反应有关。表明灵芝作用的方式是复杂的,不同种灵芝调节人类细胞的不同靶点。
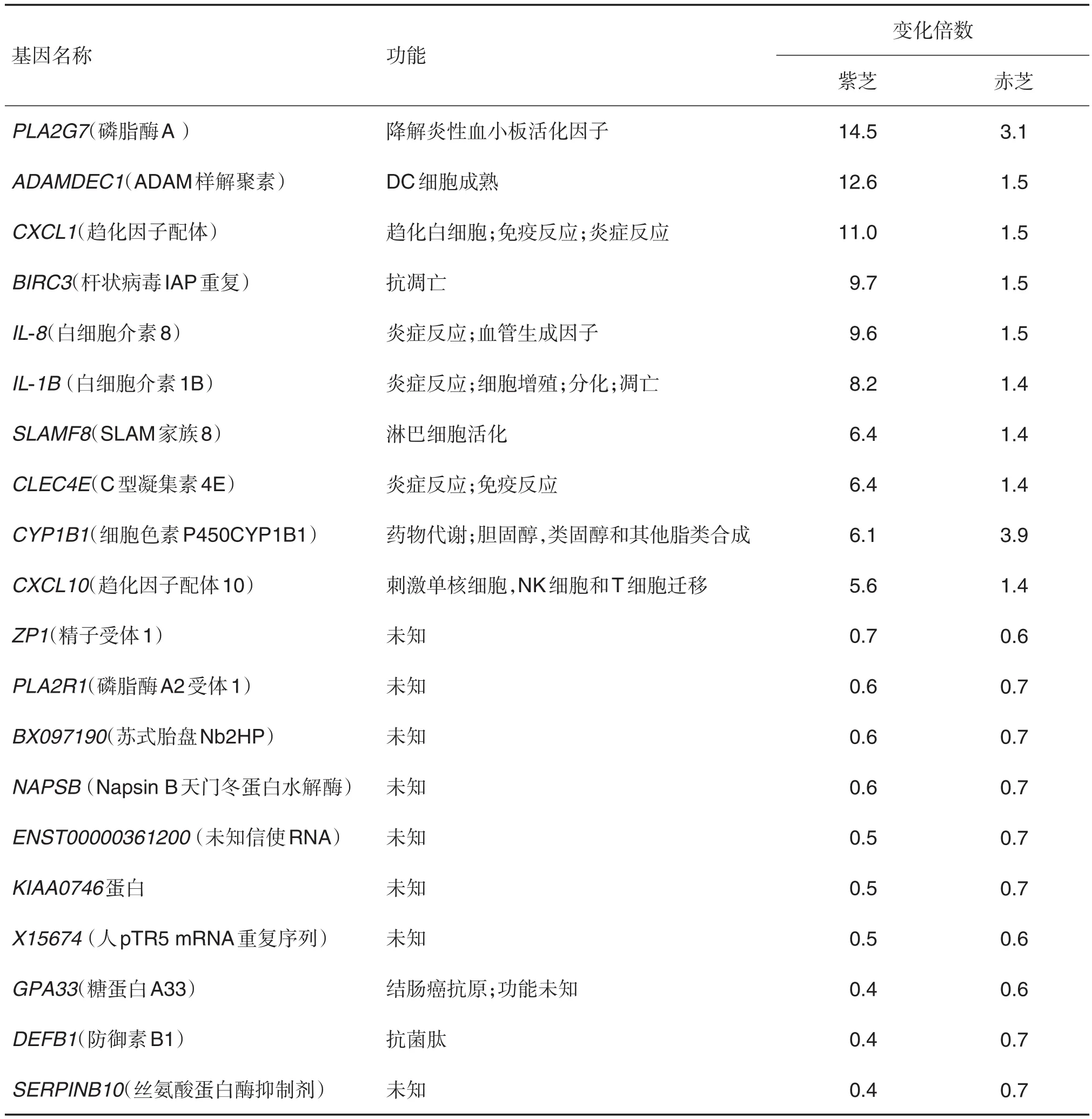
表1 紫芝和赤芝提取物共同影响的20个常见基因
2.3.2 灵芝增强自然杀伤细胞活性
NK是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下对多种靶细胞有自发性细胞毒活性的效应,参与超敏反应和自身免疫性疾病的发生。
Won等[52]采用51Cr标记的YAC-1细胞为靶细胞,与脾NK细胞(效应细胞)作用后,以靶细胞释放51Cr的百分数检测NK细胞的细胞毒活性。给正常C3H/HeN小鼠口服、腹腔注射、静脉注射灵芝水萃取物再经乙醇萃取后的醇不溶性成分(GL-AI)可增强脾NK细胞的细胞毒活性。腹腔注射的最适剂量为20~40 mg·kg-1,剂量过低或过高增强作用减弱。与此同时,给药小鼠的血清IFN滴度亦明显增加。进一步研究发现,给C57BL/6小鼠或C3H/HeN小鼠接种黑色素瘤B16-F10和肝肉瘤129P后2周,荷瘤小鼠的脾NK细胞的细胞毒活性显著降低,腹腔注射GL-AI 40 mg·kg-1,可明显增强荷瘤小鼠NK细胞的细胞毒活性。Won等[53]给小鼠腹腔注射松杉灵芝(Ganoderma tsugae)水提取物(4~200 mg·kg-1)或不溶于乙醇的灵芝提取组分(GTI,1~50 mg·kg-1),呈剂量依赖性地促进NK细胞的细胞毒活性,而溶于乙醇的松杉灵芝提取组分则无此作用。宁安红等[54]给予荷瘤小鼠腹腔注射灵芝多糖(1 mg·d-1),连续7 d,与对照组比较,明显提高荷瘤小鼠NK细胞活性、淋巴细胞增殖反应及血清中TNF-α和IL-2的含量。
小鼠一次性腹腔注射免疫抑制药环磷酰胺300 mg·kg-1制备免疫抑制小鼠模型,24 h后分别腹腔注射Gl-PS 2.5,25和250 mg·kg-1,每天1次,连续7d。与生理盐水对照组比较,GL-PS2.5mg·kg-1组免疫抑制模型小鼠,其受抑制的骨髓细胞、红细胞、白细胞、脾NK以及NKT细胞数的恢复时间明显缩短,造模后第5天GL-PS 2.5 mg·kg-1组的CTL活性、第7~9天NK细胞、淋巴因子激活杀伤细胞(lymphokine activated killer,LAK)活性以及第12天巨噬细胞吞噬和细胞毒活性均显著升高[55]。
Chang等[56]给BALB/c小鼠腹腔注射单核细胞型白血病WEHI-3细胞后,给小鼠连续口服灵芝提取物(3和6 mg·kg-1)28 d,可见小鼠脾质量降低,外周血单核细胞的吞噬作用和NK细胞活性增强;灵芝处理组能缓解CD3+和CD19+百分率的降低,抑制Mac-3和CD11b百分率的升高,促进Con A刺激的脾细胞增殖,对LPS刺激无显著影响,提示先导T 和B细胞被诱导,而巨噬细胞被抑制。
Tsai等[57]报道,以酸水解的方法分别获得灵芝多糖的两种主要溶于水的组分:肽聚糖GLPS-SF1(相对分子质量约20 ku,葡萄糖∶甘露糖≈4∶1)和寡糖GLPS-SF2(相对分子质量1~5 ku)。这两种组分(100 mg·L-1)都可诱导人外周血单核细胞、T淋巴细胞和NK细胞表面的CD69表达,不同程度地促进外周血单核细胞的Th1型细胞因子IL-12,IL-2,TNF-α和IFN-γ产生。在CD14+单核细胞,GLPSSF1诱导CD80/CD86共刺激分子和IL-12,TNF-α能力更强;GLPS-SF1能通过TLR4受体及其信号通路活化小鼠巨噬细胞(HeNC2)生成TNF-α。以蛋白酶K水解去除肽链后,剩余的GLPS-SF1多糖部分仍具有免疫活性。GLPS-SF2能特异性地活化和促进NK细胞和T细胞增殖,并能诱导IL-2,IFN-γ以及更高水平的IL-2产生。
2.3.3 灵芝增强细胞因子诱导杀伤细胞活性
将人外周血淋巴细胞在体外与多种细胞因子共培养后,获得一群异质细胞即细胞因子诱导杀伤细胞(cytokine induced killer cells,CIK),它们具有增殖力强、杀瘤活性高、杀瘤谱广及对多药耐药肿瘤细胞同样敏感等特点,是新一代抗肿瘤过继细胞免疫治疗的首选方案。
我们按常规方法制备的CIK细胞(在小鼠脾细胞培养中,加入IFN-γ 1000 kU·L-1+抗CD3抗体50 μg·L-1+IL-2 300 kU·L-1+IL-1 100 kU·L-1,培养15 d,收获CIK细胞)。结果可见,CIK细胞对体外培养的YAC-1和P815肿瘤细胞有明显的细胞毒作用。在CIK细胞培养中,加入GL-PS(100和400 mg·L-1)可明显降低IL-2和抗CD3单抗的用量(分别为未加多糖的常规CIK细胞对照组的75%和50%),但与常规CIK细胞对照组相似,能诱导和大量扩增CIK细胞,且此CIK细胞在体外对YAC-1和P815肿瘤细胞的杀伤率亦与常规对照组无明显差异。将此CIK细胞静脉输注给荷S180或荷H22肝肉瘤小鼠后,其体内抗肿瘤疗效与常规CIK细胞治疗组比较亦无差异。我们还发现,GL-PS在降低抗CD3单抗和IL-2用量50%和75%的条件下,能促进CIK细胞颗粒酶B以及穿孔素mRNA和蛋白的表达。这表明GL-PS通过增加颗粒酶B和穿孔素的表达,从而增强CIK细胞杀伤肿瘤细胞的活性。进一步实验还表明,GL-PS对CIK细胞的作用经由淋巴细胞表面的补体3型(CR3)受体介导[58-59]。
2.4 灵芝抑制肿瘤细胞的免疫逃逸
肿瘤的免疫逃逸是指肿瘤细胞可通过多种方式逃避免疫系统的监控、识别与攻击而继续分裂生长。肿瘤的免疫逃逸机制复杂,主要涉及机体全身或局部免疫功能低下,肿瘤细胞表面MHC类分子及协同刺激分子表达异常,肿瘤细胞产生免疫抑制性因子,肿瘤细胞Fas表达的抗宿主免疫等。
2.4.1 灵芝促进B16F10黑素瘤细胞MHC-Ⅰ分子和协同刺激因子的生成
通常,肿瘤抗原肽与肿瘤细胞表面的MHC-Ⅰ分子结合形成复合物,再与T细胞表面的抗原受体结合,活化T细胞并杀伤肿瘤细胞。这一过程还需要B7-1和B7-2等协同刺激分子与T细胞表面的CD28分子结合。而恶性肿瘤细胞常表现为MHC-Ⅰ分子和协同刺激分子的低表达或不表达,这是构成肿瘤免疫逃逸的重要机制。最近,Sun等[60]报道了GL-PS对B16F10黑素瘤细胞MHC-Ⅰ分子和协同刺激因子的影响。B16F10黑素瘤细胞MHC-Ⅰ分子和B7-1及B7-2分子表达不足或不表达,在B16F10黑素瘤细胞培养液中加入GL-PS可促进这些分子的表达。RT-PCR检测结果显示,与RPMI 1640培养基对照组相比,不同浓度GL-PS作用48 h,GL-PS可使B16F10黑素瘤细胞MHC-Ⅰ分子H-2Kb和H-2DbmRNA表达增加,也可使B7-1 和B7-2 mRNA表达增加;流式细胞术检测结果显示,GL-PS可使H-2Kb,H-2Db,B7-1和B7-2分子表达增强。此外,GL-PS(200,400和600 mg·L-1)作用下的B16F10黑素瘤细胞与PHA活化的小鼠脾淋巴细胞共培养,淋巴细胞介导的抗B16F10细胞毒活性较对照组明显提高[60]。
用不同浓度GL-PS作用抗原提呈功能低下的B16F10黑素瘤细胞,再与淋巴细胞混合培养,发现与RPMI 1640培养基对照组相比,GL-PS 200和400 mg·L-1可使淋巴细胞增殖活性升高,并使淋巴细胞活化抗原CD69的表达增强,GL-PS 400 mg·L-1可促进淋巴细胞FasL的表达及IFN-γ的生成[61]。
上述结果表明,GL-PS可促进B16F10黑素瘤细胞MHC-Ⅰ分子和协同刺激因子生成,因而促进淋巴细胞活化,增强淋巴细胞介导的细胞毒性。
2.4.2 灵芝抑制B16F10黑素瘤细胞分泌免疫抑制因子
已知肿瘤细胞可产生多种免疫抑制分子,抑制免疫细胞的功能,逃避机体免疫系统的攻击。IL-10,TGF-β和血管内皮生长因子(vascular endothelial growth factor,VEGF)为肿瘤细胞中常见的免疫抑制分子。
经ELISA方法检测,B16F10黑素瘤细胞培养上清中IL-10,TGF-β和VEGF水平显著高于RPMI 1640培养基对照,表明B16F10黑素瘤细胞可分泌这3种免疫抑制因子。收集B16F10黑素瘤细胞培养上清,加入小鼠脾淋巴细胞中,用PHA诱导淋巴细胞活化,并观察GL-PS对其的影响。与未加GL-PS的对照组相比,GL-PS 0.2~12.8 mg·L-1可使受抑制的淋巴细胞增殖活性显著增强和受抑制的穿孔素表达增加,GL-PS 3.2和12.8 mg·L-1可使受抑制的颗粒酶B表达增加,GL-PS 0.2~12.8 mg·L-1还可使受抑制的混合淋巴细胞反应显著增强[62]。GL-PS 0.2~12.8 mg·L-1还可使受抑制的细胞活化分子CD71和FasL表达显著增加[63]。在小鼠脾单核淋巴细胞培养中,加入B16F10黑素瘤细胞培养上清液,可抑制PHA诱导的小鼠脾淋巴细胞IL-2和IFN-γ和TNF-α mRNA表达和生成,同时加入GL-PS(0.8~12.8 mg·L-1)则可使3种细胞因子的mRNA表达和生成显著恢复[64]。
RT-PCR检测结果发现,与未加GL-PS的对照组相比,GL-PS可使B16F10黑素瘤细胞的IL-10mRNA,TGF-β1 mRNA,VEGF mRNA表达显著减少。ELISA检测结果还发现,与未加GL-PS的对照组相比,GL-PS可使B16F10黑素瘤细胞的培养上清液中IL-10,TGF-β1和VEGF生成显著减少[65]。
这些结果表明,GL-PS可在一定程度上拮抗B16F10黑素瘤细胞培养上清诱导的免疫抑制作用,其机制可能与GL-PS促进淋巴细胞活化和抑制B16F10黑素瘤细胞分泌免疫抑制因子有关。
一些研究灵芝抑制肿瘤血管新生的报道,同样也证实灵芝抑制其他肿瘤细胞表达与分泌VEGF。
我们发现,在低氧条件下培养的人肺癌细胞(PG)可分泌VEGF和GLPP可抑制其分泌[66]。王筱婧等[67]观察灵芝孢子粉对裸鼠移植性人肝肿瘤生长的影响时,发现在灵芝孢子粉抑制肿瘤生长的同时,VEGF、微血管密度表达水平显著降低。Hsu等[68]发现,松杉灵芝甲醇提取物(GTME)抑制体外培养的人表皮状癌A-431细胞增殖,还可增强紫杉醇对A-431细胞增殖的抑制作用。与此同时,抑制EGF受体和VEGF的表达,并抑制人脐静脉内皮细胞的毛细管形成。EGF可拮抗GTME所致的VEGF表达的抑制。体内给予GTME也能显著抑制A-431异种移植肿瘤在裸鼠体内生长,并抑制表皮生长因子受体和VEGF的表达。郭鹏荣等[69]观察灵芝多糖对顺铂抑制荷人膀胱癌T24细胞裸鼠肿瘤生长及血管生成作用的影响。结果发现,灵芝多糖抑制体外培养的T24细胞增殖作用较弱,但与顺铂联合给药则有明显协同作用。灵芝多糖(200 mg·kg-1,灌胃)与顺铂(25 mg·kg-1)联合,可显著增强顺铂对荷T24瘤裸鼠肿瘤生长的抑制作用。免疫组化染色结果显示,灵芝多糖与顺铂联合可抑制VEGF、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的表达,抑制肿瘤组织的血管生成,且抑制作用显著强于单用顺铂。qRT-PCR和Western蛋白印迹法检测结果也显示,与单用顺铂比较,灵芝多糖联合顺铂给药后,荷瘤裸鼠肿瘤组织中VEGF和bFGF的表达显著下降。结果显示,灵芝多糖可下调VEGF和bFGF的表达,增强顺铂对T24荷瘤裸鼠肿瘤生长及血管生成的抑制作用。肿瘤细胞分泌的免疫抑制分子对巨噬细胞的抗肿瘤活性亦有抑制作用。灵芝多糖可拮抗或抵消这种抑制作用。Sun等[70]报道,在用脂多糖活化巨噬细胞时,加入B16F10黑素瘤细胞培养上清液可抑制巨噬细胞的活化,再加入不同剂量的GL-PS可拮抗这种抑制作用。与未加GL-PS的对照组相比,GL-PS(0.2~12.8 mg·L-1)可使受抑制的巨噬细胞吞噬活性增强,可使受抑制的NO的生成及TNF-α的生成增加,GL-PS还可增强受抑制的TNF-α杀伤L929细胞的细胞毒活性。
2.4.3 灵芝拮抗肺癌患者血清诱导的淋巴细胞活性抑制
Sun等[71]将不同浓度GL-PS加入受肺癌患者血清抑制的人外周血淋巴细胞,再用PHA诱导活化淋巴细胞,发现与未加GL-PS的对照组比较,GL-PS 3.2和12.8 mg·L-1显著增强受抑制的淋巴细胞表面细胞活化抗原CD69的表达,显著改善受抑制的淋巴细胞增殖活性,明显提高受抑制淋巴细胞穿孔素和颗粒酶B的水平。
2.5 肿瘤相关的灵芝多糖抗体研究
Liao等[72]报道,从灵芝水溶性粗提取物(F3)中,纯化出一种富含L-岩藻糖(L-fucose)的多糖组分(FMS),其相对分子质量为35 ku,单糖组成比为L-岩藻糖(Fuc)∶D-木糖(Xyl)∶D-半乳糖(Gal)∶D-甘露糖(Man)=2∶1.5∶2.5∶3.5,尚含有少量葡萄糖(Glu)和氨基糖(葡萄糖胺和半乳糖胺)。注射FMS可显著抑制小鼠Lewis肺癌(LLC1)生长,并减少肿瘤相关炎症介质如单核细胞趋化蛋白-1、CXCL1(KC)和粒细胞集落刺激因子的生成,小鼠的B1 B细胞(IgMhiIgDloCD11blo)亚群数增加,提示FMS诱导抗多糖IgM生成。体外实验表明,注射FMS的小鼠血清对于表达Globo H抗原的LLC1细胞具有抗体介导的细胞毒性。以多糖微阵列分析FMS诱导生成的抗血清结果显示出高度特异性,其抗原结构位于非还原端,(即Fucα1-2Galβ1-3Gal-NAc-R;其中,Gal,GalNAc和R分别代表D-半乳糖,D-N-乙酰氨基半乳糖和还原末端),是典型的Globo H型以及肿瘤相关的抗原。FMS的组成主要包括1,4-甘露聚糖和1,6-α-半乳聚糖为主链,通过Fucα1-2Gal,Fucα1-3/4Man,Fucα1-4Xyl和Fucα1-2Fuc连接,成为FMS诱导产生IgM的分子基础,FMC的末端Fuc结构对其抗体介导的细胞毒性是十分重要的。这一发现提示,灵芝多糖促进抗Globo H抗体产生的作用对Globo H阳性的肺癌患者具有潜在的免疫治疗价值。
2.6 灵芝抗肿瘤作用的免疫学机制与中医“扶正固本”治则
20世纪70年代,通过药理和临床研究,我们建立了探讨灵芝“扶正固本”作用机制的工作假说,提出灵芝的扶正固本作用可能与其增强机体重要器官系统的功能,减轻各种致病因素对机体的损害,改善神经-内分泌-免疫系统的调节作用,加强机体的稳态调节能力,维持内环境稳定有关[73]。
中医理论认为,健康和疾病属于正邪相争的不同状态,健康是由于“正气存内,邪不可干”;而疾病则是“邪之所凑,其气必虚”,但治疗疾病不一定要彻底消除外邪,只要达到正气存内,邪不可干即可。灵芝及其有效成分灵芝多糖在体外不能抑制肿瘤细胞增殖,也不能诱导肿瘤细胞凋亡,但在体内却有明显的抗肿瘤作用。为探讨其作用机制,我们在体内抗肿瘤实验的基础上,采用血清药理学和细胞、分子药理学相结合的研究方法,发现灵芝之所以在体内有抗肿瘤作用,是因为它能增强机体抗肿瘤免疫功能,包括增强单核巨噬细胞、DC、NK和CTL细胞的功能,促进细胞因子如IFN-γ,TNF-α和IL-2等生成,促进肿瘤相关抗体产生,拮抗肿瘤细胞的免疫逃逸等。此外,一系列研究还证明,灵芝及其有效成分对化疗药和放射线引起的胃肠道、肝、肾、骨髓损伤有明显的保护作用[1]。通过这些作用,灵芝扶持了正气,实现了正气存内,邪(肿瘤)不可干或扶正祛邪(肿瘤)。
研究结果阐明了灵芝“扶正固本”作用的实质是增强机体免疫功能、改善各种致病因素对机体重要器官系统的损害,恢复机体的稳态调节。这一结论与我们的工作假说中对“扶正固本”作用机制的设想是一致的,也为用现代科技方法结合中医药传统理论研究中药药理、诠释中医理论提供了一个范例[74-75]。
3 灵芝提高肿瘤放化疗患者的免疫功能
许多临床研究均证明,灵芝制剂与化疗或放疗合用时,对一些肿瘤如胃癌、食管癌、肺癌、肝癌、膀胱癌、肾癌、大肠癌、前列腺癌和子宫癌等有较好的辅助治疗效果。其疗效特点如下:提高肿瘤患者对化疗和放疗的耐受性;减轻化疗和放疗引起的白细胞减少、食欲缺乏、体质量减轻、抗感染免疫力降低、肝肾损伤等严重不良反应;提高肿瘤患者的免疫功能,增强机体的抗肿瘤免疫力;提高肿瘤患者的生活质量,使体质增强[1]。本节仅从在国内外公开发表的20余篇灵芝临床研究论文中,选择其中包含免疫指标的临床研究报道予以介绍。
焉本魁等[76]报道,Ⅱ~Ⅳ期非小细胞肺癌(肺腺癌32例,鳞癌15例,鳞腺癌7例,大细胞癌2例)患者56例,均经胸片和肺CT证实,又经病理组织学或细胞学检查确诊为原发性非小细胞性肺癌患者;不能或不愿手术或术后肺内复发、播散;一般情况好,卡氏(Karnofsky)评分>60分,预计生存时间>3个月;具有影像学(X线摄片、CT或MRI)可测的病灶供客观评价,两组患者治疗前病情无显著性差异。将56例患者随机分为治疗组(灵芝口服液+化疗组)35例,对照组(单用化疗)21例。化疗应用顺铂加长春地辛方案。治疗组同时口服灵芝口服液(灵芝子实体提取物),每次20 mL,一日3次。所统计患者必须完成2个疗程治疗,未完成治疗的或者中途中止或死亡的都判为无效。结果发现,治疗2个疗程后,治疗组35例中完全缓解(CR)为2例(5.7%),部分缓解(PR)为21例(60%),稳定(NC)为9例(25.71%),进展(PD)为3例(8.57%),CR+PR(总缓解率)为23例(65.71%);对照组21例中CR 为1例(4.76%),PR为8例(38.14%),NC为10例(47.62%),PD为2例(9.52%),CR+PR为9例(42.85%),两组比较,有显著性差异(P<0.01)。治疗组卡氏评分增加的为24例(68.57%),稳定的为7例(20%),下降的为4例(11.43%);对照组评分增加的为9例(42.85%),稳定的为8例(38.10%),下降的为4例(19.05%),治疗组生活质量改善率(68.57%)与对照组(42.85%)比较有显著差异。治疗组治疗前后的各血像指标无明显变化,而对照组治疗前后红细胞、白细胞、血红蛋白和血小板均明显下降,表明灵芝口服液能减轻化疗对骨髓造血功能的抑制。治疗后治疗组T3,T4和T8较治疗前均有不同程度的升高,对照组患者治疗后T3,T4和T8各有不同程度的降低,提示灵芝口服液能增强肿瘤患者的细胞免疫功能。
张新等[77]报道,29例主要为经病理诊断为肺癌的Ⅲ~Ⅳ期患者,卡氏评分>50,预计可存活>6个月。随机分组,灵芝组口服灵芝片(每片含灵芝提取物55 mg),每日2次,每次2~4片,连用3个月。对照组以同样剂量服用安慰剂。观察灵芝片和安慰剂对肺癌患者免疫调节、血液流变学和临床治疗效果等的影响。结果发现,灵芝组血清TNF-α水平由治疗前的(17.7±4.3)ng·L-1增至治疗后的(28.7± 6.6)ng·L-1;对照组则分别为14.0±4.9和(19.1± 13.2)ng·L-1。对照组血清可溶性IL-2受体水平从治疗前的(259±275)kU·L-1增至治疗后的(501± 291)kU·L-1(P<0.05),而灵芝组仅从(321±311)kU·L-1增至(372±267)kU·L-1(P>0.05)。服灵芝后未见血液流变学的明显改变,仅见纤维蛋白原明显下降。未观察到肝、肾功能损害等严重毒副作用。结果提示,灵芝对肺癌患者有免疫调节和改善血液高凝状态的作用。
王跃辉等[78]将58例非小细胞肺癌患者随机分为试验组和对照组,试验组29例,在化疗同时口服破壁灵芝孢子粉,每次1 g,一日3次;对照组29例,单独应用化疗。两组化疗方案相同:紫杉醇135~175mg·m-2,第1天;顺铂20~25mg·m-2,第1~3天,3周方案,连续4个周期,于化疗前后常规给予抗过敏、止吐和保肝辅助治疗。化疗前及第2和4周期化疗后进行外周血T细胞亚群(CD3+,CD4+,CD8+,CD4+/CD8+)水平检测。结果发现,治疗后试验组外周血CD3+,CD4+,CD4+/CD8+水平增高,CD8+水平降低;对照组外周血CD3+,CD4+,CD4+/CD8+水平降低,CD8+水平升高。试验组CD4+/CD8+比值较治疗前及对照组治疗后均有显著升高,差异具有统计学意义。结果提示,破壁灵芝孢子粉可改善非小细胞肺癌化疗患者的T细胞亚群,提升患者的细胞免疫功能。
林能俤等[79]将经病理学、细胞学和CT检查证实的114例癌症(胃癌、食管癌、肺癌、肝癌、宫颈癌、结肠癌和膀胱癌)患者随机分为化疗+灵芝组(66例)和单纯化疗组(48例)进行治疗前后对照和组间比较,观察灵芝提取物配合化疗治疗癌症的疗效。治疗组:从化疗(FAM方案)开始及化疗后服灵芝提取物胶囊,每次服4粒,每日4次,40 d为1疗程。结果可见,灵芝提取物胶囊配合化疗可明显改善癌症患者的细胞免疫功能。治疗前、后化疗+灵芝组NK细胞活性分别为51.24±7.90和48.10± 7.90(P>0.05);单纯化疗组分别为51.40±6.62和44.43±7.19(P<0.05);化疗+灵芝组治疗前后CD3,CD4,CD8细胞亚型(%)无显著改变,但单纯化疗组治疗后CD3,CD4,CD8细胞亚群百分率明显降低(P<0.05)。患者的中医临床症状、生活质量亦获改善。
齐元富等[80]报道,200例住院胃癌、食管癌、肝癌、大肠癌、胰腺癌、胆囊癌、胆管癌、壶腹周围癌和胃恶性淋巴瘤肿瘤患者经细胞学或病理学诊断(肝癌为临床诊断),卡氏生活质量评分均>60分,本次治疗前1个月内未经过抗癌治疗。试验组(100例)口服灵芝孢子粉胶囊(每粒0.25 g),每次4粒,每日3次。对照组(100例)口服贞芪扶正冲剂(每包15 g),每次1包,日3次。两组病例均服药4周为1个疗程,每例用药不少于2个疗程。两组患者均在每疗程开始当日行常规化疗。胃癌、肝癌及大肠癌等用FAM方案,食管癌用CFP方案。4周为1个周期,连续应用2个周期。疗程结束后判定疗效。结果发现,①近期客观疗效:试验组总有效率(CR+ PR)43%,其中CR 3例、PR 40例、NC 45例、PD 12例;对照组有效率33%,其中CR 2例、PR 31例、NC 48例、PD 19例。两组间有显著差异(P<0.05)。②生活质量变化:试验组卡氏评分上升≥10分者66例,上、下波动在10分以内(稳定)者23例,减低>10分者11例;对照组上升49例,稳定19例,下降32例。两组比较有显著性差异(P<0.05)。③体质量变化:试验组体质量增加≥1.5 kg者68例,上、下波动在1.5 kg以内(稳定)者21例、降低>1.5 kg者11例;对照组体质量增加45例,稳定26例,降低29例。两组比较有显著性差异(P<0.05)。④外周血像变化:试验组治疗末白细胞、血小板恢复正常者分别为89和92例,低于正常者11和8例;对照组恢复正常者分别为93和95例,低于正常者分别为7和5例。两组比较无显著差异(P>0.05)。⑤免疫功能变化:治疗后与治疗前比较,试验组CD3+细胞从(55.35±7.30)%增至(67.23±6.61)%(P<0.01),CD4/CD8比值从1.35±0.67增至1.58±0.44(P<0.05),T淋巴细胞转化率从(60.19±8.05)%增至(65.02±9.64)%(P<0.05);对照组上述免疫指标治疗前后均无显著变化,而试验组治疗后与对照组治疗后比较,上述细胞免疫学指标的改善均有显著性差异(P<0.05)。试验组服药期间未见明显不良反应。结果表明,灵芝孢子粉胶囊可作为肿瘤化疗的辅助治疗药,具有增效、减毒作用。
甄作均等[81]选择2008年11月至2010年12月该院收治的70例肝癌肝切除患者,采用计算机随机数字表法将肝癌患者随机分为常规护肝治疗组(常规护肝组)和灵芝孢子粉治疗组(灵芝孢子粉组)。另选35例健康体检者作为健康对照组。常规护肝组术后1 d开始给予复方甘草酸苷注射液+极化液;灵芝孢子粉组在常规护肝治疗的基础上,术后1 d开始口服灵芝孢子粉(每粒0.3 g),每次5粒,一日3次。分别于术前(或入组时)及术后1,7和28 d检测外周血T淋巴细胞亚群(CD4+和CD8+)和NK细胞。CD4+,CD8+和NK细胞占淋巴细胞百分率的比较采用t检验。结果,肝癌患者CD4+细胞百分率(34±7)%较健康对照组(43±7)%明显降低(P<0.05);肝癌患者CD8+细胞百分率(30±3)%较健康对照组(27±3)%明显升高(P<0.05);肝癌患者NK细胞百分率为(13±4)%较健康对照组(19±5)%明显降低(P<0.05)。术前常规护肝组肝癌患者的CD4+,CD8+及NK细胞百分率与灵芝孢子粉组比较无显著差异。与术前相比,两组肝癌患者术后1 d 的CD4+,CD8+及NK细胞百分率均显著降低。灵芝孢子粉组术后7和28 d的CD4+细胞百分率与常规护肝组比较明显升高,CD8+细胞百分率明显降低,NK细胞百分率明显升高。结果表明肝癌患者术前及术后早期细胞免疫功能受到抑制,术后早期应用灵芝孢子粉可改善患者的细胞免疫抑制状态,有利于维护机体的免疫平衡,对患者术后的恢复及预后具有积极意义。
周吉华和张庆华[82]选择2012年5月-2013年5月于该院行手术治疗的90例老年宫颈癌(鳞癌、腺癌、腺鳞癌)患者,采用完全随机对照研究,随机数字表法将患者分为对照组和观察组。两组患者的年龄、病理学分型、临床分期等一般资料无统计学差异。对照组术前3周,给予动脉介入新辅助化疗,BOMP化疗方案:平阳霉素(博莱霉素)16 mg,长春新碱1 mg·m-2,丝裂霉素10 mg·m-2,顺铂50 mg·m-2。导管经单侧股动脉插入对侧髂内动脉,灌注50%剂量的化疗药物;选择至子宫动脉,明胶海绵条栓塞至造影处。插管至同侧髂内动脉,灌入另50%化疗药物,行子宫动脉栓塞,压迫包扎。术后平卧8 h,对症、抗感染。新辅助化疗后行宫颈癌根治术,主要为盆髂区淋巴清扫术和广泛性子宫切除术。观察组:在对照组治疗基础上,术后给予灵芝孢子粉,即术后第1天起开始口服灵芝孢子粉(每粒0.3 g),每次5粒,1天3次,疗程28 d。采用流式细胞仪检测外周血T淋巴细胞亚群,实时荧光定量PCR法检测VEGF mRNA。结果显示,对照组与观察组治疗前外周血T淋巴细胞亚群、NK细胞活性及VEGF mRNA无明显差异(P>0.05);与对照组比较,观察组治疗后CD8+降低,CD4+和CD4+/ CD8+比值和NK细胞活性均显著升高(P<0.05),VEGF mRNA表达显著减少。可见灵芝孢子能明显改善老年宫颈癌患者术后细胞免疫功能,且减少VEGF的表达。
Zhao等[83]将48名进行内分泌治疗具有癌相关性疲劳症状的乳腺癌患者被随机分为试验组和对照组。实验组患者接受口服灵芝孢子粉每次1 g,一日3次,共治疗4周。对照组服用安慰剂治疗。在治疗前及治疗后,患者进行癌症治疗相关疲乏功能评估表(FACIT-F),焦虑及抑郁量表(HADS),生活质量问卷表(EORTC QLQ-C30)的评估。服用灵芝孢子粉前后,检测患者血液中的TNF-α和IL-6的水平和肝肾功能。应用配对检验及回归分析对结果进行统计学分析。FACT-F评估结果显示,与对照组相比,患者接受灵芝孢子粉治疗后身体状况评分及疲劳程度评分均明显升高(分别为P<0.01 及P<0.01)。HADS及EORTC QLQ-C30结果显示,试验组患者的焦虑及抑郁程度降低及生活质量满意度增高(分别为P<0.01和P<0.01)。试验组患者用药前后血液中TNF-α分别为128.7和71.9ng·L-1,IL-6分别为62.4和37.6 ng·L-1,用药后血液中TNF-α和IL-6均明显降低(P<0.01,P<0.05)。表明灵芝孢子粉可改善接受内分泌治疗乳腺癌患者的癌相关性疲劳,改善患者的抑郁程度,提高生活质量。其疗效机制可能与降低引起癌症疲劳的免疫因子TNF-α和IL-6水平有关。服用灵芝孢子粉过程中无严重不良反应发生。
黄建明等[84]探讨了灵芝合剂与抗CD3抗体激活杀伤细胞(anti-CD3 antibody induced activated killer cell,CD3AK细胞)合用对肺癌的临床疗效。CD3AK细胞扩增速度快,细胞毒活性及体内抗肿瘤活性均明显优于LAK细胞,因而比LAK细胞更适合于肿瘤的过继免疫治疗。26例经病理证实为非小细胞肺癌(鳞癌、腺癌),不愿接受化疗、放疗的患者。14例接受CD3AK细胞治疗(A组);12例接受CD3AK细胞治疗同时服用灵芝合剂(B组)。两组资料均衡性检验,无显著差异,有可比性。患者在治疗前及治疗1个月后采用放射免疫分析法测定癌胚抗原。灵芝合剂以灵芝、黄芪、党参为主组方,每日1剂,水煎服。CD3AK细胞/脂质体IL-2疗法:采患者外周血,分离、培养CD3AK细胞,然后回输给患者。同时肌注脂质体IL-2 10 kU·d-1,30 d为1疗程。结果:26例患者经治疗后,咳嗽、咯痰、咯血、胸闷等症状明显改善。在接受CD3AK细胞治疗的14例患者中,X线显示的肿块影像有8例缩小,6例不变。在接受CD3AK细胞治疗同时服用灵芝合剂的12例患者中,X线显示的肿块影像有7例缩小,5例不变,但两组患者的“复发”(指肺癌的症状如咳嗽、咯痰、咯血、胸闷等加重;X线显示肿块影较前增大;血清癌胚抗原、唾液酸、β2微球蛋白等生化指标升高)时间有所不同,A组为(7.82±3.59)月,而B组为(13.26±5.5)月,差异有显著意义(P< 0.01)。两组治疗前后血清癌胚抗原含量均有显著差异,但两组间差异无显著意义。两组病例的中位生存期以B组较长,为19.38个月,A组较短,为15.28个月。B组的平均生存时间为(23.5±14.39)个月,A组为(15.75±8.30)个月,差异有显著意义(P<0.05)。可见灵芝合剂与CD3AK细胞合用,可增强CD3AK细胞对肺癌的临床疗效。
4 结语
多年来,学术界重视灵芝的抗肿瘤作用及其机制的研究,除涉及本文提及的免疫学机制外,尚与其抑制肿瘤血管新生[66-68,85-87],抑制肿瘤细胞移动、黏附[88-92],抑制肿瘤细胞对抗肿瘤药的多药耐药性[93-96]有关。此外,灵芝醇提取物及其所含三萜类在体外对肿瘤细胞有直接杀伤作用[97-104]。这些实验结果多是在体外培养的细胞上获得,尚需在整体动物模型上进一步研究。
灵芝用作肿瘤放化疗的辅助治疗药,发挥增效减毒作用,特别是减少放化疗的不良反应,已为许多临床研究初步证实。然而,这仅仅是开始,尚有许多事情要做,特别是进行符合GCP的多中心、大样本的临床研究。
与其他中药的研究相同,灵芝的抗肿瘤药理研究有两种思路,一种是从中找出有效成分,最终成为抗肿瘤药;另一种是中西医结合研究灵芝辅助治疗肿瘤的机制,探讨灵芝扶正固本作用的现代内涵,进一步诠释中医扶正固本治则。后者是我们多年来走过的道路,并为实践证明是正确的。
[1]Lin ZB.Modern Research on Ganoderma(Lingzhi)(灵芝的现代化研究)[M].4th ed.Beijing:Peking University Medical Press,2015.
[2]Lin ZB,Zhang HN.Anti-tumor and immunoregulatory activities of Ganoderma lucidum and its possible mechanisms[J].Acta Pharmacol Sin,2004,25(11):1387-1395.
[3]Ito H,Naruse S,Shimura K.Studies on antitumor activityofbasidiomycetepolysaccharides:Ⅶ. Antitumor effect of the polysaccharide preparation from Ganoderma lucidum on mouse sarcoma180 [J].Mie J,1977,26:147-152.
[4]Kin BK,Chung HS,Chung KS,Yang MS.Studies on the antineoplastic components of Korea basidiomycetes[J].Hanguk Kyunhakhoe Chi,1980,8(2):107-113.
[5]Miyazaki T,Nishijima M.Studies on fungal polysaccharides.ⅩⅩⅦ.Structural examination of a water-soluble,antitumor polysaccharide of Ganoderma lucidum[J].Chem Pharm Bull(Tokyo),1981,29(12):3611-3616.
[6]Mizuno T,Kato N,Totsuka,Tacanaka K,Shikai K,Shmizu M.Fractionation,structural features and antitumor activity of water-soluble polysaccharide from ″Reishi″,the fruiting body of Ganoderma lucidum[J].Nippon Nogei Kagaku Kaishi,1984,58:871-880.
[7]Mizuno T,Suzuki E,Maki K,Tamaki H.Fractionation,chemical modification and antitumor activity of water-in soluble polysaccharides of the fruiting body of Ganoderma lucidum[J].Nippon Nogei Kagaku Kaishi,1985,59:1143-1151.
[8]Lee SS,Chen FD,Chang SC,Wei YH,Liu I,ChenCF.Invivoantitumoreffectofcrude extractsfromthemyceliumofGanoderma lucidum[J].J Chin Oncol,1984,5(3):22-28.
[9]Sone Y,Okuda R,Wada N,Kishida E,Misaki A. Stractures and antitumor activities of the polysaccharides isolated from fruiting body and the growing culture of mycelium of Ganoderma lucidum[J]. Agric Biol Chem,1985,49(9):2641-2653.
[10]Maruyama H,Yamazaki K,Murofushi S,Konda C,Ikekawa T.Antitumor activity of Sarcodon aspratus (Berk.)S.Ito and Ganoderma lucidum(Fr.)Karst. [J].J Pharmacobiodyn,1989,12(2):118-123.
[11]Furusawa E,Chou SC,Furasawa S,Hirazum A,Dang Y.Antitumor activity of Ganoderma lucidum,an edible mushroom,on intraperitoneally implanted Lewis lung carcinoma in synergenic mice[J]. Phytother Res,1992,6:300-304.
[12]Ma L,Lin ZB.Antitumor effects of Ganoderma lucidum polysaccharide peptide[J].Acta Pharmacol Sin,1995,16():78-79.
[13]Zhang QH,Yu DH,Lin ZB.Study on the antitumor mechanism of Ganoderma lucidum extract(GLE)by serologic pharmacological method[J].J Beijing Med Univ(北京医科大学学报),2000,32(3):210-213.
[14]Zhang QH,Lin ZB.Study on antitumor activity and mechanism of Ganoderma polysaccharides B [J].Chin J Integrated Tradit West Med(中国中西医结合杂志),1999,19(9):544-547.
[15]Zhang QH,Lin ZB.The antitumor activityof Ganoderma lucidum(Curt.:Fr.)P.Karst.(Lingzhi)(Aphyllophormycetideae)polysaccharides is related to tumor necrosis factor-α and interferon-γ[J].Int J Med Mushroom,1999,1:207-215.
[16]Hu YH,Lin ZB.Effects of polysaccharides isolated from mycelia of Ganoderma lucidum on HL-60 cell apoptosis[J].Acta Pharm Sin(药学学报),1999,34(4)∶268-271.
[17]Cao QZ,Lin ZB.Antitumor andanti-angiogenic activity of Ganoderma lucidum polysaccharides peptide[J].Acta Pharmacol Sin,2004,25(6):833-888.
[18]Wang PY,Zhu XL,Lin ZB.Antitumor and immunomodulatoryeffectsofpolysaccharidesfrom broken-spore of Ganoderma lucidum[J].Front Pharmacol,2012,3:135.
[19]Zhang QH, Lin ZB.Effect of Ganoderma lucidum polysaccharides B on TNFα and IFNγ production and their mRNA expression[J].J Beiiing Med Univ(北京医科大学学报),1999,31(2):179-183.
[20]Hu YH, Lin ZB, He YQ,Zhao CJ.Polysaccharides isolated from mycelia of Ganoderma lucidum induced onHL-60 cell apoptosis by enhancing macrophage activity[J].Chin Pharmacol Bull(中国药理学通报),1999,15(1):27-30.
[21]Wang SY,Hsu ML,Hsu HC,Tzeng CH,Lee SS,Shiao MS,et al.The anti-tumor effect of Ganoderma lucidum is mediated by cytokines released from activated macrophages and T lymphocytes [J].Int J Cancer,1997,70(6):699-705.
[22]Li MC,Lei LS,Liang DS,Xu ZM,Yang SQ,Sun LS.Effect of Ganoderma polysaccharides on interleukin 1α and tumor necrosis factor α mRNA expression in murine peritoneal macrophages [J].Chin J Pharmaocol Toxicol(中国药理学与毒理学杂志),2000,14(3):237-240.
[23] Cao LZ,Lin ZB.Regulation on maturation and function of dendritic cells by Ganoderma lucidum polysaccharides[J].Immunol Lett,2002,83(3):163-169.
[24]Cao LZ,Lin ZB.Regulatory effect of Ganoderma lucidum polysaccharides on cytotoxic T-lymphocytes induced by dendritic cells in vitro[J].Acta Pharmacol Sin,2003,24(4):321-326.
[25]Lin YL,Liang YC,Lee SS,Chiang BL.Polysaccharide purified from Ganoderma lucidum induced activation and maturation of human monocytederived dendritic cells by the NF-kappaB and p38 mitogen-activated protein kinase pathways[J].J Leukoc Biol,2005,78(2):533-543.
[26]Lin YL,Liang YC,Tseng YS,Huang HY,Chou SY,Hseu RS,et al.An immunomodulatory protein,Ling Zhi-8,induced activation and maturation of human monocyte-derived dendritic cells by the NF-kappaB and MAPK pathways[J].J Leukoc Biol,2009,86(4):877-889.
[27]Zhou H,Sun F,Li H,Zhang S,Liu Z,Pei J,et al.Effect of recombinant Ganoderma lucidum immunoregulatory protein on cyclophosphamideinduced leukopenia in mice[J].Immunopharmacol Immunotoxicol,2013,35(3):426-433.
[28]Chan WK,Cheung CC,Law HK,Lau YL,Chan GC. Ganoderma lucidum polysaccharides can induce human monocytic leukemia cells into dendritic cells with immuno-stimulatory function[J].J Hematol Oncol,2008,1:9.
[29]Meng J,Hu X,Shan F,Hua H,Lu C,Wang E,et al.Analysis of maturation of murine dendritic cells(DCs) inducedbypurifiedGanoderma lucidum polysaccharides(GLPs)[J].Int J Biol Macromol,2011,49(4):693-699.
[30]Yoshida H,Suzuki M,Sakaguchi R,Tani I,Kotani H,Shudo N,et al.Preferential induction of Th17 cells in vitro and in vivo by Fucogalactan from Ganoderma lucidum(Reishi)[J].Biochem Biophys Res Commun,2012,422(1):174-180.
[31]Yue GG,Chan BC,Han XQ,Cheng L,Wong EC,Leung PC,et al.Immunomodulatory activities of Ganoderma sinense polysaccharides in human immune cells[J].Nutr Cancer,2013,65(5):765-774.
[32]Lin ZB,Zhang ZL,Ruan Y,Wu YC,Cong Z. The pharmacological study of Ganoderma lucidum. partⅥ:Effects of different extract fractions from Ganoderma lucidum fruiting bodies on the phagocytic activity of mouse peritoneal macrophages [J].Edib Fungi(食用菌),1980,3:5-6.
[33]Gao B,Yang GZ.Effects of Ganoderma applanatum polysaccharides on immune function of normal mouse and its tumor inhibiting action[J].Chin J Immunol(中国免疫学杂志),1989,5:363-366.
[34]Gu LG,Zhou Y,Yan XZ,Tao JD.Effectof Ganoderma capense on macropheges in mice [J].Shanghai J Immunol(上海免疫学杂志),1990,1(4):205-206.
[35]Cao LZ,Lin ZB.Comparison oftheeffectsof polysaccharides from wood-cultured and bag-cultured Ganoderma lucidum on murine spleen lymphocyte proliferation in vitro[J].Acta Pharm Sin(药学学报),2003,38(2):92-97.
[36]Tang QJ,Zhang JS,Pan YJ,Werner R,Fan H. Activation of mouse macrophages by the alkaliextracted polysaccharide from spore of Ganoderma lucidum[J].Chin J Cell Mol Immunol(细胞与分子免疫学杂志),2004,20(2):142-144.
[37]Hsu MJ,Lee SS,Lee ST,Lin WW.Signaling mechanisms of enhanced neutrophil phagocytosis and chemotaxis by the polysaccharide purified from Ganoderma lucidum[J].Br J Pharmacol,2003,139(2):289-298.
[38]Hsu MJ,Lee SS,Lin WW.Polysaccharide purified from Ganoderma lucidum inhibits spontaneous and Fas-mediated apoptosis in human neutrophils through activation of the phosphatidylinositol 3 kinase/Akt signaling pathway[J].J Leukoc Biol,2002,72(1):207-216.
[39]Chien CM,Cheng JL,Chang WT,Tien MH,Tsao CM,Chang YH,et al.Polysaccharides of Ganoderma lucidum alter cell immunophenotypic expression and enhance CD56+NK-cell cytotoxicity in cord blood[J].Bioorg Med Chem,2004,12 (21):5603-5609.
[40]Tang QJ,Zhang JS,Pan YJ,Martin ZK,Werner R,FAN H.Activation of normal and tumor-bearing mouse macrophages by active polysaccharide from Ganoderma lucidum[J].Curr Immunol(现代免疫学),2005,25(1):49-52,55.
[41]Zhang J,Tang Q,Zhou C,Jia W,Da Silva L,Nguyen LD,et al.GLIS,A bioactive proteoglycan fraction from Ganoderma lucidum,displays antitumour activity by increasing both humoral and cellular immune response[J].Life Sci,2010,87 (19-22):628-637.
[42]Wei MT,Hua KF,Hsu J,Karmenyan A,Tseng KY,Wong CH,et al.The interaction of lipopolysaccharidewithmembranereceptorsonmacrophages pretreated with extract of Reishi polysaccharides measured by optical tweezers[J].Opt Express,2007,15(17):11020-11032.
[43]Watanabe K,Shuto T,Sato M,Onuki K,Mizunoe S,Suzuki S,et al.Lucidenic acids-rich extract from antlered form of Ganoderma lucidum enhances TNFα induction in THP-1 monocytic cells possibly via its modulation of MAP kinases p38 and JNK [J].Biochem Biophys Res Commun,2011,408 (1):18-24.
[44]Zhang S,Nie S,Huang D,Li W,Xie M.Immunomodulatory effect of Ganoderma atrum polysaccharideonCT26tumor-bearing mice[J]. Food Chem,2013,136(3-4):1213-1219.
[45]Huang JQ,Nie QX,Liu XZ,Zhang SS,Nie SP,Huang DF,et al.Ganoderma atrum polysaccharidemodulates TNF-α secretion and mRNA expression in macrophages of S-180 tumor-bearing mice[J]. Food Hydrocolloids,2016,53:24-30.
[46]Li MC,Lei LS,Liang DS,Xu ZM,Yang SQ,Sun LS.Effect of Ganoderma polysacchride on intracellular free calcium in murine peritoneal macrophages[J].Chin Pharm J(中国药学杂志),1999,34(12):805-807.
[47]Li MC,Lei LS,Liang DS,Xu ZM,Yang SQ,Sun LS.Effect of Ganoderma polysacchrides on PKC activity in murine peritoneal macrophages[J]. Chin Pharmacol Bull(中国药理学通报),2000,16 (1):36-38.
[48]You YH,Lin ZB.Protective effects of Ganoderma lucidumpolysaccharidespeptideoninjuryof macrophages induced by reactive oxygen species [J].Acta Pharmacol Sin,2002,23(9):787-791.
[49]You YH,Lin ZB.Free radical scavenging activity by Ganoderma lucidum polysaccharides peptide on peritoneal macrophages in mice[J].Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2004,9(1):52-55.
[50]You YH, Lin ZB.InfluenceofGanoderma lucidum polysaccharidespeptide on free-radicalinduced peritoneal macrophage injury in early stage[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2005,19(2):137-139.
[51]Cheng CH,Leung AY,Chen CF.The effects of two different Ganoderma species(Lingzhi)on gene expression in human monocytic THP-1 cells [J].Nutr Cancer,2010,62(5):648-658.
[52]Won SJ,Lee SS,Ke YH,et al.Enhancement of splenic NK cytotoxic activity by extracts of Ganoderma lucidum mycelium in mice[J].J Biomed Lab Sci,1989,2:201-213.
[53]Won SJ,Lin MT,Wu WL.Ganoderma tsugae mycelium enhances splenic natural killer cell activity and serum interferon production in mice [J].Jpn J Pharmacol,1992,59(2):171-176.
[54]Ning AH,Cao J,Huag M,Zhang W.The antirumor action and influence of immune systerm of Ganoderma polysaccharides in mice[J].Chin J Microecol(中国微生态学杂志),2004,16(1):13-14.
[55]Zhu XL,Chen AF,Lin ZB.Ganoderma lucidum polysaccharides enhance the function of immunological effector cells in immunosuppressed mice [J].J Ethnopharmacol,2007,111(2):219-226.
[56]Chang YH,Yang JS,Yang JL,Wu CL,Chang SJ,Lu KW,et al.Ganoderma lucidum extracts inhibited leukemia WEHI-3 cells in BALB/c mice and promoted an immune response in vivo[J].Biosci Biotechnol Biochem,2009,73(12):2589-2594.
[57]Tsai CC,Yang FL,Huang ZY,Chen CS,Yang YL,Hua KF,et al.Oligosaccharide and peptidoglycan ofGanodermalucidumactivatetheimmune response in human mononuclear cells[J].J Agric Food Chem,2012,60(11):2830-2837.
[58]Zhu XL,Lin ZB.Effects of Ganoderma lucidum polysaccharides on proliferation and cytotoxicity of cytokine-induced killer cells[J].Acta Pharmacol Sin,2005,26(9):1130-1137.
[59]Zhu XL,Lin ZB.Modulation of cytokines production,granzyme B and perforin in murine CIK cells by Ganoderma lucidum polysaccharides[J].Carbohydrate Polymers,2006,63:188-197.
[60]Sun LX,Lin ZB,Duan XS,Lu J,Ge ZH,Li XF,et al.Enhanced MHC class I and costimulatory moleculesonB16F10cellsbyGanoderma lucidumpolysaccharides[J].JDrugTarget,2012,20(7):582-592.
[61]Sun LX,Lin ZB,Li XJ,Li M,Lu J,Duan XS,et al.Promoting effects of Ganoderma lucidum polysaccharidesonB16F10cellstoactivate lymphocytes[J].Basic Clin Pharmacol Toxicol,2011,108(3):149-154.
[62]Sun LX,Lin ZB,Duan XS,Lu J,Ge ZH,Li XJ,et al.Ganoderma lucidum polysaccharides antagonize the suppression on lymphocytes induced by culture supernatants of B16F10 melanoma cells[J].J Pharm Pharmacol,2011,63(5):725-735.
[63]Sun LX,Lin ZB,Duan XS,Lu J,Ge ZH,Li M,et al.Ganoderma lucidum polysaccharides counteract inhibition on CD71 and FasL expression by culture supernatant of B16F10 cells upon lymphocyte activation[J].Exp Ther Med,2013,5(4):1117-1122.
[64]Sun LX,Li WD,Lin ZB,Duan XS,Xing EH,Jiang MM,et al.Cytokine production suppression by culturesupernatantofB16F10cellsand amelioration by Ganoderma lucidum polysaccharides in activated lymphocytes[J].Cell Tissue Res,2015,360(2):379-389.
[65]Sun LX,Lin ZB,Duan XS,Qi HH,Yang N,Li M,et al.Suppression of the production of transforming growthfactorβ1, interleukin-10, and vascular endothelial growth factor in the B16F10 cells by Ganoderma lucidum polysaccharides[J].J Interferon Cytokine Res,2014,34(9):667-675.
[66]Cao QZ,Lin ZB.Ganoderma lucidum polysaccharides peptide inhibits the growth of vascular endothelial cell and the induction of VEGF in human lung cancer cell[J].Life Sci,2006,78 (13):1457-1463.
[67]Wang XJ,Xu JP,Cheng YF.Inhibitory and antiangiogeneticeffectsofGanodermaLucidum spore on the human hepatocarcinoma transplanted in nude mice[J].Acta Acad Med Xuzhou(徐州医学院学报),2006,26(2):115-119.
[68]Hsu SC,Ou CC,Chuang TC,Li JW,Lee YJ,Wang V,et al.Ganoderma tsugae extract inhibits expression of epidermal growth factor receptor and angiogenesis in human epidermoid carcinoma cells:In vitro and in vivo[J].Cancer Lett,2009,281(1):108-116.
[69]Guo PR,Sheng YW,Liu B,Wang C,Liu YD,Fu DW,et al.Influence of Ganoderma lucidum polysaccharide on the inhibitory effects of cisplatin on the tumor growth and angiogenesis in bladder cancer(T24)cells-bearing nude mice[J].Med J Chin PLA(解放军医学杂志),2014,39(6):470-474.
[70]Lu J,Sun LX,Lin ZB,Duan XS,Ge ZH,Xing EH,et al.Antagonism by Ganoderma lucidum polysaccharidesagainstthesuppressionby culture supernatants of B16F10 melanoma cells on macrophage[J].Phytother Res,2014,28 (2):200-206.
[71]Sun LX,Li WD,Lin ZB,Duan XS,Li XF,Yang N,et al.Protection against lung cancer patient plasmainduced lymphocyte suppression by Ganoderma lucidum polysaccharides[J].Cell Physiol Biochem,2014,33(2):289-299.
[72]Liao SF,Liang CH,Ho MY,Hsu TL,Tsai TI,Hsieh YS,et al.Immunization of fucose-containing polysaccharides from Reishi mushroom induces antibodies to tumor-associated Globo H-series epitopes[J].Proc Natl Acad Sci USA,2013,110 (34):13809-13814.
[73]Gong Z,Lin ZB.Thepharmacologicalstudy of Lingzhi(Ganoderma lucidum)and the research of therapeutical principle of″Fuzhengguben″in traditional Chinese medicine[J].J Beijing Med Coll(北京医学院学报),1981,1(1):6-10.
[74]Lin ZB.Integrated study with traditional and Western medicine on Ganoderma(Lingzhi)guided by theory of TCM[J].Chin J Integrated Tradit West Med(中国中西医结合杂志),2001,21(12):883-884.
[75]Lin ZB.The Fu Zhen Gu Ben principle of Ganoderma(Lingzhi)explained by integrated study with traditional and Western medicine[J].J Fujian Univ TCM(福建中医药大学学报),2010,20(6):1-2,6.
[76]Yan BK,Wei YJ,Li YQ.Effectof Laojunxian Lingzhi Oral Liquid combined with chemotherapy on non-parvicellular lung cancer at stagesⅡandⅢ[J].Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理),1998,9(2):78-80,126.
[77]Zhang X,Jia YM,Li Q,Niu SF,Zhu SN,Shen CF. Clinical curative effect investigation of Lingzhi tablets on lung cancer[J].Chin Tradit Pat Med(中成药),2000,22(7):486-588.
[78]Wang YH,Qu ZH,Zhao ZY.Effect of Ganoderma lucidum spores on immune function in patients with non small cell lung cancer during chemotherapy [J].China Pract Med(中国实用医药),2014,9 (23):20-21.
[79]Lin ND,Su JN,Zhu Z,Gao YH,Gao H,Xie GY,et al.Analysis on 66 cases of cancer patients treated by chemotherapy with extract of Ganoderma lucidum[J].J Pract Tradit Chin Intern Med(实用中医内科杂志),2004,18(5):457-458.
[80]Qi YF,Li XR,Yan M,Liu A,Jiao ZH,Liu Y. Clinical observation ofadjuvant chemotherapy by Ganoderma lucidum spore for the treatment of digestive tract cancer patients[J].Chin J Integrated Tradit West Med(中国中西医结合杂志),1999,19(9):554-555.
[81]Zhen ZJ,Wang FJ,Fan GY,Chen HW.Effect of Ganoderma lucidum spore to the immunological function of patients with hepatocellular carcinoma after operation[J].Chin J Hepat Surg(Electron Ed)(中华肝脏外科手术学电子杂志),2013,2(3):171-174.
[82]Zhou JH,Zhang QH.Effect of Ganoderma lucidum spore on T cell subtype and VEGF of peripheral blood in old patients with carcinoma of uterine cervix[J].Matern Child Health Care China(中国妇幼保健),2014,29(13):2021-2022.
[83]Zhao H,Zhang Q,Zhao L,Huang X,Wang J,Kang X.Spore powder of Ganoderma lucidum improves cancer-related fatigue in breast cancer patients undergoing endocrine therapy:a pilot clinical trial[J].Evid Based Complement Alternat Med,2012,2012:809614.
[84]Huang JM,Zhong XN,Li GB,Sun R.Therapeutic effect of Mixture Lingzhi with CD3AK cell on lung cancer[J].Mod J Integrated Tradit Chin West Med(现代中西医结合杂志),2001,10(8):704-705.
[85]Kimura Y,Taniguchi M,Baba K.Antitumor andantimetastatic effects on liver of triterpenoid fractions of Ganoderma lucidum:mechanism of action and isolation of an active substance[J].Anticancer Res,2002,22(6A):3309-3318.
[86]Song YS,Kim SH,Sa JH,Jin C,Lim CJ,Park EH. Anti-angiogenic and inhibitory activity on inducible nitric oxide production of the mushroom Ganoderma lucidum[J].J Ethnopharmacol,2004,90(1):17-20.
[87] Zhang XC,Chen GL,Ma B,Li XJ,Yu HM. Ganoderma lucidum polysaccharides inhibit angiogenesis and cell adhesion in chicken chorioallantoic membrane model[J].Basic Clin Med(基础医学与临床),2005,25(9):825-828.
[88] Wu QP,Xie YZ,Li SZ,David P.La Pierre,Deng ZQ,Chen Q,et al.Tumour cell adhesion and integrin expression affected by Ganoderma [J].Enzyme Microb T echnol,2006,40:32-41.
[89]Sliva D,Sedlak M,Slivova V,Valachovicova T,Lloyd FP Jr,Ho NW.Biologic activity of spores and dried powder from Ganoderma lucidum for the inhibition of highly invasive human breast and prostate cancer cells[J].J Altern Complement Med,2003,9(4):491-497.
[90]Sliva D,Labarrere C,Slivova V,Sedlak M,LloydFPJr,HoNW.Ganodermalucidum suppresses motility of highly invasive breast and prostate cancer cells[J].Biochem Biophys Res Commun,2002,298(4):603-612.
[91]Cao QZ,Lin SQ,Wang SZ, Lin ZB.Effect of Ganoderma lucidum polysaccharides peptide on invasion of human lung carcinoma cells in vitro [J].J Peking Univ(Health Sci)北京大学学报(医学版),2007,39(6):653-656.
[92]Zhao SF,Luo B,Cheng JX.Effect of Ganoderma lucidum spore on invasion and metastasis of human ovarian carcinoma cells[J].Chin J Basic Med Tradit Chin Med(中国中医基础医学杂志),2010,16(6):524-526,529.
[93]Li WD,Zhang BD,Wei R,Liu JH,Lin ZB. Reversal effect of Ganoderma lucidum polysaccharide on multidrug resistance in K562/ADM cell line[J].Acta Pharmacol Sin,2008,29(5):620-627.
[94]Sadava D,Still DW,Mudry RR,Kane SE.Effect of Ganoderma on drug-sensitive andmultidrugresistant small-cell lung carcinoma cells[J].Cancer Lett,2009,277(2):182-189.
[95]TANG W.Ganoderic acid T improves sensitivity of multidrug resistant KB-A-1/Dox cells to doxorubicin[J].Nat Prod Res Dev(天然产物研究与开发),2013,25:1052-1055.
[96]Tang Y,Gao QH,Xu WT,Wu Z,Li FR.Study of Ganoderma lucidum on active component reversedSGC7901/ADRmultidrugresistance [J].J Chin Med Mater(中药材),2013,36(12):2007-2010.
[97]Chung WT,Lee SH,Kim JD,Park YS,Hwang B,Lee SY,et al.Effect of mycelial culture broth of Ganoderma lucidum on the growth characteristics of human cell lines[J].J Biosci Bioeng,2001,92 (6):550-555.
[98]Chung WT,Lee SH,Kim JD,Park YS,Hwang B,Lee SY,et al.Effect of mycelial culture broth of Ganoderma lucidum on the growth characteristics of human cell lines[J].J Biosci Bioeng,2001,92 (6):550-555.
[99]Gao JJ,Min BS,Ahn EM,Nakamura N,Lee HK,Hattori M.New triterpene aldehydes,lucialdehydes A-C,from Ganoderma lucidum and their cytotoxicity against murine and human tumor cells [J].Chem Pharm Bull(Tokyo),2002,50(6):837-840.
[100]Min BS,Gao JJ,Nakamura N,Hattori M.Triterpenes from the spores of Ganoderma lucidum and their cytotoxicity against meth-A and LLC tumor cells[J].Chem Pharm Bull(Tokyo),2000,48(7):1026-1033.
[101]Su HJ,Fann YF,Chung MI,Won SJ,Lin CN. New lanostanoids of Ganoderma tsugae[J].J Nat Prod,2000,63(4):514-516.
[102]Müller CI,Kumagai T,O′Kelly J,Seeram NP,HeberD,KoefflerHP.Ganodermalucidum causes apoptosis in leukemia,lymphoma and multiple myeloma cells[J].Leuk Res,2006,30 (7):841-848.
[103]Ruan WW,Popovich DG.Ganoderma lucidum triterpenoid extract induces apoptosis in human colon carcinoma cells(Caco-2)[J].Biomed Prev Nutr,2012,2(3):203-209.
[104]Calviño E,ajuelo L, Manjón JL,Sancho P,Tejedor MC,Gil J,et al.Active fraction from Ganoderma lucidum with apoptosis activity on peripheral blood mononuclear cells from chronic lymphocytic leukemia[J].Eur J Integr Med,2012,4(3):e335-e343.
(本文编辑:齐春会)
Antitumor effect of Ganoderma(Lingzhi)mediated by
immunological mechanism and its clinical application
LIN Zhi-bin
(Department of Pharmacology,School of Basic Medical Sciences,Health Science Center,Peking University,Beijing 100191,China)
The anti-tumor effect of Ganoderma(Lingzhi)is closely related to immunoregulation. Based on our research and other references,this article discussed the antitumor effect of Ganoderma mediated by immunological mechanism,including promoting the function of mononuclear-macrophages,and natural killers,promoting maturation and differentiation of dendritic cells,increasing its antigen presentation,activating lymphocytes and increasing cytotoxicity of cytotoxin T lymphocyte,promoting production of cytokines,inhibiting tumor escape from immune surveillance.Also,clinical studies with immunological indexes were reviewed.
Ganoderma;polysaccharides;tumor;antineoplastic agents,phytogenic;tumor escape;therapeutic uses
LIN Zhi-bin,E-mail:linzb1937@sina.com
R285,R979.1
A
1000-3002(2015)06-0865-18
10.3867/j.issn.1000-3002.2015.06.001
林志彬,E-mail:linzb1937@sina.com
(2015-10-29接受日期:2015-11-06)
