IL-2通过Jak3-Stat5通路促进巨噬细胞M1极化
2015-08-28亓文静于爱莲
亓文静,李 岩,王 玉,于爱莲
(泰山医学院基础医学院病原生物学研究所,山东泰安271000)
IL-2是免疫系统中多效能的细胞因子,对巨噬细胞和单核细胞有激活作用[1]。IL-2在病毒性感染,恶性肿瘤和其他疾病中具有重要临床价值。
巨噬细胞极化是一异质过程,不同极化产生不同功能的活化细胞。根据表型和分泌的细胞因子,可将其激活分为经典活化(classically-activated,M1)和选择活化(alternatively-activated,M2),不同活化诱导不同的胞内信号。常见M1型标志物:IFN-γ、IL-1β、IL-12、IL-23及 TNF-α 等;M2 型标志物有:Arginase-1、CD163、IL-10、IL-4R1 及 TGF-β 等[2]。巨噬细胞极化是多因子相互作用的复杂过程,受到胞内多种分子及通路的调控。
IL-2能够有效激活、提高巨噬细胞的吞噬及杀伤活性[3-4]。但IL-2对巨噬细胞极化及其机制很少有报道。IL-2同家族的IL-4,已被证实能够促使M0向M2极化[5]。因此,本研究拟通过与IL-4作用的对比,探求IL-2在调控巨噬细胞极化中的作用及其所涉及的通路。
1 材料与方法
1.1 材料
小鼠单核巨噬细胞RAW 264.7(中国科学院细胞库);重组小鼠白介素-2(rmIL-2)和重组小鼠白介素-4(rmIL-4)(Sigma公司);Trizol、反转录试剂盒、SYBR-Green荧光染料[宝生物工程(大连)有限公司];引物由上海生工生物工程技术服务公司合成;蛋白裂解液RIPA、PMSF蛋白酶抑制剂和BCA蛋白定量试剂盒(碧云天生物技术研究所);anti-F4/80-PE,anti-CD206-APC(eBbioscience)和 anti-CD11c-FITC(Biolegend)(达科为公司);anti-iNOS(sc-650)和anti-Arg-1(sc-20150)(Santa Cruz公司);anti-Phospho-Stat5(p-Stat5,#4322),anti-Stat5(#9358),anti-Phospho-Jak3(p-Jak5,#5031),anti-Jak3(#8863)和辣根过氧化物酶标记的二抗(Cell Signaling Technology公司);ECL Plus发光液(Millipore公司)。
1.2 方法
1.2.1 细胞培养与处理:巨噬细胞RAW 264.7培养于含10%胎牛血清的高糖DMEM培养液中,37℃,5%CO2培养,0.05%胰蛋白酶消化传代,传至3~8代内用于实验。重组细胞因子rmIL-2(IL-2)和rmIL-4(IL-4)对细胞的处理浓度均为20 ng/mL,对照组处理采用同样浓度的BSA。
1.2.2 实时荧光定量real-time PCR:细胞经处理后,Trizol法提取总 RNA,按反转录试剂盒说明操作,1 μg RNA反转获得 cDNA第一链。Real-time PCR SYBR Green试剂盒检测各目的基因的mRNA水平,各基因引物序列见表1。检测仪器为:ABI 7300 real-time PCR仪。反应条件(二步法):95℃15 s,60 ℃ 45 s,45 循环。采用 2-ΔΔCT法计算目的基因与内参基因β-actin的相对表达量。
1.2.3 流式细胞术:RAW 264.7细胞经IL-2(20 ng/mL)和IL-4(20 ng/mL)处理24 h后,分别用F4/80-PE和 CD11c-FITC标记 M1型细胞,以F4/80-PE和CD206-APC标记M2型细胞,运用流式细胞仪FACSCalibur(BD Biosciences)检测,以Cell Quest软件分析10 000个细胞样品。
1.2.4 Western blot:细胞处理完成后,消化收集各培养板细胞,1 500 r/min离心5 min,PBS洗3次,加入适量预混PMSF的RIPA蛋白裂解液,冰浴裂解15 min,12 000 r/min离心10 min后取上清。BCA法蛋白定量,与适量比例的上样缓冲液混合后,煮沸10 min。
等量蛋白(40 μg)上样于12%SDS-PAGE胶中分离,之后将蛋白转印至硝酸纤维素膜上,5%脱脂牛奶粉封闭1~2 h后,4℃孵育一抗过夜,次日,TBST洗膜,10 min/次,共洗3次,常温孵育辣根过氧化物酶标记的二抗,TBST洗膜,10 min/次,共洗3次,化学发光底物(ECL Plus发光液),曝光。Gel Pro Analyzer软件处理条带吸光度值。

表1 细胞因子引物序列Table 1 Real-time PCR primer sequences of oytokines
1.3 统计学分析
统计分析及作图使用SPSS 18.0软件及Graph-Pad Prism 5.0软件进行。计量资料采用均数±标准差±s)表示。组间比较采用单因素方差分析或配对样本t检验。
2 结果
2.1 IL-2诱导巨噬细胞RAW 264.7表达M1型标志分子表达上调
在IL-2处理组,IL-1β的mRNA水平随处理时间延长而表达上调,在24 h表达量最高,而IL-10的mRNA水平在IL-2处理前后未发生改变(图1A);在IL-4处理组,IL-10的mRNA水平随处理时间延长而逐渐表达上调,而IL-1β的表达水平未出现显著性差异(图1B)。
IL-2和 IL-4诱导处理24 h后,TNF-α、IL-12和M2标志性分子CD163表达水平检测结果显示,IL-2能够引起TNF-α和IL-12的mRNA水平分别升高16.36和6.63倍,而CD163表达未改变(图2A);IL-4诱导引起了TNF-α和CD163 mRNA表达分别升高2.3倍和4.27倍(图2B)。
图3显示,IL-2能够引起M1型标志分子iNOS蛋白水平显著上调,而IL-4能够上调M2型分子Arg-1的蛋白水平。
2.2 IL-2诱导巨噬细胞RAW 264.7向M1极化
IL-2处理后,M1型巨噬细胞比例上升到24.6%,显著高于M2型的10.6%;与此相对应,IL-4处理后,M2型巨噬细胞比例上升到26.8%,显著高于M1型的9.4%(图4)。提示:IL-2能够体外诱导巨噬细胞RAW 264.7由M0向M1极化。
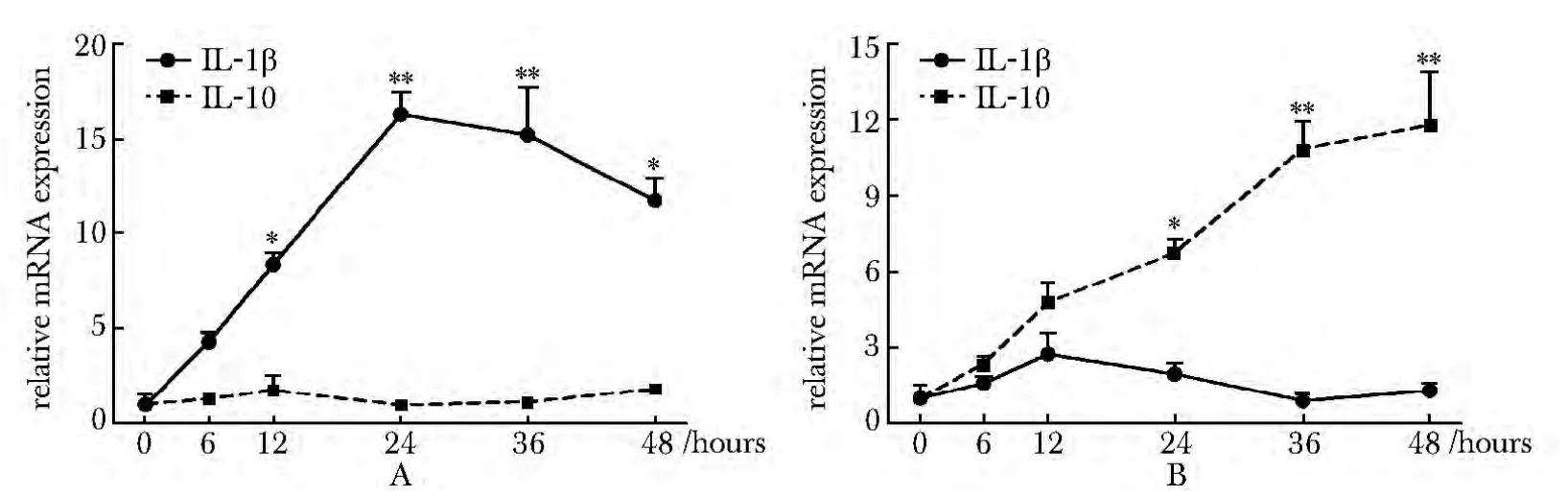
图1 IL-2或IL-4作用RAW 264.7细胞不同时间点,IL-1β和IL-10的mRNA表达水平检测Fig 1 The mRNA levels of IL-1β and IL-10 in RAW 264.7 cells treated with IL-2 or IL-4 for indicated time points

图2 IL-2或IL-4刺激RAW 264.7细胞24 h后,巨噬细胞M1型和M2型标志分子的mRNA表达水平Fig 2 The mRNA levels of M1 and M2 macrophages markers in RAW 264.7 cells after treated with IL-2 or IL-4 for 24 hours
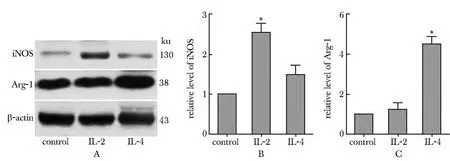
图3 IL-2或IL-4诱导巨噬细胞M1型标志分子iNOS和M2型标志分子Arg-1蛋白水平的检测Fig 3 The protein levels of iNOS and Arg-1 were detected by Western blot

图4 流式细胞术检测巨噬细胞RAW 264.7的分型Fig 4 The phenotype of macrophage RAW 264.7 were detected by Flow cytometry
2.3 IL-2通过激活Jak3-Stat5信号通路诱导巨噬细胞RAW 264.7极化
Western blot方法检测Jak3和Stat5的磷酸化及总的蛋白表达,结果显示,在IL-2处理后,Jak3和Stat5分子的磷酸化水平分别增高3.2和2.6倍(P<0.01),而其总蛋白水平没有改变(图5)。提示:Jak3-Stat5信号可能通路参与了IL-2诱导巨噬细胞的M1型极化作用。
3 讨论
巨噬细胞是固有免疫系统的重要成分,在机体的炎性反应、代谢及肿瘤微环境形成等生理过程中发挥重要作用,是针对不同环境因子产生的应答机制。巨噬细胞存在M1和M2两种极化类型[6],M1型细胞表现为促炎性反应和抗原提呈作用等,而M2型主要存在于肿瘤微环境中,主要抑制炎性反应,促进组织修复和纤维化等[7]。研究表明,IL-2可显著促进巨噬细胞分泌TNF-α,IL-1和NO等细胞因子,增强巨噬细胞对病原微生物或肿瘤细胞的杀伤作用[4]。然而,关于IL-2对巨噬细胞极化调节及其机制,至今尚未明确。

图5 Western blot检测IL-2对Jak3-Stat5信号通路激活Fig 5 The effects of IL-2 on Jak3-Stat5 signaling pathway were detected by Western blot
原始RAW 264.7细胞通常被认作M0型巨噬细胞。经IL-4作用,M0被诱导为M2[5];而经 LPS刺激,M0极化为M1[8]。本研究采用重组IL-2诱导RAW 264.7细胞,发现IL-2能够上调表达M1型标志分子的表达,而对M2型标志分子的表达无影响;之后采用流式细胞术进一步确认,IL-2能够诱导M0向M1极化。结果显示,相比于IL-4可诱导分泌M2型标志性分子,IL-2能够体外诱导M1型标志分子。再者,最新研究证明,IL-2能够促使IFN-γ的合成与分泌,IFN-γ 调节巨噬细胞向 M1型极化[9],亦间接证实本研究结果。
巨噬细胞极化是多因子多通路共同调控的结果,目前对其极性转换的具体机制仍未完全明确。有研究指出,IL-4能够通过激活Jak-Stat6通路,实现对巨噬细胞M2极化及相关标志分子的诱导[10]。IL-2及其受体γ是Jak3信号通路激活的基本条件;敲除IL-2受体γ即可阻滞其下游Stat5和MAPK等分子的磷酸化及表达[11]。作为Stat5的众多配体之一,IL-2能够在Tyr694位点使Stat5磷酸化,继而促使其激活[12];再者,在人DC细胞中,IL-2能够上调p-Stat5[9]。因此,本研究选择检测IL-2作用后Jak3和Stat5的活化程度。结果发现,IL-2作用后,Jak3和Stat5总蛋白水平没有改变,而其磷酸化水平显著提高,提示IL-2能够激活Jak3-Stat5通路。
本实验报道了IL-2具有促进巨噬细胞由M0向M1型极化的功能,并初步探究IL-2可能是通过Jak3-Stat5信号通路,实现对巨噬细胞极化的调控。从而将为继续研究IL-2的功能多样性,或深入探讨巨噬细胞极化的机制,增添新的研究资料和研究思路,同时也为机体免疫调控网络的研究提供重要参考价值。
[1]Skrombolas D,Frelinger JG.Challenges and developing solutions for increasing the benefits of IL-2 treatment in tumor therapy[J]. ExpertRev Clin Immunol,2014,10:207-217.
[2] Van Ginderachter JA,Movahedi K,Hassanzadeh Ghassabeh G,et al.Classical and alternative activation of mononuclear phagocytes:picking the best of both worlds for tumorpromotion [J]. Immunobiology, 2006, 211:487-501.
[3]曹雪涛.白细胞介素2的基础与临床[M].北京:北京科学技术出版社,1990,90-93.
[4]邱实,闵志廉,雷虹,等.IL-2基因修饰对巨噬细胞杀瘤活性的影响[J].第二军医大学学报,2000,21:24-26.
[5]Stein M,Keshav S,Harris N,et al.Interleukin 4 potently enhances murine macrophage mannose receptor activity:a marker of alternative immunologic macrophage activation[J].J Exp Med,1992,176:287-292.
[6]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8:958-969.
[7]Gordon S,Martinez FO.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32:593-604.
[8]杨琴,张志仁,姜曼,等.小鼠巨噬细胞功能极化可塑性的初步探讨[J].免疫学杂志,2013,29:104-109.
[9]Herr F,Lemoine R,Gouilleux F,et al.IL-2 phosphorylates STAT5 to drive IFN-γ production and activation of human dendriticcells[J]. JImmunol, 2014, 192:5660-5670.
[10]Martinez FO,Helming L,Gordon S.Alternative activation of macrophages:an immunologic functional perspective[J].Annu Rev Immunol,2009,27:451-483.
[11]Agarwal A,MacKenzie RJ,Eide CA,et al.Functional RNAi screen targeting cytokine and growth factor receptors reveals oncorequisite role for interleukin-2 gamma receptor in JAK3-mutation-positive leukemia[J]. Oncogene,2014,doi:10.1038/onc.2014.243.
[12] Okutani Y,Kitanaka A,Tanaka T,et al.Src directly tyrosine-phosphorylates STAT5 on its activation site and is involved in erythropoietin-induced signaling pathway[J].Oncogene,2001,20:6643-6650.
