枸橼酸氯米芬抑制大鼠子宫内膜增殖及其机制
2015-08-28王伟聿
谷 海,王伟聿,郑 沣,唐 莉
(1.昆明理工大学生命科学与技术学院,云南昆明650500;2.云南省第一人民医院生殖遗传一科,云南昆明650032)
枸橼酸氯米芬(clomiphene citrate,CC)因其可调节月经、促排卵,具有价格低廉、使用方便、促排卵效果好等优点,已成为微刺激促排卵方案中的一线药物[1],但是长期的临床实践发现,CC能够抑制子宫内膜增殖,降低子宫内膜厚度。因此,了解CC影响子宫内膜容受性的分子机制,对不孕不育症的临床治疗具有重要的指导意义。
课题组前期的研究结果显示,CC对子宫内膜增殖的抑制作用与细胞凋亡相关,但具体何种途径或信号通路诱导凋亡的发生尚不清楚[2]。已有的文献表明线粒体途径可能在子宫内膜细胞的凋亡过程中起到重要作用[3]。因此,本研究对细胞凋亡相关的线粒体途径进行检测,同时测了与之密切相关的PI3K/AKT、JNK和NF-κB通路。以期初步探索CC影响子宫内膜增殖的分子机制。
1 材料与方法
1.1 实验动物
SPF级雌性SD大鼠,体质量200~250 g[昆明医学院,SCXK(滇)2011-0004]。
1.2 主要试剂
枸橼酸氯米芬、戊酸雌二醇片,细胞线粒体分离试剂盒(上海碧云天生物技术有限公司),β-actin、PI3K、Cyt-c、mTOR、p-mTOR、Bax、Bcl-2、caspase-3、p-AKT、AKT、p-JNK、JNK、p-NF-κB 和 NF-κB 抗体(Santa Cruz Biotechnology公司),鼠、兔源二抗(Santa Cruz Biotechnology公司)。
1.3 实验方法
1.3.1 大鼠发情周期检测:早上8∶00开始实验,一直持续直到检测出两个完整发情周期才能开始进行后续实验。每只大鼠都要经过大约10~12 d的涂片检查。将当天处于发情前期的大鼠随机分配入各组。
1.3.2 大鼠分组和模型建立:将10只SD雌性大鼠均分为对照组(CO)和实验组(CC),对照组灌胃给0.9%氯化钠溶液,实验组给CC(1 mg/kg),持续给药6天。另15只大鼠均分为3组,对照组(CO)、CC组和CC+E2组,对照组灌胃给0.9%氯化钠溶液,实验组给CC和CC+E2,CC组给CC:1 mg/kg,CC+E2组给CC+E2 10 mg/只,持续给药10 d。
1.3.3 子宫获取:腹腔注射2%戊巴比妥钠液(2 mL/kg)麻醉;固定后开腹取子宫,钝性剔除子宫表面的脂肪组织;用刀片刮取内膜组织放入冻存管于-80℃保存。
1.3.4 线粒体蛋白分离:按试剂盒说明书进行。
1.3.5 Western blot检测凋亡相关通路:采用Western blot方法对 PI3K/AKT、JNK、NF-κB 通路中的标志性蛋白进行检测。具体操作为:取0.5 g内膜组织加入1.5 mL含有PMSF的RIPA裂解液中,在冰浴条件下进行组织匀浆;4℃ 12 000 r/min离心10 min,去除沉淀后,上清即为提取的蛋白。使用Bio-Rad公司的蛋白定量试剂盒,并严格按照其说明书要求测量总蛋白的浓度。根据各样本蛋白浓度,计算各样品相同蛋白量所需体积。蛋白样品中加入2×上样缓冲液,于95℃ 下变性5 min,室温下冷却后上样进行SDS-PAGE电泳。转膜后将其置于10%脱脂奶中(TBST缓冲液)封闭1 h,1×TBST洗3×5 min,加入特异性一抗(均为1∶1 000稀释)4℃下过夜孵育,1×TBST洗3×5 min,再分别加入相应的二抗(1∶5 000稀释)孵育1 h,1×TBST洗2×5 min,1×TBS洗10 min,暗室中膜上加入ECL发光液,胶片曝光、显影、定影。使用Quantity One 1.62软件扫描胶片中各条带的吸光度值,计算目的蛋白与内参蛋白β-actin的比值。每组实验重复3次。
1.4 统计学分析
实验数据采用GraphPad Prism 5统计软件进行检验,采用t检验进行两组之间比较,单因素方差检验比较各组间的差异(P<0.05),差异有统计学意义。
2 结果
2.1 大鼠发情周期检测
细胞个体较大,大部分呈椭圆形或近似椭圆形,有少量呈多边形,细胞比圆形细胞更大(图1A),由此可以判断为发情前期。出现了大量多边形细胞,并且堆叠在一块儿,这是角质化后的表皮细胞,由此可以推断为发情期或者发情后期(图1B),出现了大量的小圆细胞,这是大量的红细胞和白细胞,这是发情间期的明显标志(图1C,D)。
2.2 相关信号通路检测
2.2.1 CC给药:与对照组相比,CC给药组的Bax、caspase-3表达量增加(P<0.05),Bcl-2表达降低(P<0.05)(图2);细胞色素C(Cyt-c)从线粒体明显释放至胞质中(P<0.05)(图3)。
CC能增强JNK和NF-κB的磷酸化水平(P<0.05)(图4),激活JNK通路和NF-κB通路。同时,CC能够下调PI3K的表达水平,降低抑制mTOR和AKT的磷酸化水平,从而抑制PI3K/AKT信号通路(P<0.05)(图5)。

图1 大鼠阴道细胞涂片观察大鼠性周期Fig 1 Vaginal smear in rats estrous cycle(×40)
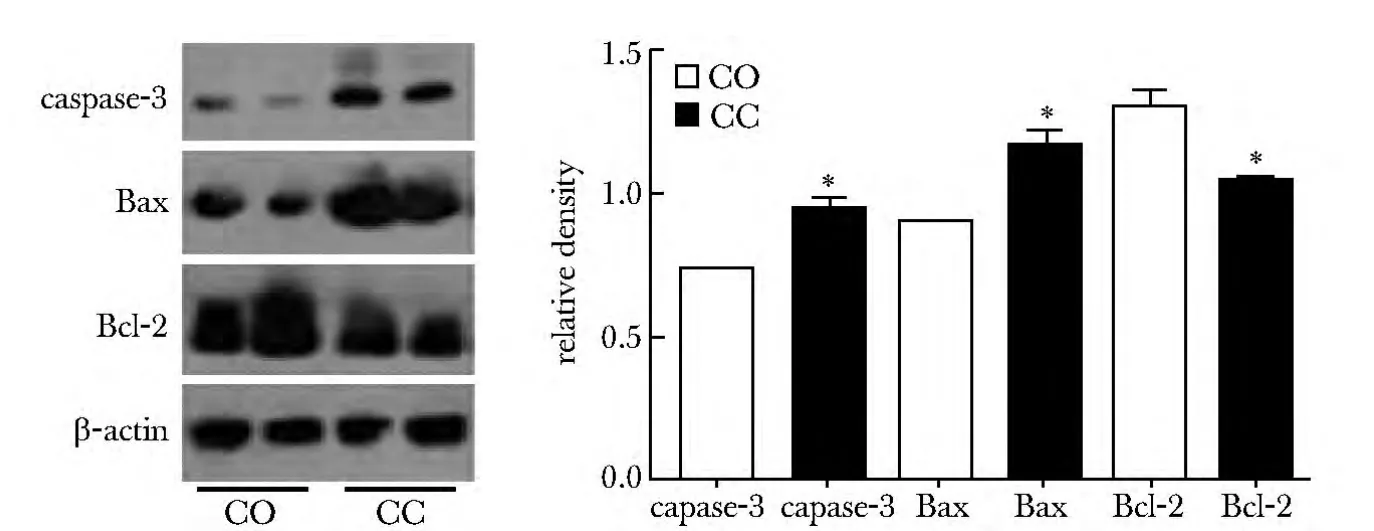
图2 线粒体相关途径的检测Fig 2 Detecting of the mitochondria related pathway

图3 细胞色素C的检测Fig 3 Detecting of cytochrome C
2.2.2 CC和E2协同给药:CC和CC与E2协同给药比较发现,caspase-3蛋白的表达反而增加(图6),内膜组织中总Cyt-c表达无明显降低(图6),E2对线粒体途径、NF-κB信号途径和JNk信号途径影响不显著,只是在一定程度上抑制了 NF-κB的表达。CC和CC+E2给药对此信号通路中某些蛋白表达量影响不显著性(图6,7),然而在PI3K/AKT信号通路中,CC+E2组PI3K、p-mTOR、p-AKT蛋白表达量均呈显著性增加(P<0.05,图8)。

图4 JNK、NF-κB信号通路的检测Fig 4 Detecting of JNK and NF-κB signal pathways
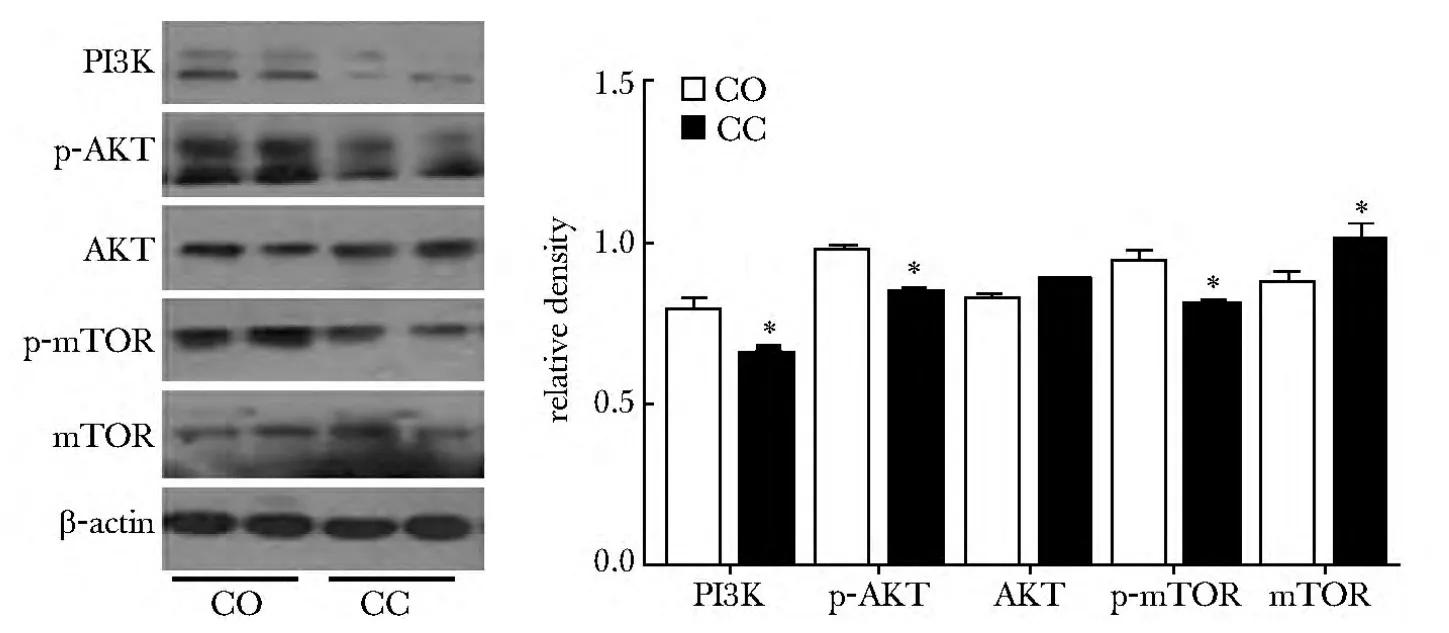
图5 PI3K/AKT信号通路的检测Fig 5 Detecting of PI3K/AKT signal pathways

图6 线粒体相关途径的检测Fig 6 Detecting of the mitochondria related pathway
3 讨论
本研究前期课题组已证实枸橼酸氯米芬能够使子宫内膜厚度降低15%,同时检测到了细胞凋亡的发生[2]。因此,推测CC对子宫内膜厚度的影响,很有可能与子宫内膜细胞的凋亡存在关联。本研究中caspase-3的Western blot结果首先初步确认了这一结果。随后的检测发现CC能够促进线粒体中细胞色素C的释放,同时上调Bax和下调Bcl-2的表达,这说明CC主要通过线粒体途径诱导凋亡的发生。这也与既往的相关性研究结果相一致,如Selvaggi等[4]发现子宫内膜异位症患者的子宫内膜细胞中的Bcl-2表达明显高于正常子宫内膜的表达。
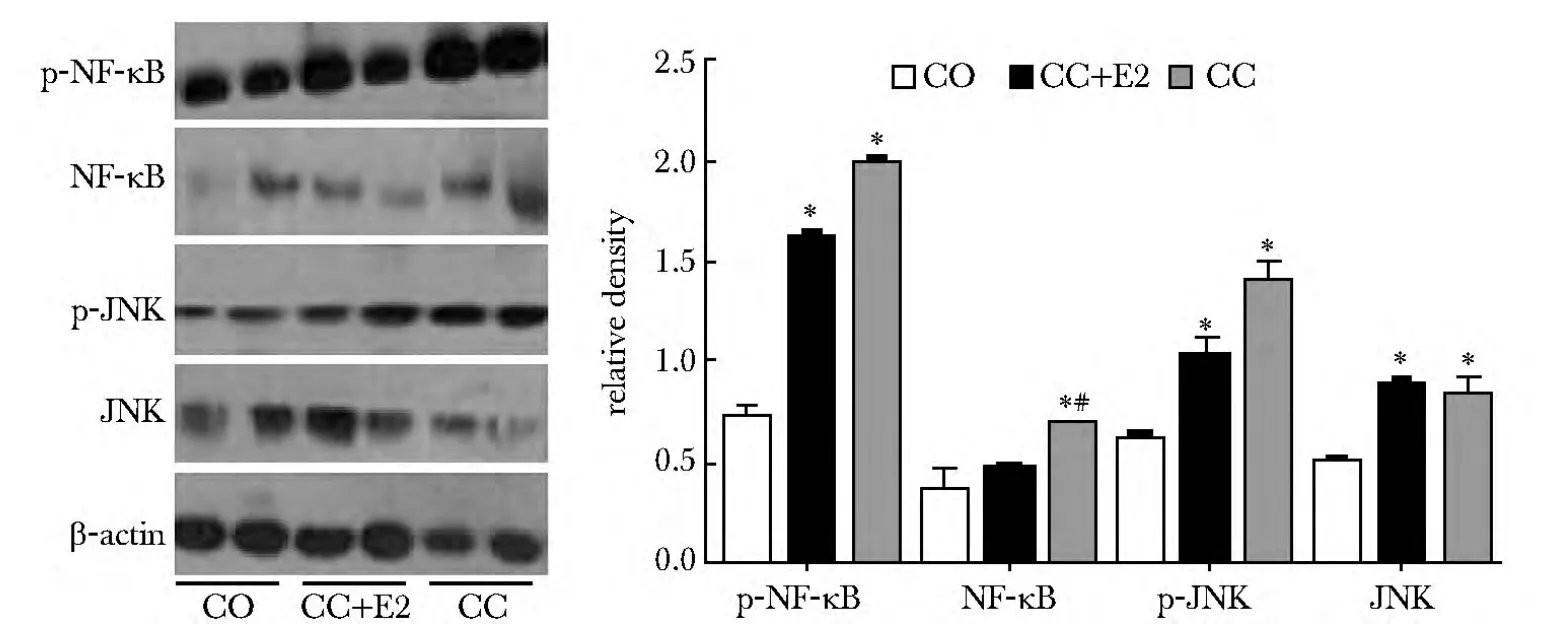
图7 JNK、NF-κB信号通路的检测Fig 7 Detecting of JNK and NF-κB signal pathways
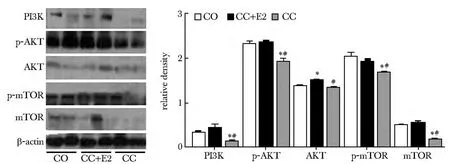
图8 PI3K/AKT信号通路的检测Fig 8 Detecting of PI3K/AKT signal pathways
本研究同时发现了CC所诱导的细胞凋亡涉及到了JNK和NF-κB信号通路的参与。JNK被各种物理、生物因素激活[5],活化的JNK进入细胞核激活核内转录因子如P53、c-Myc等和非转录因子,如Bcl-2家族[6],通过磷酸化转录因子活性产生包括炎性反应、增殖、凋亡等生物学效应[7]。NF-κB 是一种转录因子,它控制细胞黏附分子、细胞因子、生长因子和凝血系统一些成分的基因表达[8],活化的NF-κB转移入核后启动基因转录,活化caspase-1进而使细胞发生程序性死亡[9]。
此外,CC还能够与子宫内膜上雌激素受体结合,激活一系列信号反应(包括PI3K通路),产生抗雌激素作用可影响子宫内膜增殖[10]。本实验中单独CC给药显著抑制了PI3K信号通路;而在CC与E2协同给药时,该通路的抑制作用消失。E2作为雌激素治疗剂,同样能够与雌激素受体结合,因此在协同给药时能发挥竞争作用[11]。其拮抗CC的检测结果证实了CC能够对PI3K通路的调控作用。但E2并没有影响CC对NF-κB和JNK信号通路中某些蛋白的表达。有研究表明[12]CC促排时加用小剂量雌激素可以缓解CC的抗雌激素作用引起的子宫内膜厚度下降,但有人提出CC治疗周期中加用雌激素可以增加子宫内膜厚度,但并不能完全阻止CC导致的子宫内膜基质细胞的凋亡[13],与本研究结果相吻合。
本研究发现了CC能够促进子宫内膜上线粒体途径的细胞凋亡以及雌激素受体结合,涉及到JNK,NF-κB,PI3K等多种通路的参与。研究结果为靶向消除CC在促排卵时所带来的副作用提供了新的思考点。
[1]Homburg R.Clomiphene citrate—end of an era?A mini-review[J].Hum Reprod,2005,20:2043-2051.
[2]王伟聿,唐莉.氯米芬对雌性SD大鼠子宫内膜基因组表达影响及机制研究[D].昆明理工大学,2014:21-41.
[3]Sivalingam VN,Myers J,Nicholas S,et al.Metformin in reproductive health,pregnancy and gynaecological cancer:established and emerging indications[J].Hum Reprod Update,2014,20:853-868.
[4] Selvaggi L,Depalo R.Apoptosis in normal ovaries of women with and without endometriosis[J].Repord Biomed Online,2009,19:808-815.
[5]甄永占,林雅军,骆广玲,等.赖氨大黄酸通过激活 JNK诱导宫颈癌 HeLa细胞凋亡[J].基础医学与临床,2011,31:68-72.
[6]Liu J,Lin A.Role of JNK activation in apoptosis:a double-edged sword[J].Cell Res,2005,15:36-42.
[7]Elloumi-Mseddi J,Jemel-Oualha I,Beji A,et al.Effect of estradiol and clomiphene citrate on Erk activation in breast cancer cells[J].J Recept Signal Transduct,2014:1-5.
[8]王丹阳,朱广瑾,徐成丽.NF-κ B在某些心血管疾病中的作用[J]基础医学与临床,2011,31:1070-1073.
[9]Kottarathil VD,Antony MA,Nair IR,et al.Recent advances in granulosa cell tumor ovary:A review[J].Indian J Surg Oncol,2013,4:37-47.
[10]Musgrove EA,Sutherland RL.Biological determinants of endocrine resistance in breast cancer[J].Nat Rev Cancer,2009,9:631-643.
[11] Amita M,Takahashi T,Tsutsumi S,et al.Molecular mechanism of the inhibition of estradiol-induced endometrial epithelial cell proliferation by clomiphene citrate[J].Endocrinology,2010,151:394-405.
[12]Nutu M,Feng Y,Egecioglu E,et al.Stromal cell-specific apoptotic and antiestrogenic mechanisms may explain uterine defects in humans after clomiphene citrate therapy[J].Am J Obstet Gynecol,2010,203:65.e1-65.e10.
[13]Gonen Y,Casper RF.Jacobson W.et al.Endometrial thickness and growth during ovarian stimulation:a possible predictor of implantation in in vitro fertilization[J].Fertil Steril,1989,52:446-450.
