α-硫辛酸减轻高尿酸血症大鼠氧化应激损伤
2015-08-28马玲,周勇,王莉,姚华
马 玲,周 勇,王 莉,姚 华
(新疆医科大学1.公共卫生学院营养与食品卫生学教研室;2.基础医学院生物学教研室,新疆乌鲁木齐830011;3.北京市东城区社区卫生服务管理中心,北京100701;4.新疆医科大学新疆重大疾病医学重点实验室省部共建国家重点实验室培育基地,新疆乌鲁木齐830011)
随着尿酸与心血管之间关系的深入研究,高尿酸血症是否为心血管疾病的独立危险因素的争议不断。体外培养发现尿酸可导致血管内皮细胞炎性反应和功能障碍[1-2]。目前认为高尿酸导致的内皮细胞炎性反应与氧化应激有关。高尿酸血症大鼠体内的抗氧化能力下降[3]。α-硫辛酸 (Alpha-lipoic acid,α-LA)是线粒体酶系复合物的一种辅助因子,能够抑制脂质过氧化、清除氧自由基、恢复和增加体内其他抗氧化剂水平,从而减弱氧化应激、降低炎性标志物水平和改善内皮细胞功能[4]。本研究通过动物实验观察α-硫辛酸对高尿酸血症大鼠体内氧化应激水平和血管内皮细胞形态的影响,为进行此类疾病的防治提供理论依据。
1 材料与方法
1.1 主要试剂
酵母(97%)和β-actin(Sigma公司),氧嗪酸钾(OA)(OXOID公司),α-LA(江苏神龙药业有限公司),超氧歧化物酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)和丙二醛(MDA)试剂盒(为南京建成生物工程研究所),SOD一抗和二抗(Santa公司),CAT一抗(Epitomics公司),CAT二抗(北京中杉金桥公司),BCA蛋白定量试剂盒(Thermo公司)。
1.2 实验动物
SPF级雄性SD大鼠60只,体质量(200±35)g[新疆医科大学实验动物中心,动物许可证号:SYXK(新)2003-0004]。随机分为对照组、模型组、α-LA低剂量组(LLA组)、α-LA中剂量组(MLA组)和α-LA高剂量组(HLA组),每组12只。对照组给予普通饲料喂饲,模型组和α-LA干预组参照文献[3]进行高尿酸血症大鼠造模,3周后在持续造模的基础上,每天分别给予10、30和90 mg/kg的α-硫辛酸灌胃,连续2周。实验期间,动物自由摄食和饮水。
1.3 样本收集与指标检测
1.3.1 样本收集:干预2周后,乌拉坦腹腔麻醉,经腹主动脉取血,取胸主动脉,0.9%氯化钠溶液冲洗后,去近心端约1 cm,一段放入甲醛小瓶中固定,病理HE染色切片观察、一段放入已编号的盛有2.5%戊二醛小瓶中固定,电镜观察超微结构,剩余部分-80℃保存备用蛋白测定。
1.3.2 指标检测:生化法检测血清尿酸(UA),试剂盒检测血清SOD、GSH-Px、CAT和MDA水平。
1.3.3 Western blot:检测大鼠胸主动脉SOD、CAT蛋白:RlPA提取细胞蛋白,并用BCA法测定蛋白浓度。根据所测得浓度调整上样量,使每孔蛋白上样量均为40 μg,依次进行电泳、转膜、封闭、杂交和显影,扫描片子后用Quantity One软件进行分析。
1.4 统计学分析
采用软件SPSS17.0对数据进行统计分析,数据以均数±标准差±s)表示。多组之间比较采用方差齐性检验和单因素方差分析;两两比较时,方差齐,进行SNK检验(Student-Newman-Keuls);方差不齐,进行Games-Howell检验。
2 结果
2.1 α-LA干预前后各组大鼠血清尿酸水平比较
干预前,模型组和α-硫辛酸干预组的血清尿酸水平均高于对照组(P<0.05);干预后,各剂量干预组血清尿酸水平低于模型组(P<0.05)(表1)。
2.2 α-LA干预后各组大鼠血清抗氧化酶活力的比较
模型组的SOD、GSH-Px和CAT酶活力均低于对照组,MDA含量高于对照组(P<0.05)。α-硫辛酸干预后,高、中和低剂量组MDA含量低于模型组,中剂量和高剂量组SOD酶活力高于模型组(P<0.05)(表2)。
表1 各组大鼠α-LA干预前后的血清尿酸水平比较Table 1 Comparison of serum uric acid in hyperuricemia rats before and after intervention of α-lipoic acid(n=12± s,mmol/L)

表1 各组大鼠α-LA干预前后的血清尿酸水平比较Table 1 Comparison of serum uric acid in hyperuricemia rats before and after intervention of α-lipoic acid(n=12± s,mmol/L)
#P<0.05 compared with control group;*P<0.05 compared with model group.
group before intervention after intervention normal control 76.3±19.3* 65.0±23.3*model 127.4±18.0# 123.2±29.3#LLA 124.7±25.2# 59.5±29.5*MLA 123.5±24.2# 47.8±18.3*HLA 151.5±26.9# 31.7±21.3*
2.3 α-LA干预后各组大鼠胸主动脉SOD、CAT蛋白表达
模型组的SOD和CAT蛋白表达水平均显著低于正常对照组(P<0.05)(图1,2)。
LLA、MLA、HLA组SOD吸光度值均高于模型组;MLA、HLA组CAT吸光度值均高于模型组(P<0.05)(表3)。
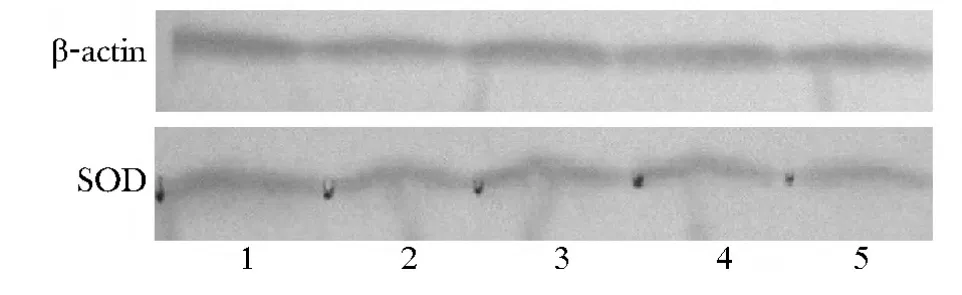
图1 各组大鼠胸主动脉SOD蛋白表达水平Fig 1 SOD's protein expression of rat's thoracic aorta in different groups(Western blot)

图2 各组大鼠胸主动脉CAT蛋白表达水平Fig 2 CAT's protein expression of rat's thoracic aorta in different groups(Western blot)
2.4 α-LA干预后大鼠胸主动脉的病理改变
正常对照组大鼠的胸主动脉壁内膜表面光滑、完整、各层结构正常,内皮细胞排列紧密无脱落,少见炎性细胞黏附、浸润。模型组可见大鼠部分内皮细胞水肿、脱落,内膜凸起;干预高剂量组大鼠胸主动脉内皮水肿、凸起数量减少(图3)。
2.5 干预后大鼠胸主动脉超微结构的改变
正常对照组:内膜表面光滑,内皮细胞多扁平,可见细胞核,染色质较均匀。中膜弹性膜连续,层次清楚。平滑肌细胞单层排列,核多见。模型组:内皮细胞水肿或脱落,细胞核基质密度增大。内弹力膜较厚,部分区域断裂、缺失。平滑肌细胞层,宽窄不一,多见“多支性平滑肌细胞”,平滑肌细胞向腔内移。线粒体肿胀,密度增大(图4)。
LLA组:内皮细胞肿胀明显,内皮细胞与内皮细胞下层连接不紧密,形成较大空泡。内皮基质密度较模型组有下降。细胞核异染色质较多,线粒体较多。MLA组:内皮细胞水肿程度较LLA组轻。中膜弹力层线粒体肿胀,数量增多。细胞核异染色质较多,平滑肌细胞层不连续。HLA组:内皮细胞水肿减轻,线粒体数量减少,内弹力膜连续。平滑肌线粒体水肿减轻(图5)。
表2 各组大鼠α-LA干预后血清SOD、GSH-Px、CAT和MDA的影响Table 2 Comparison of serum SOD,GSH-Px,CAT and MDA in hyperuricemia rats after the intervention of α-lipoic acid(n=12,mmol/L)

表2 各组大鼠α-LA干预后血清SOD、GSH-Px、CAT和MDA的影响Table 2 Comparison of serum SOD,GSH-Px,CAT and MDA in hyperuricemia rats after the intervention of α-lipoic acid(n=12,mmol/L)
#P<0.05 compared with control group;*P<0.05 compared with model group.
?
表3 各组大鼠α-LA干预后胸主动脉SOD、CAT蛋白表达值Table 3 Comparison of expression of SOD and CAT protein in hyperuricemia rats after the intervention of α-lipoic acid(n=12±s)

表3 各组大鼠α-LA干预后胸主动脉SOD、CAT蛋白表达值Table 3 Comparison of expression of SOD and CAT protein in hyperuricemia rats after the intervention of α-lipoic acid(n=12±s)
#P<0.05compared with control group;*P<0.05compared with model group.
group SOD CAT normal control 0.5378±0.0789* 0.5875±0.0441*model 0.2425±0.0464# 0.1952±0.0229#LLA 0.3278±0.0397#* 0.2448±0.0292#MLA 0.3727±0.0425#* 0.5728±0.0506*HLA 0.4249±0.0393#* 0.5966±0.0577*
3 讨论
本实验发现高尿酸血症大鼠进行α-硫辛酸干预后,血清尿酸水平均显著降低,提示α-硫辛酸干预有效。若延长给药时间,是否趋于稳定,还有待进一步研究。
血管内皮功能紊乱涉及多种病理、生理机制,氧化应激可能是内皮细胞损伤的主要机制之一[5]。当血清尿酸水平>380 μmol/L时,氧化应激可能导致血管内皮功能障碍[6]。本研究发现α-LA干预后,MDA含量降低,SOD活力升高,并且 SOD和CAT蛋白表达也显著增高,提示α-LA增加抗氧化能力。但各组大鼠血清中CAT和GSH-Px活性无显著性变化,可能由于灌胃给药方法的首过效应降低了α-LA的生物利用率,另外不排除由于样本量所造成的第二类错误。
研究报道尿酸诱导的内皮细胞功能紊乱与线粒体损伤及细胞内ATP产生减少有关[7]。本研究通过光镜未观察到高尿酸血症大鼠血管形态学的差异,但电镜发现模型大鼠的胸主动脉内皮细胞水肿或脱落,提示高尿酸血症大鼠体内抗氧化能力下降,出现氧化应激损伤。为保证内皮细胞正常功能,线粒体数目在早期出现代偿性的增加,后由于α-LA干预,适度缓解了线粒体的氧化应激损伤,使线粒体代偿性增加的趋势得到控制,线粒体数目先增加后减少,从而出现线粒体一过性增加。近年来关于高尿酸血症血管内皮细胞超微结构的鲜有研究,本研究提示线粒体的改变对HUA的致病机制有重要意义。但此次实验未能对血管弹性以及血管内皮功能相关指标进行检测,还需在今后的研究中予以补充。

图3 光镜下大鼠胸主动脉病理改变Fig 3 Pathological alteration of rat's thoracic aorta nuder microscope(HE×400)

图4 电镜下大鼠胸主动脉超微结构Fig 4 Ultrastruction of rat's thoracic aorta under electron microscope

图5 电镜下不同剂量的α-硫辛酸干预组的大鼠胸主动脉超微结构Fig 5 Ultrastruction of rat's thoracic aorta under electron microscope in different groups ofα-lipoic acid intervention
[1]吴振,王颜刚,于江苏,等.尿酸盐致血管内皮细胞损伤的机制[J].中国分子心脏病杂志,2012,12:43-46.
[2]张雪光,洪权,侯剀,等.高尿酸通过miR-155下调eNOS表达而导致内皮细胞功能障碍[J].南方医科大学学报,2013,33:1141-1145.
[3]孟馨,王涤非,伊桐凝,等.α-硫辛酸对糖基化终产物诱导血管内皮细胞凋亡的影响[J].中国老年学杂志,2010,30:3104-3105.
[4]王莉,马玲,姚华,等.单纯酵母喂饲和氧嗪酸联合酵母暴露高尿酸血症肾病大鼠模型的建立及其抗氧化活力变化的比较研究[J].环境与健康杂志,2012,29:612-614.
[5]Yu MA,Sánchez-Lozada LG,Johnson R,et al.Oxidative stress with an activation of the rennin‐angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid induced endothelial dysfunction[J].J Hypertens,2010,28:1234-1242.
[6]Sugiura T,Dohi Y,Takase H,et al.Increased reactive oxygenmetabolites are associated with cardiovascular risk factors andvascular endothelial damage in middle‐aged Japanese subjects[J].Vasc Health Risk Manag,2011,7:475-482.
[7]Sánchez‐ Lozada LG,Lanaspa MA,Cristóbal‐ García M,et al.Uric acid ‐ induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121:71-78.
