Vaspin对HUVECs中TNF-α介导的NF-κB和PI3K/Akt信号通路的影响
2015-08-28刘师伟王明明楼晓华董艳婷赵术君何玉洁
刘师伟,王明明,王 军,楼晓华,董艳婷,张 丽,赵术君,何玉洁
(1.山西医科大学附属大医院内分泌科,山西太原030032;2.山西医科大学研究生学院,山西太原030001;3.休斯敦Methodist代谢研究中心,休斯敦德克萨斯州美国77030;4.山西医科大学第一医院妇产科,山西太原030001)
胰岛素抵抗是一个慢性亚临床炎性反应过程,二者相互促动,引起机体内环境的改变[1-2]。炎性反应过程中分泌的大量炎性因子可干扰胰岛素的生理作用,影响机体的能量摄入、存储和代谢,促进胰岛素抵抗的发生。Vaspin是从OLETF大鼠内脏脂肪组织中分离出来的一种具有胰岛素增敏和抗感染效应的脂肪细胞因子。用Vaspin干预高糖及高脂诱导的肥胖ICR小鼠后,胰岛素抵抗改善,增加糖耐量,并且与胰岛素抵抗相关的基因(如瘦素、抵抗素和 TNF-α 等)表达下降[3]。
本研究探讨Vaspin对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)TNF-α介导的NF-κB和PI3K/Akt信号通路的影响,及在血管内皮细胞中Vaspin作用于与肥胖相关的炎性反应及胰岛素抵抗的机制。
1 材料与方法:
1.1 主要实验材料
重组人Vaspin(Leinco Technologies公司);重组人TNF-α(Biovision公司);NF-κB荧光酶报告质粒pGL4.32[luc2P/NF-κB-RE/Hygro](Promega 公司);羊抗人ICAM-1一抗、羊抗人VCAM-1一抗、鼠抗人Akt一抗、鼠抗人磷酸化Akt一抗、IL-1和IL-6 ELISA试剂盒(R&D Systems公司);鼠抗人MCP-1一抗(Gen Scipt公司);鼠抗人β-actin一抗(Sigma公司);HRP标记的鼠抗羊二抗和羊抗鼠二抗(Santa Cruz公司);Trizol试剂(Invitrogen公司);SYBR Green Master Mix反应试剂盒(Applied Biosystems公司)。
1.2 方法
1.2.1 原代HUVECs的培养:HUVECs取自新生儿脐带。用0.1% Ⅰ型胶原蛋白酶溶液分离内皮细胞,将分离好的内皮细胞接种到铺有明胶的25 cm2培养瓶中,加入含20%胎牛血清、ECGS、肝素、1×105U/L青霉素-100 mg/L链霉素的M199培养液,置于37℃、5%CO2饱和湿度培养箱中培养。当细胞汇合80%以上时进行传代培养。
1.2.2 瞬时转染和NF-κB荧光酶活力的测定:将2.5×105/mL的70% ~80%汇合的HUVECs接种于直径 6 cm的培养皿,用 1.5 μL lipofectamine 2000、0.6 μg NF-κB 荧光酶报告质粒 pNF-κB-Luc和0.5 μg β-gal质粒共转染,在37 ℃,5%CO2培养箱中保温6 h。作用6 h之后,更换含有血清的正常完全培养基,置于37℃,5%CO2培养箱中,24 h后用不同浓度(0~320 μg/L)Vaspin干预8 h,然后用10 μg/L TNF-α继续培养4 h。最后用荧光素酶发光仪测定系统测定NF-κB荧光素酶活力。
1.2.3 Western blot分析:用0~320 μg/L Vaspin 预培养HUVEC 8 h,接着用10 μg/L TNF-α作用4 h后,采用Western blot检测磷酸化的Akt以及ICAM-1、VCAM-1和MCP-1蛋白的表达水平。取细胞加蛋白提取液,加样品电泳、转膜、封闭和加相应一抗孵育,4℃过夜,再用HRP标记的二抗孵育1 h。用含0.05%Tween的PBS缓冲液漂洗膜3次,ECL化学发光后用Western blot检测系统检测。数据用Gel-Pro分析软件进行分析。
1.2.4 实时荧光定量PCR:用0~320 μg/L Vaspin培养HUVECs 8 h 后,再加入10 μg/L TNF-α 继续培养4 h,用 real-time PCR检测下游分子 ICAM-1、VCAM-1及MCP-1的mRNA的表达水平。用Trizol试剂按说明书提取HUVECs的总RNA。采用SuperScript First-Strand Synthesis System 将各5 μg RNA反转录为cDNA。实验使用SYBR Green Master Mix反应试剂,反应在ABI 7500 real-time PCR系统完成。PCR总反应条件为:50℃ 2 min,95℃ 10 min,95 ℃ 15 s,60℃ 30 s,72℃ 30 s,循环40次,72℃10 min。延伸阶段检测荧光。数据由 ABI Prism 7000 SDS软件分析。引物序列见表1。

表1 Real-time PCR引物序列Table 1 Primer sequences for real-time PCR
1.2.5 酶联免疫分析(ELISA):用0~320 μg/L Vaspin 预培养 HUVECs 8 h,再用10 μg/L TNF-α 作用4 h后,用ELISA试剂盒检测经Vaspin和TNF-α处理后的HUVECs上清液中NF-κB下游炎性因子IL-1和IL-6的表达水平。
1.3 统计学分析
用SPSS 17.0统计软件进行分析,数据以均数±标准差±s)表示,组间比较采用单因素方差分析和LSD-t检验。
2 结果
2.1 Vaspin对 TNF-α作用下HUVECs中 Akt磷酸化的影响
与对照组相比,Vaspin干预组中磷酸化的Akt水平呈剂量依赖性增加(P<0.05)(图1)。
2.2 Vaspin对 TNF-α作用下 HUVECs中 NF-κB荧光酶活力的影响
与对照组相比,Vaspin干预组中NF-κB荧光酶活力呈剂量依赖性被抑制(P<0.05)(图2)。
2.3 Vaspin对TNF-α作用下HUVECs上清液中炎性因子IL-1和IL-6表达的影响
与对照组相比,Vaspin干预组中IL-1和IL-6的表达呈剂量依赖性下降(P<0.05)(图3)。
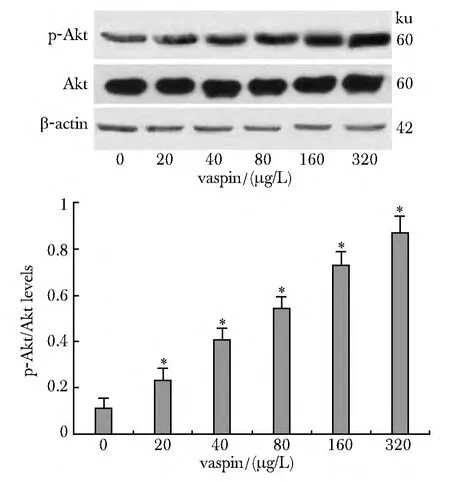
图1 在HUVECs中Vaspin对TNF-α介导的Akt磷酸化的影响Fig 1 Effects of Vaspin on TNF-α-induced phosphorylation of Akt in HUVECs ± s,n=3)

图2 在HUVECs中Vaspin对TNF-α介导的NF-κB荧光酶活力的影响Fig 2 Effects of Vaspin on TNF-α-induced NF-κB activity in HUVECs± s,n=3)
2.4 Vaspin对TNF-α作用下HUVECs中ICAM-1、VCAM-1和MCP-1表达的影响
与对照组相比,Vaspin干预组中 ICAM-1、VCAM-1和MCP-1的mRNA和蛋白表达呈剂量依赖性被抑制(P<0.05)(图4,5)。
3 讨论

图3 在HUVECs中Vaspin对TNF-α介导的炎性因子表达的影响Fig 3 Effects of Vaspin on TNF-α-induced expression of inflammatory cytokines in HUVECs± s,n=3)
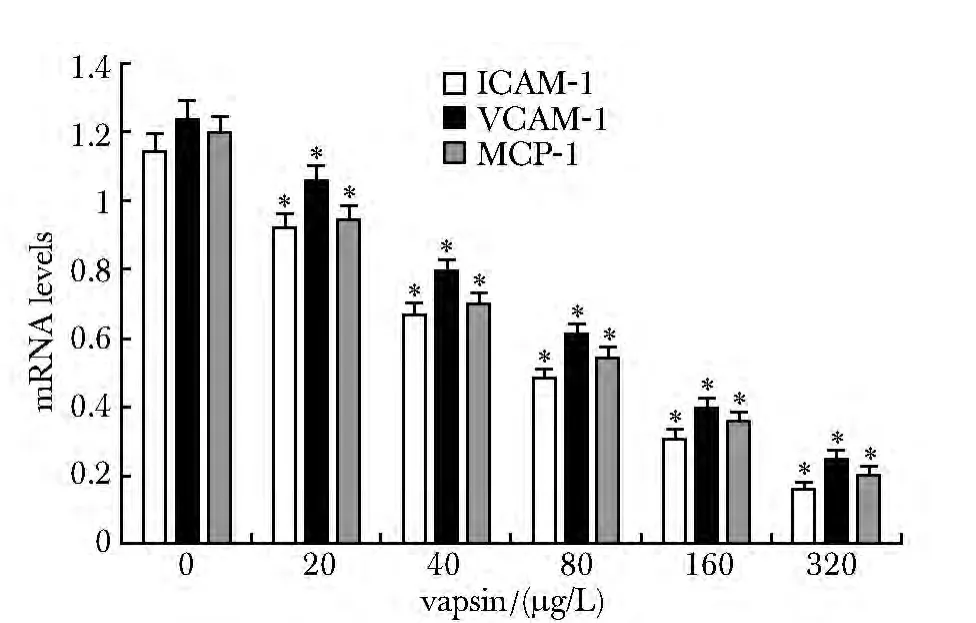
图4 在HUVECs中Vaspin对TNF-α介导的ICAM-1、VCAM-1和MCP-1基因表达的影响Fig 4 Effects of Vaspin on TNF-α-induced mRNA expressions of NF-kB downstream molecules ICAM-1,VCAM-1 and MCP-1 in HUVECs s,n=3)
炎性反应通过胰岛素受体影响信号传导通路IRS-1-PI3K-PKB/Akt是导致胰岛素抵抗的主要分子机制。作为一种新的脂肪细胞因子,Vaspin具有胰岛素增敏和抗感染效应[3-6]。本研究用Vaspin干预HUVECs后,磷酸化的Akt水平增加,表明Vaspin可使血管内皮细胞PI3K/Akt信号传导作用增强,可能进一步作用于胰岛素信号通路的下游分子,改善胰岛抵抗,保护血管内皮细胞。但有报道Vaspin在大鼠血管平滑肌细胞可以抑制高糖诱导的PI3K/Akt信号通路[4]。这虽与本结果有差异,但都表明Vaspin可作用于PI3K/Akt信号通路,对血管平滑肌细胞或血管内皮细胞发挥保护作用。

图5 在HUVECs中Vaspin对TNF-α介导的ICAM-1、VCAM-1和MCP-1蛋白表达的影响Fig 5 Effects of Vaspin on TNF-α-induced protein levels of NF-kB downstream molecules ICAM-1,VCAM-1 and MCP-1 in HUVECs(x ±s,n=3)
本文运用高敏感和高特异的NF-κB荧光酶报告系统,研究Vaspin对HUVECs中NF-κB转录活性的影响。显示Vaspin可明显抑制HUVECs由TNF-α介导的NF-κB转录活性,并减轻炎性反应。还有报道用 TNF-α处理 HUVECs 30 min后,Vaspin对NF-κB磷酸化作用不明显[7]。本研究用 Vaspin作用于HUVECs 8 h可明显抑制NF-κB磷酸化。
血管内皮细胞通过调节炎性因子、黏附分子及趋化因子的表达来影响血管的功能[8]。NF-κB的激活促进炎性因子TNF-α、IL-1和IL-6的释放以及使血管内皮细胞内黏附分子ICAM-1和VCAM-1及趋化因子 MCP-1的表达增加,进而加重血管损伤[9-10]。本研究中,Vaspin 显著抑制 HUVECs中TNF-α介导的 NF-κB的活化及其下游分子 IL-1、IL-6、ICAM-1、VCAM-1及 MCP-1的表达。提示Vaspin可影响血管内皮细胞的炎性因子、黏附分子及趋化因子的表达,保护血管内皮细胞,进一步阻止与肥胖和胰岛素抵抗相关的心血管疾病的发生。
PI3K/Akt信号在调节NF-κB的激活存在争议。通过激活PI3K/Akt信号的传导,抑制NF-κB信号的传导,可以抑制炎性反应[11-12]。也有报道抑制PI3K/Akt与NF-κB信号通路的传导,同样可发挥抗炎效应[13]。本研究中PI3K/Akt信号通路的激活可能与NF-κB信号通路的抑制存在直接或间接的关系,对此尚需进一步研究。
总之,Vaspin可作用于 HUVECs中 NF-κB和PI3K/Akt信号传导通路,保护血管内皮细胞。这对阐明Vaspin与NF-κB和PI3K/Akt信号通路在肥胖和胰岛素抵抗中的机制具有重要意义。
[1]Muise ES,Azzolina B,Kuo DW,et al.Adipose fibroblast growth factor 21 is up-regulatedby peroxisome proliferatoractivated receptor gamma and altered metabolic states[J].Mol Pharmacol,2008,74:403-412.
[2]Zulet MA,Puchau B,Navarro C,et al.Inflammatory biomarkers:the link between obesityand associated pathologies[J].Nutr Hosp,2007,22:511-527.
[3]Hida K,Wada J,Eguchi J,et al.Visceral adipose tissuederived serine protease inhibitor:a unique insulin-sensitizing adipocytokine in obesity[J].Proc Natl Acad Sci U S A,2005,102:10610-10615.
[4]Li H,Peng W,Zhuang J,et al.Vaspin attenuates high glucose-induced vascular smooth muscle cells proliferation and chemokinesis by inhibiting the MAPK,PI3K/Akt,and NF-κB signaling pathways [J].Atherosclerosis,2013,228:61-68.
[5]Blüher M.Vaspin in obesity and diabetes:pathophysiological and clinical significance[J].Endocrine,2012,41:176-182.
[6]Liu S,Dong Y,Wang T,et al.Vaspin inhibited proinflammatory cytokine induced activation of nuclear factor-kappa B and its downstream molecules in human endothelial EA.hy926 cells[J].Diabetes Res Clin Pract,2014,103:482-488.
[7]Fu BD,Yamawaki A,Okada M,et al.Vaspin can not inhibit TNF-α-induced inflammation of human umbilical vein endothelial cells [J]. JVetMed Sci,2009,71:1201-1207.
[8]Tedgui A,Mallat Z.Cytokines in atherosclerosis:pathogenic and regulatory pathways[J].Physiol Rev,2006,86:515-581.
[9]Anand AR,Bradley R,Ganju RK.LPS-induced MCP-1 expression in human microvascular endothelial cells is mediated by the tyrosine kinase,Pyk2 via the p38 MAPK/NF-kappaB-dependent pathway[J].Mol Immunol,2009,46:962-968.
[10] Lu Y,Zhu X,Liang GX,et al.Apelin-APJ induces ICAM-1,VCAM-1 and MCP-1 expression via NF-kappaB/JNK signal pathway in human umbilical vein endothelial cells[J].Amino Acids,2012,43:2125-2136.
[11]Lee SH,Lee JH,Oh EY,et al.Ethanol extract of Cnidium officinale exhibits anti-inflammatory effects in BV2 microglial cells by suppressing NF-κB nuclear translocation and the activation of the PI3K/Akt signaling pathway[J].Int J Mol Med,2013,32:876-882.
[12]Xu CQ,Liu BJ,Wu JF,et al.Icariin attenuates LPS-induced acuteinflammatory responses:involvementof PI3K/Akt and NF-kappaB signaling pathway[J].Eur J Pharmacol,2010,642:146-153.
[13]Wang L,Xu Y,Yu Q,et al.H-RN,a novel antiangiogenic peptide derived from hepatocyte growth factor inhibits inflammation in vitro and in vivo through PI3K/AKT/IKK/NF-κB signal pathway [J].Biochem Pharmacol,2014,89:255-265.
