志贺菌1、2类整合子及ISCR1携带情况与耐药性的关系
2015-08-24董利娟杨贤王俊祁伟吕星梁帆
董利娟,杨贤,王俊,祁伟△,吕星,梁帆
专题研究·细菌与耐药
志贺菌1、2类整合子及ISCR1携带情况与耐药性的关系
董利娟1,杨贤1,王俊1,祁伟1△,吕星2,梁帆3
目的 了解天津地区志贺菌1类、2类整合子及插入序列共同区(ISCR1)携带情况及其与耐药性的关系。方法 K-B纸片扩散法测定临床分离的159株志贺菌的药敏情况。以煮沸法制备细菌总DNA作为PCR扩增模板。采用PCR方法扩增1类、2类整合子及ISCR1并测序分析。PCR产物直接测序,结果经BLAST程序与Gen⁃Bank数据库标准株比对分析。结果 159株志贺菌中,53株福氏志贺菌对四环素的耐药率最高88.68%,其次是链霉素81.13%、氯霉素及SMZco均为56.60%,多重耐药率77.36%;106株宋氏志贺菌对氨苄西林的耐药率最高97.17%,其次是SMZco95.28%、四环素83.96%、庆大霉素76.42%,多重耐药率98.11%。1类整合子阳性118株,其中典型1类整合子23株,共有5种基因盒,分别为aadA2、aadA1、dfrⅠ、blaoxa-10及blaoxa-1;非典型1类整合子95株,基因包括intI1、aadA、blaoxa-1和IS1等;2类整合子阳性89株,其基因盒有dfrA1、satl及aadA1;1类、2类整合子同时阳性的菌株70株。未发现ISCR1阳性菌株。整合子阳性菌株中多重耐药率高于整合子阴性菌株(90.65%vs 50%,P<0.05)。结论 1、2类整合子广泛存在于志贺菌中且与志贺菌的多重耐药相关。
志贺菌属;整合子类;耐药性,微生物;序列共同区
细菌性痢疾居我国法定传染病发病率的第3位,是我国最常见的感染性腹泻之一[1]。随着抗生素的广泛使用,志贺菌耐药率上升,并呈现多重耐药趋势。通过对细菌耐药机制的研究发现,整合子及插入序列共同区(ISCR)作为一种可移动元件,与细菌耐药率上升及多重耐药趋势的出现密切相关[1]。本研究对分离出的志贺菌临床株携带1类、2类整合子及ISCR1情况进行调查并分析其与耐药性的关系。
1 材料与方法
1.1 菌株及来源 收集分离自天津医科大学第二医院、天津市儿童医院和天津医科大学总医院3所三级甲等医院肠道门诊就诊患者的粪便标本中志贺菌共计159株。经常规生化及血清凝集试验证实,其中包括福氏志贺菌53株,宋氏志贺菌106株。ISCR1阳性菌株2414及质控菌株ATCC25922为本研究所保存。
1.2 培养基及药敏纸片 水解酪蛋白(MH)琼脂购自上海伊华生物科技有限公司。药敏纸片包括氨苄西林、头孢噻肟、头孢曲松、亚胺培南、庆大霉素、链霉素、四环素、阿米卡星、氧氟沙星、诺氟沙星、左氧氟沙星、复方新诺明(SMZco)、头孢哌酮、氯霉素共14种,购自北京天坛生物制品研究所。引物合成及PCR产物测序由生工生物工程(上海)股份有限公司完成。
1.3 方法
1.3.1 抗菌药物敏感试验 所有菌株严格按照2012年临床实验室标准化研究所(CLSI)的规定,采用改良Kirby-Bauer纸片扩散法进行检测,质控菌株为大肠埃希菌ATCC25922。
1.3.2 细菌总DNA的提取 采用煮沸法提取细菌总DNA[2]。
1.3.3 志贺菌相关基因的检测与测序分析 引物设计及反应体系、条件参照文献[3-5]的方法进行。7对引物分别扩增1类整合子整合酶、1类整合子可变区、3'保守末端(3'CS)、非典型1类整合子基因盒、2类整合子整合酶、2类整合子可变区及插入序列共同区ISCR1,见表1。扩增产物经1%琼脂糖凝胶电泳,溴化乙锭染色后,凝胶成像系统下观察结果。测序结果经BLAST程序与GenBank数据库公布的标准菌序列进行比对、分析,确定基因型。
1.3.4 主要实验仪器 DNA扩增热循环(PCR)仪(德国Ep⁃pendorf公司)、DYY-6D型电泳仪(北京六一仪器厂)、GEL⁃DOC-200型凝胶成像系统(美国BIO-RAD公司)及Quanti⁃ty One 4.6版分析软件。
1.4 统计学方法 实验数据采用SPSS 17.0统计软件,χ2检验进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 药敏试验 159株志贺菌药敏结果显示,福氏志贺菌对四环素的耐药率最高,其次是链霉素、氯霉素及SMZco;多重耐药率77.36%。宋氏志贺菌对氨苄西林的耐药率最高,其次是SMZco、四环素和庆大霉素;多重耐药率98.11%。159株志贺菌的多重耐药率为89.94%。未发现对亚胺培南耐药的菌株。见表2。

Tab.1 The PCR primer sequences表1 PCR反应引物
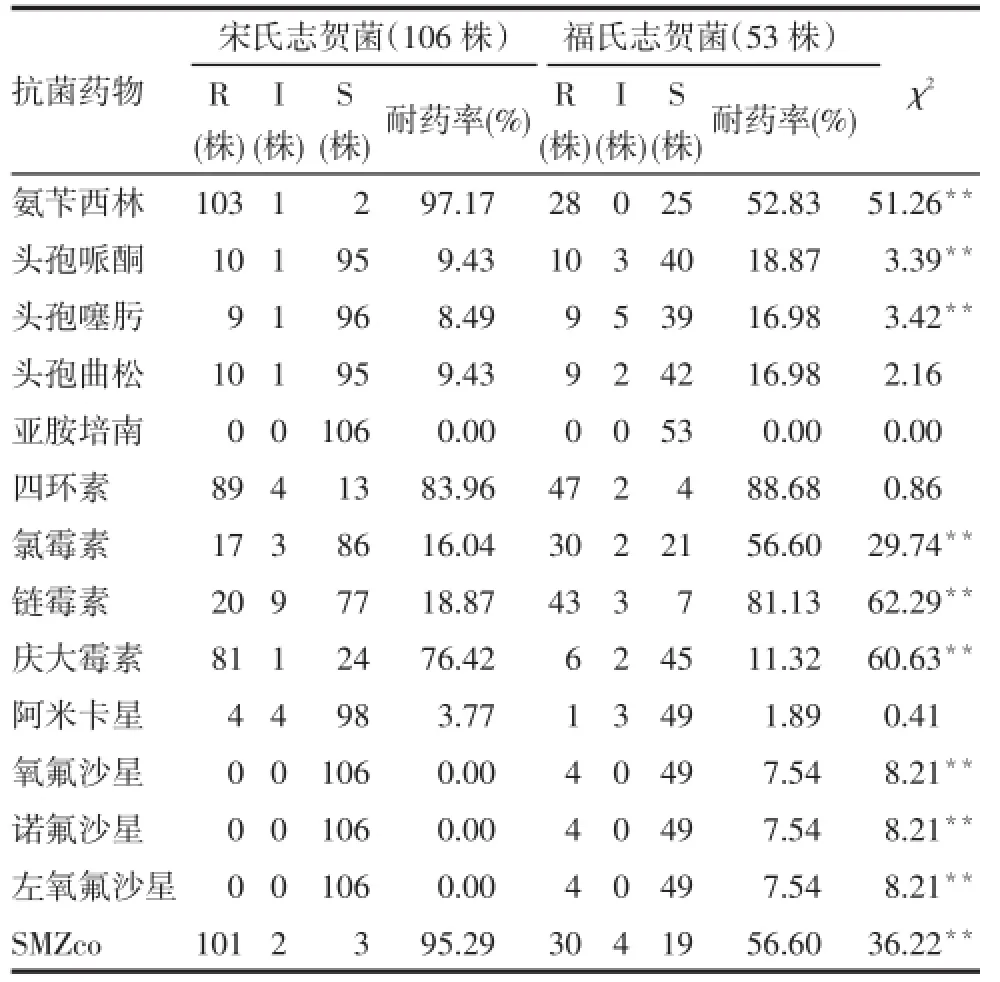
Tab.2 Antibiotic sensitivity of different serotype of 2009/2010 and 2013 years表2 2009、2010年及2013年组不同血清型药敏结果
2.2 整合子分布及与耐药性的关系 159株志贺菌中,1类整合子阳性的菌株数为118株(74.21%),2类整合子阳性的菌株数为89株(55.97%),1类、2类整合子均阳性的有70株。见表3。
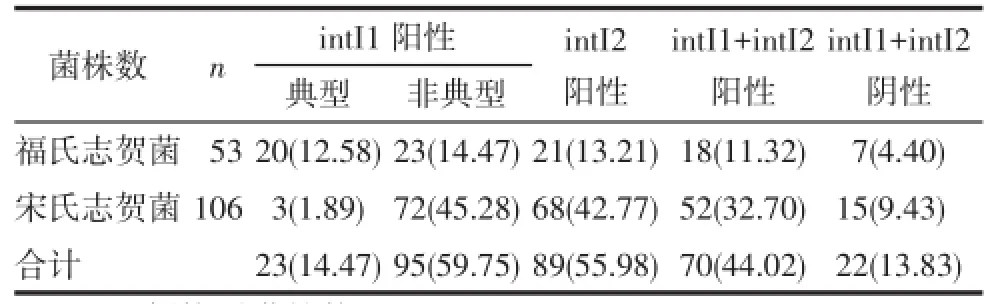
Tab.3 Distribution of integrase in different serotypes表3 不同血清型整合酶携带情况 例(%)
2.2.1 1类整合子的分布 118株1类整合子阳性的菌株中,典型1类整合子23株,福氏志贺菌20株,宋氏志贺菌3株;非典型1类整合子95株,福氏志贺菌23株,宋氏志贺菌72株。典型1类整合子部分PCR扩增图谱见图1。
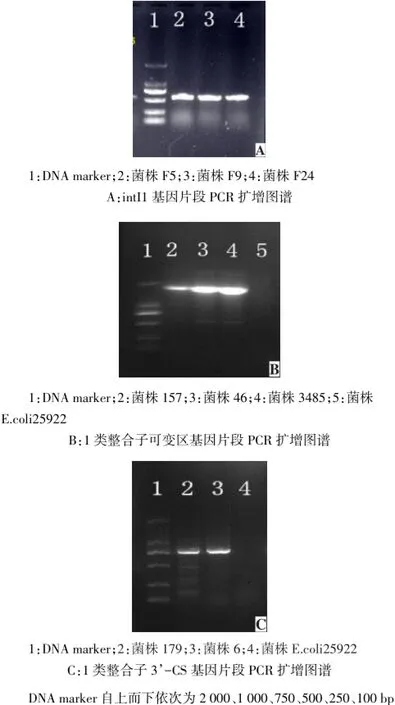
Fig.1 Electrophoresis of intI1/variable region/3'CS of typical class 1 integrons图1 典型1类整合子intI1、可变区、3'CS基因扩增图谱
典型1类整合子可变区共有5种基因盒:氨基糖苷腺苷酰基转移酶A2(aadA2)、aadA1、二氢叶酸还原酶Ⅰ(dfrⅠ)、blaoxa-10及 blaoxa-1。20株福氏志贺菌中,18株携带aadA1、dfrⅠ及blaoxa-10的基因盒;另2株携带aadA2、dfrⅠ及blaoxa-1的基因盒。3株宋氏志贺菌中2株携带aadA2+blaoxa-10+dfrⅠ,另1株携带aadA1+blaoxa-1+dfrⅠ。
对非典型1类整合子测序分析,表明此插入片段依次由intI1基因、attI位点以及2个基因盒组成,3'保守区部分被一段插入序列IS1所替代;经BLAST比较,两个基因盒分别为blaoxa-1和aadA1。
2.2.2 2类整合子的分布 携带2类整合子的89株,福氏志贺菌21株,宋氏志贺菌68株。带有dfrA1、耐链丝菌素(satl)及aadA1 3种基因盒;部分菌株PCR扩增图谱见图2。
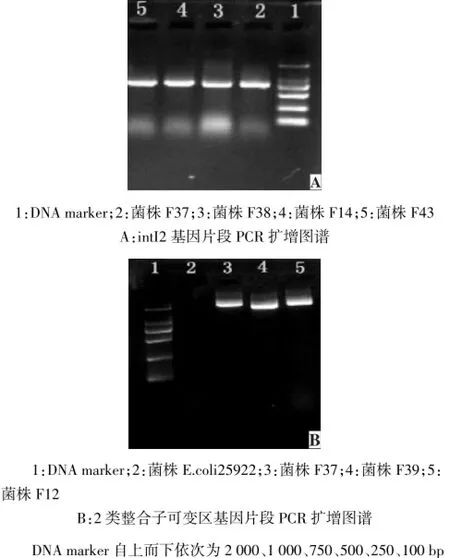
Fig.2 Electrophoresis of intI2/variable region of class 2 integrons图2 2类整合子intI2、可变区基因扩增图谱
2.2.3 整合子与多重耐药性的关系 intI1和(或)intI2阳性菌株中多重耐药所占比例为90.65%,高于整合子阴性菌株的50%,差异有统计学意义(χ2= 23.34,P<0.05);其中intI1、intI2阳性菌株中多重耐药菌株出现的比率分别为91.53%和94.38%。
2.3 插入序列共同区分布情况 对159株志贺菌进行插入序列共同区(ISCR1)扩增,未发现阳性扩增条带。
3 讨论
近年来由于抗生素的广泛及不合理使用,细菌的耐药问题越来越严重,细菌的多重耐药现象随之发生。研究表明,整合子作为可移动基因元件,能整合不同的耐药基因盒表达出对抗菌药物的耐药甚至多重耐药。目前,具有捕获及表达外来基因能力的整合子系统越来越引起研究者的关注,尤其对多重耐药性研究有着非常重要的意义[6-7]。
整合子的基本结构由5'保守末端(5'CS)、3'保守末端(3'CS)及两者之间的可变区构成。可变区含有1个或多个基因盒。整合子含有1个编码整合酶的基因(intI),1个重组位点attI和1个启动子3个功能元件。这3个功能元件均位于整合子5'CS区。3'CS区则因整合子类型不同而异。在1类整合子中把intI1阳性、可变区阳性及3'CS阳性的称之为典型1类整合子,只有intI1阳性的称之为非典型1类整合子。有学者利用反向PCR方法在非典型1类整合子中扩增出基因盒片段[3]。临床中出现多重耐药与整合子对耐药基因的积累是分不开的[8]。
本研究显示,我院近年临床分离的志贺菌对四环素、链霉素、氨苄西林和SMZco的耐药较为严重(均在50%以上);多重耐药率89.94%。整合子检出率高达86.16%(137/159)。可变区分别携带aadA2、blaoxa-10、dfrⅠ及satl等耐药基因。在本实验中1类、2类整合子阳性菌株中多重耐药株所占比例高于整合子阴性菌株,表明1、2类整合子在志贺菌多重耐药中起到重要作用,与文献[9-10]的报道相似。部分1、2类整合子阳性的菌株未检出可变区,可能的原因有:(1)整合子基因突变,即3'CS缺失;(2)可变区长度超过PCR的可扩增范围[11]。
Stokes等[12]首次发现并报道在复合1类整合子中发现了称作ISCR的DNA序列,此序列和许多耐药基因紧密连接。ISCR不同于以往的插入序列,它是一种新型的可移动元件。近年来,国内外多位学者在大肠埃希菌、克雷伯杆菌、枸橼酸杆菌、阴沟肠杆菌等多种革兰阴性菌中发现了ISCR1的存在,且与细菌的耐药性有一定的相关性,但本文在对分离的志贺菌属的研究中未发现ISCR1阳性菌株。
[1]Chen YH,Lin HY.Study of the distribution and drug resistance of ClassⅠandⅡintegrons in Bacillus proteus[J].China J Nosocomi⁃ol,2014,24(3):526-528.[陈奕慧,林红燕.Ⅰ、Ⅱ类整合子在变形菌属中的分布及耐药性研究[J].中华医院感染学杂志,2014,24 (3):526-528].doi:1005-4529(2014)03-0526-03.
[2]Talukder KA,Islam MA,Dutta DK,et al.Phenotypic and genotypic characterization of serologically atypical strains of Shigella flexneri⁃type 4 isolated in Dhaka,Bangladesh[J].Clin Microbiol,2002,40 (4):2490-2497.doi:10.1128/JCM.40.7.2490-2497.2002.
[3]Pan JC.Characteristic of Class 1 and Class 2 Integron and their Rela⁃tion to Antibiotic Resistance in Shigella isolates from Hangzhou,China[D].Zhejiang:Institute of Infectious Diseases,The first Affili⁃ated Hospital,College of Medicine,Zhejiang University,2000.[潘劲草.志贺菌流行株1类和2类整合子的特征及与耐药性关系的研究[D].浙江:浙江大学医学院附属第一医院传染病研究所,2000].
[4]Wang J,Qi W,Wang SX,et al.Study on integrons and antibiotic re⁃sistance of Shigella flexneri in Tianjin[J].Journal of Pathogen Biolo⁃gy,2014,9(2):146-149.[王俊,祁伟,王淑香,等.天津地区福氏志贺菌整合子携带及耐药性研究[J].中国病原生物学杂志,2014,9 (2):146-149].doi:10.13350/j.cjpb.140213.
[5]Wu XM,Song SD,Qi W.Relation between ISCR1 and ESBLs gene in third generation cephalosporin clinical strains of Enterobaceria⁃ceae[J].Chinese Journal of Infecrion Control,2011,10(2):86-92.[吴小妹,宋诗铎,祁伟.肠杆菌科耐第三代头孢菌素临床株中ISCR1元件与ESBLs基因的关系[J].中国感染控制杂志,2011,10(2):86-92].doi:1671-9638(2011)02-0086-06.
[6]Wu K,Wang F,Sun J,et al.Class 1 integron gene cassettes in multi⁃druh-resistant Gram-negative bacteria in southern China[J].Int J Antimicrob Agents,2012,40(3):264-267.doi:10.1016/j.ijantimi⁃cag.2012.05.017.
[7]Shen Y,Qian H,Gong J,et al.High prevalence of Antibiotic Resis⁃tance and Molecular Characterization of Integrons among Shigella Isolates in Eastern China[J].Antimicrob Agents Chemother,2013,57(3):1549-1551.doi:10.1128/AAC.02102-12.
[8]Li LM,Yuan XY,Wang MY,et al.The integron-gene cassette sys⁃tem and the echanism of bacterial drug resistance:research progress [J].Chinese Journal of Microecology,2014,26(2):246-248.[李鲁明,袁晓燕,王明义,等.整合子-基因盒系统与细菌耐药机制的研究进展[J].中国生态学杂志,2014,26(2):246-248].doi:10.13381/j.cnki.cjm.201402033.
[9]Tariq A,Haque A,Ali A,et al.Molecular profiling of antimicrobial resistance and integron association of multidrug-resistant clinical isolates of Shigella species from Faisalabad,Pakistan[J].Can J Mi⁃crobiol,2012,59(9):1047-1054.doi:10.1139/w2012-085.
[10]Yang HF,Chen GS,Zhu YL,et al.Surbeillance of Antimicrobial Susceptibility Patterns among Shigella Species Isolated in China during the 7-year Period of 2005-2011[J].Ann Lab Med,2013,33 (2):111-115.doi:10.3343/alm.2013.33.2.111.
[11]Jiang B,Wei QH,Lyu HX.Molecular characteristics of typeⅠinte⁃gron in Escherichia coli isolated from urine and correlation with drug resistance[J].China Journal Nosocomiol,2014,24(1):5-8.[姜波,魏取好,吕火祥.尿液分离大肠埃希菌Ⅰ类整合子分子特征与耐药性的关系研究[J].中国医院感染学杂志,2014,24(1):5-8].doi: 10.11816/cn.ni.2014-132892.
[12]Stokes HW,Tomaras C,Parsons Y,et al.The partial 3'-conserved segment duplications in the integrons In6 from pDGO100 have a common origin[J].Plasmid,1993,30(1):39-50.
(2014-06-18收稿 2014-11-14修回)
(本文编辑 魏杰)
Carriage rates of class 1,class 2 integrons as well as ISCR1 in Shigella isolates and their relationship with drug resistance
DONG Lijuan1,YANG Xian1,WANG Jun1,QI Wei1△,LYU Xing2,LIANG Fan3
1 Second Hospital of Tianjin Medical University Institute of Infectious Disease,Tianjin 300211,China;2 Tianjin Medical University General Hospital;3 Tianjin Children's Hospital
△Correspongding Author E-mail:qiweiwyx@yahoo.com
Objective To explore carrying rates of class 1,class 2 integrons as well as ISCR1 in Shigella isolates and their connection with drug resistance.Methods Antibiotic sensitivities were detected by K-B disk diffusion in 159 clinical isolates.Total bacteria DNA was prepared through boiling the isolates and the DNA was then used as template for PCR amplification.PCR,ZSCR1 and sequencing analyse of integrons were applied to all of them.Results were compared by Blast and GenBank.Results Antibiotic sensitivity results showed that in the S.flexneri strains the incidence of resistance to tet⁃racycline and streptomycin were 88.68% and 81.13% in the S.flexneri strains while the incidence of resistant to chloram⁃phenicol and trimethoprim-sulfamethoxazol were both 56.60%,and the incidence of multidrug drug resistance was 77.36%.In the sonnei strains,the incidence of resistance to ampicillin,trimethoprim-sulfamethoxazo were 97.17% and 95.28%,83.96% and 76.42% respectively,and the incidence of multidrug resistance was 98.11%.Among all isolates,118 were class 1 integron positive,70 were class 2 integron positive and 89 were double positives.For those 118 isolates that are positive of class 1 integron,23 were typical while 95 weres atypical.The gene cassettes of typical class 1 integrons contains aadA2,aa⁃dA1,dfrⅠ,blaoxa-10 and blaoxa-1.IntI1,aadA,blaoxa-1 and IS1 were included in the gene cassetes of the atypical class 1 integrons.Class 2 integrons positive isolates carried gene cassttes which include dfrA1,satl and aadA1.No ISCR1 was found in any isolate.Integron carriage strains were closely associated with higher rate of multiple antibiobic resistance compared with the organisms without integrons(90.65%,50%,P<0.05).Conlusion Class 1 and class 2 integrons were widely existence in Shigella isolates and were related to the multidrug resistance.
shigella;integrons;drug resistance,microbiol;sequence common region
R378.25
A
10.11958/j.issn.0253-9896.2015.04.018
1天津医科大学第二医院感染研究所(邮编300211);2天津医科大学总医院;3天津市儿童医院
董丽娟(1989),女,硕士在读,主要从事志贺菌耐药性方面研究
△E-mail:qiweiwyx@yahoo.com
