2型糖尿病性动脉粥样硬化大鼠血浆VEGF、TGF-β1、CTRP3的表达及辛伐他汀的干预作用
2015-08-24王婉秋孙侃靳瑾周婷
王婉秋,孙侃△,靳瑾,周婷
2型糖尿病性动脉粥样硬化大鼠血浆VEGF、TGF-β1、CTRP3的表达及辛伐他汀的干预作用
王婉秋1,孙侃1△,靳瑾2,周婷3
目的 观察2型糖尿病性动脉粥样硬化大鼠血浆血管内皮生长因子(VEGF)、转化生长因子β1(TGF-β1)、C1q/TNF相关蛋白3(CTRP3)的表达及辛伐他汀的干预作用。方法 将SD大鼠随机分为正常饮食(NC)组(n=8)、高脂饮食(HFD)组(n=8)、高脂干预(HFD+S)组(n=8)、模型(M)组(n=18)、模型干预(M+S)组(n=16)。采用链脲佐菌素+维生素D3+高脂饮食建立糖尿病动脉粥样硬化大鼠模型,HFD+S、M+S组用辛伐他汀溶液20 mg/(kg·d)灌胃进行干预,蒸馏水20 mL/(kg·d)灌胃作为对照。测定各组大鼠空腹血糖(FPG)、血脂、空腹胰岛素(FINS)、VEGF、TGF-β1、CTRP3的水平。结果 M组动脉病理可见明显粥样斑块,M+S组病变较M组明显减轻。HFD组VEGF、TGF-β1及CTRP3高于NC组;M组VEGF、TGF-β1高于NC组,VEGF高于HFD组,CTRP3低于HFD组。辛伐他汀干预后,HFD+S组TGF-β1、CTRP3高于HFD组,M+S组VEGF低于M组,且TGF-β1、CTRP3均高于M组(P<0.05)。结论 VEGF、TGF-β1、CTRP3可能参与糖尿病性动脉粥样硬化的发生,辛伐他汀除降脂外,还能下调VEGF、上调TGF-β1、CTRP3表达,并对糖尿病性动脉粥样硬化发挥保护作用。
糖尿病,2型;动脉粥样硬化;血管内皮生长因子类;转化生长因子β1;C1q/TNF相关蛋白3;辛伐他汀
胰岛素抵抗(IR)被认为是引发2型糖尿病(T2DM)的始动因素,我国每年以IR为发病基础的T2DM的发病率以12%的增长率显著上升,且T2DM患者致残致死的主要原因是其伴随发生的严重动脉粥样硬化(AS)[1]。因此,有效地防治糖尿病性大血管并发症显得尤为重要。研究表明,血管内皮生长因子(VEGF)能够引起内皮细胞分裂、增殖、迁移,促进炎性细胞在血管壁的黏附,促进AS斑块中血管形成,加重AS[2]。转化生长因子β1(TGF-β1)在动脉内皮损伤、动脉壁脂质聚集、炎性细胞浸润、血管平滑肌迁移和细胞外基质沉积等引起AS的关键步骤中发挥重要作用[3]。脂肪因子C1q/TNF相关蛋白3 (CTRP3)是新近发现的脂肪细胞因子,参与糖代谢,具有抗炎、抗AS的作用[4]。本实验通过复制糖尿病合并AS大鼠模型,以辛伐他汀进行药物干预,旨在探讨VEGF、TGF-β1、CTRP3与糖尿病合并AS及糖脂代谢的相关性以及辛伐他汀的干预作用,为临床预防和治疗糖尿病大血管并发症的发生、发展提供一定的理论依据。
1 材料与方法
1.1 实验材料 (1)动物。3周龄清洁级雄性SD大鼠(体质量160~200 g),购于新疆医科大学动物中心,动物生产许可证号:SCXK(新)2003-0001。(2)主要试剂。大鼠VEGF酶联免疫吸附测定(ELISA)试剂盒、大鼠TGF-β1 ELISA试剂盒、大鼠CTRP3 ELISA试剂盒(上海西唐生物科技有限公司);胰岛素放免试剂盒(北京原子高科核技术应用股份有限公司);链脲佐菌素(streptozotocin,STZ,Sigma公司);维生素D3(上海通用药业股份有限公司);辛伐他汀(江苏黄河药业股份有限公司)。(3)仪器与设备。血糖仪(罗氏CE0088);El-800型全自动酶标分析仪(美国PE公司生产);倒置荧光显微镜(日本OLYMPUS公司)。
1.2 方法
1.2.1 动物分组、处理及模型建立 取70只雄性SD大鼠,适应性饲养1周后,随机分成正常饮食(NC)组(n=8)、高脂饮食(HFD)组(n=8)、高脂干预(HFD+S)组(n=8)、模型(M)组(n=23)、模型干预(M+S)组(n=23)。NC组给予普通饲料,其余组均给予高脂饲料喂养。M和M+S组给予高脂饮食4周诱导IR,禁食12 h,腹腔注射STZ溶液45 mg·kg-1,破坏部分胰岛β细胞,使胰岛素合成和分泌能力降低,造成血糖升高,于72 h后测尾静脉血糖,空腹血糖≥7.0 mmol/L和餐后血糖≥11.1 mmol/L确定为糖尿病模型制模成功。再给成模糖尿病大鼠维生素D3注射液,按总剂量50万U·kg-1,分3 d灌胃,使大鼠动脉壁完整性受到破坏,内皮通透性增高,促进脂质及钙对血管壁的浸入和沉积,造成动脉钙超负荷[5],促使平滑肌细胞变性和钙化。继续给予高脂饮食4周,8周实验过程中HFD+S、M+S组给予辛伐他汀溶液20 mg(/kg·d)灌胃,NC、HFD、M组给予蒸馏水20 mL(/kg·d)灌胃。实验结束时处死全部大鼠,取胸主动脉送病检,最终共有34只大鼠糖尿病大血管病变模型制模成功,其中M组18只、M+S组16只,成模率73.9%。
1.2.2 指标检测 于第8周末全部大鼠禁食12 h后内眦静脉取血,离心(3 000 r·min-1,15 min),取上清液存放-80℃冰箱备用。采用全自动生物化学分析仪测定血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c)、空腹血糖(FPG)。采用液相平衡竞争放射免疫分析法检测血浆空腹胰岛素(FINS)水平。按照公式计算稳态模型胰岛素抵抗指数(HOMA-IR),HOMAIR=(FPG×FINS)/22.5。采用双抗体夹心ELISA法测定血浆VEGF、TGF-β1、CTRP3水平,严格按照说明书操作。
1.2.3 动脉病理形态学观察 实验结束时迅速取胸主动脉上段约1 cm长,生理盐水冲洗后立即置于体积分数4%中性甲醛缓冲液固定,常规石蜡包埋,制成3~4 μm厚石蜡切片,采用苏木精-伊红(HE)染色,200倍光镜下观察。
1.3 统计学方法 采用SPSS 17.0统计软件处理;计量资料以±s表示,多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t检验;多变量间相关性采用Pearson相关分析;影响因素分析采用多元线性逐步回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠动脉病理形态学观察 肉眼观察:NC、HFD、HFD+S、M+S组内膜光滑,未见明显改变;M组动脉内膜上可见散在点状或线状淡黄色微隆起内膜的病灶。常规HE染色光镜下可见NC、HFD+ S组动脉内膜光滑连续,各层分界清楚,结构完整,未见脂质沉积及泡沫细胞;HFD组动脉可见少量泡沫细胞;M组动脉可见粥样斑块,表层可见纤维帽,其下可见数量不等的泡沫细胞,深层含大量坏死物质、脂质沉积、胆固醇结晶及钙盐沉积,中膜平滑肌纤维增生且排列不规则,弹力纤维断裂;M+S组动脉未见明显粥样斑块,病变较M组明显减轻。见图1。
2.2 各组体质量、FPG、FINS、HOMA-IR的比较 HFD组FINS、HOMA-IR高于NC组;M组体质量、FINS均低于NC、HFD、HFD+S组,FPG高于NC、HFD、HFD+S组,HOMA-IR高于NC组和HFD+S组;干预后M+S组FPG低于M组,FINS高于M组(P<0.05),见表1。
Tab.1 Comparison of body weight as well as levels of FPG,FINS and HOMA-IR among all groups表1 各组体质量、FPG、FINS及HOMA-IR的比较(±s)
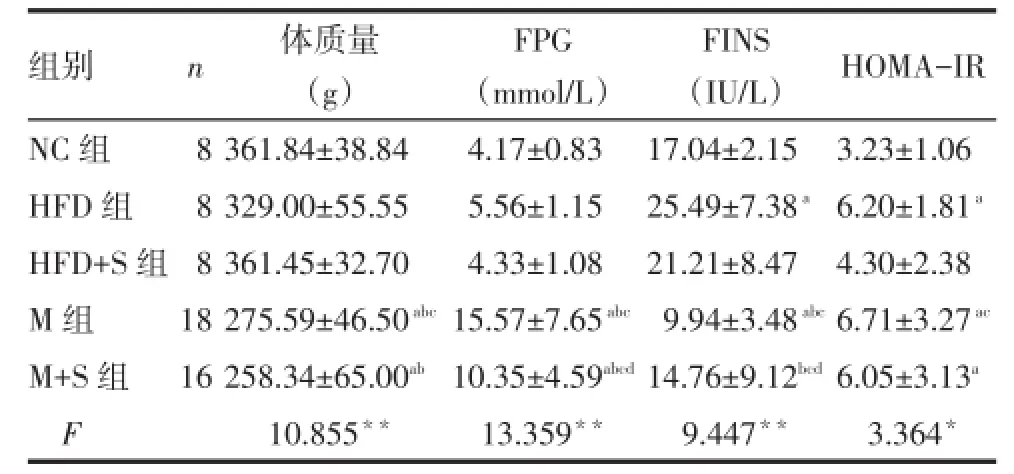
Tab.1 Comparison of body weight as well as levels of FPG,FINS and HOMA-IR among all groups表1 各组体质量、FPG、FINS及HOMA-IR的比较(±s)
*P<0.05,**P<0.01;a与NC组比较,b与HFD组比较,c与HFD+S组比较,d与M组比较,P<0.05;表2、3同
组别n 体质量FPGFINSHOMA-IR (g) (mmol/L) (IU/L)NC组8361.84±38.844.17±0.8317.04±2.153.23±1.06 HFD组8329.00±55.555.56±1.1525.49±7.38a6.20±1.81aHFD+S组8361.45±32.704.33±1.0821.21±8.474.30±2.38 M组18275.59±46.50abc15.57±7.65abc9.94±3.48abc6.71±3.27acM+S组16258.34±65.00ab10.35±4.59abcd14.76±9.12bcd6.05±3.13aF 10.855**13.359**9.447**3.364*
2.3 各组血脂水平的比较 M组TC、TG、LDL-c均高于NC、HFD、HFD+S组,M组HDL-c高于HFD、HFD+S组,干预后M+S组TC、TG、LDL-c及HDL-c均低于M组(P<0.05),见表2。
Tab.2 Comparison of serum levels of TC,TG,LDL-c and HDL-c among all groups表2 各组TC、TG、LDL-c及HDL-c的比较(mmol/L,±s)
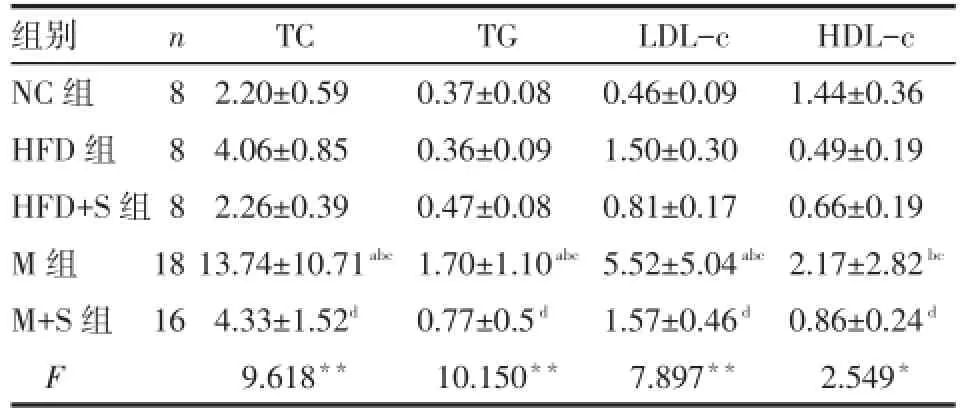
Tab.2 Comparison of serum levels of TC,TG,LDL-c and HDL-c among all groups表2 各组TC、TG、LDL-c及HDL-c的比较(mmol/L,±s)
组别NC组HFD组HFD+S组M组M+S组F n8881 8 16 TC 2.20±0.59 4.06±0.85 2.26±0.39 13.74±10.71abc4.33±1.52d9.618**TG 0.37±0.08 0.36±0.09 0.47±0.08 1.70±1.10abc0.77±0.5d10.150**LDL-c 0.46±0.09 1.50±0.30 0.81±0.17 5.52±5.04abc1.57±0.46d7.897**HDL-c 1.44±0.36 0.49±0.19 0.66±0.19 2.17±2.82bc0.86±0.24d2.549*
2.4 各组 VEGF、TGF-β1、CTRP3水平的比较 HFD组VEGF、TGF-β1及CTRP3均高于NC组,干预后HFD+S组TGF-β1、CTRP3高于HFD组(P<0.05)。M组VEGF、TGF-β1高于NC组,且VEGF高于HFD组,CTRP3低于HFD组,干预后M+S组VEGF低于M组,TGF-β1及CTRP3高于M组(P<0.05),见表3。
2.5 血浆VEGF、TGF-β1、CTRP3水平与其他指标的相关分析 血浆VEGF与FPG、TC、TG、LDL-c、HOMA-IR呈正相关,与体质量、FINS呈负相关;TGF-β1与TG、CTRP3呈正相关,与HDL-c呈负相关;CTRP3与TGF-β1呈正相关,与TC、HDL-c呈负相关,见表4。
Tab.3 Comparison of serum levels of VEGF,TGF-β1 and CTRP3 among all groups表3 各组VEGF、TGF-β1及CTRP3的比较(μg/L,±s)
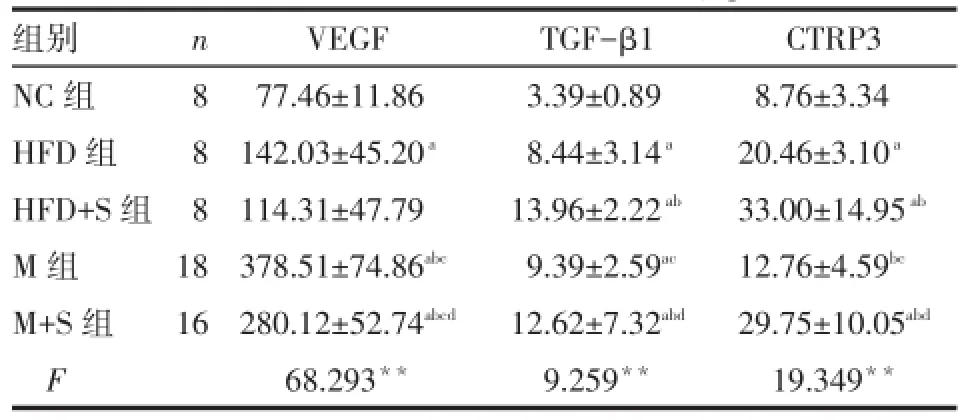
Tab.3 Comparison of serum levels of VEGF,TGF-β1 and CTRP3 among all groups表3 各组VEGF、TGF-β1及CTRP3的比较(μg/L,±s)
组别NC组HFD组HFD+S组M组M+S组F n8881 8 16 VEGF 77.46±11.86 142.03±45.20a114.31±47.79 378.51±74.86abc280.12±52.74abcd68.293**TGF-β1 3.39±0.89 8.44±3.14a13.96±2.22ab9.39±2.59ac12.62±7.32abd9.259**CTRP3 8.76±3.34 20.46±3.10a33.00±14.95ab12.76±4.59bc29.75±10.05abd19.349**

Tab.4 Correlation analysis between VEGF,TGF-β1,CTRP3 and other indicators表4 VEGF、TGF-β1、CTRP3水平与其他指标的相关性分析 (r)
2.6 VEGF、TGF-β1、CTRP3的影响因素分析 分别以VEGF、TGF-β1、CTRP3为因变量,以体质量、FPG、TC、TG、LDL-c、HDL-c、FINS、HOMA-IR为自变量,进行多元线性逐步回归分析,结果显示FPG、TG、HDL-c、LDL-c是VEGF水平的影响因素;CTRP3是TGF-β1水平的影响因素;TG、TGF-β1是CTRP3水平的影响因素,见表5~7。

Tab.5 The stepwise multiple regression analysis of influential factors of VEGF表5 VEGF影响因素的多元线性逐步回归分析
3 讨论
3.1 辛伐他汀在糖尿病合并AS中的作用 临床发现T2DM患者存在脂代谢紊乱,其特点是TG升高和HDL-c降低,伴或不伴小而密LDL-c升高[6]。辛伐他汀除具有降脂作用外,还在改善胰岛素敏感性、胰岛β细胞功能和糖代谢,以及抗AS方面起重要作用,已成为临床改善血脂紊乱及预防心血管事件的一线用药。本研究发现,M组动脉可见明显粥样斑块,且FPG、TC、TG、LDL-c均高于NC、HFD组,体质量、FINS低于NC、HFD组,干预后血管病变明显减轻,且FPG、TC、TG、LDL-c明显降低,FINS明显增高,提示糖尿病合并AS大鼠模型复制成功,辛伐他汀能够降脂、改善胰岛功能、降低血糖、稳定和消退AS斑块,在防治糖尿病并发大血管疾病中发挥重要作用。

Tab.6 The stepwise multiple regression analysis of influential factor of TGF-β1表6 TGF-β1影响因素的多元线性逐步回归分析
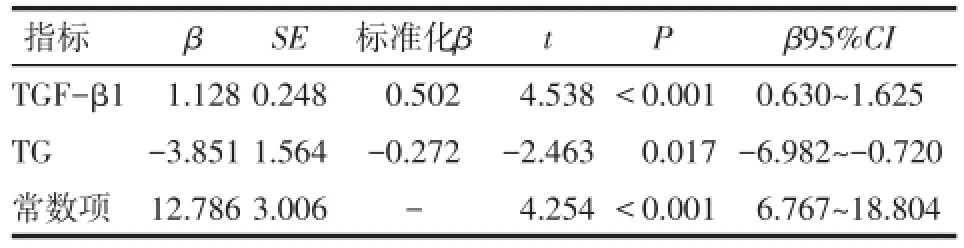
Tab.7 The stepwise multiple regression analysis of influential factors of CTRP3表7 CTRP3影响因素的多元线性逐步回归分析
3.2 VEGF促进AS形成的机制及辛伐他汀的作用 VEGF是一种高度特异性作用于血管内皮细胞的多功能细胞因子,能够引起内皮细胞分裂、增殖和迁移,并能促进炎性细胞在血管壁的黏附、促进动脉粥样斑块中血管形成;还能增加血管通透性,引起血浆蛋白渗漏、血管壁水肿、炎症细胞的浸润[2],进而加重AS,并形成恶性循环。本研究发现,HFD、M组VEGF均高于NC组,且M组高于HFD组,辛伐他汀干预后VEGF降低,且FPG、TG、HDL-c、LDL-c 是VEGF的影响因素,提示高水平VEGF能促进糖尿病大血管并发症的发生,辛伐他汀可能通过降低血脂、血糖、改善胰岛功能,下调VEGF,对糖尿病大血管病变发挥保护作用。
3.3 TGF-β1维持粥样斑块的稳定性 TGF-β1是一种具有多种生物学活性的多肽。研究表明,TGF-β1与粥样斑块的稳定性有关,TGF-β1既可以降低内皮细胞的迁移和增殖,抑制单核/巨噬细胞的趋化,抑制氧化型低密度脂蛋白的吸收,减少脂质沉积[7],发挥强大的抗炎、抗泡沫细胞作用;也能促进血管平滑肌细胞增殖、迁移,使细胞外基质降解受抑制、沉积增加[8],维持斑块的稳定,但却有可能引起血管纤维化重塑、血管或支架内的再狭窄等病理过程,因此有人称它为“双刃剑”。本研究发现,HFD、M组TGF-β1均高于NC组,辛伐他汀干预后HFD+S、M+ S组TGF-β1均明显增高,表明IR时高水平TGF-β1可能参与抗炎、抗泡沫细胞形成,以保护性作用为主;但HFD、M组间TGF-β1差异无统计学意义原因尚不清楚,可能是糖尿病合并AS时粥样斑块稳定性降低,TGF-β1在早期抗炎、抑制细胞外基质降解、稳定易损斑块的过程中有所消耗,辛伐他汀干预时发挥抗炎作用、改善AS,减少了TGF-β1的消耗。
3.4 CTRP3改善血糖及AS的机制 CTRP3是新近发现的脂肪细胞因子,它可以通过激活肝脏丝氨酸/苏氨酸蛋白激酶(Akt)活性,抑制糖异生途径中的关键酶葡萄糖-6磷酸酶(G6Pase)和磷酸烯醇丙酮酸羧激酶(PEPCK)的表达,降低血糖水平[9]。Choi等[10]发现,糖耐量异常和 T2DM患者血浆CTRP3水平较正常组明显增高。CTRP3也可特异性抑制脂多糖(LPS)与Toll样受体4(TLR4)结合,减轻炎症反应[4],减少血小板黏附、聚集,促进血管平滑肌增殖[11],改善AS。有研究表明,CTRP3活化因子的启动子中含有对TGF-β1有作用的位点,TGF-β1能诱导CTRP3的表达,促进血管平滑肌增殖[11]。人AS斑块中大量钙化结节与CTRP3共表达[12]。本研究发现,TGF-β1与CTRP3呈正相关,TGF-β1是影响CTRP3的因素,与Maeda等[11]研究结果一致。M、M+S组FPG高于NC、HFD组,HFD、M+S组CTRP3高于NC组;M组CTRP3低于HFD组,辛伐他汀干预后CTRP3明显增高。考虑可能的原因是:(1)高水平CTRP3可能对高血糖状态起保护作用,而糖尿病性动脉粥样硬化大鼠给予高脂饮食导致血脂紊乱、内皮细胞损伤,继而激活各种炎性细胞(如肿瘤坏死因子-α、白介素-6等),而CTRP3在抗炎过程中部分消耗,导致CTRP3降低。(2)辛伐他汀干预时发挥抗炎作用,减少了CTRP3的消耗。(3)可能辛伐他汀干预后斑块稳定性增加,减少TGF-β1在抑制细胞外基质降解过程中的消耗,从而提高TGF-β1的水平,进而诱导CTRP3的表达。另外,本研究样本量较少,研究时间较短;且在不同病变程度的糖尿病机体中CTRP3的生物学作用不同,而本研究建立的是糖尿病合并大血管病变模型大鼠,病变程度较重。因此,对CTRP3与糖尿病及其大血管并发症发病机制之间的相关性,有待进一步研究观察。
(图1见插页)
[1]Yang WY,Lu JM,Weng JP,et al.Prevalence of Diabetes among Men and Women in China[J].N Engl J Med,2010,362(12):1090-1101.doi:10.1056/NE JMoa0908292.
[2]Li L.Affection of Vascular endothelial growth factor on the expression of ADAMTS5,ADAMTS4 and MMP9 in human umbilical Veins en⁃dothelia cells[D].Shandong:Medical College of Shangdong University,2012.[李蕾.VEGF对血管内皮细胞基质金属蛋白酶ADAMTS5、ADAMTS4、MMP9表达的影响[D].山东:山东大学医学院,2012].
[3]Zhu B,Wang YX,Chen S.Changes of serum blood levels of B-type natriuretic peptide and transforming growth factor-β1 in patients with acute coronary syndrome[J].Clinical Focus,2012,27(17): 1488-1491.[朱斌,王永霞,陈珅.急性冠状动脉综合征患者血浆心钠素和转化生长因子β1的变化[J].临床荟萃,2012,27(17): 1488-1491].doi:1004-583X(2012)17-1488-04.
[4]Schaffler A,Buechler C.CTRP family:linking immunity to metabo⁃lism[J].Trends Endocrinol Metab,2012,23(4):194-204.doi: 10.1016/j.tem.2011.12.003.
[5]Zhao J,Li XJ,Sun B,et al.Establishment of a rat model of athero⁃sclerosis using vitamin D3 and high-fat diet[J].The Journal of Prac⁃tical Medicine,2009,25(21):3569-3571.[赵娟,李相军,孙波,等.维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J].实用医学杂志,2009,25(21):3569-3571].
[6]American diabetes association.Dyslipidemia management in adults with diabetes[J].Diabetes Care,2004,27(supplement 1):S68-S71.doi:10.2337/diacare.27.2007.S68.
[7]Lin J,Li M,Wang Z,et al.The role of CD4+CD25+regulatory T cells in macrophage-derived foam-cell formation[J].J Lipid Res,2010,51(5):1208-1217.doi:10.1194/jlr.D000497.
[8]Sheng W,Li LB,Lu JY.Role of TGF-β,MMPs and TIMPs in per⁃sistent atrial fibrillation associated with rheumatic mitral stenosis [J].Med J Chin PLA,2014,39(8):614-617.[盛炜,李力兵,陆江阳.TGF-β、MMPs和TIMPs在风湿性心脏病二尖瓣狭窄合并持续性房颤中的作用[J].解放军医学杂志,2014,39(8):614-617].doi:10.11855/j.issn.0577-7402.2014.08.04.
[9]Peterson JM,Wei ZK,Wong GW.C1q/TNF-related protein-3 (CTRP3),a novel adipokine that regulates hepatic glucose output[J].J Biol Chem,2010,285(51):39691-39701.doi:10.1074/jbc.M110.180695.
[10]Choi KM,Lee J,Lee KW,et al.Serum adiponectin concentrations predict the developments of type 2 diabetes and the metabolic syn⁃drome in elderly Koreans[J].Clin Endocrinol(Oxf),2004,61(1):75-80.doi:10.1111/j.1365-2265.2004.02063.x.
[11]Maeda T,Wakisaka S.CTRP3/cartducin is induced by transforming growth factor-β1 and promotes vascular smooth muscle cell prolifer⁃ation[J].Cell Biol Int,2010,34(3):261-266.doi:10.1042/ CBI20090043.
[12]Zhou Y,Wang C,Li L,et al.Molecular mechanisms of promotive ef⁃fect of CTRP-3 on vascular smooth muscle cell calcification[J].Journal of Ningxia Medical University,2011,33:99-100.[周允,王程,李丽,等.CTRP-3促进血管平滑肌细胞钙化及其分子机制研究[J].宁夏医科大学学报,2011,33:99-100].
(2014-09-15收稿 2014-11-21修回)
(本文编辑 李鹏)
Serum levels of VEGF,TGF-β1 and CTRP3 in type II diabetic rat with atherosclerosis and the interventional mechanism of simvastatin
WANG Wanqiu1,SUN Kan1△,JIN Jin2,ZHOU Ting3
1 Department of Endocrinology,The First Affiliated Hospital of Medical College,Shihezi University,Shihezi,Xinjiang 832002,China;2 Department of Endocrinology,The Fifth Affiliated Hospital of Xinjiang Medical University,Urumqi;3 Central Laboratory,The First Affiliated Hospital of Medical College,Shihezi University,Shihezi
△Corresponding Author E-mail:sunkan_shz@126.com
Objective To investigate the serum expressions of vascular endothelial growth factor(VEGF),transforming growth factor-β1(TGF-β1)and C1q/tumor necrosis factor-related protein 3(CTRP3)in type II diabetic rats with atheroscle⁃rosis and to undermine the interventional mechanism of simvastatin.Methods SD rats were randomly divided into normal diet(NC)group(n=8),high-fat diet(HFD)group(n=8),high-fat diet intervention(HFD+S)group(n=8),model(M)group (n=18)and model intervention(M+S)group(n=16).The diabetic atherosclerosis model was established by streptozotocin (STZ)+Vitamin D3(VitD3)+High-fat diet.The group HFD+S and group M+S rats were administrated with simvastatin at 20 mg/(kg·d)intragastrically as intervention while distilled water[20 mL/(kg·d)]were given to other groups.Serum levels of fasting plasma glucose(FPG),blood lipid,fasting insulin(FINS),VEGF,TGF-β1 and CTRP3 were compared between each groups.Results Characteristics of atheromatous plaque were seen in group M and group M+S whose pathological change were markedly attenuated compared to group M.Serum levels of VEGF,TGF-β1 and CTRP3 were significantly high⁃er in rats from Group HFD than those in rats from group NC.Serum levels of VEGF and TGF-β1 were significantly higher in rats from Group M than those in rats from group NC.Serum level of VEGF was significantly higher in rats from Group M than it in rats from group HFD.Serum level of CTRP3 was significantly lower in rats from Group M than it in rats from group HFD.Moreover,serum levels of TGF-β1 and CTRP3 were significantly higher in rats from Group HFD+S than those in rats from group HFD after the intervention with simvastatin.Serum level of VEGF was significantly lower in rats from Group M+S than it in rats from group M,and serum levels of TGF-β1 and CTRP3 were significantly higher in rats from group M+S than those in rats from group M after the intervention with simvastatin.Conclusion VEGF,TGF-β1 and CTRP3 may partici⁃pate in development of diabetic atherosclerosis.In addition to its hypolipidemic role,Simvastatin can also down regulate se⁃rum level of VEGF and up regulate serum levels of TGF-β1 and CTRP3 to exert a significant protective effect on diabetic atherosclerosis.
diabetes mellitus,type 2;atherosclerosis;vascular endothelial growth factors;transforming growth factor beta1;C1q/tumor necrosis factor-related protein 3;Simvastatin
R587.2
A
10.11958/j.issn.0253-9896.2015.04.010
1石河子大学医学院第一附属医院内分泌代谢科(邮编832002);2新疆医科大学第五附属医院内分泌代谢科;3石河子大学医学院第一附属医院中心实验室
王婉秋(1989),女,硕士在读,主要从事糖尿病及其慢性并发症研究
△E-mail:sunkan_shz@126.com
