人脐带血造血干细胞体外分化为NK细胞的效率及功能检测
2015-08-23罗琦尹洁李杨黄珊王玺何景华
罗琦,尹洁,李杨,黄珊,王玺,何景华△
人脐带血造血干细胞体外分化为NK细胞的效率及功能检测
罗琦1,尹洁2,李杨2,黄珊2,王玺2,何景华1△
目的检测人脐带血造血干细胞(HSCs)体外分化为自然杀伤(NK)细胞的效率及功能。方法从人脐带血中分离CD34+HSCs,接种于含20 μg/L FMS样酪氨酸激酶3配体(Flt3L)、干细胞生长因子(SCF)、白细胞介素(IL)-7、IL-15及IL-21的SCGM培养基中,定向诱导CD34+HSCs分化为NK细胞。观察细胞生长状态,在分化的第7、14、21及28天,采用流式细胞术检测各阶段CD56、NKG2D、NKp46、CD3、CD19及CD34等细胞免疫表型的表达变化;分化的第21、28天,以分化得到细胞为效应细胞,K562细胞作为靶细胞,设置8∶1、4∶1、2∶1和1∶1 4组效靶细胞比,分别采用乳酸脱氢酶(LDH)细胞毒性检测法和7AAD/CFSE标记法,检测分化得到的细胞杀伤功能。结果脐带血来源的CD34+HSCs在体外适宜的条件下可大量增殖;整个分化进程的不同阶段中,CD3和CD19表达量差异无统计学意义,CD56、NKG2D及NKp46的表达量逐渐增加,最高达(72.57±1.60)%、(32.83±1.29)%和(29.53± 2.40)%,CD34的表达量逐渐降低,最低为(12.13±2.01)%。LDH毒性检测法和7AAD/CFSE标记法测得最大杀伤效率可达(49.91±2.76)%和(40.87±1.12)%,8∶1、4∶1、2∶1和1∶1组NK细胞杀伤能力均依次降低(P<0.05),诱导分化28 d的NK细胞杀伤能力与21 d差异无统计学意义。结论人脐带血HSCs在体外适宜的培养条件下,可定向分化为NK细胞,诱导分化得到的NK细胞具有杀伤功能。
胎血;造血干细胞;杀伤细胞,天然;免疫表型分型;细胞毒性试验,免疫;CD34+HSCs;体外分化;细胞杀伤
脐带血(UCB)中富含造血干细胞(HSCs),是除骨髓和外周血之外的第3种HSCs的重要来源[1]。在适宜的条件下,HSCs可以在体内和体外分化为自然杀伤(NK)细胞[2]。随着细胞免疫治疗的兴起,NK细胞越来越为人们所重视。由于人体自身NK细胞数量有限,而且在NK细胞不同发育阶段,甚至同一发育阶段的不同组织中,NK细胞的表型和功能都存在很大的差异,这些都严重限制了NK细胞在临床上大规模运用[3-4]。本研究利用从脐带血中富集到的CD34+HSCs进行体外培养,加入相应细胞因子诱导其分化为NK细胞,并对诱导分化的NK细胞免疫表型及杀伤功能进行检测,为研究不同发育阶段的NK细胞的相应功能及其临床应用提供实验参考。
1 材料与方法
1.1材料新鲜人脐带血取自天津市中心妇产科医院;人慢性骨髓性白血病细胞K562为天津市血液学研究所馈赠;羟乙基淀粉(HES)、人淋巴细胞分离液(Ficoll)均购自天津市灏洋生物制品科技有限责任公司;EDTA购自美国Amresco公司;Human CD34 Microbead Kit购自德国美天旎公司;细胞因子Human FMS样酪氨酸激酶3配体(Flt-3L)、Human干细胞生长因子(SCF)、Human白细胞介素(IL)-7、Human IL-15 及Human IL-21均购自于美国Pepro Tech公司;Cell Gro®GMP SCGM培养基购自德国Cell Genix公司;RPMI-1640培养基、DMEM培养基、青霉素-链霉素溶液(PS)及HEPES溶液均购自美国Hyclone公司;胎牛血清(FBS)、非必需氨基酸(MEM NEAA)、丙酮酸钠(Sodium pyrovate)、β-巯基乙醇(2-Mercaptoethanol)及庆大霉素(Gentamicin)均购自美国Gibco公司;乳酸脱氢酶(LDH)Cytotoxicity Assay Kit购自美国Promega公司;7-AAD/CFSE Cell-Mediated CytotoxicityAssay Kit购自美国Abcam公司;荧光标记抗体FITC-CD56、FITCNKp46、PE-NKG2D、Percp-Cy5.5-CD3、Percp-Cy5.5-CD19、APC-CD34均购自美国BioLegend公司;PBS缓冲液(pH 7.4,137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4);CO2恒温培养箱、Multiskan GO酶标仪(美国Thermo公司);Accuri C6流式细胞仪(美国BD公司)。
1.2方法
1.2.1K562细胞培养将人慢性骨髓性白血病细胞K562置于RPMI-1640培养基中(含有10%FBS及1%PS溶液),置于37℃,5%CO2培养箱中培养,每隔2~3 d进行换液。
1.2.2CD34+HSCs分离将新鲜人脐带血80 mL置于无菌血浆瓶中,按脐带血∶HES=5∶1的比例加入HES,充分混匀,室温静置40 min以沉降红细胞;离心管中预置15 mL Ficoll,缓慢加入2倍体积沉降红细胞后的脐带血,20℃,2 000 r/ min,离心20 min(升5降3);移液管轻轻吸取单个核细胞层,置于PBS缓冲液(含2 mmol/L EDTA)中,洗涤细胞2次;计数后,按Miltenyi Human CD34 Microbead Kit说明书,从单个核细胞中富集CD34+HSCs。
1.2.3体外定向诱导CD34+HSCs分化为NK细胞从脐带血中富集到CD34+HSCs共计4.0×105,接种于含SCGM(含有20%FBS、1%MEM NEAA、1 mmol/L Sodium Pyrovate、10 mmol/ L HEPES,1%Mercaptoethanol、25 mg/L Gentamicin及1%PS)培养基的24孔板中,同时加入浓度均为20 μg/L的Flt3L、SCF、IL-7、IL-15及IL-21等细胞因子,定向诱导CD34+HSCs进行体外分化,置于37℃,5%CO2培养箱中培养。在细胞培养的1~7 d,每隔3 d对细胞进行半换液;7 d后,将所有细胞接种于6孔板中,每隔3 d对细胞进行换液。
1.2.4诱导分化细胞形态学和细胞生长曲线诱导分化的第7、14、21及28天,分别于倒置显微镜下观察细胞形态;同时进行计数,计算均值,绘制生长曲线。
1.2.5诱导分化细胞免疫表型检测诱导分化的第7、14、21 及28天,分别对细胞进行免疫表型检测。细胞吹匀计数后,取1.0×106个细胞于含有500 μL DMEM培养基的流式管中,加入适量Fc受体阻断剂,混匀后,4℃避光,封闭30 min;后加入适量待检测的荧光标记的细胞表面分子特异性抗体,或荧光标记的同型对照抗体,4℃避光,染色30 min;加入1 mL DMEM培养基洗涤细胞1遍,再加入500 μL DMEM培养基重悬;用BD Accuri C6流式细胞仪进行检测,CFlow Plus软件获取数据并进行分析,表达率≥20%为阳性。
1.2.6LDH细胞毒性检测法检测诱导分化细胞的杀伤功能诱导分化的第21天和第28天,对得到的NK细胞进行杀伤功能检测。以K562作为靶细胞,浓度调整为2.0×105/ mL,按50 μL/孔接种于96孔板;以NK细胞作为效应细胞,浓度调整为3.2×106/mL,取1.6×105/50 μL细胞悬液进行倍比稀释,每组效应细胞数目为0.8×105/50 μL、0.4×105/50 μL、0.2×105/50 μL和0.1×105/50 μL,按50 μL/孔接种于96孔板,最终效应细胞与靶细胞的比例分别为8∶1、4∶1、2∶1和1∶1。将该96孔板置于37℃,5%CO2培养箱中孵育4 h;250×g,离心4 min,取50 μL上清液按Promega LDH Cytotoxicity Assay Kit说明书进行LDH测定。
1.2.7荧光染料(7AAD/CFSE)标记法检测诱导分化细胞杀伤功能在体外分化的第21天和第28天,对得到的NK细胞进行杀伤功能检测。以K562作为靶细胞,浓度调整为2.0×106/ mL,按50 μL/孔接种于96孔板,用绿色荧光染料CFSE对靶细胞进行标记,4℃避光,染色30 min;加入NK细胞作为效应细胞,每组效应细胞数目为0.8×106/50 μL、0.4×106/50 μL、0.2× 106/50 μL和0.1×106/50 μL,最终效应细胞与靶细胞的比例分别为8∶1、4∶1、2∶1和1∶1,将该96孔板置于37℃,5%CO2培养箱中孵育4 h;用红色荧光染料7AAD标记已死的效应细胞和靶细胞,4℃避光,染色30 min;用BD Accuri C6流式细胞仪进行检测,CFlow Plus软件获取分析数据并进行分析。
1.3统计学方法采用SPSS 17.0软件进行统计分析。符合正态分布的计量数据用±s表示,2组间均数比较用t检验,多组间均数比较采用方差分析,组间多重比较采用SNK-q法,以P<0.05为差异有统计学意义。
2 结果
2.1诱导分化NK细胞形态学及生长特点分化第1周,细胞呈悬浮状均匀分布于培养基中,胞浆丰富,核仁明显;分化第2、3周,细胞迅速增殖,部分细胞呈抱团状;分化第4周,细胞生长缓慢,细胞体积增大,细胞内颗粒增加,有少部分细胞开始呈现贴壁状,见图1。整个体外分化进程中,起始细胞数为4.0×105,分化第1周,细胞数增加到7.68×105;分化第2周,细胞开始大量增殖,细胞数明显增多达4.48×106;分化第3周,细胞保持良好的增殖能力,细胞数达8.4×106;分化第4周,细胞生长缓慢,细胞数目维持在稳定状态,最终细胞数为8.96×106,整个进程中细胞倍增时间约为24 h,见图2、3。
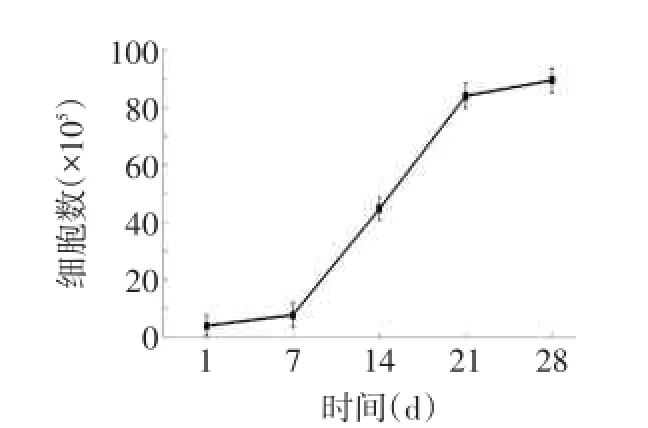
Fig.2 The growth curve of induced differentiation of NK cells图2 诱导分化的NK细胞生长曲线
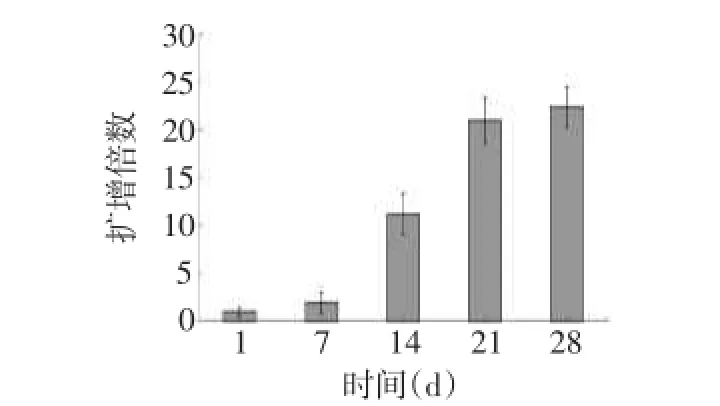
Fig.3 The amplification of induced differentiation of NK cells图3 诱导分化的NK细胞扩增倍数
2.2诱导分化NK细胞免疫表型诱导分化的前2周,大部分细胞还处于干细胞状态,CD34表达量相对较高,部分细胞开始表达CD56,而NKG2D和NKp46表达量较低;诱导分化的后2周,CD34表达量逐渐降低,绝大部分细胞表达CD56,NKG2D和NKp46的表达量也随之增加,差异均有统计学意义(P<0.05);整个分化进程中,CD3和CD19表达量无明显变化(P>0.05),见表1。
Tab.1 Comparison of immune phenotypes of NK cells between different differentiation stages表1 诱导分化不同阶段的NK细胞免疫表型比较(n=8,%,±s)
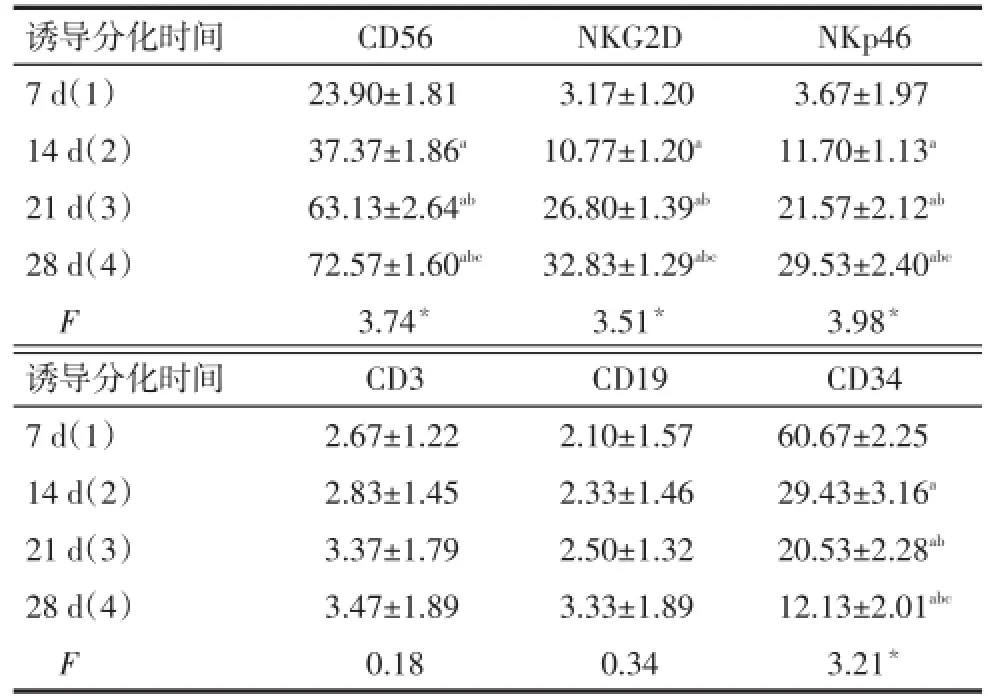
Tab.1 Comparison of immune phenotypes of NK cells between different differentiation stages表1 诱导分化不同阶段的NK细胞免疫表型比较(n=8,%,±s)
*P<0.05;a与(1)比较,b与(2)比较,c与(3)比较,P<0.05;表2、3同
诱导分化时间7 d(1)14 d(2)21 d(3)28 d(4)F诱导分化时间7 d(1)14 d(2)21 d(3)28 d(4)F CD56 23.90±1.81 37.37±1.86a63.13±2.64ab72.57±1.60abc3.74*CD3 2.67±1.22 2.83±1.45 3.37±1.79 3.47±1.89 0.18 NKG2D 3.17±1.20 10.77±1.20a26.80±1.39ab32.83±1.29abc3.51*CD19 2.10±1.57 2.33±1.46 2.50±1.32 3.33±1.89 0.34 NKp46 3.67±1.97 11.70±1.13a21.57±2.12ab29.53±2.40abc3.98*CD34 60.67±2.25 29.43±3.16a20.53±2.28ab12.13±2.01abc3.21*
2.3LDH细胞毒性法检测诱导分化的NK细胞杀伤能力同一效靶细胞比例,诱导分化28 d的NK细胞的杀伤能力与诱导分化21 d差异均无统计学意义。同一诱导分化时间,8∶1、4∶1、2∶1和1∶1组NK细胞杀伤能力均依次降低(均P<0.05),见表2。
Tab.2 Comparison of killing activity of NK cells detected by LDH method between at 21-d group and 28-d group表2 LDH细胞毒性法检测诱导分化21 d和28 d的NK细胞杀伤能力比较 (n=8,%,±s)
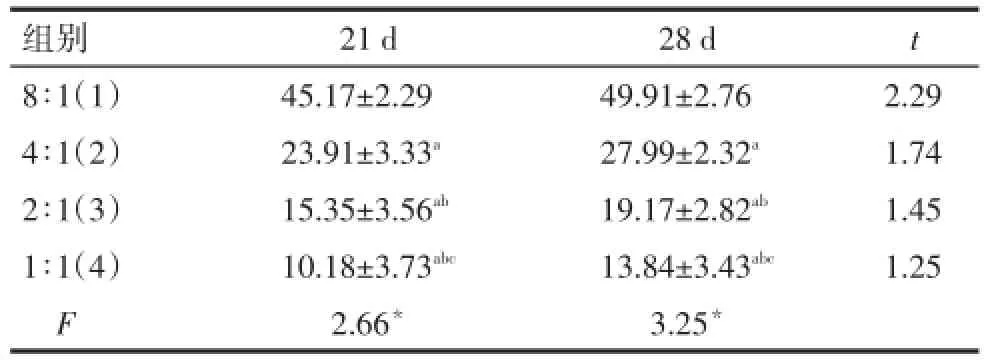
Tab.2 Comparison of killing activity of NK cells detected by LDH method between at 21-d group and 28-d group表2 LDH细胞毒性法检测诱导分化21 d和28 d的NK细胞杀伤能力比较 (n=8,%,±s)
组别8∶1(1)4∶1(2)2∶1(3)1∶1(4)F 21 d 45.17±2.29 23.91±3.33a15.35±3.56ab10.18±3.73abc2.66*28 d 49.91±2.76 27.99±2.32a19.17±2.82ab13.84±3.43abc3.25*t2 .291.741.451.25
2.47AAD/CFSE标记法诱导分化的NK细胞杀伤能力同一效靶细胞比例,诱导分化28 d的NK细胞的杀伤能力与诱导分化21 d差异均无统计学意义。同一诱导分化时间,8∶1、4∶1、2∶1和1∶1组NK细胞杀伤能力均依次降低(均P<0.05),见表3。
Tab.3 Comparison of killing activity of NK cells detected by 7AAD/CFSE between 21-d group and 28-d group表3 7AAD/CFSE标记法检测诱导分化21 d和28 d的NK细胞杀伤能力比较 (n=8,%,±s)
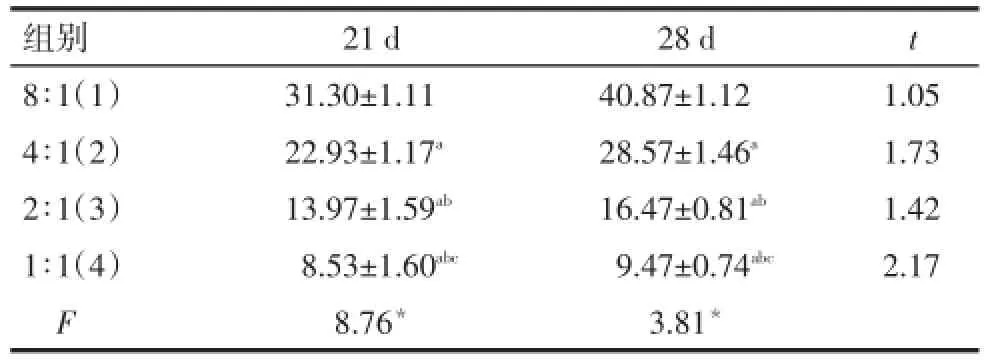
Tab.3 Comparison of killing activity of NK cells detected by 7AAD/CFSE between 21-d group and 28-d group表3 7AAD/CFSE标记法检测诱导分化21 d和28 d的NK细胞杀伤能力比较 (n=8,%,±s)
组别8∶1(1)4∶1(2)2∶1(3)1∶1(4)F 21 d 31.30±1.11 22.93±1.17a13.97±1.59ab8.53±1.60abc8.76*28 d 40.87±1.12 28.57±1.46a16.47±0.81ab9.47±0.74abc3.81*t 1.05 1.73 1.42 2.17
3 讨论
脐带血中富含CD34+HSCs,来源广泛,操作方便,易在体外培养和扩增[5]。Mantri等[6]研究显示,从脐带血中富集的CD34+HSCs在添加SCF和Flt3L的培养基中可以大量扩增,并维持低分化的状态。本研究结果显示,从脐带血富集的CD34+HSCs,体外培养过程中显示出很强的增殖能力,从生长曲线中可知其倍增时间约为24 h。在相应细胞因子的刺激下,细胞形态发生变化,由悬浮状态变为贴壁状态。提示本研究所获取的CD34+HSCs可以在体外大量扩增并进行分化,为其临床应用提供实验依据。
既往研究发现CD34+HSCs可以在体内和体外分化为NK细胞[7]。Cany等[8]通过体内实验观察到,CD34+HSCs可以在淋巴细胞缺陷的 NOD/SCID/ IL2Rg(null)小鼠体内分化为NK细胞,并具有杀死肿瘤细胞的能力。Montaldo等[9]研究显示,在添加SCF、Flt3L和IL-15等细胞因子的培养基中,CD34+HSCs可以分化为NK细胞,通过体内和体外杀伤实验证明了分化得到的NK细胞具有杀死肿瘤细胞的能力。这些研究为NK细胞应用于临床提供了依据。
本研究显示,脐带血来源的CD34+HSCs在体外可以定向分化为NK细胞,在含有20 μg/L的Flt3L、SCF、IL-7、IL-15和IL-21细胞因子的培养基中,细胞大量增殖,细胞数由起始的4.0×105扩增到8.96× 106;细胞增殖的同时进行分化,大部分细胞表达NK细胞表面标志性抗原CD56、NKG2D以及NKp46。分化进程中,T细胞表面标志性抗原CD3以及B细胞表面标志性抗原CD19的表达量无明显上升,而NK细胞表面标志性抗原CD56随着分化进程延长,表达量持续升高,同扩增初期相比,其表达量增加了3倍。提示本研究所采取的体外分化方法可以使CD34+HSCs只分化为NK细胞,而不会分化为T或B细胞。作为与NK杀伤功能需密切相关的表面抗原NKG2D和NKP46,在分化后期也开始大量表达,LDH细胞毒性检测法和7AAD/CFSE标记法结果均显示,分化得到的NK细胞具有杀伤功能,且杀伤能力随效靶比增加而增加。提示本研究利用CD34+HSCs分化得到的NK细胞具有杀伤肿瘤细胞能力。
Vacca等[10]研究发现CD34+HSCs与基质细胞共培养可以得到更高比例的NK细胞,且分化进程相对缩短。本研究得到的NK细胞虽然具有一定的杀伤能力,但杀伤效率偏低。Dungan等[11]研究显示,内源性干扰素(IFN)-γ可提高NK细胞的杀伤能力。Konievic等[12]通过体外实验证明,添加外源性IFN-γ后,细胞增殖和杀伤能力均增加。因此,NK细胞体外分化的培养环境和细胞因子的种类会对其分化进程及功能产生重要的影响,具体作用机制尚需进一步研究。
(图1见插页)
[1]Huang GP,Pan ZJ,Jia BB,et al.Ex vivo expansion and transplantation of hematopoietic stem/progenitor cells supported by mesenchymal stem cells from human umbilical cord blood[J].Cell Transplant,2007,16(6):579-585.
[2]Kao IT,Yao CL,Kong ZL,et al.Generation of natural killer cells from serum-free,expanded human umbilical cord blood CD34+cells [J].Stem Cells Dev,2007,16(6):1043-1051.
[3]Montaldo E,Vacca P,Moretta L,et al.Development of human natural killer cells and other innate lymphoid cells[J].Semin Immunol,2014,26(2):107-113.doi:10.1016/j.smim.2014.01.006.
[4]Moretta L,Pietra G,Montaldo E,et al.Human NK cells:from surface receptors to the therapy of leukemias and solid tumors[J].Front Immunol,2014,5:87.doi:10.3389/fimmu.2014.00087.
[5]ChakrabortySK,BanuLA,RahmanMF,etal.Cordbloodstemcells-a dreamforfuturemedicine[J].MymensinghMedJ,2014,23(3):614-620.
[6]Mantri S,Mohapatra PC.In-vitro behavior of human umbilical cord blood stem cells towards serum based minial cytokine growth conditions[J].Indian J Clin Biochem,2014,29(3):279-289.doi:10.1007/ s12291-013-0346-8.
[7]Chakraborty D,Rumi MA,Soares MJ.NK cells,hypoxia and trophoblast cell differentiation[J].Cell Cycle,2012,11(13):2427-2430.doi: 10.4161/cc.20542.
[8]Cany J,van der Waart AB,Tordor M,et al.Natural killer cell generated from cord blood hematopoietic progenitor cells efficiency target bone marrow residing human leukemia cells in NOD/SCID/ IL2Rg(null)mice[J].PLoS One,2013,8(6):e64384.doi:10.1371/ journal.pone.0064384.
[9]Montaldo E,Vitale C,Cottalasso F,et al.Human NK cells at early stage of differentiation produce CXCL8 and express CD161 molecule that functions as an activating receptor[J].Blood,2012,119 (17):3987-3996.doi:10.1182/blood-2011-09-379693.
[10]Vacca P,Vitale C,Montaldo E,et al.CD34+hematopoietic precursors are present in human decidua and differentiate into natural killer cells upon interaction with stromal cells[J].Proc Natl Acad Sci U S A,2011,108(6):2402-2407.doi:10.1073/pnas.1016257108.
[11]Dungan LS,McGuinness NC,Boon L,et al.Innate IFN-γ promotes development of experimental autoimmune encephalpmyelitis:A role for NK cells and M1 macrophages[J].Eur Immunol,2014,44(10): 2903-2917.doi:10.1002/eji.201444612.
[12]Konievic G,Miriacic-Matrinovic K,Vuletic A,et al.In vitro increased natural killer cell activity of metastatic melanoma patients with interferon alone as opposed to its combination with 13-cis retinoic acid is associated with modulation of NKG2D and CD161 activating receptor expression[J].J BUON,2012,17(4):761-769.
(2014-10-01收稿2014-10-30修回)
(本文编辑陈丽洁)
The efficiency and function detection of NK cell differentiation from human umbilical cord hematopoietic stem cells in vitro
LUO Qi1,YIN Jie2,LI Yang2,HUANG Shan2,WANG Xi2,HE Jinghua1△
1 Department of Pharmacology,College of Basic Medicine,Tianjin Medical University,Tianjin 300070,China;2 Department of Cell Biology,College of Basic Medicine,Tianjin Medical University
△Corresponding AuthorE-mail:hejinghuacn@163.com
ObjectiveTo detect the efficiency and function of NK cell differentiation from human umbilical cord hematopoietic stem cells(HSCs)in vitro.MethodsCD34+hematopoietic stem cells were isolated from human umbilical cord blood,and inoculated into SCGM medium containing 20 μg/L FMS like tyrosine kinase 3 ligand(Flt-3L),stem cell factor(SCF),interleukin(IL)-7,IL-15 and IL-21.And CD34+HSCs were differentiated into NK cells in directional inducing. The growth state of cells was observed.The expressions of CD56,NKG2D,NKp46,CD3,CD19 and CD34 were detected by flow cytometry in the differentiation of 7,14,21 and 28 d.In the differentiation of 21 d and 28 d,the differentiation cells were used as effector cells,and K562 cells as target cells.The ratios of effector cells and target cells were 8∶1,4∶1,2∶1 and 1∶1.The killing activity of the differentiated cells was detected by lactate dehydrogenase(LDH)cell toxicity assay and 7AAD/CFSE labeling method.ResultsCD34+HSCs derived from human umbilical cord blood can proliferate in vitro under appropriate condition.There were no significant differences in the expression of CD3 and CD19 between different differentiation stages(7,14,21 and 28 d,P>0.05).The expressions of CD56,NKG2D and NKp46 were significantly different(P<0.05),and the ultimate expression amount was(72.57±1.60)%,(32.83±1.29)%and(29.53±2.40)%.The expression of CD34 decreased gradually,and the lowest was(12.13±2.01)%.The maximum killing activity detected by LDH cell toxicity assay and 7AAD/CFSE labeling method reached(49.91±2.76)%and(40.87±1.12)%.The killing activity of NK cells was decreased in the order of 8∶1,4∶1,2∶1 and 1∶1 groups(P<0.05).There was no significant difference in the killing activity between NK cells of 28 d and 21 d.ConclusionHuman umbilical cord hematopoietic stem cells can differentiate into NK cells un-der appropriate conditions in vitro,and the NK cells induced from differentiation are with killing activity.
fetal blood;hematopoietic stem cells;killer cells,natural;immunophenotyping;cytotoxicity tests,immunologic;CD34+hematopoietic stem cells;in vitro differentiation;cytotoxicity
R392
ADOI:10.11958/j.issn.0253-9896.2015.03.001
973国家重大科学研究计划资助项目(2014CB910104);国家自然科学基金资助项目(81171899)
1天津医科大学基础医学院药理学教研室(邮编300070);2天津医科大学细胞生物学系
罗琦(1990),女,硕士在读,主要从事肿瘤与免疫药理学方面研究
△E-mail:hejinghuacn@163.com
