野黄芩苷对人舌鳞癌Tca8113细胞凋亡及caspase-8表达的影响
2015-08-23张颖李俊玫秦博文葛志华
张颖,李俊玫,秦博文,葛志华△
野黄芩苷对人舌鳞癌Tca8113细胞凋亡及caspase-8表达的影响
张颖1,李俊玫2,秦博文3,葛志华2△
目的探讨野黄芩苷诱导人舌鳞癌Tca8113细胞凋亡的可能机制。方法将体外培养的人舌鳞癌Tca8113细胞分成对照组和不同浓度野黄芩苷组(浓度分别为80、120、160 mg/L),每组设3个复孔。采用Tunel检测细胞凋亡情况;采用免疫细胞化学法和Western blot法检测caspase-8蛋白表达情况。结果 (1)80、120、160 mg/L野黄芩苷组Tca8113细胞凋亡率高于对照组[(17.63±0.25)%、(36.23±0.36)%、(51.84±0.58)%vs(4.45± 0.27)%,P<0.05]。(2)与对照组相比,80、120、160 mg/L野黄芩苷组caspase-8蛋白的表达增加(0.283±0.040 vs 0.474±0.031、0.592±0.077、0.781±0.020,P<0.05)。结论野黄芩苷能明显诱导舌鳞癌细胞Tca8113的凋亡,可能与上调caspase-8蛋白表达有关。
舌肿瘤;细胞凋亡;半胱氨酸天冬氨酸蛋白酶8;野黄芩苷;Tca8113细胞
舌癌是常见的口腔颌面部恶性肿瘤,多数为鳞癌,一般生长较快,浸润性较强,恶性程度较高,易发生淋巴道转移。目前舌癌的治疗是以手术治疗为主的综合治疗[1]。但术后复发及转移率较高,5年生存率约为53%[2]。因此,寻求有效且不良反应小的药物来防治舌癌,对于改善患者生活质量和提高生存率具有积极的意义。野黄芩苷是一种黄酮类化合物,是黄芩茎叶、半枝莲中总黄酮的主要活性成分,具有抗癌、抗氧化、抗病毒、抗炎、抑制变态反应等多方面的药理作用[3]。本研究采用野黄芩苷作用于体外培养的人舌鳞癌Tca8113细胞,观察Tca8113细胞的凋亡情况及caspase-8蛋白表达的改变,探讨其对Tca8113细胞凋亡的影响及可能机制,为野黄芩苷抗癌作用的研究提供理论依据。
1 材料与方法
1.1主要试剂和仪器人舌鳞癌Tca8113细胞株(南京凯基生物科技有限公司),中药野黄芩苷(中国生物药品检定所),1640培养液(美国Gibco公司),胎牛血清(fetal bovine serum,FBS,天津血液学研究所),YT-CJ-1N型洁净工作台(北京亚泰科隆实验科技开发中心),倒置相差显微镜及照相系统(Olympus,日本),CO2孵箱(SANYO,日本),caspase-8一抗(美国SantaCruz公司),caspase-8二抗、3%H2O2(北京中杉金桥生物技术有限公司),DAB显色试剂盒(福州迈新生物技术开发有限公司),Tunel试剂盒(南京凯基生物科技有限公司),BCA蛋白定量试剂盒(北京普利莱公司),蛋白裂解液(北京普利莱公司),辣根过氧化物酶标记的二抗(美国Santa Cruz公司)。
1.2实验分组实验分为对照组和不同浓度野黄芩苷组。对照组用10%胎牛血清(FBS)的1640培养液培养舌鳞癌Tca8113细胞;野黄芩苷组用10%FBS的1640培养液配制野黄芩苷终浓度分别为 80、120、160 mg/L处理舌鳞癌Tca8113细胞。
1.3人舌鳞癌Tca8113细胞的培养人舌鳞癌Tca8113细胞为单层贴壁生长。培养液为RPMI1640培养基,内含10% FBS、青霉素和链霉素各100 mg/L。将Tca8113细胞置于37℃、5%CO2培养箱内进行培养,根据生长情况1~2 d换液1次。取对数生长期的细胞进行实验。
1.4Tunel技术检测细胞凋亡情况
1.4.1细胞爬片、固定将浓度为1×108/L的Tca8113细胞悬液,滴加到载玻片上。每张载玻片上滴加约0.2 mL,每组设3个复孔,培养箱中进行培养。3~4 h后弃去培养液,分别加入含不同浓度野黄芩苷(80、120、160 mg/L)的RPMI-1640培养。48 h后将载玻片先后浸入固定液中固定和封闭液中封闭。期间用PBS洗3遍,然后浸入通透液中。
1.4.2标记和显色反应PBS洗3遍。每个样本滴加50 μL TdT酶反应液反应60 min。PBS洗3遍,滴加50 μL Streptavidin-HRP工作液反应30 min,PBS洗3遍,滴加50~100 μL DAB工作液显色10 min。PBS洗3遍,然后光学显微镜下进行观察、拍照。
1.4.3结果判定阳性细胞核呈棕黄色即为凋亡细胞,非凋亡细胞核呈蓝色。每张切片在显微镜400倍下随机读取100个细胞,根据凋亡阳性细胞数/总细胞计数×100%计算细胞凋亡率,取其均值。
1.5免疫细胞化学检测caspase-8的表达将浓度为1×108/ L的Tca8113细胞,在每张载玻片上滴加0.2 mL,每组设3个复孔,置培养箱中培养。3~4 h弃去培养液,分别加入含不同浓度野黄芩苷(80、120、160 mg/L)的RPMI-1640完全培养液,并以RPMI-1640完全培养液作对照,48 h后甲醇固定10 min,晾干。切片经PBS漂洗3遍。3%H2O2,处理 20 min。PBS漂洗后,滴加10%小牛血清封闭30 min。caspase-8一抗(1∶50),4℃过夜。caspase-8二抗,30 min。DAB显色,苏木素复染,1%盐酸乙醇分化,氨水返蓝,梯度乙醇脱水,二甲苯透明,中性树脂封片,拍照记录结果。阳性细胞胞浆染色黄色或棕黄色。显微镜下取5个典型高倍视野(×200倍)。±:阳性细胞0~25%;+:阳性细胞26%~50%;++:阳性细胞51%~75%;+++:阳性细胞76%~100%。
1.6Western-blot检测caspase-8的表达分别消化收集不同浓度野黄芩苷的细胞,用细胞裂解液在冰浴中裂解提取蛋白,用BCA方法测定蛋白含量,采用相同蛋白量上样,经SDS-PAGE电泳分离蛋白后,转移到硝酸纤维素膜,加入一抗(1∶1 000),ECL检测试剂盒显影和定影。用Image-Pro Plus 5.1图像分析软件对各蛋白条带和β-actin条带进行分析,各条带的灰度值代表其蛋白的表达量,用β-actin条带灰度值进行校正,得出各条带的相对灰度值。重复3次实验取其平均值。
1.7统计学方法采用SPSS 17.0统计软件分析数据,数据用±s表示,多组间数据比较采用单因素方差分析,组间多重比较采用LSD-t检验,等级资料采用秩和检验,并用Nemenyi法进行多重比较,P<0.05为差异有统计学意义。
2 结果
2.1野黄芩苷对Tca8113细胞凋亡的影响检测结果对照组和野黄芩苷 80、120、160 mg/L组Tca8113细胞凋亡率分别为(4.45±0.27)%、(17.63± 0.25)%、(36.23±0.36)%、(51.84±0.58)%,凋亡率依次增加,差异均有统计学意义(n=3,F=8 628.948,P<0.01)。对照组阳性细胞较少,野黄芩苷组随着药物浓度的增高,阳性细胞逐渐增多,见图1。
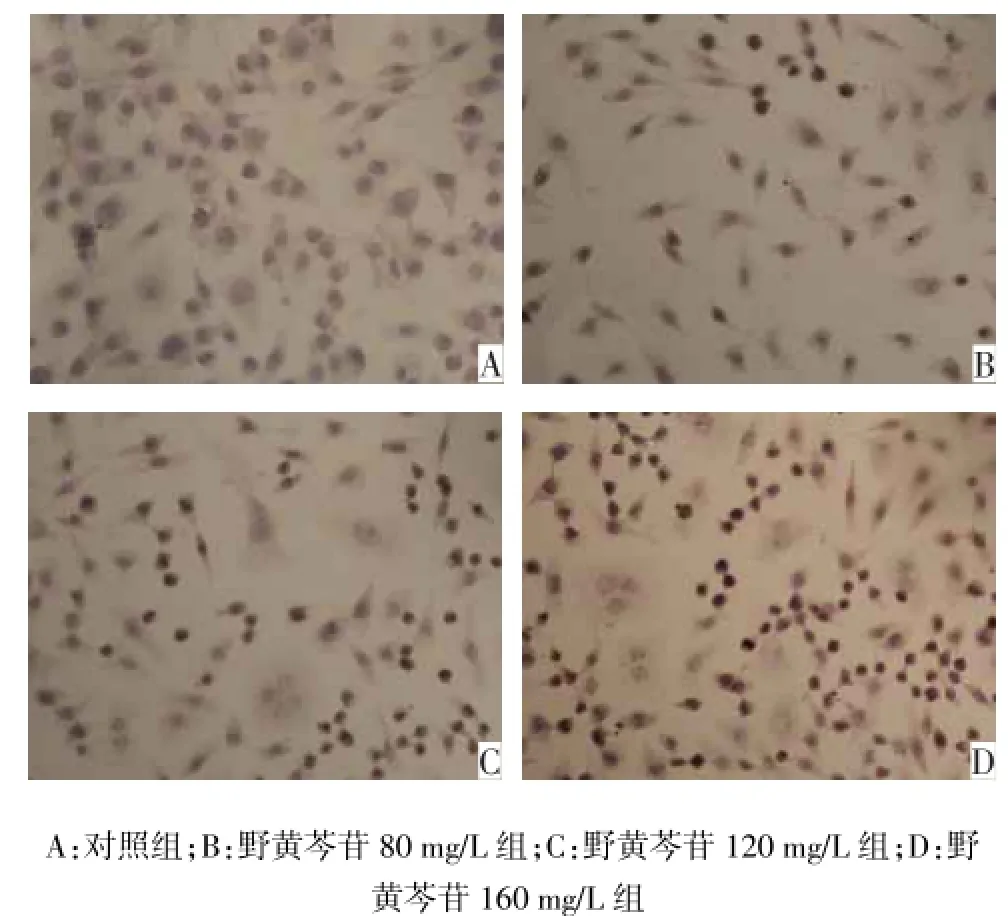
Fig.1 The apoptotic expressions induced by different concentrations of scutellarin in Tca8113 cells(Tunel,×400)图1 不同浓度野黄芩苷组Tca8113细胞凋亡表达(Tunel,×400)
2.2caspase-8表达 (1)免疫细胞化学结果显示:对照组细胞caspase-8表达很弱,野黄芩苷组随着药物浓度的增高,caspase-8表达逐渐增强,见图2。120 mg/L与160 mg/L组比较差异无统计学意义,其余组比较差异均有统计学意义(P<0.05),见表1。(2)Western-Blot检测显示:对照组caspase-8蛋白的表达最弱,野黄芩苷组随着药物浓度增高,caspase-8蛋白的表达依次递增,见图3。对照组及野黄芩苷各浓度组caspase-8蛋白表达量分别为0.283±0.040、0.474±0.031、0.592±0.077、0.781± 0.020,随野黄芩苷浓度增加,各组之间差异均有统计学意义(F=58.927,P<0.01)。
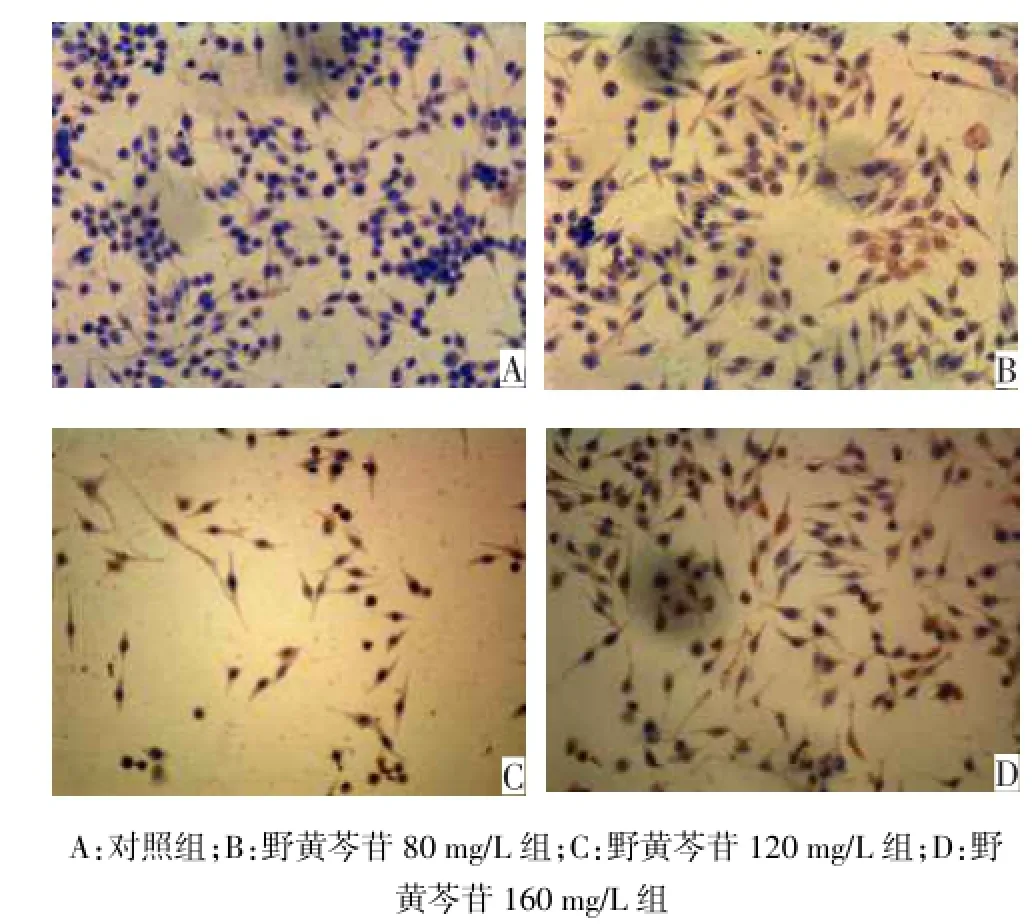
Fig.2 The caspase-8 expressions induced by different concentrations of scutellarin in Tca8113 cells(DAB×200)图2 野黄芩苷不同浓度组Tca8113细胞caspase-8的表达(DAB染色×200)

Tab.1 The expressions of caspase-8 protein in four groups of cells表1 caspase-8蛋白在各组细胞中的表达
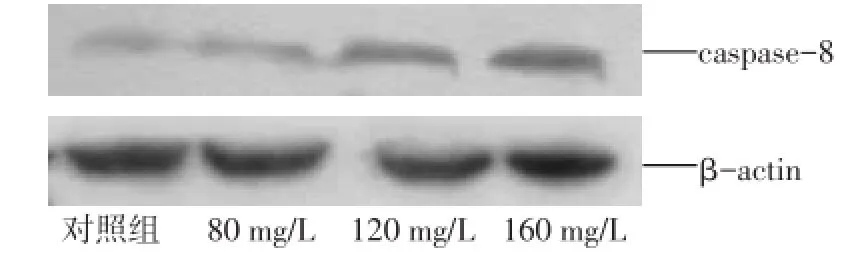
Fig.3 Effects of scutellarin on the expression of caspase-8 in Tca8113 cells图3 野黄芩苷不同浓度作用后Tca8113细胞caspase-8蛋白表达
3 讨论
3.1caspase-8在肿瘤细胞凋亡中的作用目前认为肿瘤是细胞的凋亡被抑制而增殖趋势加强,使生长的动态平衡遭受破坏所致。细胞凋亡受阻或减少在肿瘤的形成中起着重要作用。因此,诱导肿瘤细胞凋亡已成为寻找有效抗癌药物的新靶点。细胞凋亡率也成为抗肿瘤疗效评价的一项新指标。促凋亡蛋白酶(caspase)是一类半胱氨酸蛋白酶。caspase能够灭活凋亡抑制物,水解蛋白质结构形成凋亡小体以及水解凋亡相关活性蛋白。caspase蛋白酶家族是导致细胞凋亡的介导者和执行者[4]。caspase-8 是caspase家族中最重要的起始因子,它几乎能激活所有的caspase,也是启动死亡受体介导的凋亡途径的关键因子。当Fas被FasL激活后,通过胞质中的衔接蛋白FADD(fas—associated death domain)募集并激活前体caspase-8。活化的caspase-8可以引起caspase的级联反应,引发细胞凋亡。这是细胞凋亡的主要途径之一。活化的caspase-8还能通过裂解Bid诱导线粒体释放细胞色素C启动线粒体/细胞色素C通路,有效放大了凋亡信号。研究表明caspase-8在宫颈癌[5]、胃腺癌[6]、乳腺癌[7]、肺癌[8]等多种肿瘤中低表达。以上研究说明,caspase-8低表达导致肿瘤细胞对凋亡刺激敏感性降低,可能与肿瘤的发生发展有关。
3.2野黄芩苷对舌癌细胞凋亡及caspase-8表达的影响近年来,随着中药药理学、免疫学、细胞生物学等多学科研究方法和技术手段的提高,已发现很多中药活性成分有抗肿瘤作用,如姜黄素[9]、白花丹素[10]可以影响舌癌细胞的增殖和凋亡。野黄芩苷是从黄芩茎叶中分离出来的黄酮类化合物,具有抗炎、抗变态反应、抗肿瘤等药理活性。随着研究的逐步深入,其抗肿瘤活性日益受到重视。有研究证实半枝莲中野黄芩苷可明显抑制乳腺癌MCF-7细胞的生长[11]。野黄芩苷可以通过提高人舌鳞癌细胞Fas蛋白表达抑制细胞增殖而达到抗肿瘤作用[12]。
本实验以不同浓度的野黄芩苷作用于舌鳞癌细胞Tca8113,Tunel结果显示:随着野黄芩苷浓度的增加,舌鳞癌Tca8113细胞的凋亡率逐渐增加。免疫细胞化学法和Western blot法检测结果显示:随着野黄芩苷浓度增加,caspase-8表达逐渐增强。这些结果表明,野黄芩苷有诱导舌鳞癌细胞凋亡的作用,其机制可能是通过增加caspase-8蛋白的表达来启动死亡受体通路和线粒体/细胞色素C通路这2条凋亡途径,促进细胞的凋亡过程。
综上所述,野黄芩苷可以通过上调caspase-8蛋白的表达来诱导舌鳞癌细胞的凋亡,且呈一定的量效关系。虽然野黄芩苷对肿瘤具有独特作用,且来源广泛、不良反应少等优点,但其抗肿瘤机制较为复杂,且本身不溶于水,因此仍需要对野黄芩苷的抗肿瘤机制、不良反应、药代动力学、剂型等方面进行更深入的研究,使之成为具有药理活性强、高稳定性、给药方便的新型抗癌药物。
[1]Qiu WL.Oral and maxillofacial surgery[M].Version 4.Beijing:People's medical publishing house,2006:226-227.[邱蔚六.口腔颌面外科学[M].第4版.北京:人民卫生出版社,2006:226-227].
[2]Lam L,Logan RM,Luke C.Epidemiological analysis of tongue cancer in South Australia for the 24-year period,1977-2001[J].Aust-Dent J,2006,51(1):16-22.
[3]Ning H.Pharmacological research progress of scutellariae flavonoids chemical components[J].Inner Mongol Journal of Traditional Chinese Medicine,2013,32(15):142-143.[宁宏.黄芩黄酮类化学成分药理研究新进展[J].内蒙古中医药,2013,32(15):142-143].doi:10.3969/j.issn.1006-0979.2013.15.143
[4]Mao DW,Chen YQ,Wang L,et al.Relationship of Caspase-8 and Caspase-3 to Apoptosis[J].Journal of Liaoning university of traditional Chinese medicine,2008,10(10):148-150.[毛德文,陈月桥,王丽,等.Caspase-8及Caspase-3与细胞凋亡[J].辽宁中医药大学学报,2008,10(10):148-150].doi:10.3969/j.issn.1673-842X.2008.10.091.
[5]Ma LY,Li CS,Chen KS,et al.The expression and signicance of cFLIP and caspase-8 in Cervical cancer tissue[J].Guangdong Medical Journal,2010,31(18):2422-2425.[马丽影,李晟磊,陈奎生,等.凋亡相关蛋白cFLIP及Caspase-8在宫颈鳞癌组织中的表达及意义[J].广东医学,2010,31(18):2422-2425].doi:10.3969/ j.issn.1001-9448.2010.18.037.
[6]Li XF.The expression and significance of RCAS1and Caspase-8 in gastric adenocarcinoma tissue[J].Shandong Medical Journal,2011,5l(20):100-102.[李晓芳.RCAS1、Caspase-8在胃腺癌组织中的表达及意义[J].山东医药,2011,51(20):100-102].doi:10.3969/j.issn.1002-266X.2011.20.049.
[7]Pan Z,Chen J,Qin GD,et al.Expression of c-FLIP and Caspase-8 in Breast Cancer and Their Clinical Significance[J].The practical journal of cancer,2012,27(3):244-246.[潘峥,陈军,覃冠德.c-FLIP及Caspase-8表达在乳腺癌组织中的表达及临床意义[J].实用癌症杂志,2012,27(3)244-246].doi:10.3969/j.issn.1001-5930.2012.03.008.
[8]Du N,Sun XF,Hu LJ,et al.Expression of caspase-8 in non-small cell lung cancer and its role in invasion and metastasis of lung cancer A549 cells[J].Chinese Journal of Cellular and Molecular Immunology,2012,28(6):572-575.[杜宁,孙向飞,胡丽娟,等.Caspase-8在非小细胞肺癌中的表达及其在肺癌A549细胞侵袭转移中作用[J].细胞与分子免疫学杂志,2012,28(6):572-575].
[9]Chen JH,Tang YH,Liu H,et al.Anti-proliferative and anti-metastatic effects of curcumin on oral cancer cells[J].West China Journal of Stomatology,2011,29(1):83-86.[陈教文,汤亚玲,刘红,等.姜黄素对口腔舌癌细胞增殖与转移能力影响的实验研究[J].华西口腔医学杂志,2011,29(1):83-86].doi:10.3969/j. issn.1000-1182.2011.01.020.
[10]Du Z,Sun Q,Qiao W,et al.Discuss of White Dan on proliferation and apoptosis in human tongue carcinoma Tca cell[J].Shi Zhen National Physician National Medicine,2011,22(4):942-944.[杜泽乡,孙情,乔伟,等.白花丹素对人舌癌Tca细胞增殖及凋亡作用的探讨[J].时珍国医国药,2011,22(4):942-944].doi:10.3969/j. issn.1008-0805.2011.04.072.
[11]Shi Y,Zhou ZY,Cheng LJ,et al.The Effects of scutellarin in barbated skullcup herb on galactophore cancer MCF-7 cell proliferation and invasion potentia[J].Journal of Jiangxi Medical College,2009,49(10):12-14.[石杨,周志愉,程流剑,等.半枝莲中野黄芩苷对乳腺癌MCF-7细胞增殖及侵袭能力的影响[J].江西医学院学报 ,2009,49(10):12-14].doi:10.3969/j.issn.1000-2294.2009.10.004.
[12]Li JM,Yang N,Wang HT,et al.Effects of scutellarin on the expression of Fas and cell cycle in Human tongue squamous carcinoma Tca-8113 cell[J].Journal of Practical Oral Medical,2013,29(2):250-252.[李俊玫,杨宁,王行天,等.野黄芩苷对人舌鳞癌Tca8113细胞周期及Fas蛋白表达的影响[J].实用口腔医学杂志 ,2013,29(2):250-252].doi:10.3969/j.issn.1001-3733.2013.02.022.
(2014-08-29收稿2014-11-30修回)
(本文编辑李鹏)
The effects of scutellarin on apoptosis and the expression of caspase-8 in human tongue squamous carcinoma Tca8113 cells
ZHANG Ying1,LI Junmei2,QIN Bowen3,GE Zhihua2△
1Pathology Teaching and Research Section,Chengde Nursing Vocational College,Chengde 067000,China;2Department of Scientific Research,The Affiliated Hospital of Chengde Medical College;3Department of Scientific Research,Chengde Nursing Vocational College
△Corresponding AuthorE-mail:gzh9138@sina.com
ObjectiveTo investigate the possible mechanism of scutellarin on the apoptosis of human tongue squamous carcinoma Tca8113 cells.MethodsHuman tongue squamous carcinoma Tca8113 cells were divided into control group and scutellarin groups(80,120 and 160 mg/L).Tunel method was used to detect the apoptosis.Immunohistochemistry and Western blot assay was used to detect the caspase-8 protein expression of cells.Results(1)The apoptotic rates of Tca8113 cells were significantly high in scutellarin groups(80,120 and 160 mg/L)than those in control group[(17.63± 0.25)%,(36.23±0.36)%,(51.84±0.58)%vs(4.45±0.27)%,P<0.05].(2)Compared with control group,the expressions of caspase-8 protein were significantly increased in different concentrations(80,120 and 160 mg/L)of scutellarin groups(0.283± 0.040 vs 0.474±0.031,0.592±0.077,0.781±0.020,P<0.05).ConclusionScutellarin could obviously induce the apoptosis of human tongue squamous carcinoma Tca8113 cells,which may be related to the caspase-8 protein expression.
tongue neoplasms;apoptosis;caspase-8;Scutellarin;Tca8113
R739.8
ADOI:10.11958/j.issn.0253-9896.2015.03.004
1承德护理职业学院病理教研室(邮编067000);2承德医学院附属医院科研处;3承德护理职业学院科研处
张颖(1972),副教授,硕士学位,主要从事病理学方面研究
△E-mail:gzh9138@sina.com
