人参皂苷Rg1对局灶性脑缺血大鼠PARP-1和TNFR1表达的影响
2015-08-23于洋刘学政包翠芬李晓明刘霞
于洋,刘学政△,包翠芬,李晓明,刘霞
实验研究
人参皂苷Rg1对局灶性脑缺血大鼠PARP-1和TNFR1表达的影响
于洋1,刘学政1△,包翠芬2,李晓明3,刘霞3
目的探讨人参皂苷Rg1对局灶性脑缺血大脑皮质多聚二磷酸腺苷核糖聚合酶(PARP)-1和肿瘤坏死因子受体(TNFR)1表达的影响。方法90只健康SD大鼠随机均分为假手术组,单纯缺血组,人参皂苷Rg1低、中、高组,阳性对照组。于术前5 d至取材当日,假手术组与单纯缺血组分别腹腔注射生理盐水45 mg/kg,人参皂苷Rg1分别给10、20、40 mg/kg,阳性对照组尼莫地平1 mg/kg。采用大脑中动脉栓塞法制备局灶性脑缺血模型,神经功能缺损评分和TTC染色验证模型是否成功;采用免疫组织化学法和蛋白免疫印迹法检测大脑皮质缺血后PARP-1、TNFR1的表达。结果单纯缺血组较假手术组可见明显神经功能缺陷症状及大面积苍白色梗死区域;人参皂苷Rg1各组和阳性对照组神经功能评分和脑梗死体积百分比高于假手术组,低于单纯缺血组(P<0.05);人参皂苷Rg1各组与阳性对照组差异无统计学意义。人参皂苷Rg1低组每高倍视野PARP-1、TNFR1阳性细胞数高于假手术组和阳性对照组;中、高组高于假手术组,低于单纯缺血组(P<0.05)。单纯缺血组皮质PARP-1、TNFR1较假手术组阳性表达条带显著增强;人参皂苷Rg1低组PARP-1、TNFR1阳性表达高于假手术组;中组高于假手术组,低于单纯缺血组;高组低于单纯缺血组(P<0.05)。结论人参皂苷Rg1对大鼠局灶性脑缺血具有保护作用,其机制可能与下调大脑组织PARP-1、TNFR1的表达,对抗脑细胞坏死有关。
人参皂甙;脑缺血;聚ADP核糖聚合酶类;受体,肿瘤坏死因子,Ⅰ型;人参皂苷Rg1;局灶性脑缺血;PARP-1;TNFR1
研究证实,局灶性脑缺血损伤时脑细胞可出现不同程度的细胞凋亡和细胞坏死现象[1]。以往研究认为,细胞坏死是由于某些原因对细胞造成严重损害所导致的一个被动过程,具有不可控性[2]。因此,对于局灶性脑缺血的防治主要集中于干预细胞凋亡过程,而局灶性脑缺血早期的坏死多伴有明显的局部炎症刺激,对脑组织的损害更为严重,单纯地干预细胞凋亡过程对局灶性脑缺血的防治效果不甚理想[3]。近年来研究表明,某些形式的坏死是受到细胞信号通路的调控,多聚ADP核糖聚合酶1(poly ADP-ribose polymerase,PARP1)的过度激活以及肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)在坏死细胞中发挥的作用越来越引起人们的关注[4-5]。人参皂苷Rg1是从人参中提取的小分子活性物质,具有减小脑梗死体积、改善神经功能缺损症状等脑保护作用,但是其作用机制还不明确。本研究通过制备动物局灶性脑缺血模型,并采用人参皂苷Rg1进行干预,观察缺血后脑组织PARP-1、TNFR1的表达情况,探讨Rg1对缺血损伤致脑细胞坏死的影响。
1 材料与方法
1.1材料人参皂苷Rg1(纯度>95%,由吉林大学有机化学教研室提供);尼莫地平注射液(山西亚宝药业,批号:071001);羊抗鼠PARP-1(santa cruz公司)、兔抗鼠TNFR1单克隆抗体(abcam公司);2,3,5-三苯基氯化四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC;SIGMA公司)。
1.2方法
1.2.1分组与给药健康 Sprague-Dawley大鼠,体质量(250±50)g,由北京维通利华实验动物技术有限公司提供,生产许可证:SCXK(京)2012-0001。采用随机区组法将大鼠分为6组:假手术组,单纯缺血组,人参皂苷Rg1低、中、高组,阳性对照组,每组15只。术前5 d至取材当日,假手术组和单纯缺血组分别给予腹腔注射生理盐水(45 mg/kg),人参皂苷Rg1低、中、高组和阳性对照组分别给予腹腔注射人参皂苷Rg1(10、20、40 mg/kg)、尼莫地平(1 mg/kg),1次/d。
1.2.2大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型制备及鉴定采用改良线栓法制备右侧大脑中动脉阻塞脑缺血模型[6]。用10%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠后,采用仰卧式颈正中切口,暴露颈总动脉(CCA)及右侧颈内动脉(ICA)、颈外动脉(ECA),在CCA分叉处结扎ECA,夹闭CCA近心端及远心端,在其近分叉处剪口,将线栓向ICA插入直至大脑中动脉起始处,以阻塞其开口。随后,收紧预先留置于剪口处的丝线,松开CCA近心端动脉夹,逐层缝合。术中保持肛温在37.0~37.5℃。假手术组除不插入线栓外,其他步骤同上。于大鼠苏醒后进行神经功能缺陷5分制评分,每组选取5只大鼠于术后24 h采用TTC染色以验证局灶性脑缺损模型是否成功。
1.2.3光、电镜标本的制备及染色取每组大鼠各5只,于MCAO术后24 h,采用2.5%多聚甲醛-戊二醛脑部灌流固定。冠状切取前囟尾侧顶叶大脑皮质,于灌流液中浸润固定24 h。取小块标本进行常规电镜标本制备,其余部分制备成光镜石蜡标本。石蜡标本经切片后行焦油紫染色,光镜下观察脑组织病理改变,电镜标本行超薄切片,重金属双染后,于透射电镜下观察脑细胞坏死情况。
1.2.4免疫组织化学法检测及分析取上述石蜡标本制备5 μm防脱切片。采用Envision法进行免疫组化染色。切片常规脱蜡至水后,采用pH 6.0枸椽酸缓冲液高压修复以恢复抗原活性,进一步以3%过氧化氢溶液消除内源性过氧化物酶反应;然后滴加1∶100稀释的羊抗鼠PARP-1抗体/兔抗鼠TNFR1抗体,4℃孵育过夜;滴加辣根过氧化物酶标记的抗羊/抗兔多聚体,37℃孵育25 min;DAB显色,苏木素复染,脱水、透明、封片。阴性对照采用PBS替代一抗。
光镜下观察,PARP-1阳性表达部位定位于细胞核。TNFR1阳性表达部位定位于细胞质。采用细胞图像分析系统检测每400倍视野PARP-1、TNFR1的阳性细胞数量。
1.2.5蛋白免疫印迹法检测及分析取每组大鼠各5只,于MCAO术后24 h,大鼠经水合氯醛麻醉后迅速断头取出顶叶大脑皮质,匀浆粉碎,制成上清液。经二喹啉甲酸法测定各组蛋白含量后,将上清液制备成样品储备液。取适量的样品储备液加入电泳槽内进行电泳、转膜、半干转印,采用5%脱脂奶粉室温封闭2 h。分别加入一抗稀释液(羊抗鼠PARP-1,兔抗鼠TNFR1,稀释度为1∶1 000),4℃孵育过夜;加入辣根酶标记的抗羊/抗兔IgG抗体室温孵育1 h。各步骤之间均采用TBST缓冲液洗脱3次×10 min。采用β-Actin作为内参照。电化学发光法显色后,用UVP专用软件分析各蛋白目的条带与内参条带吸光度的比值。
1.3统计学方法应用SPSS 13.0软件分析,计量资料用±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1脑缺血神经功能缺陷评分的比较假手术组未见神经功能缺陷症状;单纯缺血组可见明显的神经功能缺陷症状;人参皂苷Rg1各组和阳性对照组可见不同程度的神经功能缺陷症状,其神经功能评分均高于假手术组,低于单纯缺血组(均P<0.05);人参皂苷Rg1各组与阳性对照组差异无统计学意义。见表1。
Tab.1 Comparison of percentages of neurological function and infarct volume between six groups表1 各组大鼠神经功能评分及脑梗死体积百分比比较(±s)

Tab.1 Comparison of percentages of neurological function and infarct volume between six groups表1 各组大鼠神经功能评分及脑梗死体积百分比比较(±s)
*P<0.05;a与假手术组比较,b与单纯缺血组比较,c与阳性对照组比较,P<0.05;表2同
组别假手术组单纯缺血组阳性对照组人参皂苷Rg1低组人参皂苷Rg1中组人参皂苷Rg1高组F神经功能评分(n=15)0 2.87±0.35a1.20±0.41ab1.53±0.52ab1.33±0.49ab1.13±0.35ab82.340*脑梗死体积百分比(%)(n=5)0 36.75±5.33a17.87±3.42ab20.44±2.82ab17.80±5.73ab15.77±2.53ab47.257*
2.2脑梗死体积的比较正常脑组织被染成红色,而缺血脑组织则被染成苍白色。单纯缺血组右侧大脑皮质可见较大面积的苍白色梗死区域,且与正常脑组织分界较明显;人参皂苷Rg1各组和阳性对照组可见不同程度减小的苍白色梗死区域,以人参皂苷Rg1高组减小最为明显,见图1。人参皂苷Rg1各组和阳性对照组脑梗死体积百分比均高于假手术组,低于单纯缺血组(均P<0.05);人参皂苷Rg1各组与阳性对照组差异无统计学意义,见表1。
2.3大脑皮质微细结构的比较光镜下观察可见假手术组右侧大脑皮质结构完整、层次分明,细胞排列整齐;脑细胞形态结构正常。单纯缺血组则可见细胞排列紊乱、稀疏,部分细胞变性坏死,胞质与胞核界限不清,核呈不规则形;进一步采用透射电镜观察,部分神经元呈典型的坏死表现,核膜局部破损,核质外溢,细胞肿胀,内质网扩张,线粒体肿胀空泡化。人参皂苷Rg1各组和阳性对照组细胞排列较整齐,各项病理改变均较单纯缺血组有不同程度的改善,见图2。
2.4大脑皮质PARP-1、TNFR1免疫组化表达的比较假手术组可见少量PARP-1、TNFR1阳性细胞表达;单纯缺血组皮质可见大量PARP-1、TNFR1阳性细胞表达;人参皂苷Rg1低组每高倍视野PARP-1、TNFR1阳性细胞数高于假手术组和阳性对照组(均P<0.05),与单纯缺血组差异无统计学意义;人参皂苷Rg1中、高组均高于假手术组,低于单纯缺血组(均P<0.05),与阳性对照组差异无统计学意义。见表2,图3、4。
Tab.2 Comparison of positive cells and grey scale of PARP-1 and TNFR1 in rat cerebral cortex between six groups表2 各组大鼠大脑皮质PARP-1、TNFR1表达情况阳性细胞数及灰度比值比较 (n=5,±s)
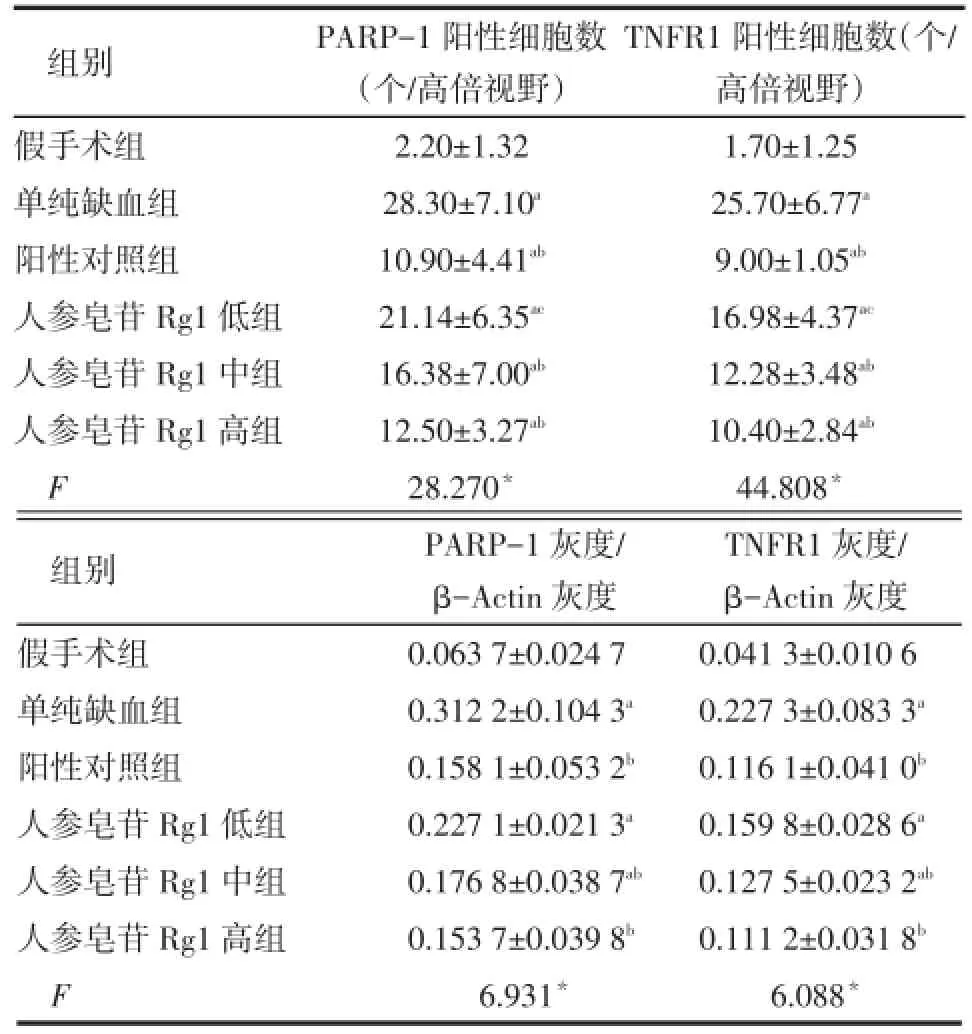
Tab.2 Comparison of positive cells and grey scale of PARP-1 and TNFR1 in rat cerebral cortex between six groups表2 各组大鼠大脑皮质PARP-1、TNFR1表达情况阳性细胞数及灰度比值比较 (n=5,±s)
组别假手术组单纯缺血组阳性对照组人参皂苷Rg1低组人参皂苷Rg1中组人参皂苷Rg1高组F PARP-1阳性细胞数(个/高倍视野)2.20±1.32 28.30±7.10a10.90±4.41ab21.14±6.35ac16.38±7.00ab12.50±3.27ab28.270*TNFR1阳性细胞数(个/高倍视野)1.70±1.25 25.70±6.77a9.00±1.05ab16.98±4.37ac12.28±3.48ab10.40±2.84ab44.808*组别假手术组单纯缺血组阳性对照组人参皂苷Rg1低组人参皂苷Rg1中组人参皂苷Rg1高组F PARP-1灰度/ β-Actin灰度0.063 7±0.024 7 0.312 2±0.104 3a0.158 1±0.053 2b0.227 1±0.021 3a0.176 8±0.038 7ab0.153 7±0.039 8b6.931*TNFR1灰度/ β-Actin灰度0.041 3±0.010 6 0.227 3±0.083 3a0.116 1±0.041 0b0.159 8±0.028 6a0.127 5±0.023 2ab0.111 2±0.031 8b6.088*
2.5大脑皮质PARP-1、TNFR1蛋白免疫印迹表达水平的比较假手术组可见微弱的PARP-1、TNFR1阳性表达条带;单纯缺血组皮质PARP-1、TNFR1较假手术组阳性表达条带显著增强;人参皂苷Rg1低组PARP-1、TNFR1的表达均高于假手术组(均P<0.05),与单纯缺血组和阳性对照组差异均无统计学意义;人参皂苷Rg1中组高于假手术组,低于单纯缺血组(均P<0.05),与阳性对照组差异均无统计学意义;人参皂苷Rg1高组低于单纯缺血组(均P<0.05),与假手术组和阳性对照组差异均无统计学意义。见表2,图5。
3 讨论
局灶性脑缺血所引起的供血障碍可使局部脑组织发生缺血、缺氧,进一步引起组织损伤。其中在缺血半暗带表现以细胞凋亡为主;而在缺血性脑损伤的中心区则以细胞坏死为主要特征。
近年来越来越多的证据表明,某些形式的坏死是受到细胞信号通路的调控。其中以肿瘤坏死因子-α(TNF-α)所介导的信号通路尤为重要[7-8]。TNF-α所诱导的多种生理或病理过程均依赖于细胞膜表面受体TNFR1和TNFR2的参与,二者均属于TNF/神经生长因子受体超家族成员,在胞外区具有多个富含半胱氨酸的结构。以三聚体形式存在的TNF-α结合TNFR1或TNFR2,导致受体三聚化,引发下游信号转导。其中,TNF-α只有与拥有死亡结构域的TNFR1结合才能诱发细胞死亡[9]。细胞坏死的信号途径包括启动阶段、传导阶段、执行阶段三个步骤。其中启动阶段可以通过死亡受体、PARP-1的过度活化等途径介导,再经传导阶段使信号得以放大,最终在执行阶段导致细胞坏死。PARP-1作为催化ADP核糖化的细胞核酶,可在DNA损伤时激活并对DNA结合蛋白进行聚ADP核糖化修饰,但过度活化的PARP-1可作用于烟酰胺腺嘌呤二核苷酸并将其水解,导致其耗竭,最终引起细胞能量耗尽而引起细胞坏死。因此,目前PARP-1可作为检测细胞坏死的标志性因子[10]。
人参皂苷Rg1是自中药人参根、茎部分提取所得,研究证实该物质具有抗疲劳、抗衰老等神经保护作用[11-13]。文献证实,采用人参皂苷Rgl预处理后,缺血再灌注大鼠大脑皮质和海马CA1区缺血半暗带的凋亡神经细胞数量显著减少[14]。以上研究证实人参皂苷Rg1可能通过抑制细胞凋亡来发挥脑保护作用。而局灶性脑缺血早期因细胞坏死所致的脑损伤尤为严重,但是关于Rg1对于该种原因所致的细胞坏死的影响尚少见文献报道。本研究结果表明,单纯缺血组大鼠出现明显的神经功能缺陷症状,且大脑皮质的PARP-1和TNFR1表达显著增多;通过人参皂苷Rg1处理后,缺血大鼠神经功能症状得到显著改善,而大脑皮质PARP-1、TNFR1的阳性细胞数量显著减少,免疫印迹结果也证实其阳性表达量显著降低,其中以人参皂苷Rg1中、高组效果尤为明显,提示中、高剂量的人参皂苷Rg1可能通过下调脑组织PARP-1、TNFR1蛋白的表达,减少细胞坏死数量,减轻由于坏死所致的的脑损伤,从而发挥脑保护作用。但是细胞坏死的调控机制是非常复杂的,人参皂苷Rg1通过何种途径调控PARP-1和TNFR1的活性还有待于深入研究。
(图1~5见插页)
[1]Yenari MA,Han HS.Neuroprotective mechanisms of hypothermia in brain ischaemia[J].Nat Rev Neurosci,2012,13(4):267-278.doi: 10.1038/nrn3174.
[2]Christofferson DE1,Li Y,Yuan J.Control of life-or-death decisions byRIP1kinase[J].AnnuRevPhysiol,2014,76:129-150.doi: 10.1146/annurev-physiol-021113-170259.
[3]Yang GY,He XS,Wang YT.The role and significance of the neurovascular unit in the treatment of cerebral ischemia[J]Chin J Contemp Neurol Neurosurg,2011,11(2):125-131.[杨国源,贺小松,王永亭.神经血管单元在脑缺血治疗中的作用和意义[J].中国现代神经疾病杂志,2011,11(2):125-131].
[4]Huang X,Dong Y,Bey EA,et al.An NQO1 substrate with potent antitumor activity that selectively kills by PARP1-induced programmed necrosis[J].Cancer Res,2012,72(12):3038-3047.doi: 10.1158/0008-5472.
[5]Cabal-Hierro L,Lazo PS.Signal transduction by tumor necrosis factor receptors[J].Cell Signal,2012,24(6):1297-1305.doi:10.1016/j. cellsig.2012.02.006.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1): 84-91.
[7]Herson PS,Palmateer J,Hurn PD.Biological sex and mechanisms of ischemic brain injury[J].Transl Stroke Res,2013,4(4):413-419. doi:10.1007/s12975-012-0238-x.
[8]Nikoletopoulou V,Markaki M,Palikaras K,et al.Crosstalk between apoptosis,necrosis and autophagy[J].Biochim Biophys Acta,2013,1833(12):3448-3459.doi:10.1016/j.neuropharm.2013.07.036.
[9]Moriwaki K,Chan FK.RIP3:a molecular switch for necrosis and inflammation[J].Genes Dev,2013,27(15):1640-1649.doi:10.1101/ gad.223321.113.
[10]Vandenabeele P,Declercq W,Van Herreweghe F,et al.The role of the kinases RIP1 and RIP3 in TNF-induced necrosis[J].Sci Signal,2010,3(115):re4.doi:10.1126/scisignal.3115re4.
[11]Wang QY,Liu F,Wu FJ,et al.Effects of ginsenoside Rg1 on the expressions of p-eRK1/2 and p-JNK in local cerebral ischemia/reperfusion injury rats[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2013,33 (2):229-234.
[12]Comparative analysis of the neuroprotective effects of ginsenosides Rg1 and Rb1 extracted from Panax notoginseng against cerebral ischemia[J].Can J Physiol Pharmacol,2014,92(2):102-108.doi: 10.1139/cjpp-2013-0274.
[13]Qu HY,Yuan J,Bao CF,et al.Effects of Ginsenoside Rg1 on nNOS and iNOS expressions in rat brain tissue after cerebral ischemia reperfusion[J].Tianjin Medical Journal,2014,42(9):889-892.[屈惠莹,袁静,包翠芬,等.人参皂苷Rg1对脑缺血再灌注大鼠nNOS、iNOS表达的影响[J].天津医药,2014,42(9):889-892].doi: 10.3969/j.issn.0253-9896.2014.09.010.
[14]Liu X.Experiement research of Ginsenoside Rg1 on the ERK signal pathway in Cerebral Ischemic-Reperfusion(Doctoral Dissertation)[D].China:Liaoning University of Traditional Chinese Medicine,2010.[刘霞.人参皂苷Rg1对抗脑缺血再灌注ERK通路的实验研究(博士学位论文)[D].中国:辽宁中医药大学,2010].
(2014-10-17收稿2014-10-27修回)
(本文编辑陈丽洁)
Effects of ginsenoside Rg1 on PARP-1 and TNFR1 expression in rat model of focal cerebral ischemia
YU Yang1,LIU Xuezheng1△,BAO Cuifen2,LI Xiaoming3,LIU Xia3
1 Department of Human Anatomy,Liaoning Medical University,Jinzhou 121000,China;2 Key Lab of Molecular Cell Biology and New Drug Development;3 Histology and Embryolog
△Corresponding AuthorE-mail:liuxuezheng168@vip.sina.com
ObjectiveTo explore effects of ginsenosides Rg1 on the expression of poly(ADP-ribose)polymerase-1(PARP-1)and tumor necrosis factor receptor(TNFR)1 in cortex cells after focal cerebral ischemia in rats.Methods Ninety healthy rats were randomly divided into sham-operative group,focal cerebral ischemia group,ginsenoside Rg1groups (low,medium and high concentrations)and drug control group.Rats were intraperitoneally injected saline 45 mg/kg,saline 45 mg/kg+ginsenosides Rg1 10,20 and 40 mg/kg,nimodipine 1 mg/kg 5 d before surgery,respectively.Focal cerebral ischemia model was made by middle cerebral artery occluding in rats.The neurological deficit score and TTC staining were used to verify the success of the rat model.The expressions of PARP-1 and TNFR1 were evaluated by immunohistochemical method and Western blot technique.ResultsThere were obvious symptoms of neurological deficit and large pale infarct area in focal cerebral ischemia group compared with those of sham-operative group.There were higher percentages of neurological deficit score and infarct area in ginsenosides Rg1 groups and positive control group than those of sham-operative group,but which were lower than those of ischemia group(P<0.05).There were no significant differences between ginsenosides Rg1 groups and positive control group.The positive cells of PARP-1 and TNFR1 were higher in ginsenosides Rg1 low-dose group than those of sham-operative group and positive control group,while ones of medium and high-dose Rg1 group were higher than those of sham-operative group,and were lower than those of ischemia group(P<0.05).Compared with sham-operative group,PARP-1 and TNFR1 expression strips were significantly enhanced in ischemia group.Expression strips werehigher in ginsenosides Rg1 low-dose group than those of sham-operative group.Expression strips were higher in ginsenosides Rg1 medium-dose group than those of sham-operative group,but which were lower than those of ischemia group,and ones of high-dose group were lower than ischemia group(P<0.05).ConclusionGinsenoside Rg1 shows protective effects on focal ischemia injury,which may be related with down-regulation of the expression of PARP-1 and TNFR1.
GINSENOSIDE;brain ischemia;poly(ADP-ribose)polymerases;receptors,tumor necrosis factor,type I;ginsenoside Rg1;focal cerebral ischemia;PARP-1;TNFR1
R743.3
ADOI:10.11958/j.issn.0253-9896.2015.03.006
国家自然科学基金资助项目(81202783);辽宁省自然科学基金项目(2014022008);辽宁省教育厅一般项目(LR2013092)
1辽宁医学院解剖学教研室(邮编121000);2省高校分子细胞生物与新药开发重点实验室;3组织胚胎学教研室
于洋(1980),女,硕士在读,主要从事脑血管疾病防治的基础研究
△E-mail:liuxuezheng168@vip.sina.com
