糖基化改造β-葡萄糖醛酸苷酶的热稳定性
2015-08-22王小艳樊艳爽韩蓓佳冯旭东李春
王小艳,樊艳爽,韩蓓佳,冯旭东,李春,
(1天津大学化工学院,天津 300072;2北京理工大学生命学院,北京100081)
引 言
大量研究表明糖基化是调节酶活性和稳定性的关键因素,可以赋予许多蛋白质有益属性和功 能[1-4]。蛋白质经糖基修饰后能避免热力学降解,提高其热稳定性,而天然糖基化蛋白质的糖基侧链的去除会降低其热力学稳定性,从而增加蛋白质聚集的可能性[5-6]。例如,糖基化在维持组织蛋白酶E稳定性中发挥重要作用,潜在糖基化位点的去除导致了组织蛋白酶E对热和酸稳定性的下降[7]。Fonseca- Maldonado等[8]发现,毕赤酵母中重组表达的糖基修饰的木聚糖酶与大肠杆菌中表达的未发生糖基化的对照酶相比热稳定性得到显著提高。研究表明,糖基化可提高弹性蛋白酶rPAEd 在有机溶剂中的稳定性,使其在70℃时的半衰期延长至32.2 min, 与未糖基化的对照(23.1 min)相比热稳定性有了显著改善[5]。另外,由于糖链自身的亲水性,经过糖基化修饰后蛋白质的水溶性可能会发生变化,有利于一些糖蛋白的分泌[9]。由于糖基化具有赋予蛋白质有益特性和功能的潜力,近年来糖基化在蛋白质改造方面得到越来越广泛的关注。
真核生物中N-糖基化识别位点主要有N-X-T和N-X-S两种形式,研究发现N-X-T结构比N-X-S结构更容易被糖基化[10]。但很多自然界蛋白质存在自身含有的潜在糖基化位点并未被糖基修饰的现象,有研究表明,位于蛋白结构反向转角区上的糖基化位点天冬酰胺前面2~3个位置的氨基酸为苯丙氨酸时,有利于芳香族侧链和糖链的N-乙酰葡糖胺相互作用,从而提高糖基化效率,该特征氨基酸序列主要有3种形式:F-N-X-T、F-X-N-X-T和F-X-X-N-X-T,具有该特征的序列被称为EAS(enhanced aromatic sequon)序列[11-12]。而随着对糖基修饰和糖蛋白之间关系的研究,发现将N-糖链引入蛋白质适当的二级结构中能增加其结构稳定性。因此通过定点突变来减少或增加糖基化位点,对探索N-糖基化对全局糖蛋白的影响是一种有效手段。
β-葡萄糖醛酸苷酶(GUS,EC 3.2.1.31)属于糖苷酶,大部分属于糖基水解酶第二家族,它能催化各种类型的β-葡萄糖醛酸苷水解产生多种衍生物同时释放出β-葡萄糖醛酸[13]。相关研究表明,该酶可以转化甘草酸(GL)生成单葡萄糖醛酸甘草次酸(GAMG)[14-18],且与GL相比,GAMG具有极性适中、安全性更高及生物利用度更高等优点,更能满足工业生产应用的需求。前期将来自Penicillium purpurogenumLi-3菌中的β-葡萄糖醛酸苷酶在毕赤酵母中重组表达后发现其发生了糖基修饰,而经糖基修饰后的β-葡萄糖醛酸苷酶(PGUS-P)的热稳定性与野生型相比得到明显提高[19]。
考虑到糖基化对糖蛋白热稳定性的显著影响,本研究以PGUS-P为研究对象,基于结构模拟对其进行半理性设计,通过定点突变技术在该酶的氨基酸序列中引入具有EAS序列的新N-糖基化位点,并对突变酶进行活性检测和糖基化验证,同时对突变酶的催化特性和热稳定性进行分析,以期得到含有不同位点糖基化的热稳定性提高的β-葡萄糖醛酸苷酶,同时也为将来对其他工业用酶稳定性的改造提供一种新思路和理论基础。
1 实验材料与方法
1.1 菌株与质粒
表达宿主毕赤酵母P.pastorisGS115和大肠杆菌BL21(DE3)Star为本实验室自行保藏。用于分子克隆实验的克隆宿主为(E.coli)Top10购自博迈德公司,毕赤酵母和大肠杆菌的表达质粒模板为潜在糖基化位点突变了的pGAPZ-Pgus-ungly和pET28a-Pgus-ungly(图1),为实验室自行构建保存。

图1 质粒示意图 Fig.1 Schematic diagram of plasmid
1.2 酶和试剂
PCR相关试剂如rTaq DNA聚合酶等购自TaKaRa公司;凝胶回收试剂盒和质粒提取试剂盒购自北京博迈德科技发展有限公司;限制性内切酶,如BlnI、DpnI等购自TaKaRa公司。
1.3 微生物的培养
大肠杆菌的培养:采用 LB培养基,37℃,摇床转速170 r·min-1时培养12 h。
毕赤酵母P.pastorisGS115的培养:采用YPD培养基,30℃,摇床转速170 r·min-1,培养3 d。
1.4 定点突变
①以质粒为模板,利用表1中的引物克隆整个质粒,同时在目标基因上引入突变位点;②PCR产物可直接利用DpnI消化甲基化或半甲基化的模板;③将酶切产物直接转化到大肠杆菌Top10感受态细胞中;④筛选到阳性克隆、测序正确后将质粒在表达宿主中表达。

表1 引物序列表 Table 1 Primers sequence table
1.5 突变酶的表达
大肠杆菌的表达体系构建与突变酶的表达参照Merck Novagen 的pET表达系统说明书。
毕赤酵母P.pastorisGS115的表达体系构建与突变酶的表达根据Invitrogen公司pGAPZ表达载体操作手册进行操作。
1.6 重组蛋白的纯化及SDS-PAGE分析
大肠杆菌表达蛋白的纯化采用Ni Fast Flow镍柱亲和色谱柱进行;毕赤酵母表达蛋白的纯化采用Q Sepharose Fast Flow强阴离子交换柱进行;蛋白质的丙酮沉淀,向培养基中加入等体积的预冷的丙酮,轻轻混匀后,4℃,12000 r·min-1离心10 min,收集蛋白沉淀,最后加入适量的缓冲液溶解蛋白。SDS-PAGE分析,样品处理:取样品40 μl加入10 μl蛋白上样缓冲液重悬,在沸水浴中煮沸5 min后离心后取上清电泳;制胶,参考说明书配制10%的分离胶和5%的浓缩胶;电泳:初始电压控制在80 V,等样品泳过浓缩胶后将电压调节到120 V直至电泳结束;染色和脱色:将凝胶剥下后用考马斯亮蓝R250染色液染色1 h,然后用脱色液脱色,期间换脱色液1~2次,脱色充分后拍照保存。
1.7 糖蛋白PAS染色
PAS( periodic acid-Schiff’s base method)染色方法:利用品红的高碘酸-希夫试剂,通过对糖链染色来检测糖蛋白的存在。取出SDS-PAGE后的凝胶,将其在10%冰醋酸-35%甲醇溶液中浸泡1~2 h以固定蛋白条带;然后将固定后的凝胶取出用5%的冰醋酸清洗2次,每次10 min;然后把凝胶浸泡在用5%冰醋酸配制的1%的高碘酸溶液中,在4℃中黑暗条件下氧化1 h;用5%冰醋酸将凝胶漂洗几次后,用50 ml的偏重亚硫酸钠溶液(0.2 g偏重亚硫酸钠溶于100 ml 5 %冰醋酸)浸泡10 min;用Schiff试剂于4℃避光染色1 h;染色完毕后将凝胶用大量5%冰醋酸进行清洗,即可见红色糖蛋白电泳条带。
1.8 糖蛋白糖苷酶F酶法
糖苷酶F酶切条件如下:①20 µg糖蛋白在1×糖蛋白变性缓冲液中,100℃煮沸10 min,使糖蛋白变性。②加入1/10体积的10×G7缓冲液及10% NP-40。③加入1~5 μl PNase F,37℃温育1 h,将酶切后样品进行SDS-PAGE检测。
1.9 β-葡萄糖醛酸苷酶的活性测定
以硝基苯-葡萄糖醛酸苷(p-NPG)为底物的 酶活测定:取10 μl酶液加40 μl p-NPG(1.25 mmol·L-1)最适温度下反应10 min后,加入200 μl、0.4 mol·L-1的碳酸钠终止反应,用酶标仪(405 nm)检测样品溶液中对硝基苯酚的含量。β-葡萄糖醛酸苷酶活力定义:一个活力单位(U)为上述条件下,每分钟催化生成1 μmol对硝基苯酚所需的酶量。
以甘草为底物的酶活测定:取100 μl 酶液与400 μl甘草酸缓冲溶液反应,一定温度下反应一段时间后,沸水浴处理10 min使酶失活,样品与甲醇的混合比例为1:9,用HPLC检测GL、GAMG 和GA 的含量。采用高效液相色谱外标法对甘草酸、GAMG 和甘草次酸进行测定,仪器设置参数为:岛津LC-10A,色谱柱:Shim-pack,VP-ODS,检测器:SPD,检测波长:254nm,流动相:甲醇:0.6%乙酸=81:19,进样量:10 μl,流速:1 ml·min-1,柱温箱:40℃,工作站:LCsolution。β-葡萄糖醛酸苷酶活力定义为:在一定条件下,每分钟消耗1 nmol 的甘草酸所需要的酶量为一个活力单位。
1.10 突变酶催化特性的测定
温度稳定性:将β-葡萄糖醛酸苷酶液放于65℃水浴中保温,分别在不同时间间隔取样,测定剩余酶活力,以初始酶活作为参照,确定β-葡萄糖醛酸苷酶的温度稳定性。
动力学常数的测定:在最适pH条件下配制0.2、0.4、0.6、0.8、1.0和1.2 g·L-1的甘草酸溶液,取一定量的酶液与甘草酸溶液在40℃反应,10 min后,进行酶活检测。采用Lineweaver-Burk双倒数作图法计算酶动力学参数。
1.11 结构模拟分析
蛋白质结构模拟采用SWISS-MODEL进行同源建模,模板选取已经公布的大肠杆菌来源的β-葡萄糖醛酸苷酶蛋白三维晶体结构(PDB编号:3K46)[20],结构显示分析均采用PyMol软件完成。
2 结果与讨论
2.1 N-糖基化位点的设计
根据PGUS-P氨基酸序列(Genebank 登录号为EU095019),对其一级结构进行分析选取目标N-糖基化位点。首先,为提高新糖基化位点发生糖基修饰的可能性,选择最易将其突变成为具有EAS(enhanced aromatic sequence)序列特征的糖基化位点,其次兼顾改变较少氨基酸即可形成EAS序列的原则,初期选取了10个目标N-糖基化位点。
为进一步分析新设计的糖基化位点是否合理,以已经公布的大肠杆菌来源的β-葡萄糖醛酸苷酶蛋白三维晶体结构为模板(PDB编号:3K46)[20],利用SWISS-MODEL对PGUS-P的结构进行同源建模,并结合PyMOL蛋白质三维结构分析软件对PGUS-P三维结构进行展示与分析。从蛋白质二级结构上来说,糖基化在loop/turn区发生概率较高[21],进一步从初期选取的10个目标N-糖基化位点中选取位于loop/turn区的突变位点;而从蛋白质三级结构上分析,避免选取位于蛋白质亚基结合面,且靠近活性中心的序列,最终确定了3个位于蛋白质三维结构表面且远离活性中心同时位于loop/turn区的目标序列突变为EAS序列,其突变序列见表2,这3个新的糖基化位点在PGUS-P蛋白结构上的位置分布情况如图2所示。

表2 目标突变序列 Table 2 Targeted sequon
从图2中可见,1号目标突变EAS序列位于氨基酸序列的26~30之间,该段氨基酸序列位于PGUS-P三维结构中的糖基结合保守域,将其命名为PGUS-P-26;同样位于该区域的还有2号目标突变EAS序列(氨基酸序列35~39),将其命名为PGUS-P-35;而3号(命名为PGUS-P-259)则位于免疫球蛋白β-三明治状结构域。

图2 突变位点在β-葡萄糖醛酸苷酶三维结构上的位置分布 Fig.2 Location of EAS on subunit form of PGUS-P (a) [E414 and E505 (labeled in red) were two presumed activity catalytic residues] and location of EAS on tetramer form of PGUS-P (b)

图3 PGUS-P-26,PGUS-P-35和PGUS-P-259与PGUS-P蛋白结构比对 Fig.3 Structural alignment of mutant enzymes and PGUS-P (Red and yellow represent sequence before and after mutation, respectively)
为考察3个目标突变位点氨基酸的突变是否引起PGUS-P结构的改变,利用SWISS-MODEL将突变后的序列重新建模,将PGUS-P-26、PGUS-P-35和PGUS-P-259建模后的结构与PGUS-P进行叠合比对,分析新糖基化位点对β-葡萄糖醛酸苷酶本身结构的影响。叠合比对结果如图3所示,由图3可以看出,与PGUS-P结构相比,只有PGUS-P-26的氨基酸改变导致了蛋白局部结构的变化,但并未引起蛋白三级结构的变化,而PGUS-P-35和PGUS-P-259的蛋白质结构在氨基酸改变前后并未发生变化。进一步说明新设计的3个糖基化位点进行N-糖基修饰是合理可行的。
2.2 突变酶的表达及糖基化验证
选择了适度甘露糖糖链的毕赤酵母对目标突变序列进行糖基修饰的底盘宿主,同时选择了组成型分泌表达载体pGAPZa通过定点突变成功构建了3个突变酶的毕赤酵母表达体系。经培养表达后利用丙酮沉淀法对培养液上清中的蛋白进行初步浓缩,用SDS-PAGE进行检测目标蛋白是否表达,从图4的结果可以看出,3个突变酶均获得了成功表 达,突变酶蛋白条带大小均与原始PGUS-P的蛋白分子量大小相同。

图4 突变酶SDS-PAGE检测分析 Fig.4 SDS-PAGE of crude enzyme from Picha pastoris
为验证3个含有新N-糖基化位点的突变酶是否都成功引入糖基修饰,首先选择糖蛋白分析中较为常用的PAS染色。将SDS-PAGE后的凝胶进行PAS染色,从3个突变酶的PAS染色结果[图5(a)]中可以看出,PGUS-P及3个突变酶均能观察到紫红色条带,而大肠杆菌中表达β-葡萄糖醛酸苷酶PGUS-E泳道则没有紫红色条带出现。为了进一步观察目标条带的变化,将PAS染色后的凝胶重新进行考马斯亮蓝染色,结果如图5(b)所示,经蓝染后,目标位置出现明显条带,而原本无条带的PGUS-E也出现蓝色条带。以上结果可以初步确定3个突变体均成功引入糖基化修饰。
为了更进一步确认突变酶发生了糖基修饰,采用了糖苷酶F作为去糖链剂来处理目标酶样品。酶切前后样品分别进行SDS-PAGE,检测糖苷酶处理前后分子量变化,SDS-PAGE结果见图6。从结果中可以看出,3个突变酶糖苷酶F酶切前后条带均发生迁移,表明酶切后由于糖链的去除,分子量发 生了变化。酶切前大小与自身含有糖基化的PGUS-P一致,而酶切后大小则与无糖基化的PGUS-E大小保持一致,糖苷酶F酶切结果表明3个突变酶均发生了糖基修饰。

图5 突变酶的PAS染色 Fig.5 SDS-PAGE of mutants stained by PAS

图6 糖苷酶F处理前后SDS-PAGE电泳图 Fig.6 SDS-PAGE analysis of mutant enzymes treated with/without PNGase F
2.3 突变酶的催化特性分析
为检测获得的突变酶是否具有活性,对纯化得到的突变酶样品进行了以p-NPG为底物的酶活检查,如图7所示,发现不同糖基化位点比酶活呈现较大差异。PGUS-P -35的比酶活为141.5 U·mg-1,明显高于对照PGUS-P的106.1 U·mg-1,PGUS-P-259与PGUS-P相比也有所提高,为125.5 U·mg-1,而PGUS-P-26的比酶活却下降为60.07 U·mg-1。此种现象可能与发生糖基化的位点不同有关系,PGUS-P-26的突变位点的糖基修饰可能影响到了酶的正常活性导致其比酶活下降。Miller等曾报道过当把endothelial lipase(EL)的N373、N449和N471位的糖链去除后,EL的酶活降低了70%,但去除N62位的糖链,EL的酶活反而提高了5倍[22-23],也说明了不同糖基化位点对酶活的影响不同。

图7 毕赤酵母表达突变酶的比酶活测定 Fig.7 Specific activity analysis of mutant enzymes expressed in P.pastoris
利用HPLC分析考察了突变酶水解甘草酸模式(催化特异性)有无发生变化,图8显示了各突变酶水解甘草酸反应的结果。甘草酸(GL)为底物,产物为单葡萄糖醛酸基甘草次酸(GAMG)和甘草次酸(GA),三者的保留时间分别为5.2 min,11.6 min和21.3 min[24]。从图8的结果可以看出,PGUS-P-26、PGUS-P-35和PGUS-P-259对甘草酸的水解模式均未发生变化,与对照PGUS-P一样生成GAMG和GA两种产物。表明不同位点糖基化修饰不会改变β-葡萄糖醛酸苷酶的催化反应类型。该结论与江南大学余晓斌课题组报道的N-糖基化对弹性蛋白酶的底物特异性没有显著影响是一致的[5]。
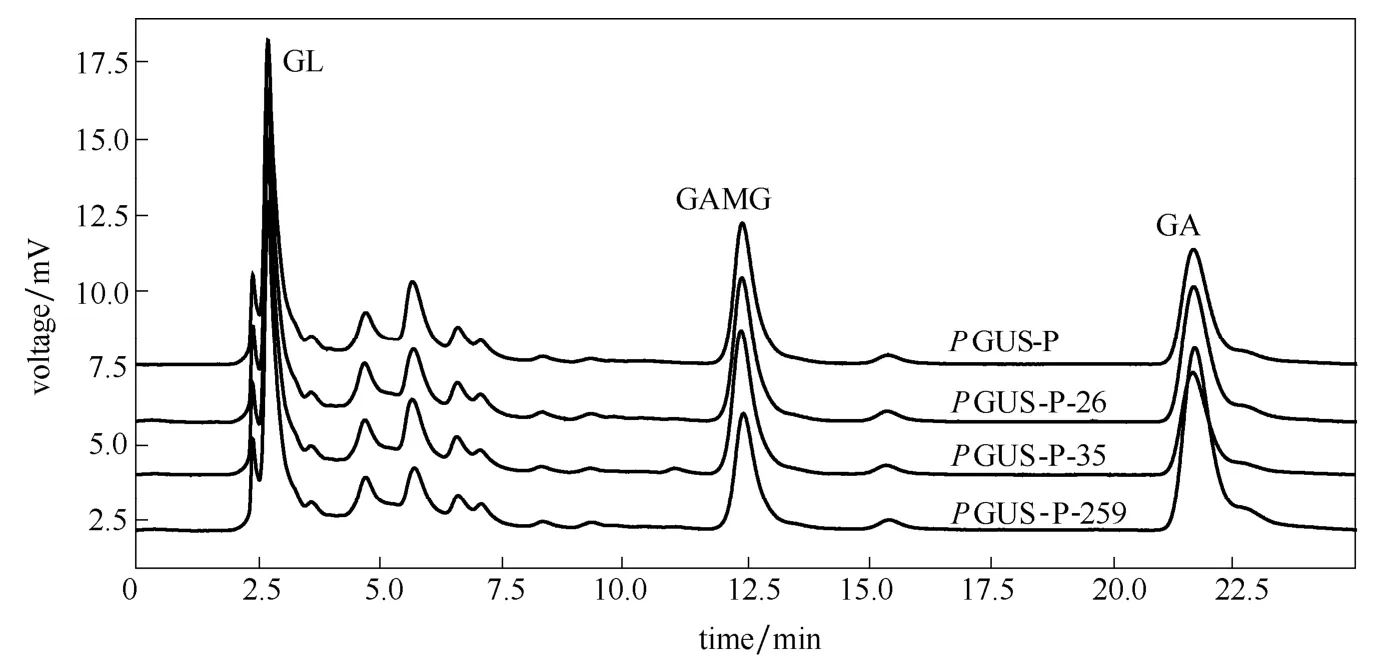
图8 突变酶水解甘草酸(GL)的模式 Fig.8 Hydrolysis of glycyrrhizin by mutant enzymes

表3 突变酶与甘草酸反应的动力学常数 Table 3 Kinetic parameters of mutant enzymes in GL hydrolysis
大多数情况下,发生了N-糖基化的蛋白质的催化特性要优于与其对应的没有被糖基修饰的蛋白,尽管有时候糖基修饰并未引起蛋白结构的显著改变[25]。糖链的添加可能通过影响酶蛋白环状结构域与催化残基的相互作用来影响酶与底物之间的亲和力[26]。为了考察新引入糖基修饰的突变酶在实际催化反应体系中的催化性质,采用Lineweaver-Burk双倒数作图法计算酶反应动力学常数(Km,Vmax,Kcat,Kcat/Km),结果如表3所示。PGUS-P-35的最大反应速率Vmax与PGUS-P相比得到提高,为120.48 μmol·(L·min)-1。三者的Km和Kcat与PGUS-P相比均减小,说明新引入的糖基化不同程度地提高了β-葡萄糖醛酸苷酶与甘草酸底物的亲和力,可能是糖基修饰使得酶蛋白空间构象更有利于底物的结合,而且3株突变酶PGUS-P-26、PGUS-P-35和PGUS-P-259的Kcat/Km与PGUS-P相比分别提高了30.1%,23.9%和12.6%,表明其催化底物甘草酸的效率同时也得到提高。
2.4 突变酶热稳定性分析
大量研究表明,N-糖基化可以提高蛋白的稳定性,其原因主要有两个:一是糖链的形成可以降低未折叠蛋白的无序度,即提高了一些未折叠的糖蛋白的稳定性;二是由于糖链本身是一些分子量较大的亲水基团,会增加蛋白的可溶性并且有利于抑制蛋白聚集体的形成[27]。另外,也有研究表明,虽然有时候一些糖蛋白的糖基化并没有显著改变蛋白的二级结构,但会减缓其热失活过程,一定程度上抑制了热变性过程中蛋白的聚集[28],这也进一步证明了糖基化可提高蛋白稳定性。为验证不同位点新引入的N-糖基化对β-葡萄糖醛酸苷酶热稳定性的影响,首先在大肠杆菌中表达了相应的含有这3个突变序列的 β-葡萄糖醛酸苷酶,分别命名为PGUS-E-26、PGUS-E-35和PGUS-E-259,然后同时考察了有糖基修饰的PGUS-P-26、PGUS-P-35和PGUS-P-259和无糖基修饰的 PGUS-E-26、PGUS-E-35和PGUS-E-259在65℃时的热稳定性。将酶液置于65℃水浴中,每隔30 min时间间隔取样,测定酶活,以保温前的酶活为对照并记为100%,测定结果如图9所示。
在65℃保温时,糖基化突变酶PGUS-P-35和PGUS-P-259的热稳定性与对照PGUS-P相比得到提高。65℃保温90 min时,二者剩余酶活力分别维持在95%和93%,而PGUS-P剩余酶活为84%左右。但PGUS-P-26在65℃ 保温90 min时的剩余酶活仅为74%左右。继续延长保温时间可以发现,PGUS-P-35,PGUS-P-259两突变体的剩余酶活下降非常缓慢,3 h后仍然保留高达85%以上的剩余酶活,而PGUS-P只保留70%以上的酶活。且糖基化系统中表达的 PGUS-P-26,PGUS-P-35和PGUS-P-259热稳定性均显著高于非糖基化系统中的表达的相应酶,上述结果表明糖基修饰提高了该酶的热稳定性。
此外,从图9(a)可以看出,PGUS-E-26与其对照PGUS-E相比提高约10%,表明该位点的氨基酸突变有利于热稳定性的提高,但糖基修饰的PGUS-P-26的热稳定性却低于对照PGUS-P,原因可能是该位点的糖基修饰影响了酶的局部结构导致其稳定性降低。而PGUS-E-35和PGUS-E-259的热稳定性与PGUS-E相比并未有显著变化趋势[图9(b),(c)],说明相应位点的氨基酸突变对稳定性影响不大,但糖基修饰的PGUS-P-35和PGUS-P-259热稳定性与对照PGUS-P相比明显提高,进一步说明二者的热稳定性提高确实是由引入的糖基化引起的。上述结果表明糖基化对β-葡萄糖醛酸苷酶的热稳定性有显著影响,且不同位点的糖基化对该酶的影响有明显差异,这与文献中报道的不同位点上的糖基化对酶具有明显不同影响的结论是一致的[8]。
3 结 论
本研究以糖基修饰作为一种新的酶稳定性改造手段,以毕赤酵母重组表达PGUS-P为研究对象,在对PGUS-P结构模拟的基础上,采用半理性设计方法对其进行糖基改性,利用定点突变方法在β-葡萄糖醛酸苷酶氨基酸序列中引入3个具有EAS序列的新N-糖基化位点,经活性检测和PAS染色及糖苷酶F酶切分析,获得了糖基修饰的突变酶PGUS-P-26、PGUS-P-35、PGUS-P-259。研究发现引入糖基化后得到了稳定性优良的两株突变酶PGUS-P-35和PGUS-P-259,65℃ 保温90 min时,二者剩余酶活力分别维持在95%和93%;而PGUS-P-26的热稳定性无明显变化,推测可能与之前模拟的该位点氨基酸的改变引起其结构的细微改变有关。此外,引入糖基化后,PGUS-P-26、PGUS-P-35和PGUS-P-259对底物甘草酸的亲和力均增加,催化效率分别提高了30.1%,23.9%和12.6%。本研究初步探究糖基化的位点对蛋白质结构以及催化特性的影响,推测位于turn/loop区的糖链的添加可能会在一定程度上影响到一些loop环的柔性,从而改变蛋白质结构的刚性。

图9 突变酶热稳定性分析 Fig.9 Thermostability analysis of mutant enzymes
[1] Skropeta D.The effect of individual N-glycans on enzyme activity [J].Bioorganic & Medicinal Chemistry, 2009, 17 (7): 2645-2653.
[2] Stengel C, Newman S P, Day J M, Tutill H J, Reed M J, Purohit A.Effects of mutations and glycosylations on STS activity: a site-directed mutagenesis study [J].Molecular and Cellular Endocrinology, 2008, 283 (1): 76-82.
[3] Liao X, Wang W, Chen S, Wu Q.Role of glycosylation in corin zymogen activation [J].Journal of Biological Chemistry, 2007, 282 (38): 27728-27735.
[4] LeBowitz J H, Grubb J H, Maga J A, Schmiel D H, Vogler C, Sly W S.Glycosylation-independent targeting enhances enzyme delivery to lysosomes and decreases storage in mucopolysaccharidosis type VII mice [J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101 (9): 3083-3088.
[5] Han M, Wang X, Ding H, et al.The role of N-glycosylation sites in the activity, stability, and expression of the recombinant elastase expressed by Pichia pastoris[J].Enzyme and Microbial Technology, 2014, 54: 32-37.
[6] Shi Yumei (石玉梅), Zheng Lei (郑磊), Li Juan (李娟).Research progress of glycosilation on protein stability [J].Progress Modern Biomedicine(现代生物医学进展), 2011, 11 (24):5190-5192.
[7] Yasuda Y, Ikeda S, Sakai H, Tsukuba T, Okamoto K, Nishishita K, et al.Role of N-glycosylation in cathepsin E [J].European Journal of Biochemistry, 1999, 266 (2): 383-391.
[8] Fonseca-Maldonado R, Vieira D S, Alponti J S, Bonneil E, Thibault P, Ward R J.Engineering the pattern of protein glycosylation modulates the thermostability of a GH11 xylanase [J].Journal of Biological Chemistry, 2013, 288 (35): 25522-25534.
[9] Anumula K I L.High-sensitivity and high-resolution methods for glycoprotein analysis [J].Analytical Biochemistry, 2000, 283 (1): 17-26.
[10] Kasturi L, Eshleman J R, Wunner, et al.The hydroxy amino acid in an Asn-X-Ser/Thr sequon can influence N-linked core glycosylation efficiency and the level of expression of a cell surface glycoprotein [J].J.Biol.Chem., 1995, 270: 14756-14761.
[11] Culyba E K, Price J L, et al.Protein native-state stabilization by placing aromatic side chains in N-glycosylated reverse turns [J].Science, 2011, 331 (6017): 571-575.
[12] Joshua L Price, David L Powers, Evan T Powers, et al.Glycosylation of the enhanced aromatic sequon is similarly stabilizing in three distinct reverse turn contexts [J].Proceedings of the National Academy of Sciences, 2011, 108 (34): 14127-14132.
[13] Odon V V, Laura A, Palomaresb E D.The role of N-glycosylation on the enzymatic activity of a Pycnoporus sanguineuslaccase [J].Enzyme and Microbial Technology, 2009, 45: 233-239.
[14] Akao T.Differences in the metabolism of glycyrrhizin, glycyrrhetic acid and glycyrrhetic acid monoglucuronide by human intestinal flora [J].Biological and Pharmaceutical Bulletin, 2000, 23 (12): 1418-1423.
[15] Feng S J, Li C, Xu X L, Wang X Y.Screening strains for directed biosynthesis of beta-d-mono-glucuronide-glycyrrhizin and kinetics of enzyme production [J].Journal of Molecular Catalysis B, Enzymatic, 2006, 43: 63-67.
[16] Kim D H, Lee S W, Han M J.Biotransformation of glycyrrhizin to 18beta-glycyrrhetinic acid-3-O-beta-D-glucuronide by StreptococcusLJ-22, a human intestinal bacterium [J].Biological and Pharmaceutical Bulletin, 1999, 22 (3): 320-322.
[17] Kuramoto T, Ito Y, Oda M, Tamura Y, Kitahata S.Microbial-production of glycyrrhetic acid 3-O-mono-β-D-glucuronide from glycyrrhizin by Cryptococcus magnusMG-27 [J].Bioscience, Biotechnology, and Biochemistry, 1994, 58 (3): 455-458.
[18] Park H Y, Kim N Y, Han M J, Bae E A, Kim D H.Purification and characterization of two novel beta-d-glucuronidases converting glycyrrhizin to 18β-glycyrrhetinic acid-3-O-beta-D-glucuronide from StreptococcusLJ-22 [J].Journal of Microbiology and Biotechnology, 2005, 15 (4): 792-799.
[19] Zou S, Xie L, Liu Y, Kaleem I, et al.N-linked glycosylation influences on the catalytic and biochemical properties of Penicillium purpurogenumβ-d-glucuronidase [J].Journal of biotechnology, 2012, 157 (3): 399-404.
[20] Wallace B D, Wang H, Lane K T, Scott J E, Orans, J, Koo J S, Venkatesh M, Jobin C, Yeh L A, Mani S, Redinbo M R.Alleviating cancer drug toxicity by inhibiting a bacterial enzyme [J].Science, 2010, 330 (6005): 831-835.
[21] Petrescu A J, Milac A L, et al.Statistical analysis of the protein environment of N-glycosylation sites: implications for occupancy, structure, and folding [J].Glycobiology, 2004, 14 (2): 103-114.
[22] Miller G C, Long C J, Bojilova E D, Marchadier D, Badellino K O, Blanchard N, Fuki I V, Glick J M, Rader D J.Role of N-linked glycosylation in the secretion and activity of endothelial lipase [J].Journal of Lipid Research, 2004, 45 (11): 2080-2087.
[23] Brown R J, Miller G C, Griffon N, Long C J, Rader D J.Glycosylation of endothelial lipase at asparagine-116 reduces activity and the hydrolysis of native lipoproteins in vitroand in vivo[J].Journal of Lipid Research, 2007, 48 (5): 1132-1139.
[24] Zou S P, Liu G Y, Kaleem I, Li C.Purification and characterization of a highly selective glycyrrhizin-hydrolyzing β-glucuronidase from Penicillium purpurogenumLi-3 [J].Process Biochemistry, 2013, 48: 358-363.
[25] Apweiler R, Hermjakob H, Sharon N.On the frequency of protein glycosylation, as deduced from analysis of the SWISS-PROT database [J].Biochim.Biophys.Acta, 1999, 1473 (1): 4-8.
[26] Nick Holmes.A splicing switch for T cells [J].Science, 2008, 321: 646-647.
[27] Imperiali B, O’Connor S E.Effect of N-linked glycosylation on glycopeptide and glycoprotein structure [J].Curr.Opin.Chem.Biol., 1999, 3 (6): 643-649.
[28] Wang C, Eufemi M, Turano C, et al.Influence of the carbohydrate moiety on the stability of glycoproteins [J].Biochemistry, 1996, 35 (23): 7299-9307.
