铁粉还原脱除电解锰阳极液中的硒
2015-08-22王雨红吕艳农敬义蓝姿柳蒋佳鸾粟海锋
王雨红,吕艳,农敬义,蓝姿柳,蒋佳鸾,粟海锋
(广西大学化学化工学院广西高校资源化工应用新技术重点实验室,广西 南宁 530004)
引 言
目前,国内电解锰工业广泛采用二氧化硒作为添加剂,可以显著提高锰电解的电流效率,并具有良好的抗氧化效果[1]。每生产1 t电解锰需消耗 0.9~2.5 kg的二氧化硒[2],其中60.7%由产品带走,22.3%进入阳极泥,17.0%随锰阳极液带走[3]。阳极液被送回锰矿浸出工序作为浸出剂循环使用,经压滤分离后,约85%的硒随锰渣带走损失掉,不仅造成硒资源的浪费,而且水溶态的硒酸盐及亚硒酸盐有剧毒,给周边环境留下严重的污染隐患[4]。硒的价格昂贵,而中国是一个贫硒国家,硒产品绝大部分依赖于进口。国内每年硒消费量约占全球总消费量的60%,其中电解锰行业是硒最大的需求领域。因此,研究电解锰阳极液中硒的脱除及回收具有重要的经济价值与环保意义。
近年来,研究溶液中硒的脱除方法主要包括还原沉淀、共沉淀、物理吸附、光催化还原、离子交换法、生化法、萃取法、电化学法等[5]。其中,共沉淀法适用于原水中的Se(Ⅳ)脱除,但经沉淀后的物质杂质较多,对硒回收不利[6-7]。离子交换法、物理吸附法脱硒过程中,受硫酸根、氯离子及重金属离子的影响大,且解吸出来的硒溶液浓度不高,缺乏回收价值[8-10]。生物法处理时间长,占地面积大[11-12]。电化学法、光催化还原法脱硒过程中设备投资大、能耗高[13-14]。在酸性条件中,还原性物质如SO2、铁粉、铝粉、钛粉、亚铜离子等,能够把溶液中的硒酸盐和亚硒酸盐还原成单质硒,再通过压滤或者沉淀可回收硒[15-18]。Ling等[16]采用纳米铁粉处理水中的Se(Ⅳ),发现Se(Ⅳ)转移与转化过程经扩散、还原、沉积及表面缺陷影响4个步骤,形成Se(Ⅱ)和Se(0)。Sivan等[19]研究了酸性条件下曝气对铁粉还原Se(Ⅵ)的作用机理,发现曝气可以降低酸耗和污泥的产生量,提高硒的脱除率。Tang等[20]研究了Mn2+、Co2+对铁粉还原浸出Se(Ⅵ)的促进作用,Se(Ⅳ)及Se(0)为主要产物。
电解锰阳极液成分复杂,溶液中含有一定量的硫酸、硫酸铵和硫酸锰等物质,且硒含量较低(约10 g·m-3),需处理的阳极液量也很大;同时,还要考虑在分离回收硒的过程中不能给阳极液的循环使用带入难以脱除的杂质,以免影响电解锰的生产。因此,硒的回收难度较大。由于铁粉具有较强的还原能力,且在脱硒过程中未反应掉的铁粉及Fe2+随阳极液循环进入锰矿浸出工序能强化锰矿的浸出。因此,本研究采用铁粉为还原剂脱除电解锰阳极液中的硒,通过考察搅拌速度、铁粉用量、硫酸用量、反应温度及反应时间等因素对硒脱除速率及铁粉溶出率的影响,得到脱硒过程的动力学参数,并通过XRD及SEM初步分析反应机理,其研究结果可为锰阳极液中硒的回收利用提供基础数据和理论指导。
1 实验材料和方法
1.1 材料
实验所用电解锰阳极液取自广西大新某电解锰企业,其化学成分见表1。在使用前,对样品进行过滤去除固体杂质。

表1 电解锰阳极液的化学组成 Table 1 Chemical composition of EM anolyte sample
还原铁粉(Fe),粒径为<0.15 mm,含铁量大于98%;硫酸(H2SO4),分析纯,广东西陇化工有限公司;二氧化硒(SeO2),分析纯,广东西陇化工有限公司;其他试剂均为分析纯,水为去离子水。
1.2 仪器与装置
主要实验仪器:Rigaku D/MAX2500 V型X射线衍射仪,日本理学公司;S-3400N扫描电子显微镜(SEM),日本日立公司;JP-303型极谱分析仪,成都仪器厂;S212恒速搅拌器,上海申顺生物科技有限公司;DKB-501S超级恒温水槽,上海精宏实验设备有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;AB104-N电子分析天平,梅特勒-托利多仪器有限公司。
实验装置如图1所示。包括超级恒温水浴、变频无级调速的机械搅拌浆。动力学实验在置于水浴中的三口烧瓶中进行。三口烧瓶一侧装有冷凝管防止水分蒸发,一口装有温度计及取样器。
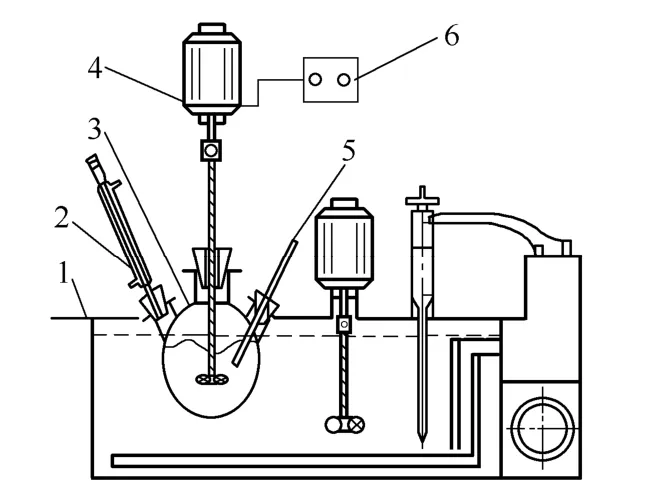
图1 实验装置示意图 Fig.1 Schematic diagram of experimental apparatus
1.3 分析方法
溶液总硒含量采用极谱法测定[21];铁含量采用邻二氮杂菲光度法[21];硫酸浓度采用酸碱滴定法分析[21]。反应后滤渣采用X射线多晶衍射仪(XRD)、扫描电镜(SEM)分析颗粒形貌、粒度、物相组成。
1.4 实验方法
动力学实验在1000 ml三口烧瓶中进行,取500 ml电解锰阳极液及一定量的硫酸加入到三口烧瓶中,开启搅拌装置,待溶液温度达到设定值后,加入一定量的还原铁粉,开始计时,定期取样分析,测定相应时刻溶液总硒浓度CSe及总铁浓度CFe,计算总硒脱除率ηSe及铁的溶出率ηFe,其计算公式如式(1)所示。

式中,ηSe/Fe表示总硒脱除率或铁的溶出率,%;表示硒或铁的初始浓度,mg·L-1;CSe/Fe表示反应到某一时刻溶液中硒或铁的浓度,mg·L-1。
2 实验结果与讨论
2.1 搅拌速度的影响
固定温度为30℃,铁粉用量100 mg·L-1,研究了不同搅拌速度对硒脱除率和铁溶出率的影响,结果如图2所示。
从图中可以看出,随着搅拌速度的增加,硒的脱除率及铁溶出率不断增加,当搅拌速度在300~600 r·min-1时,两者变化并不明显。分析其原因,加大搅拌速度可以促进铁粉的分散,减少与酸反应而结块的可能,增加了溶液中、与铁粉接触的机会,且增加搅拌强度,液相湍动强度增加,液膜减薄,传质速率增加,反应加快。同时可以看出,硒的脱除反应在前60 min基本完成,图2 (b)中铁粉溶出率以反应至第60 min为界限,前60 min主要为铁与及硫酸的竞争反应为主,后期为铁与硫酸反应为主。而在硫酸浓度远远大于铁粉理论反应所需酸度的情况下,反应120 min后铁粉溶出率仅达到66%左右,可以推测铁粉由于硒产物层的包裹而导致酸与铁接触不充分[16],导致溶出过程缓慢。综上所述,为了消除外扩散的影响,搅拌速度选择600 r·min-1。
2.2 铁粉用量的影响

图2 搅拌速度对脱除过程的影响 Fig.2 Effect of stirring speed on removing process
固定搅拌速度为600 r·min-1,反应温度为 30℃,研究不同铁粉用量下硒脱除率和铁溶出率随时间变化曲线,结果如图3所示。从图3中可以看 出,硒脱除率随着铁粉用量增加而增加,且当铁粉用量大于300 mg·L-1时,硒脱除率在很短时间内(≤20 min)能达到90%以上,铁粉用量为400 mg·L-1,反应30 min硒脱除率达到100%。由于铁粉脱除溶液中硒的反应主要发生在铁的表面[22],因此,增加铁粉用量相当于增大铁的表面积,增大了溶液中、与铁反应的机会,因而硒的脱除率也就越高。图3 (b)中铁粉溶出率在铁粉用量大于200 mg·L-1时变化不大,略有下降,在铁粉用量为50 mg·L-1时,铁粉溶出率较高,反应120 min达到约76%左右,但继续延长时间,铁的溶出率不发生变化,可以推测铁粉用量少时,结块现象并不明显,铁的溶出率高。同时对各反应时间点的Fe2+、Fe3+浓度进行检测,发现反应过程中Fe3+一直未被检出,可以推断该过程还原机理如式(2)~式(6)所示[16,18-19],少量生成的Fe3+被还原成Fe2+。


图3 铁粉用量对脱除过程的影响 Fig.3 Effect of dosage of Fe on removing process

2.3 硫酸用量的影响
固定搅拌速度为600 r·min-1,反应温度为 30℃,铁粉用量100 mg·L-1。由于锰阳极液中硫酸浓度达到33.10 g·L-1,且含有13.56 g·L-1的锰离子,调低酸度会造成锰离子的沉降,带走部分硒,导致结果不准确,且阳极液在用于浸出锰矿时要将酸度提高到80 g·L-1[23],因此本研究主要考虑在锰阳极液本身酸度基础上添加0~50 g·L-1硫酸,考察硫酸用量对硒脱除率、铁溶出率影响及余酸随时间变化,结果如图4所示。
从图4中可以看出,随着硫酸用量的增加,硒的脱除率不断下降,且铁粉的溶出率也有所下降,然而通过检测不同酸度条件下余酸浓度,发现余酸的消耗量基本一致,可以推测,由于硫酸的加入,铁粉颗粒与硫酸分子接触的机会增大,造成铁粉表面出现局部钝化现象,降低了其与、接触的机会,从而导致硒的脱除率降低,铁的溶出率略有下降。因此,在脱除锰阳极液中硒的过程中, 以不额外添加硫酸为宜。
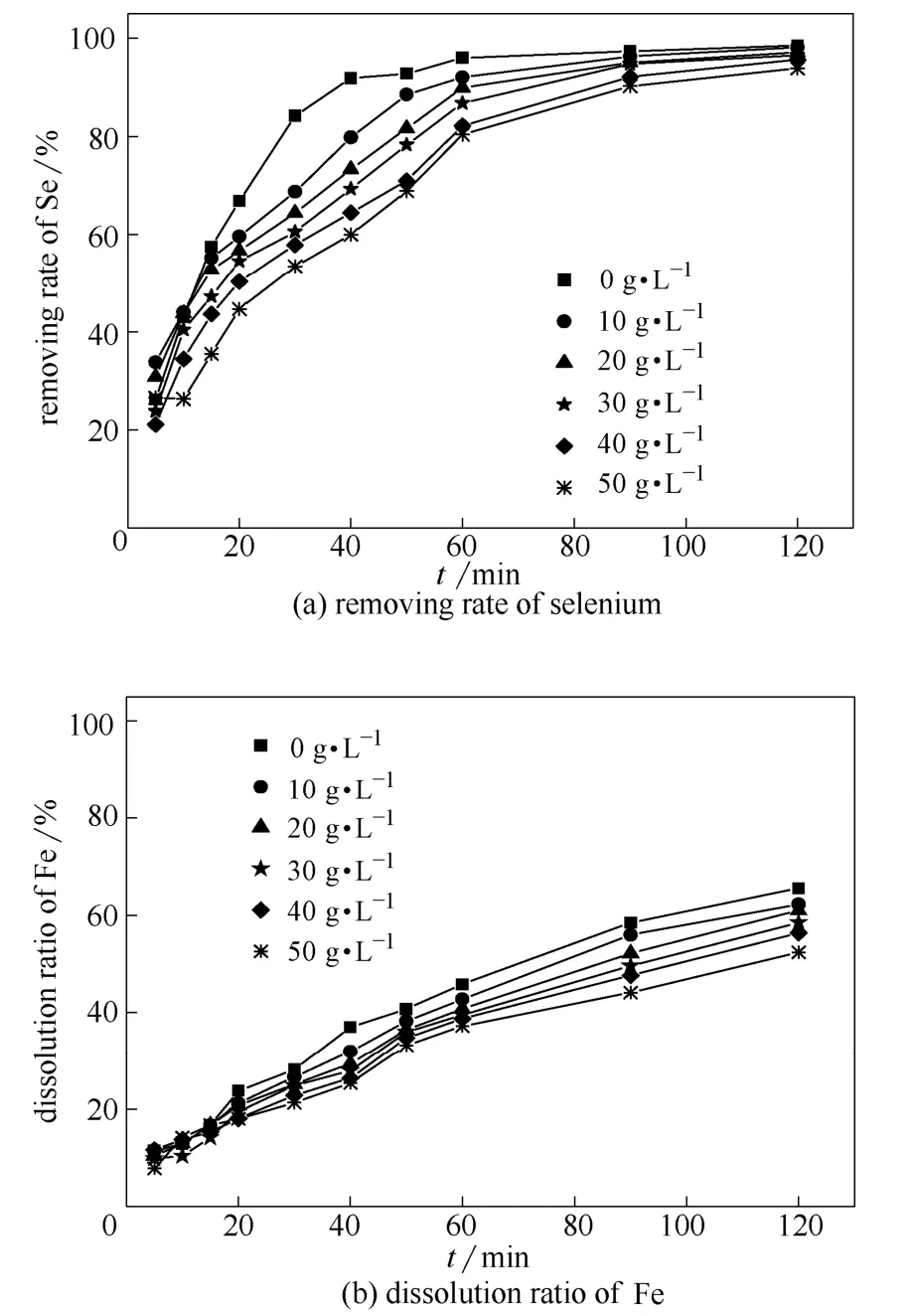
图4 硫酸用量对脱除过程的影响 Fig.4 Effect of concentration of sulphric acid on removing process
2.4 温度的影响
固定搅拌速度为600 r·min-1,铁粉用量100 mg·L-1,研究不同反应温度下硒脱除率和铁溶出率随时间变化曲线,结果如图5所示。
从图5中可以看出,随着温度升高,硒的脱除速率加快,90℃反应15 min,硒的脱除率达到90%以上,50 min时脱除率达到100%。通过观察溶液颜色,发现温度越高,溶液变红的速率越快,90℃时迅速变成血红色,进而转变为灰黑色,20 min时又恢复回锰阳极液本身颜色,推测在此温度下,生产的硒单质由红硒转变为灰硒。从图5(b)可看出,90℃反应60 min后,铁的溶出率达到90.13%,这是因为反应温度的升高能够增大体系的活化能,加快分子运动,增加分子碰撞机会,促进反应的发生。同时,从图5(b)中可以发现,90℃反应60 min后铁的溶出率不发生改变,推测其可能被产物层包裹或与硒生成其他物质而不被酸溶解。

图5 温度对脱除过程的影响 Fig.5 Effect of temperature on removing process
分别对30℃和90℃反应180 min的固体产物进行XRD及SEM图谱分析,结果见图6和图7。从 图6(a)可知,在30℃反应的固体产物晶型毛刺较多,存在Se、Fe、FeSe2、Fe2(SeO4)34种物相,图7(a)中可以看到硒结晶形态为纺锤形的红硒[24]。而90℃反应的固体产物晶型发育较好,硒峰明显增强,产物中只存在Se和FeSe2两种物相,即锰阳极液中的硒还原成Se(Ⅰ)和Se(0)两种形式[16],通过图7(b)可以看出,硒结晶形态为球形的灰硒[15]。
2.5 动力学分析
由于铁粉具有较大的表面积,吸附能力强,能够在表面形成一层电解质层,因此,其参与的置换反应过程大多属于扩散控制机理,假设动力学数据服从一级反应速率规律,本实验过程可用Ginstling-Brounshtein方程进行拟合[式(7)][25]。


式中,c(Se)表示反应时间为t时Se的浓度,mol·L-1;c0(Se)表示Se的初始浓度,mol·L-1;x表示硒的脱除率;t表示反应时间,min;D表示Se 的扩散系数;s表示反应物的表面积;V表示溶液的体积,ml;δ表示扩散层厚度,μm;k表示反应速率常数。

图6 固体产物的XRD谱图 Fig.6 XRD patterns of solid product

图7 固体产物的SEM图谱 Fig.7 SEM graph of solid product
采用式(8)处理图5中数据,结果见图8,其皆为直线关系,相关系数R2分别是0.994(30℃)、0.997(45℃)、0.993(60℃)、0.997(75℃)、0.999(90℃),说明式(8)能在一定程度上描述铁粉置换锰阳极液中的硒的动力学过程,符合一级反应速率规律。通过计算获得相应温度的表观速率常数k(各直线斜率)分别为0.05547、0.06075、0.07441、0.09539、0.16118,即k值随着温度的升高而增大,说明提高反应温度会加快硒的脱除速率。
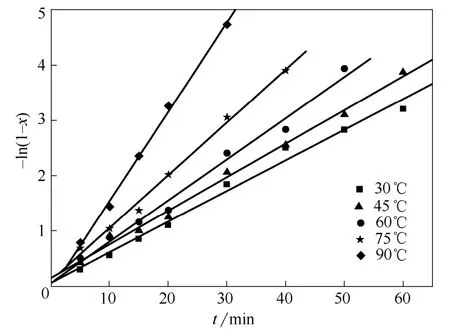
图8 不同温度下硒脱除动力学数据 Fig.8 Removing kinetics data of selenium at different temperature
将图8中得到的不同温度下浸出过程的表观速率常数k,代入Arrhenius方程的对数形式中,得

以lnk与1/T作图(图9),分别拟合数据,得到总锰浸出的方程为:ln k=-1 916.6/ T+ 3.3541,方程的相关系数为0.978,可求得硒脱除的表观活化能Ea为15.94 kJ·mol-1。从活化能的数值来看,该反应过程属于扩散控制。
3 结 论
本文主要研究铁粉还原脱除电解锰阳极液中硒的过程机理,在实验范围内,可得如下主要结论。
(1)加大搅拌速度可以有效地促进铁粉的分散,减少与酸反应而结块的可能,消除反应过程中液膜阻力,提高硒的脱除率,并能促进铁的溶解。而随着硒产物层的形成,将包裹未反应的铁粉,导致铁粉溶出率仅66%左右。

图9 lnk-1/T关系 Fig.9 Relationship between lnkand 1/T
(2)增大铁粉用量可以显著提高硒的脱除速率,使硒的脱除率在反应30 min时即达到100%。但随着铁粉用量的增大,铁粉的溶出率降低。反应过程中并未检测出Fe3+,可能是溶液中存在的Fe迅速将其还原为Fe2+。过多的硫酸将导致铁粉表面局部钝化,使硒的脱除率及铁的溶出率均降低。
(3)提高反应温度能加快硒的脱除速率。不同的反应温度条件下生成的产物及结构各不相同,低温下以生成纺锤形的红硒为主,从XRD可以发现仍有部分铁粉没有参加反应,而高温下生成球形的灰硒,产品晶形发育较好,铁的溶出率较高,反应完成后的渣中铁只以FeSe2形式存在,此时,阳极液中的硒还原成Se(Ⅰ)和Se(0)两种形式。
(4)该反应过程受固体产物层扩散控制,动力学过程符合一级反应速率规律,表观活化能为15.94 kJ·mol-1。
符 号 说 明
CSe/Fe——反应到某一时刻溶液中硒或铁的浓度,mg·L-1
c(Se)——反应时间为t时Se的浓度,mol·L-1
c0(Se)——Se的初始浓度,mol·L-1
D——Se的扩散系数
Ea——表观活化能,kJ·mol-1
k——反应速率常数
S——反应物的表面积
T——热力学温度,K
t——反应时间,min
V ——溶液的体积,ml
x ——硒的脱除率,%
δ ——扩散层厚度,μm
ηSe/Fe——总硒脱除率或铁的溶出率,%
[1] Lu Jianming, Dreisinger David, Glück Thomas.Manganese electrodeposition—a literature review [J].Hydrometallurgy, 2014, 141: 105-116.
[2] Jiang Linhua (降林华), Duan Ning (段宁), Wang Yunyu (王允雨), Luo Le (罗乐), Zhao Chunguo (赵纯国).Analysis of selenium pollution in China and the control of electrolytic manganese metal industries [J].Environment Science & Technology(环境科学与技术), 2011, 34 (12H): 393-396.
[3] Duan Ning, Wang Fan, Zhou Changbo, Zhu Chunlei, Yu Hongbing.Analysis of pollution materials generated from electrolytic manganese industries in China [J].Resources,Conservation and Recycling, 2010, 54: 506-511.
[4] Sun Yan, Tian Xike, He Binbin, Yang Chao, Pi Zhenbang, Wang Yanxin, Zhang Suxin.Studies of the reduction mechanism of selenium dioxide and its impact on the microstructure of manganese electrodeposit [J].Electrochimica Acta, 2011, 56: 8305-8310.
[5] Grigori Zelmanov, Raphael Semiat.Selenium removal from water and its recovery using iron (Fe3+) oxide /hydroxide -based nanoparticles sol (NanoFe) as an adsorbent [J].Separation and Purification Technology, 2013, 103: 167-172.
[6] Hu Chengzhi, Chen Qingxin, Chen Guixia, Liu Huijuan, Qu Jiuhui.Removal of Se(IV) and Se(VI) from drinking water by coagulation [J].Separation and Purification Technology, 2015, 142: 65-70.
[7] Staicu Lucian C, van Hullebusch Eric D, Oturan Mehmet A, Ackerson Christopher J, Lens Piet N L.Removal of colloidal biogenic selenium from wastewater [J].Chemosphere, 2015, 125: 130-138.
[8] Mavrov V, Stamenov S, Todorova E, Chmiel H, Erwe T.New hybrid electrocoagulation membrane process for removing selenium from industrial wastewater [J].Desalination, 2006, 201 (1/2/3): 290-296.
[9] Chubar N.New inorganic (an) ion exchangers based on Mg-Al hydrous oxides: (alkoxide-free) sol-gel synthesis and characterisation [J].Journal of Colloid and Interface Science, 2011, 357: 198-209.
[10] Li Dong (李栋), Xun Runze (徐润泽), Xu Zhipeng (许志鹏), Guo Xueyi (郭学益).Research development of selenium resource and its extraction technology [J].Nonferrous Metals Science and Engineering(有色金属科学与工程), 2015, 6 (1): 18-23.
[11] Rashmi Ranjan Mishra, Sunita Prajapati, Jyotirmayee Das, Tushar Kanti Dangar, Nigamananda Das, Hrudayanath Thatoi.Reduction of selenite to red elemental selenium by moderately halotolerant Bacillus megateriumstrains isolated from Bhitarkanika mangrovesoil and characterization of reduced product [J].Chemosphere, 2011, 84 (9): 1231-1237.
[12] Hageman Simon P W, van der Weijden Renata D, Weijma Jan, Buisman Cees J N.Microbiological selenate to selenite conversion for selenium removal [J].Water Research, 2013, 47: 2118-2128.
[13] Malgorzata Szlachta, Natalia Chubar.The application of Fe-Mn hydrous oxides based adsorbent for removing selenium species from water [J].Chemical Engineering Journal, 2013, 217: 159-168.
[14] Nguyen V N H, Beydoun D, Amal R.Photo-catalytic reduction of selenite and selenate using TiO2photo-catalyst [J].J.Photochem.Photobiol.A: Chem.2005, 171: 113–120.
[15] Zheng Yajie (郑雅杰), Chen Kunkun (陈昆昆), Sun Zhaoming (孙召明).Recycling Se and Te and capturing Pt and Pd from solution after precipitation gold by SO2reduction [J].The Chinese Journal of Nonferrous Metals(中国有色金属学报), 2011, 21 (9): 2258-2264.
[16] Ling Lan, Pan Bingcai, Zhang Weixian.Removal of selenium from water with nanoscale zero-valent iron: mechanisms of intraparticle reduction of Se(IV) [J].Water Research, 2015, 71: 274-271.
[17] Mohammad Mokmeli, David Dreisinger, Berend Wassink.Modeling of selenium and tellurium removal from copper electrowinning solution [J].Hydrometallurgy, 2015, 153: 1-11.
[18] Peng Libing (彭立兵), Lin Bonan (林柏楠).The methods of removal selenium from water[P]: CN, 201180011304.2.2013-01-16.
[19] Sivan Klas, Donald W Krik.Understanding the positive effects of low pH and limited aeration on selenate removal from water by elemental iron [J].Separation and Purification Technology, 2013, 116: 222-229.
[20] Tang Cilai, Huang Yong H, Zeng Hui, Zhang Zengqiang.Promotion effect of Mn2+and Co2+on selenate reduction by zero-valent iron [J].Chemical Engineering Journal, 2014, 244: 97-104.
[21] Mei Guanggui (梅光贵), Zhang Wenshan (张文山), Zeng Xiangbo (曾湘波), Zeng Kexin (曾克新), Li Guangming (李广明), Shi Chaojun (石朝军), Li Jifa (李基发), Jiang Taiqian (蒋太钱).Technology of China Manganese Industry[M].Changsha: Central South University Press, 2012: 720-729.
[22] Zhao Yaguang (赵雅光), Wan Junfeng (万俊峰), Wang Jie (王杰), Yu Fei (余飞), Wang Yan (王岩).Removal of arsenite from aqueous environment by zero-valent iron (ZVI) [J].CIESC Journal(化工学报), 2015, 66 (2): 730-737.
[23] Zhang Wensheng, Cheng Chuyong.Manganese metallurgy review (Ⅰ): Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide [J].Hydrom Etallurgy, 2007, 89: 137-159.
[24] Zhang Jiafeng (张佳峰), Zhang Bao (张宝), Guo Xueyi (郭学益), Zou Danqing (邹丹青), Shen Chao (沈超), Li Qian (李倩).Study on crude selenium purifying by a sulfite sodium leaching method [J].Rare Metal Materials and Engineering(稀有金属材料与工程), 2011, 40 (1): 121-125.
[25] Wu Shaohua (吴绍华), Liu Chunyan (刘春艳), Lan Yaozhong (兰尧中).Kinetic study on cementation of bismuth from solution using iron powder [J].Hydrometallurgy of China(湿法冶金), 2007, 26 (3): 139-142.
