2,5-二芳基-1,3,4-噻二唑衍生物的合成及缓蚀性能
2015-08-20钱建华潘晓娜张强刘琳
钱建华,潘晓娜,张强,2,刘琳
(1 渤海大学功能化合物的合成及应用辽宁省重点实验室,辽宁 锦州 121000; 2 中国科学院大连化学物理研究所,辽宁 大连 116023)
引 言
出厂合格的喷气燃料在储存、运输过程中相继出现银片腐蚀不合格现象,严重影响喷气燃料的质量和使用。经实验发现,喷气燃料不合格的主要原因是活性硫的存在。研究表明[1-2],微量的活性硫就会造成银片严重腐蚀。添加缓蚀剂作为防腐技术的方法之一,因具有高效、添加量少、经济、操作简单等优点,从而被广泛应用于金属防护方面[3-4]。缓蚀剂的缓蚀效率不仅仅由缓蚀剂分子的物理性质、化学性质和电子性质(包括官能团、分子尺寸、供电子原子电子云密度等)决定的,还与环境因素(如自然环境、金属表面电荷和腐蚀介质的类型等)有关[5-6]。作为缓蚀剂的有机化合物分子中大都具有杂原子,如S、N、P、O,或多重键,或芳香环,使得在缓释过程能更容易发生吸附[7]。吸附是通过缓蚀剂分子中的孤对电子或π-轨道与金属表面原子空的d-轨道之间的相互作用。
近年来理论计算化学(量子化学计算和分子动力学模拟)已被广泛应用于解释缓蚀剂缓蚀机 理[8-9]。自从1976年Vosta 等[10]首次利用量子化学计算研究缓蚀剂的缓蚀机理之后,研究人员就开始致力于研究缓蚀效率和量子化学参数之间的关系,以便于设计新型高效的缓蚀剂。与量子化学计算相比,分子动力学模拟因其可以在分子水平上研究较大的系统和解释在金属表面缓蚀剂的吸附特性,而逐渐成为一种更佳的研究手段。
本文通过理论与实验相结合的方法研究2,5-二芳基-1,3,4-噻二唑的缓蚀性能与缓蚀机理。首先,合成4 种噻二唑衍生物。利用电化学测试方法和表面分析技术对4 种缓蚀剂在50 mg·L-1硫-乙醇体系中的缓蚀性能进行研究。采用吸附动力学分析4种缓蚀剂在金属表面的吸附行为,并计算其吸附Gibbs 自由能。通过量子化学计算和分子动力学模拟解释4 种噻二唑衍生物的缓蚀效率与其分子结构之间的关系,并对4 种缓蚀剂的缓蚀效率进行了比较。
1 实验部分
1.1 缓蚀剂的合成及表征
1.1.1 实验材料与仪器 单质硫,无水乙醇,苯甲醛,水杨醛,间羟基苯甲醛,对羟基苯甲醛,80%水合肼,36% 浓HCl,氢氧化钠,以上试剂均为分析纯度,且实验前均未经过特殊处理。
原子力显微镜(XE-70,Park Systems),扫描电子显微镜(Hitachi S-4800,Japan),液相色谱/质谱联用仪(1100SeriseLC/MSD VL ESI,美国安捷伦公司),核磁共振光谱仪(400/54Premium Shielded NMR Magnet System,美国安捷伦公司),电化学工作站(PGSTAT302N,瑞士万通中国有限公司),接触角测定仪(JC2000C1,上海中辰数字技术设备有限公司)。
1.1.2 噻二唑衍生物的合成 根据文献[11]合成噻二唑衍生物,合成路线如图1 所示。将芳基醛(0.02 mol)、单质硫(0.01mol)、水合肼(0.08 mol)溶于20 ml 乙醇中,并于钢制反应釜中,加热到150℃,反应12 h,然后自然冷却,再减压条件下蒸发溶剂。
将残留部分用氯仿溶解,然后用浓的硫化钠溶液(除去大多数的硫)、水洗涤,无水硫酸镁干燥,过滤,旋转蒸发,乙醇重结晶,得产物DPTD。
将剩余部分(反应12 h,冷却,减压蒸发溶剂后剩下的部分)用乙醇稀释,过滤除去过量的单质硫,将乙醇减压蒸发,将残余部分加入50 ml 20% NaOH 溶液中,过滤,滤液中加入36% HCl 酸化,然后由沉淀析出,抽滤,固体用乙醇重结晶,得目标产物n-DHPTD(n=2,3,4)。

图1 噻二唑衍生物的合成路线Fig.1 Synthetic route of thiadiazole derivatives
1.2 缓蚀性能测试
1.2.1 动电位极化曲线法 在未添加和添加缓蚀剂的溶液中进行电化学测试,电化学测试采用三电极体系,银电极为工作电极,铂电极为对电极,Ag/AgCl 电极为参比电极。测试前对银片试样用1500#和2000#的SiC 砂纸打磨银片(逐级打磨),除去银表面的氧化层,再依次用丙酮、蒸馏水、乙醇冲洗,冷风干燥,备用。待开路电位稳定后进行极化曲线测试,动电位极化曲线采用扫描速率为0.01 mV·s-1,扫描电位-0.6~0 V(相对参比电极)。
1.2.2 电化学阻抗法 电化学阻抗(EIS)测试,采用的频率扫描范围为100 kHz~0.01 Hz,振幅为0.01 V,将预处理的电极浸于添加与未添加缓蚀剂的溶液中30 min 后进行电化学阻抗测试,以上电化学测试均是在室温条件下进行,测试结果均采用NOVA 1.8 软件进行数据分析。
2 计算方法
2.1 量子化学计算
采用Materials Studio 6.0 软件包构建4 种噻二唑分子的初始构型。采用DMol3模块[12],运用密度泛函理论(DFT)中的广义梯度GGA/PBE 方法,计算各分子的前线轨道分布,用于分析分子结构与缓蚀剂缓蚀性能之间的关系[13-14]。
2.2 分子动力学模拟
用Materials Studio 6.0 软件包中Discover 模块进行分子动力学模拟[15],模拟研究选取Ag(111)晶面为表面,因为这个晶面具有稳定的性质。Ag(111)晶面首先由Ag 晶胞“cleave”,再用“smart minimizer method”优化,然后再用“supercell”增大表面,从而构建出一个11 层的Ag(111)表面,添加真空层,真空度选为零。再利用Amorphous Cell 模块建构只包含一个缓蚀剂的中间层,最后采用“build layer”工具将两个独立结构构建在一起,构建过程中“layer 2”上方添加一个3 nm 的真空层。“layer”完成后,固定Ag(111)表面两层以下的原子,然后用Discover模块中Dynamic 进行动力学计算。模拟过程采用compass 力场对体系优化,选取模拟温度为298 K,NVT 系综,Andersen 恒温器条件下,模拟时间步长为0.1 fs,模拟时间为100 ps。表面吸附能与缓蚀剂分子和Ag(111)表面之间的关系计算公式为[16]

式中,Eadsorption为吸附能;Emolecule是自由分子的能量;Esurface是未吸附分子时金属表面的能量;Etotal是包含一个分子和金属表面体系的总能量。缓蚀剂与Ag(111)表面的结合能的值为吸附能的相反数,即

3 结果与讨论
3.1 噻二唑衍生物的合成及结构表征
采用一锅缩合法合成2,5-二芳基-1,3,4-噻二唑及其衍生物,反应过程较简单,转化率较高,产率在80%~95%,其质谱数据和产率列于表1,表2为4 种缓蚀剂的氢质子核磁共振谱,由表可知合成的4 种物质均为目标产物,且4-DHPTD 产率最大,2-DHPTD 产率最小,这可能是由于苯环取代基在关环时位阻较大造成的。

表1 噻二唑衍生物的特征数据Table 1 Characterization data of thiadiazole derivatives
3.2 电化学测试
3.2.1 动电位极化曲线测试结果 银片在未添加和添加不同浓度缓蚀剂的溶液中的Tafel 极化曲线如图2 所示。通过Tafel 外推法得到相关动力学参数,如腐蚀电流密度(icorr)、阳极极化曲线斜率(βa)和阴极极化曲线斜率(βc),并列于表3。表3 中,缓蚀效率IE(%)的计算公式为

从图2 和表3 可以看出,随着缓蚀剂的浓度不断增大,其缓蚀效率IE 不断增大,当缓释剂浓度为80 mg·L-1时,缓蚀效率达到90%以上;而继续增大缓蚀剂的浓度,缓蚀效率变化不大,这可能是因为随着缓蚀剂的浓度不断增大,缓蚀剂在银表面的吸附趋于平衡,再继续增大缓蚀剂浓度,缓蚀效率也不会变化很大。从动电位极化曲线的实验结果可以看出,4 种噻二唑衍生物的缓蚀效率大小顺序为:4-DHPTD>3-DHPTD>2-DHPTD>DPTD,说明取代基苯环上有羟基时会增大噻二唑衍生物的缓蚀性能,但是羟基的位置对其缓蚀性能也有影响,即对位>间位>邻位。

表2 2,5-二芳基-1,3,4-噻二唑的1H NMR 数据Table 2 1H NMR data (d values, dimethyl-d6 sulfoxide) for 2,5-diaryl-1,3,4-thiadiazoles

图2 银在未添加和添加不同浓度缓蚀剂溶液中的动电位极化曲线Fig.2 Tafel polarization curves for silver strip corrosion in 50 mg·L-1 sulfur solution without and with different concentration of DPTD, 2-DHPTD, 3-DHPTD, and 4-DHPTD
3.2.2 电化学阻抗测试结果 用电化学阻抗测试研究在不同条件下Ag/电解液界面的阻抗性质。图3为在未添加和添加不同浓度缓蚀剂的50 mg·L-1硫-乙醇溶液中Ag 的Nyquist 图。图4 为拟合Nyquist图的等效电路图。电化学阻抗数据被列于表4,其中Rs为溶液电阻,RP为极化电阻,CPE 为常相位角元件。从图3 和表4 可知Rs和RP随着噻二唑衍生物浓度的增大而增大。据报道[17],半圆的高频区与电极双膜电容的弛豫一致,同时高频容抗弧的直径可以被看作电荷转移电阻。通过电荷转移电阻计算缓蚀剂对Ag 的缓蚀率和表面覆盖率θ 的计算公 式为
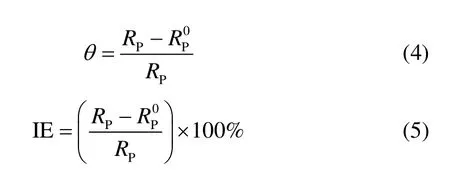
式中,PR 和分别为在添加和未添加缓蚀剂的溶液中的电荷转移电阻。计算得到的IE 列于表4。从表4 可以看出随着缓蚀剂浓度的增大,缓蚀率IE增大,这与动电位极化曲线结果一致。

表3 银在未添加和添加缓蚀剂的溶液中的动电位极化曲线的参数Table 3 Tafel polarization parameters for silver strip in 50 mg·L-1 sulfur-ethanol
3.3 等温方程分析
采用吸附动力学分析,研究4 种噻二唑衍生物的缓蚀剂机理。将由电化学阻抗测试得到的表面覆盖率θ 代入等温吸附方程中进行模拟。通过对4 种缓蚀剂进行等温方程拟合可以得到C/θ vs C 的一条直线,且从图5 可以看到4 条直线的斜率和相关系数R 都近似等于1,这说明4 种缓蚀剂在金属表面的吸附遵循Langmuir 吸附等温方程。图5 中直线的截距等于吸附等温常数Kad的倒数,从而可以计算出吸附等温常数的数值,吸附Gibbs 自由能()用来描述缓蚀剂与金属之间键的稳定性的参数,其计算公式为[18]

式中,R 是理想气体常数,数值是 8.314 J·mol-1·K-1;T 是热力学温度(298.15 K);17.13 mol·L-1是1 L 溶液中乙醇的物质的量。通过计算得4 种缓蚀剂的吸附Gibbs 自由能()的值列于表5,负的说明缓蚀剂吸附到金属表面是自发的。实验计算得4 种缓蚀剂的值都接近-40 kJ·mol-1,这说明4 种噻二唑衍生物吸附到金属表面是以化学吸附为主的混合型吸附。
3.4 SEM 分析
图6 为银片在未添加和添加缓蚀剂的腐蚀液中腐蚀前后的SEM 图片。图6 (a)为新打磨的银片,可以看出腐蚀前银片比较平整;图6 (b)为银片在未添加缓蚀剂的溶液中腐蚀后的银片,可以看到表面有很多腐蚀线和腐蚀坑(A 和B),表面腐蚀严重。从图6 (c)~(f)可知,添加缓蚀剂后,缓蚀剂在银片表面形成了一层保护膜,从而抑制了银片腐蚀。实验结果表明,4 种噻二唑衍生物具有很好的缓蚀作用,且能很好地吸附于银片的表面,阻止腐蚀物质到达银片表面,从而抑制腐蚀。

图4 拟合图2 实验数据的等效电路Fig.4 Equivalent circuit used to fit experimental data presented in Fig.3
3.5 AFM 分析
在纳米和微米尺度AFM 是观察表面形貌的权威技术,并且成为研究新一代缓蚀剂和金属/溶液界面腐蚀过程的新选择[19]。图7 为在未添加和添加缓蚀剂的溶液中腐蚀前后,银片表面形貌的三维AFM图片。与在未添加缓蚀剂的溶液中腐蚀的银片[图7 (b)]相比,添加缓蚀剂后银片[图7 (c)~(f)]腐蚀减弱。图7 (a)和图7 (b)银片粗糙度分别为36.6 nm 和278 nm,且在图7 (b)上存在一个腐蚀坑,说明银片表面腐蚀严重;从图7 (c)~(f)银片表面的粗糙度分别为109、92.1、55.2 和36.2 nm。图6 (f)表面有断层,但仍可以观察到金属表面变得更加平整,膜比较致密,图7 (c)~(f)显示缓蚀剂在银片表面存在小的凸起和浅的凹陷,这种现象归因于缓蚀剂膜的存在抑制了金属的溶解,从而导致了较低的表面粗 糙度。
3.6 量子化学计算结果
为进一步研究4 种噻二唑衍生物的缓蚀机理,采用量子化学计算分析了4 种缓蚀剂的活性。理论计算常常是在气相条件下的,但众所周知电化学测试是在溶液中进行的,所以在计算时考虑溶剂效应是非常有必要的。根据前线分子轨道理论[20-21],最高占有轨道能EHOMO是衡量分子给电子的能力的量度,其值越小,该轨道上的电子越稳定,反之则该分子越容易提供电子,参与亲核反应;最低空轨道能ELUMO是分子得电子能力的量度,其值越小,该分子越易接受外界电子,参与亲电反应。EHOMO和ELUMO的差值用E(E=ELUMO-EHOMO)表示,其差值越小,说明分子不稳定,越易参与化学反应,反之E 值越大,说明分子越稳定[22]。

表4 银在未添加和添加不同浓度噻二唑衍生物的腐蚀溶液中的EIS 数据Table 4 EIS parameters obtained by fitting Nyquist plots shown in Fig.3 with equivalent circuit shown in Fig.4 for silver in 50 mg·L-1 sulfur solutions without and with various concentrations of thiadiazole derivatives
表5 4 种缓蚀剂的吸附自由能数值Table 5 Values of for four inhibitors adsorbed onto silver strip surface/kJ·mol-1

表5 4 种缓蚀剂的吸附自由能数值Table 5 Values of for four inhibitors adsorbed onto silver strip surface/kJ·mol-1
DPTD 2-DHPTD 3-DHPTD 4-DHPTD -29.0 -29.8 -33.3 -34.4
根据前线轨道理论,HOMO 和LUMO 的密度分布是区别负责缓蚀剂与金属之间相互作用力的分子的活性中心[23]。从图8 和图9 可知,HOMO 和LUMO 轨道能量分布均在噻二唑环和取代基上,如苯环和羟基,这表明这些位置可能是优先吸附到金属表面的活性位点。然而更值得注意的是,在气相条件下计算的HOMO 和LUMO 密度分布和溶剂效应下计算的并没有显著的差异。表6 和表7 为气相条件下和溶剂效应下计算得到的缓蚀剂分子的前线分子轨道能量,由表可知无论在气相条件下计算还是溶剂效应下的E 的大小顺序均为4-DHPTD>3-DHPTD>2-DHPTD>DPTD,因此4-DHPTD 分子的活性最高,与金属的作用最强烈,缓蚀效率最高,而 DPTD 分子的活性最低,缓蚀性能最弱,3-DHPTD 和2-DHPTD 居中。

表6 经密度泛函理论(DFT)计算得到的缓蚀剂在 气相中的前线轨道能量值Table 6 Frontier orbital energy values for inhibitors calculated with DFT methods in gas phase

图5 噻二唑衍生物在银表面的Langmuir 吸附等温线Fig.5 Langmuir adsorption isotherms for DPTD, 2-DHPTD, 3-DHPTD and 4-DHPTD on silver strip

图6 在未添加和添加缓蚀剂的溶液中腐蚀前后银片的SEM 图片Fig.6 SEM images of silver strip without and with inhibitor before and after immersion in aggressive solution
3.7 分子动力学模拟结果
分子动力学模拟用来研究DPTD、2-DHPTD、3-DHPTD 和4-DHPTD 在Ag(111)面上的吸附行为。噻二唑衍生物分子在Ag(111)表面的最优吸附构型如图10 所示。图中缓蚀剂分子结构中,黄色圆点代 表S 原子,蓝色圆点代表N 原子,灰色圆点代表C原子,白色圆点代表H 原子。模拟过程中发现:无论初始构型如何,分子的头部(噻二唑环及其极性官能团)由于较强的电荷转移作用,总是优先吸附于金属表面,最终分子平行吸附于Ag(111)面上。根据平衡吸附可以总结出4 种缓蚀剂在Ag(111)面上的吸附是这些有机物通过噻二唑环和其他极性取代基吸附到离子表面。4 种噻二唑衍生物分子在Ag(111)表面的吸附能(Eadsorption)和结合能(Ebinding)根据式(1)计算得到(表8)。计算得到DPTD、2-DHPTD、3-DHPTD 和 4-DHPTD 的吸附能(Eadsorption)分别为-451.47、-576.66、-586.29 和-594.22 kJ·mol-1,得到吸附能的值均为负数,说明吸附是自发的过程。结合能大小顺序为DPTD<2-DHPTD<3-DHPTD<4-DHPTD,在整个模拟过程中4-DHPTD 的结合能最大,这表明在吸附到金属表面时,4-DHPTD 具有更强的吸附能力,同时它的缓蚀性能更好。

图7 在未添加和添加缓蚀剂的溶液中腐蚀前后银片的三维AFM 图片Fig.7 Three-dimensional AFM images of silver strip before and after immersion in aggressive solution without and with inhibitor

图8 气相条件下4 种缓蚀剂的最优结构以及HOMO 和LUMO 密度分布Fig.8 Optimized molecular structures, HOMOs and LUMOs of inhibitors in gas phase

图9 溶剂条件下4 种缓蚀剂的最优结构以及HOMO 和LUMO 密度分布Fig.9 Optimized molecular structures, HOMOs and LUMOs of inhibitors in solvent phase

表7 经密度泛函理论(DFT)计算得到的缓蚀剂在 溶剂相中的前线轨道能量值Table 7 Frontier orbital energy values for inhibitors calculated with DFT methods in solvent phase

表8 噻二唑衍生物与Ag(111)表面的吸附能Table 8 Adsorption energies between thiadiazole derivatives molecule with surface of Ag(111)

图10 噻二唑衍生物在Ag(111)面上的平衡吸附构型Fig.10 Equilibrium configurations for adsorption ofthiadiazole derivatives on Ag(111) surface
为了能够模拟真实的情况,考虑溶液带来的影响是非常有必要的。利用Amorphous Cell 模块和“build layer”工具构建一个中间层(包含1000 个乙醇分子和一个缓蚀剂分子)和最上层(包含500个乙醇分子),并将这两个独立的结构组合到Ag(111)面上,模拟结果如图11 所示,同时计算的吸附能和结合能列于表9。图11 中,噻二唑衍生物在溶液中的平衡吸附与没有溶液时是一样的,因此有溶液时计算得到的吸附能和没有溶液时是一样的,但是有溶液时得到的值更大,确保了在不同环境下缓蚀剂可以在金属表面形成保护膜,阻止腐蚀物质与金属表面接触,从而增强缓蚀效率。

表9 溶液中噻二唑衍生物与Ag(111)表面的吸附能Table 9 Adsorption energies between thiadiazole derivatives molecule with surface of Ag(111) in aqueous solution

图11 溶液中噻二唑衍生物在Ag(111)面上的平衡吸附构型Fig.11 Equilibrium configurations for adsorption ofthiadiazole derivatives on Ag(111) surface in aqueous solution
4 结 论
(1)电化学测试结果表明,4 种缓蚀剂具有很好的缓蚀作用,且缓蚀效率随着缓蚀剂浓度的增大而增大,其中4-DHPTD 的缓蚀性能最好。
(2)表面形貌分析结果表明,缓蚀剂在金属表面形成了保护膜,从而抑制了金属腐蚀。
(3)经分子动力学分析得知,4 种缓蚀剂在金属表面的吸附遵循Langmuir 吸附等温方程,且吸附属于以化学吸附为主的混合型吸附。
(4)量子化学计算结果表明,噻二唑环和极性取代基是吸附过程中的活性位点,这些活性位点可以优先吸附到金属表面。
(5)分子动力学模拟分析结果表明,4 种缓蚀剂在吸附达到平衡时是平行吸附到金属表面的,且从理论上给出了4-DHPTD 具有更好缓蚀性能的可靠依据,结果与实验结果一致。
符 号 说 明
C ——腐蚀液中缓蚀剂的浓度,mg·L-1
CPE ——常相位角元件,µF·cm-2
Eadsorption——吸附能,kJ·mol-1
Ebinding——结合能,kJ·mol-1
Ecorr——腐蚀电位,V
EHOMO——缓蚀剂分子的最高占有轨道能,eV
ELUMO——缓蚀剂分子的最低空轨道能,eV
Emolecule——自由分子的能量,kJ·mol-1
Esurface——未吸附分子时金属表面的能量,kJ·mol-1
Etotal——包含一个分子和金属表面体系的总能量,kJ·mol-1
HOMO ——最高占有轨道
IE ——缓蚀剂的缓蚀率,%
Kad——吸附等温常数,L·mol-1
LUMO ——最低空轨道
m/z ——质量和电荷的比值,简称质荷比
N ——常相位角原件的指数
OCP ——开路电位,V
PP,——分别为在添加和未添加缓蚀剂的溶液中的电荷转移电阻,M·cm2
Rs——溶液电阻,k·cm2
Y0——常相位角原件数值
βa,βc——分别为阳极极化曲线斜率和阴极极化曲线斜率,V·dec-1
θ ——表面覆盖率
[1]Liu Lin (刘琳), Qian Jianhua (钱建华), Zhang Baoyan (张宝砚).Research on the inhibitor of the silver strip corrosion in jet fuel [J].J.Chinese Soc.Corros.Prot.(中国腐蚀与防护学报), 2004, 24 (6): 376-378.
[2]Wang Deyan (王德岩).Characteristics and corrosivity of corrosive substances in jet fuel [J].Corros.Sci.Protect.Technol.(腐蚀科学与防护技术), 2000,18 (5): 361-365.
[3]Ji G, Shukla S K, Dwivedi P, Sundaram S, Prakash R.Inhibitive effect of argemone Mexicana plant extract on acid corrosion of mild steel [J].Ind.Eng.Chem.Res., 2011, 50: 11954-11959.
[4]Alvarez-Bustamante R, Negron-Silva G, Abreu-Quijano M, Herrera-Hernandez H, Romero-Romo M, Cuan A, Palomar-Pardave M.Electrochemical study of 2-mercaptoimidazole as a novel corrosion inhibitor for steels [J].Electrochim.Acta, 2009, 54: 5393-5399.
[5]Tang Y M, Yang X Y, Yang W Z, Chen Y Z, Wan R.Experimental and molecular dynamics studies on corrosion inhibition of mild steel by 2-amino-5-phenyl-1,3,4-thiadiazole [J].Corros.Sci., 2010, 52: 242-249.
[6]Gece G.Drugs: a review of promising novel corrosion inhibitors [J].Corros.Sci., 2011, 53: 3873-3898.
[7]Yadav D K, Quraishi M A, Maiti B.Inhibition effect of some benzylidenes on mild steel in 1 M HCl: an experimental and theoretical correlation [J].Corros.Sci., 2012, 55: 254-266.
[8]Obot I B, Gasem Z M.Theoretical evaluation of corrosion inhibition performance of some pyrazine derivatives [J].Corros.Sci., 2014, 83: 359-366.
[9]Hu Songqing (胡松青), Hu Jianchun (胡建春), Fan Chengcheng (范成成), Jia Xiaolin (贾晓林), Zhang Jun (张军), Guo Wenyue (郭文跃).Theoretical and experimental study of corrosion inhibition performance of new imidazoline corrosion inhibitors [J].Acta Chim.Sinica (化学学报), 2010, 68 (20): 2051-2058.
[10]Vosta J, Eliasek J, Knizek P.Study on corrosion inhibition from aspect of quantum chemistry [J].Corrosi., 1976, 32 (5): 183-187.
[11]Mazzone G, Puglisi G, Bonina F, Corsaro A.A new synthesis of symmetrical 2,5-diaryl-1,3,4-thiadiazoles [J].1983, 20: 1399-1401.
[12]Fu J J, Zang H S, Wang Y, Li S N, Chen T, Liu X D.Experimental and theoretical study on the inhibition performances of quinoxaline and its derivatives for the corrosion of mild steel in hydrochloric acid [J].Ind.Eng.Chem.Res., 2012, 51 (18): 6377-6386.
[13]Hao Ningmei (郝宁眉), Chen Yinjuan (陈银绢), Mi Siqi (米思奇), Jia Xiaolin (贾晓林), Hu Songqing (胡松青).Synthesis of new oleic imidazoline corrosion inhibitors and evaluation of their performance [J].CIESC Journal (化工学报), 2013, 64 (4): 1485-1492.
[14]Feng Lijuan (冯丽娟), Yang Huaiyu (杨怀玉), Wang Fuhui (王福会).Inhibition behavior of ascorbic benzoate for steel rebar in alkaline solution [J].Acta Chim.Sinica (化学学报), 2011, 69 (20): 2359-2367.
[15]Hu Songqing (胡松青), Hu Jianchun (胡建春), Gao Yuanjun (高元军), Jia Xiaolin (贾晓林), Guo Wenyue (郭文跃).Corrosion inhibition and adsorption of laury-1-imidazolines for Q235 steel [J].CIESC Journal (化工学报), 2011, 62 (1): 147-155.
[16]Li W H, He Q, Pei C L, Hou B R.Experimental and theoretical investigation of the adsorption behaviour of new triazole derivatives as inhibitors for mild steel corrosion in acid media [J].Electrochim.Acta, 2007, 52: 6386-6394.
[17]El-Sayed M Sheif.Corrosion mitigation of copper in acidic chloride picking solution by 2-amino-5-ethyl-1,3,4-thiadiazole [J].J.Mater.Engineer.Perform., 2010, 19 (6): 873-879.
[18]Liu Lin (刘琳), Pan Xiaona (潘晓娜), Peng Dan (彭丹), Zhang Qiang (张强), Qian Jianhua (钱建华).Corrosion inhibition and molecular structure of thiadiazole derivatives in sulfur-ethanol system [J].CIESC Journal (化工学报), 2014, 65 (10): 4039-4048.
[19]You Long (尤龙), Liu Jinxiang (刘金祥), Zhang Jun (张军), Liu Linfa (刘林法), Yu Lijun (于立军), Qiao Guimin (乔贵民).MD study of imidazoline corrosion inhibitor membranes restrain corrosive medium diffusion behaviors [J].J.Acta.Chimica.Sin.(化学学报), 2010, 68 (8): 747-752.
[20]Zhang Shiguo (张士国), Yang Pin (杨频).The molecular structure and corrosion inhibitor efficiency of some cyclic nitrogen compounds: an DFT study [J].J.Chinese Soc.Corros.Protect.(中国腐蚀与防护学报), 2004, 24 (4): 240-244.
[21]Fukui K.Chemical reactivity theory-its pragmatism and beyond [J].Pure & Appl.Chern., 1982, 54 (10): 1825-1836.
[22]Masoud M S, Awad M K, Shaker M A, El-Tahawy M M T.The role of structural chemistry in the inhibitive performance of some aminopyrimidines on the corrosion of steel [J].Corros.Sci., 2010, 52: 2387-2396.
[23]Zhang Jun (张军), Hu Songqing (胡松青), Wang Yong (王勇), Guo Wenyue (郭文跃), Liu Jinxiang (刘金祥), You Long (尤龙).Theoretical investigation on inhibition mechanism of 1- (2-hydroxyethyl)- 2-alkyl- imidazoline corrosion inhibitors [J].Acta Chim.Sinica (化学学报), 2008, 66 (22): 2469-2475.
