负载型KI催化甘油与CO2合成甘油碳酸酯
2015-08-19王富丽黄世勇余青云黄媚孙果宋
王富丽,黄世勇,余青云,黄媚,孙果宋
(1广西壮族自治区化工研究院,广西 南宁 530006;2广西大学化学化工学院,广西 南宁 530004)
生物柴油作为一种新型绿色能源越来越受到世界各国的广泛关注。然而,生物柴油制备过程中会副产甘油,若能实现甘油的高效转化,可以有效地降低生物柴油的生产成本,并延伸产业链。现今已发展出多种甘油转化的新技术[1-2],其中合成甘油碳酸酯(GC)是研究的热点之一[3-6],特别是以甘油和CO2为原料直接合成甘油碳酸酯更加具有吸引 力[7-8],但是由于反应受到热力学平衡限制[9],甘油碳酸酯产率较低。一些研究人员[10-11]通过加入一定的耦合剂来克服反应的热力学限制,从而提高反应的产率。黄世勇等[10]通过加入乙腈作为耦合脱水剂,极大地提高了甘油碳酸酯的产率,但会有大量副产物生成。Ma等[11]使用KI等碱金属卤化物作为催化剂,在反应体系中加入环氧丙烷(PO)作为耦合剂,CO2首先与环氧丙烷反应生成碳酸丙烯酯(PC),然后再与甘油进行酯交换反应,从而实现了甘油和CO2一步法合成甘油碳酸酯,反应式如式(1)所示。该反应路线提供了一条合成甘油碳酸酯的有效方法。然而,该研究中使用的KI等为均相催化剂体系,为此本文作者课题组[12]在前期研究中对该催化剂体系进行了负载多相化,制备了KI/Al2O3等催化剂,具有较好的催化活性及稳定性。为满足工业生产需求,该催化剂的活性还需进一步提升,增加甘油的转化率,从而降低后期产物分离费用。

目前,对氧化铝载体进行调变改性已经得到了广泛关注[13-14],改性后的载体能够配合活性组分协助反应进行,提高催化剂的整体性能。本工作在上述研究的基础上,添加不同组分对氧化铝载体进行调变改性,再把活性组分KI负载到改性氧化铝载体表面上,制备了一系列负载型KI催化剂,系统考察了不同催化剂在二氧化碳、环氧丙烷和甘油合成甘油碳酸酯反应中的催化性能,并优化了反应条件。
1 实验部分
1.1 试剂及仪器
碘化钾、甘油和环氧丙烷均为分析纯,未经处理直接使用;拟薄水铝石,分析纯,比表面≥300m2/g;MgO、ZnO、TiO2和ZrO2均为纳米级粉末,分析纯;二氧化碳,纯度>99.95%。
采用Quantachrome公司Autosorb-1-C-TCD物理化学吸附仪进行比表面积和平均孔径分析;采用PANalytical公司X’Pert Pro MPDX衍射仪进行XRD分析;CO2程序升温脱附(CO2-TPD)装置为自制。催化剂置于U形石英管中,活化后吸附CO2至饱和,再进行升温脱附,脱附的CO2由四极质谱检测。
1.2 催化剂的制备
实验所用的氧化铝载体为自制,将拟薄水铝石于500℃马弗炉中焙烧5h得到;改性氧化铝载体的制备是将拟薄水铝石分别与MgO、ZnO、TiO2或ZrO2纳米粉末按照一定比例充分混匀后(其中,Al2O3与MgO、ZnO、TiO2或ZrO2的质量比均为5∶1),再于500℃马弗炉中焙烧5h。
催化剂的制备采用等体积浸渍法。分别将一定量的KI负载到氧化铝或改性氧化铝表面上,室温下浸渍12h,再于80℃的烘箱中干燥8h,最后将所得固体样品于500℃的马弗炉中焙烧3h,即得实验所用负载型催化剂。
1.3 催化剂的评价
反应在带有磁力搅拌的50mL不锈钢反应釜中进行,主要过程如下:称取一定量的催化剂、甘油和环氧丙烷加入到反应釜中,通入CO2置换3次空气,然后在一定的条件下进行反应。反应结束后用冷水快速冷却至室温,卸掉反应釜中的压力。液相产物经离心分离出催化剂,上层清液用Agilent 6820气相色谱仪进行分析。色谱柱为PE-FFAP毛细管柱(30m × 0.25mm × 0.25μm),氢火焰检测器(FID),采用内标法进行定量分析,内标物为正丁醇。下层所得催化剂用一定量的无水乙醇进行洗涤,80℃烘干后,再进行催化剂的重复稳定性测试。
2 结果与讨论
2.1 催化剂的筛选
考察了不同催化剂在二氧化碳、甘油和环氧丙烷合成甘油碳酸酯反应中的活性,实验结果如表1所示。由表1可以看到,在均相KI催化剂作用下,甘油转化率为75.6%,GC产率为70.9%。当把KI负载到氧化铝表面后,其活性有所下降,以KI/Al2O3为催化剂时,甘油的转化率下降为58.5%,GC产率为54.6%。为进一步提高催化活性,对氧化铝载体改性后,制备了一系列改性的负载KI催化剂,如KI/Al2O3-MgO、KI/Al2O3-ZnO、KI/Al2O3-TiO2和KI/Al2O3-ZrO2。由实验结果可以发现,载体中加入少量MgO有利于总反应的进行,以KI/Al2O3-MgO为催化剂,甘油转化率为65.5%,GC产率为60.8%,其活性要明显高于KI/Al2O3。这可能是由于 Al2O3-MgO载体上有少量中强碱性位的存在[14],能够在一定程度上活化二氧化碳[15],促进二氧化碳与环氧丙烷生成碳酸丙烯酯,同时一定强度和数量的碱性位也能够加速碳酸丙烯酯与甘油的酯交换反应,有利于甘油碳酸酯的生成。然而,催化剂上的中强碱性位过多会加快副反应的发生,当Al2O3-MgO载体中Al2O3与MgO质量比为5∶2时,甘油碳酸酯选择性下降为80.8%。此外,由表1可以看到,并不是所有的载体调变都能促进反应进行,催化剂KI/Al2O3-ZnO、KI/Al2O3-TiO2和KI/Al2O3- ZrO2上可能由于没有明显的碱性中心,其催化活性与KI/Al2O3相比差别不大,甘油的转化率分别为56.4%、59.8%和57.9%。
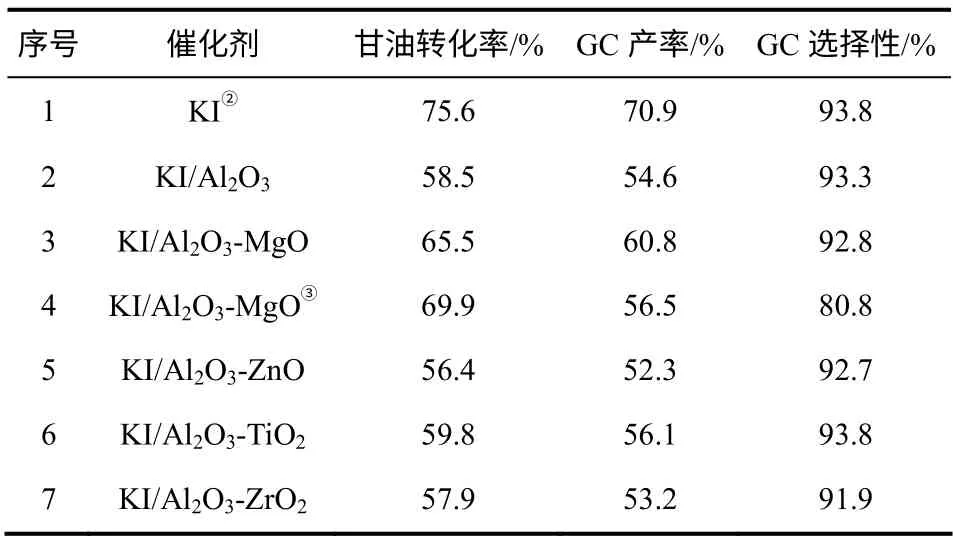
表1 不同催化剂对反应的影响①
以Al2O3-MgO为载体,考察了不同KI负载量对催化剂活性和稳定性的影响,如图1。随着KI负载量的增加,催化剂的活性在首次使用时逐渐增高,当催化剂负载量为2.0mmol/g时,甘油转化率可达70%以上。然而,KI负载量过多,会导致催化剂的稳定性下降。KI/Al2O3-MgO(2.0mmol/g)在第2次使用过程中,其活性明显下降,甘油转化率低于60%,与KI/Al2O3-MgO(1.5mmol/g)活性相当,甚至略低。这说明KI负载量高于1.5mmol/g时,载体表面的KI晶粒可能产生了团聚现象,生成更大的晶体,从而更容易脱落,发生均相催化反应。相对来说,KI/Al2O3-MgO(1.5mmol/g)则具有较好的活性及稳定性,经过5次使用其活性仍没有明显下降。
2.2 催化剂的表征
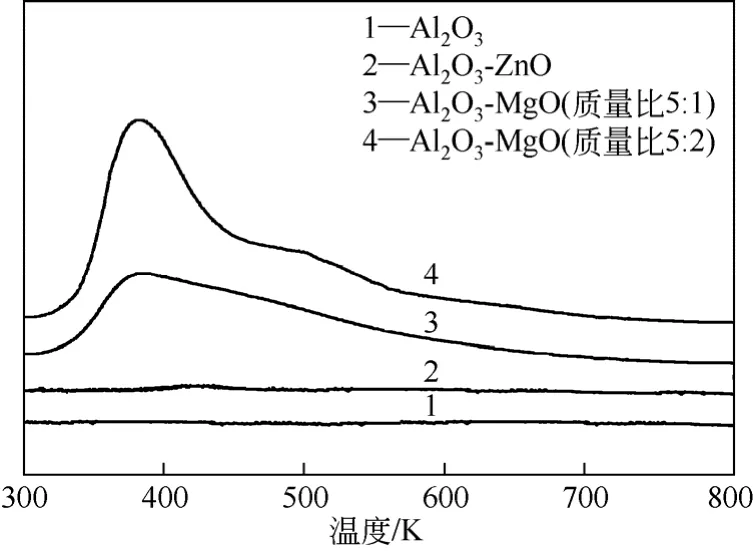
图2 载体的CO2-TPD图
为了进一步验证碱性位的存在对反应的影响,实验选择了部分载体进行了CO2-TPD表征分析,结果如图2所示。由图2可以看出,当氧化铝载体中 加入MgO后(质量比5∶1),在温度约380K时出现CO2的脱附峰,随着MgO的添加量进一步增加(质量比5∶2),在温度510K左右也开始出现弱的CO2脱附峰。这说明Al2O3-MgO载体表面存在一定量的中强碱性位,MgO含量越高,碱性位数量越多。此外,从图2中还可以看到,载体Al2O3和Al2O3-ZnO表面上没有明显的碱性位存在。载体Al2O3-TiO2和Al2O3-ZrO2的脱附曲线与γ-Al2O3相似,图中没有一一列出。由上可知,图2中的表征结果与表1中的反应数据相一致,从而进一步说明了少量碱性位的存在有利于反应进行。
由于实验采用大孔容拟薄水铝石作为载体前体的主要成分,因此得到的载体比表面积相对较大,并具有一定的介孔材料特征,这样的结构有利于活性组分的均匀分散,可以提高KI的负载量。从样品N2吸附/脱附等温曲线(图3)可以看到,载体Al2O3-MgO和催化剂KI/Al2O3-MgO都具有类似于Ⅳ型的等温曲线,存在明显的回滞环,说明样品中有介孔结构存在。其等温线在中压段增加幅度相对较小,突跃点相对平缓,表明其孔道结构规整性稍 差,孔径分布相对较宽[16]。随着KI负载量加大后,可以看到等温曲线的回滞环逐渐平缓,并向低压端位移,说明介孔孔径逐渐变小,孔结构有序性逐渐变差。因此,KI负载量不宜过多。
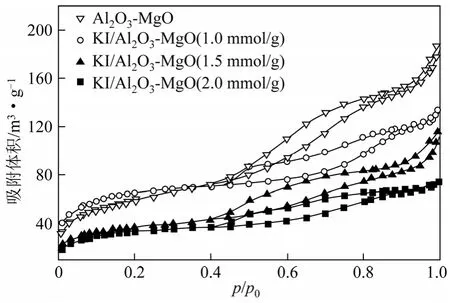
图3 样品的N2吸附/脱附等温线
由表2可以发现,负载活性组分KI后,载体Al2O3-MgO的表面积、孔容和孔径都有所减小,这是由于KI晶体占据了部分孔道的结果。当KI负载量为1.5mmol/g时,催化剂的比表面积仍维持在200m2/g以上。这说明KI晶粒分散比较均匀,没有明显堵塞载体的孔道。而当KI负载量增加到2.0mmol/g时,样品的比表面积等下降较为明显,这可能是由于部分KI晶粒已经开始团聚,形成更大的晶体,从而堵塞了部分催化剂孔道。在反应过程中,这种大晶体更加容易脱落,造成催化剂稳定性下降。
图4为不同催化剂及载体的XRD谱图。可以看到,谱图中均存在Al2O3(2θ为19.5°、37.6°、45.9°和67.0°)、MgO(2θ为36.9°、42.9°和62.2°)和MgAl2O4(2θ为19.3°、31.5°、37.0°、45.1°、59.6°、65.7°和69.0°)的衍射峰,且样品峰形呈弥散状态,这说明载体Al2O3-MgO晶型不完整,是以MgA12O4-xMgO-yAl2O3无定形复合氧化物的形式存在的[17]。当活性组分KI(负载量1.0mmol/g或1.5mmol/g)负载到载体表面后,有弱 的KI衍射峰(2θ为21.8°、25.2°、35.9°、44.6°、58.4°和64.6°)出现,这说明此时KI在载体表面上分散较均匀。增加KI负载量为2.0mmol/g,则可以看到KI的衍射峰明显增强,说明部分KI晶粒开始团聚[18]。
综上所述,可以得出载体Al2O3-MgO上KI负载量为1.5mmol/g是较为适宜的,这与图1所示的实验结果相一致。
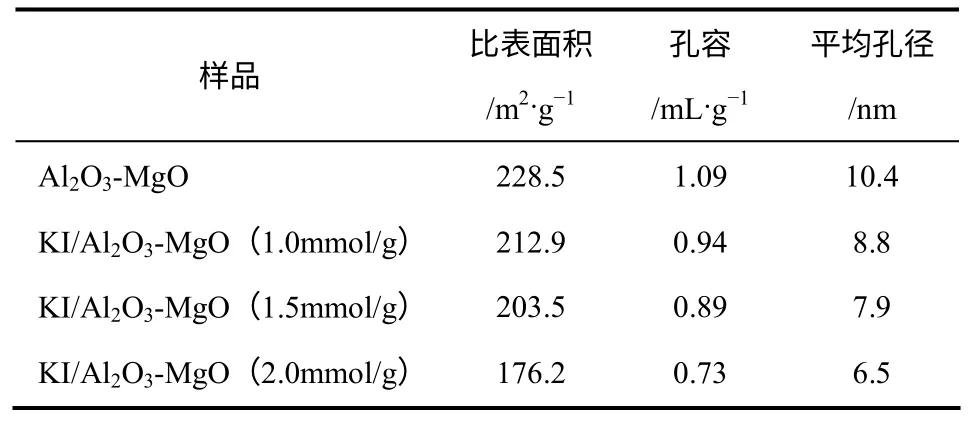
表2 样品的比表面积、孔容和平均孔径
图4 样品的XRD图谱
2.3 反应条件的优化
实验以KI/Al2O3-MgO(1.5mmol/g)为催化剂,考察了反应温度、反应时间、反应压力及反应物摩尔比对反应的影响。
图5为反应温度对反应的影响。随着反应温度的增加,甘油转化率不断增大,在150℃时达到70%以上。而GC产率在130℃时达到最大(约60%),之后随着反应温度的增加GC产率逐渐下降。这是由于在低于130℃时,升高温度能够加快主反应的进行速度,甘油转化率和GC产率逐渐上升,而温 度高于130℃时,反应物甘油和产物GC发生副反应的速度加快[10],从而导致GC产率开始下降。因此,最佳的反应温度为130℃。

图5 反应温度对反应的影响
图6 反应时间对反应的影响
图6为反应时间对反应的影响。随着反应时间的增加,甘油的转化率逐渐增大,当反应时间为5h时,转化率能达到75%以上。GC产率随着反应时间先增大后下降,其中在2h达到最大。这是由于主反应在2h时已经达到热力学平衡,之后随着反应时间的继续延长,会使GC继续发生其他副反应[11],导致GC产率下降。因此,最佳的反应时间为2h。
图7为反应压力对反应的影响。随着反应压力的增加,甘油转化率和GC产率逐渐增大。当反应压力达到6.0MPa后,继续增加反应压力,甘油转化率和GC产率增加不是很明显,这可能是反应已经达到平衡状态[10]。因此,适合的反应压力为6.0MPa。
图8为环氧丙烷和甘油摩尔比对反应的影响。 随着环氧丙烷与甘油摩尔比的增大,甘油的转化率逐渐增大,而GC产率先增大后减小,其中在摩尔比为3时达到最大。这是由于环氧丙烷在本反应中既充当溶剂又是反应的耦合剂,环氧丙烷数量的增加能够提升反应物的浓度和传质速度,有利于反应的进行。然而过多的环氧丙烷会导致一些其他副反应的发生[11]。因而,最佳的环氧丙烷和甘油摩尔比为3∶1。
图7 反应压力对反应的影响
图8 环氧丙烷用量对反应的影响
3 结 论
(1)以改性氧化铝为载体,采用浸渍法制备了负载型KI催化剂,并考察了催化剂在CO2、甘油和环氧丙烷合成甘油碳酸酯反应中的活性。环氧丙烷在该反应体系中起到了溶剂和耦合剂的作用。由不同载体的CO2-TPD分析可以发现,载体表面少量碱性位的存在有利于反应进行,其中Al2O3-MgO(质量比5∶1)是最适合的载体。以KI/Al2O3-MgO为催化剂,甘油转化率能达到65.5%,甘油碳酸酯产率为60.8%。然而添加过多的MgO会加速副反应的进行。
(2)以Al2O3-MgO为载体,考察了不同KI负载量对反应的影响,其中负载量为1.5 mmol/g的KI/Al2O3-MgO具有较好的活性和稳定性。经过5次重复使用,仍保持较好的催化活性。通过BET、XRD等手段对催化剂KI/Al2O3-MgO进行表征,进一步说明了KI负载过多会导致晶粒团聚,进而影响催化剂的活性和稳定性。最后,实验系统优化了反应条件,最佳条件为环氧丙烷0.3mol,甘油0.1mol,反应温度130℃,反应时间2h,反应压力6.0MPa。
[1] Pagliaro M,Ciriminna R,Kimura H,et al. From glycerol to value-added products[J].Angew. Chem. Int. Ed.,2007,46(24):4434-4440.
[2] Zheng Y,Chen X,Shen Y. Commodity chemicals derived from glycerol,an important biorefinery feedstock[J].Chem. Rev.,2008,108:5253-5277.
[3] 郭爽,李金丽,王家喜. 尿素与甘油反应制甘油碳酸酯的绿色合成工艺[J]. 化工进展,2012,31(3):658-661.
[4] Lanjekar K,Rathod V K. Utilization of glycerol for the production of glycerol carbonate through greener route[J].J. Environ. Chem. Eng.,2013,1(4):1231-1236.
[5] Liu P,Derchi M,Hensen E J M. Synthesis of glycerol carbonate by transesterification of glycerol with dimethyl carbonate over MgAl mixed oxide catalysts[J].Appl. Catal. A,2013,467:124-131.
[6] Bai R,Wang Y,Wang S,et al. Synthesis of glycerol carbonate from glycerol and dimethyl carbonate catalyzed by NaOH/γ-Al2O3[J].Fuel. Process Technol.,2013,106:209-214.
[7] Aresta M,Dibenedetto A,Nocito F,et al. A study on the carboxylation of glycerol to glycerol carbonate with carbon dioxide:The role of the catalyst,solvent and reaction conditions[J].J. Mol. Catal. A:Chem.,2006,257(1-2):149-153.
[8] George J,Patel Y,Pillai S M,et al. Methanol assisted selective formation of 1,2-glycerol carbonate from glycerol and carbon dioxide usingnBu2SnO as a catalyst [J].J. Mol. Catal. A:Chem.,2009,304(1-2):1-7.
[9] 赵毅,郝荣杰,沈艳梅,等. CO2和丙三醇合成丙三醇碳酸酯的热力学分析[J]. 天然气化工,2010,35(6):8-10.
[10] 黄世勇,王富丽,魏伟,等. 碱催化二氧化碳和丙三醇合成丙三醇碳酸酯的研究[J]. 现代化工,2008,28(10):35-37.
[11] Ma J,Song J,Liu H,et al. One-pot conversion of CO2and glycerol to value-added products using propylene oxide as the coupling agent[J].Green Chem.,2012,14(6):1743-1748.
[12] 余青云,黄世勇,黄青则,等. KI/γ-Al2O3催化CO2与甘油合成甘油碳酸酯的研究[J]. 现代化工,2014,34(4):112-115.
[13] 王明胜,梅华. Ni-MgO/Al2O3催化己二腈加氢制备己二胺的研究[J]. 石油炼制与化工,2012,43(9):44-49.
[14] 付新. MgO/Al2O3吸附剂对CO2静态吸附性能研究[J]. 化工新型材料,2013,41(2):120-122.
[15] Tu M,Davis R J. Cycloaddition of CO2to epoxides over solid base catalysts[J].J. Catal.,2001,199(1):85-91.
[16] 蓝冬雪,林丹,赵会民,等. 以脱脂棉为模板制备高比表面积Al2O3-MgO固体酸碱双功能材料[J]. 催化学报,2011,32(7):1214-1219.
[17] 连奕新,王会芳,方维平,等. 载体焙烧温度对Co-Mo/MgO-Al2O3变换催化剂性能的影响[J]. 催化学报,2009,30(6):549-554.
[18] 赵天生,韩怡卓,孙予罕,等. 金属氧化物负载的KI对合成碳酸丙烯酯的催化性能[J].石油化工,2000,29(2):101-105.
