早期胃癌淋巴结转移规律及内镜切除的可行性
2015-08-16周羽翙蔡振寨卢光荣叶梦思何云薛战雄
周羽翙,蔡振寨,卢光荣,叶梦思,何云,薛战雄
·论著·
早期胃癌淋巴结转移规律及内镜切除的可行性
周羽翙,蔡振寨,卢光荣,叶梦思,何云,薛战雄
(温州医科大学附属第二医院&育英儿童医院 成人消化内科,浙江 温州 325000)
目的探讨早期胃癌(EGC)淋巴结转移规律及其影响因素,指导内镜下治疗适应证的选择。方法回顾性分析417例行胃癌根治术治疗并经病理证实的EGC患者的临床病理资料,对患者的性别、年龄,肿瘤的大小、浸润深度、大体类型、部位、组织学类型与淋巴结转移的关系进行单因素及多因素分析。结果EGC的淋巴结转移率为13.9%(58/417)。其中,黏膜内癌的淋巴结转移率为5.3%(11/208),黏膜下层癌的淋巴结转移率为22.5%(47/209)。性别(P=0.050)、肿瘤大小(P=0.047)、浸润深度(P=0.000)和组织学类型(P=0.000)是影响EGC淋巴结转移的独立危险因素。48例肿瘤直径≤2.0 cm的男性分化型黏膜内癌患者未见淋巴结转移。结论肿瘤直径≤2.0 cm的男性分化型黏膜内EGC患者可考虑行内镜切除术,但尚需后期大样本资料来验证该结果的准确性。
早期胃癌;淋巴结转移;危险因素;内镜切除
早期胃癌(early gastric cancer,EGC)指病变局限于黏膜层或黏膜下层,不论有无淋巴结转移(lymph node metastasis,LNM)[1]。目前,我国EGC的治疗仍以传统外科手术为主,经腹胃切除术+D2淋巴结清扫术仍被视为标准术式,术后5年生存率可达95.0%左右[2-3]。与传统外科手术相比,内镜切除技术(endoscopic resection,ER),包括内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),具有创伤小、并发症少、恢复快和费用低等优点,且疗效相当,其5年生存率亦可达90.0%以上[4]。尽管由于超声、CT、MRI、EUS及FDG-PET/CT等影像学技术的发展,EGC淋巴结转移的诊断准确率仍较低,淋巴结转移与EGC的复发密切相关[5-7],提高内镜下治疗有效性的关键是选择那些淋巴结转移概率较低的EGC患者。本研究回顾性分析近十余年来行胃癌根治术的EGC患者的临床病理资料,分析其与淋巴结转移之间的关系,为制定合适的治疗方案提供依据。
1 资料与方法
1.1一般资料
收集2002年1月-2014年10月于温州医科大学附属第一医院、温州医科大学附属第二医院、瑞安市人民医院、丽水市中心医院和绍兴第二医院行胃癌根治术并具有完整临床病理资料的EGC患者共417例,所有病例均符合日本胃癌协会提出的EGC定义,即肿瘤局限于黏膜层或黏膜下层,伴或不伴淋巴结转移[1]。
1.2资料收集与方法
收集患者的性别、年龄、肿瘤的大小、浸润深度、大体类型、部位和组织学类型共7项可能影响EGC淋巴结转移的因素作为分析指标。根据我国对老年人的定义将患者年龄分为大于或等于60岁、小于60岁两个区间。肿瘤大小为术后病理检测量的病灶最大直径,分为≤2.0 cm,>2.0~≤3.0 cm,>3.0 cm 3组。根据《日本胃癌分类》[1],大体类型分为0~I(隆起型),0~Ⅱa型(浅表隆起型),0~Ⅱb型(浅表平坦型),0~Ⅱc型(浅表凹陷型),0~Ⅲ型(凹陷型),本研究进一步将其分成3个亚型:隆起型(0~Ⅰ、0~Ⅱa),平坦型(0~Ⅱb),凹陷型(0~Ⅱc、0~Ⅲ)。组织学类型分为分化型及未分化型,分化型包括高、中分化型管状腺癌及乳头状腺癌,未分化型包括低分化腺癌、印戒细胞癌、黏液腺癌及以低分化腺癌、印戒细胞癌、黏液腺癌为主的混合型。
1.3统计学方法
本研究采用SPSS 19.0软件进行数据统计学分析。以χ2检验或Fisher确切概率法进行单因素分析,二元Logistic回归模型进行多因素分析。P<0.05时认为差异有统计学意义。
2 结果
在入选的417例EGC患者中,总淋巴结转移率为13.9%(58/417)。其中,黏膜内癌淋巴结转移率为5.3%(11/208),黏膜下层癌的淋巴结转移率为22.5%(47/209)。
2.1淋巴结转移影响因素的单因素及多因素分析结果
单因素分析显示患者的性别(P=0.006)、年龄(P=0.040),肿瘤的大小(P=0.000)、浸润深度(P= 0.000)、组织学类型(P=0.000)与淋巴结转移相关,详见表1。进一步采用Logistic回归模型进行多因素分析显示性别(P=0.050)、肿瘤大小(P=0.047)、浸润深度(P=0.000)和组织学类型(P=0.000)是影响EGC淋巴结转移的独立危险因素,其中浸润深度是最有力的影响因素。详见表2。
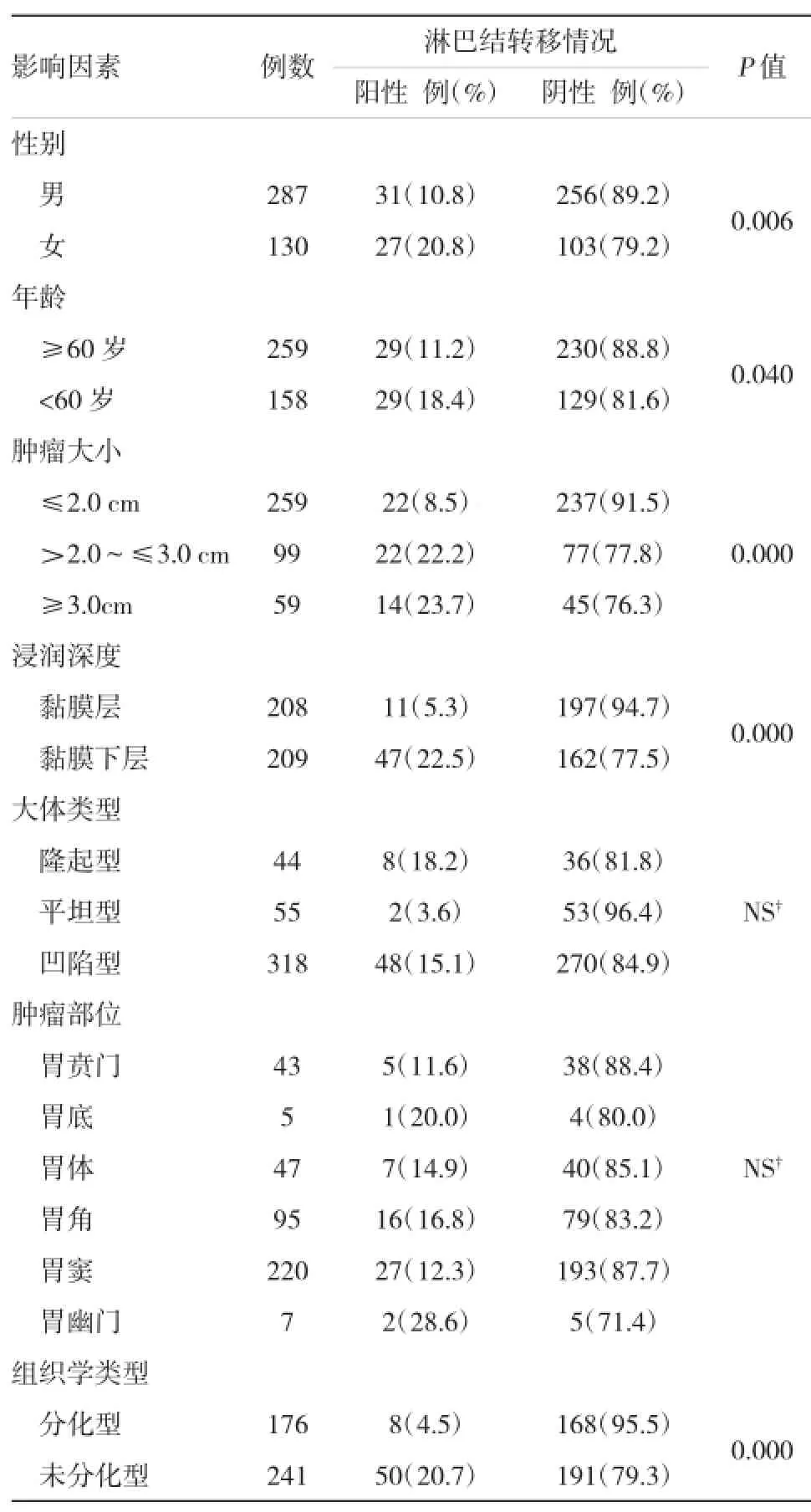
表1 EGC患者淋巴结转移影响因素的单因素分析结果
2.2联合性别、肿瘤大小及组织学类型分析不同浸润深度对淋巴结转移的影响
黏膜层组中,48例肿瘤直径≤2.0 cm的男性分化型黏膜内癌患者未见淋巴结转移,直径>2.0~≤3.0 cm的男性分化型黏膜内癌15例,以及直径≤2.0 cm的女性分化型黏膜内癌19例亦未见淋巴结转移。黏膜下层组中,直径≤2.0 cm的女性患者24例,不论组织学类型,均未见淋巴结转移,未见直径>2.0 cm的女性分化型病例,其余均见淋巴结转移。详见表3。
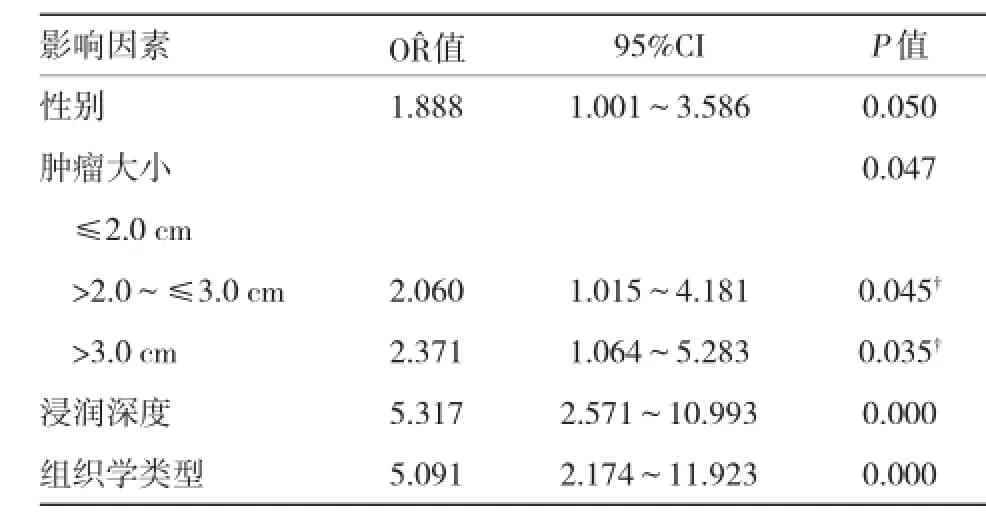
表2 EGC患者淋巴结转移影响因素的多因素分析结果

表3 黏膜内EGC组和黏膜下EGC组根据性别、组织学类型及肿瘤大小分析淋巴结转移结果

组别 淋巴结转移情况阴性例(%) 阳性例(%)黏膜下层组(n=209)分化型(男)≤2.0 cm 41(91.1) 4(8.9)>2.0~≤3.0cm 14(87.5) 2(12.5)>3.0cm 11(91.7) 1(8.3)未分化型(男)≤2.0 cm 35(74.5) 12(25.5)>2.0~≤3.0 cm 17(77.3) 5(22.7)>3.0 cm 10(83.3) 2(16.7)分化型(女)≤2.0 cm 24(100.0) 0(0.0)>2.0~≤3.0 cm 0(0.0) 0(0.0)>3.0 cm 0(0.0) 0(0.0)未分化型(女)>2.0~≤3.0 cm 7(33.3) 14(66.7)>3.0cm 3(30.0) 7(70.0)
3 讨论
目前,我国多地区EGC的治疗仍以传统外科手术为主,其标准术式为经腹胃切除术+D2淋巴结清扫术。TAKUJI等[8]统计日本国家癌症中心5 265 例EGC患者的资料发现,淋巴结转移率为8.9% (467/5 265),且淋巴结转移阳性者中,所转移的胃周淋巴结大部分局限于第一站[9-10]。因此,对于绝大多数EGC患者而言,D2淋巴结清扫术是不必要的。传统术式术后并发症多,如术后出血、吻合口瘘、输入输出襻梗阻、残胃癌等,严重影响患者术后生存质量。近年来,越来越多的临床工作者将EGC治疗的重心转移至内镜切除技术。内镜切除技术,包括EMR和ESD,是治疗消化道早癌及癌前病变的内镜微创新技术,尤其是以ESD为代表的整片黏膜切除技术,因其治疗效果确切、创伤小、安全性高、患者依从性好、治疗成本低、可完整切除早期病灶并对肿瘤进行分期等优点,已经越来越多地应用于临床。由于EMR和ESD无法行淋巴结切除,且EGC的复发与淋巴转移密切相关[7]。因此,评估淋巴结转移情况对于治疗方式的选择及患者预后的估计十分重要。临床上现主要应用超声、MDCT、MRI、EUS和FDG-PET/CT等影像学技术评估淋巴结转移情况。国内外报道MDCT对淋巴结转移的敏感性为57.4% ~70.8%[11-12],PARK等[13]研究表明EUS诊断胃周围肿大淋巴结的敏感性较高,但微小浸润及局部破坏由于极少引起淋巴结结构的改变而常常不易被低频超声探及。KWEE等[14]进行的系统评价分析认为当前的影像学手段对EGC淋巴结转移的检出,均不能达到较高的敏感性和特异性,漏诊或误诊率相对较高。因此,从临床病理资料预测EGC淋巴结转移情况仍具有重要意义。
本研究通过分析浙江省3大地区(温州、丽水和绍兴)共417例EGC患者的临床病理资料显示,总淋巴结转移率为13.9%(58/417)。其中,黏膜内癌淋巴结转移率为5.3%(11/208),黏膜下层癌的淋巴结转移率为22.5%(47/209),与日本大规模研究水平相当[15]。进一步对EGC患者的临床病理资料进行单因素及多因素分析表明,性别、肿瘤大小、浸润深度和组织学类型是淋巴结转移的独立危险因素。其中,浸润深度(O=5.317)为最有力的影响因素。根据文献报道,不同国家或者同一国家不同区域EGC的临床病理特征与淋巴结转移的关系仍存在差异,如韩国的KIM等[16]认为男性更易发生淋巴结转移,而大多数学者认为性别与淋巴结转移无关;我国北京的王婕敏等[17]报道组织学类型与淋巴结转移无关,而韩国的KIM等[18]将印戒细胞癌独立分析,认为黏膜下层印戒细胞癌的淋巴结转移率与高分化腺癌类似,但显著低于中、低分化型腺癌。同样我国上海的范晓飞等[19]也通过研究发现印戒细胞癌的淋巴结转移率显著低于低分化腺癌。此种差异产生的原因,可能是由于样本量的不足,也可能与人种和环境等有关。
根据2014年《中国早期胃癌筛查及内镜诊治共识意见》[4],目前我国较为公认的EGC内镜切除适应证如下。绝对适应证:①病灶最大径≤2.0 cm,无合并溃疡的分化型黏膜内癌;②胃黏膜高级别上皮内瘤变(high grade intraepithelial neoplasia,HGIN)。相对适应证:①病灶最大径>2.0 cm,无溃疡的分化型黏膜内癌;②病灶最大径≤3.0 cm,有溃疡的分化型黏膜内癌;③病灶最大径≤2.0 cm,无溃疡的未分化型黏膜内癌;④病灶最大径≤3.0 cm,无溃疡的分化型浅层黏膜下癌;⑤除以上条件外的EGC,伴有一般情况差、外科手术禁忌证或拒绝外科手术者可视为ESD的相对适应证。基本参照《日本胃癌治疗指南(2010年版)》[20]。但由于人种、地域的差异性,国内仍需要更多大规模、多中心的研究来进一步证实。
本研究将4个独立危险因素进一步分析发现,48例肿瘤直径≤2.0 cm的男性分化型黏膜内癌患者未见淋巴结转移,直径>2.0~≤3 cm的男性分化型黏膜内癌15例,以及直径≤2.0 cm的女性分化型黏膜内癌19例亦未见淋巴结转移。但由于后两者样本基数较小,需进一步扩大患者样本量证实上述结果的可靠性。因此,本研究得出,男性分化型黏膜内癌,且肿瘤直径≤2.0 cm者未见淋巴结转移,可行EMR/ESD治疗。此结果尚未在既往国内外文献中报道。
本研究是一项基于术后病理结果的回顾性分析,尚存在一定的局限性和不足之处:首先,对于经胃镜下活检证实为胃恶性肿瘤的患者,主要依靠超声内镜进行术前分期,YOSHINAGA等[21]报道传统EUS对于EGC浸润深度评估的准确性为63.0%,应用高频超声探头后其准确率上升至80.0%,但仍难以检出黏膜下层癌组织的微小浸润,且受多种因素如病灶的部位、大体类型、表面有无溃疡形成等影响。因此,需寻找准确性更高的检测方法,或多种影像学手段联合,以减少T分期过度或不足的发生。其次,国内EGC病理报告相对不规范,本研究所收集的病理资料中并未包含肿瘤表面溃疡形成情况、脉管浸润情况以及黏膜下层浸润的具体深度(如sm1、sm2和sm3)。因此,未将其纳入研究范围,但国内外有研究表明表面溃疡形成、脉管浸润是淋巴结转移的独立危险因素[15,19],不同的黏膜下层浸润深度其淋巴结转移情况也不同,同时胃镜下活检与术后病理结果回报存在一定的差异性,脉管浸润情况也不易在活检标本中观察到。因此,在完善病理报告的同时,对于已行内镜下切除术治疗的患者,需关注肿瘤表面溃疡及脉管浸润情况,以便加强随访。
综上所述,男性分化型黏膜内癌,且肿瘤直径≤2.0 cm者,可考虑行EMR/ESD治疗。由于此结果尚未在国内外文献中有所报道,且基于淋巴结转移及治疗方式对于患者生存期的重要性,未来需收集更多EGC患者的临床病例资料来验证此结果的准确性。
[1]Japanese Gastric Cancer Association.Japanese classification of gastric carcinoma:3rd english edition[J].Gastric Cancer,2011,14(2):101-112.
[2]LEE JH,YOM CK,HAN HS.Comparison of long-term outcomes of laparoscopy-assisted and open distal gastrectomy for early gastric cancer[J].Surg Endosc,2009,23(8):1759-1763.
[3]MATSUKI A,NASHIMOTO A,YABUSAKI H,et al.Long-term clinical outcome and survival after pylorus-preserving gastrectomy[J].Hepatogastroenterology,2011,59(118):2012-2015.
[4]中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜专业委员会.中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)[J].中华消化内镜杂志,2014,31(7):433-448.
[5]LI H,LU P,LIU CG,et al.Clinicopathological analysis as predictive factors for recurrence in early gastric cancer[J].Chin J Clin Oncol,2008,5(2):122-124.
[6]SAKA M,KATAI H,FUKAGAWA T,et al.Recurrence in early gastric cancer with lymph node metastasis[J].Gastric Cancer,2008,11(4):214-218.
[7]YOUN HG,AN JY,CHOI MG,et al.Recurrence after curative resection of early gastric cancer[J].Ann Surg Oncol,2010,17(2): 448-454.
[8]GOTODA T,YANAGISAWA A,SASAKO M,et al.Incidence of lymph node metastasis from early gastric cancer:estimation with a large number of cases at two large centers[J].Gastric Cancer,2000,3(4):219-225.
[9]黄宝俊,鲁翀,徐莹莹,等.292例早期胃癌淋巴结转移规律的研究[J].中华外科杂志,2007,45(3):192-195.
[10]OHDAIRA H,NIMURA H,MITSUMORI N,et al.Validity of modified gastrectomy combined withsentinel node navigation surgery for early gastric cancer[J].Gastric Cancer,2007,10(2): 117-122.
[11]田小溪,赵晓晏,王雷,等.内镜超声与仿真CT检查在胃癌分期诊断中的对比研究[J].中华消化内镜杂志,2007,24(2):83-86.
[12]BHANDARIS,SHIMCS,KIMJH,etal.Usefulnessof three-dimensional,multidetector row CT(virtual gastroscopy and multiplanar reconstruction)in the evaluation of gastric cancer:a comparison with conventional endoscopy,EUS,and histopathology[J]. Gastrointest Endosc,2004,59(6):619-626.
[13]PARK YS,LEE D,LEE DH,et al.Assessment of factors affecting the accuracy of endoscopic ultrasonography in T2 stage gastric cancer[J].Korean J Gastroenterol,2008,52(2):86-90.
[14]KWEE RM,KWEE TC.Imaging in assessing lymph node status in gastric cancer[J].Gastric Cancer,2009,12(1):6-22.
[15]HIRASAWA T,GOTODA T,MIYATA S,et al.Incidence of lymph node metastasis and the feasibility of endoscopic resectionforundifferentiated-typeearlygastriccancer[J].Gastric Cancer,2009,12(3):148-152.
[16]KIM DY,JOO JK,RYU SY,et al.Factors related to lymph node metastasis and surgical strategy used to treat early gastric carcinoma[J].World J Gastroenterol,2004,10(5):737-740.
[17]王婕敏,周丽雅,林三仁,等.早期胃癌淋巴结转移规律及其影响因素分析[J].中华内科杂志,2010,49(4):297-300.
[18]KIM BS,OH ST,YOOK JH,et al.Signet ring cell type and other histologic types:differing clinical course and prognosis in T1 gastric cancer[J].Surgery,2014,155(6):1030-1035.
[19]范晓飞,戈之铮,高云杰,等.早期胃癌淋巴结转移规律及内镜切除指征的探讨[J].中华消化内镜杂志,2013,30(11):626-630.
[20]Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2010(ver.3)[J].Gastric Cancer,2011,14(2): 113-123.
[21]YOSHINAGA S,ODA I,NONAKA S,et al.Endoscopic ultrasoundusingultrasoundprobesforthediagnosisofearly esophageal and gastric cancers[J].World J Gastrointest Endosc,2012,4(6):218-226.
(吴静编辑)
Lymph node metastasis in early gastric cancer and the feasibility of endoscopic resection
Yu-hui ZHOU,Zhen-zhai CAI,Guang-rong LU,Meng-si YE,Yun HE,Zhan-xiong XUE
(Department of Gastroenterology,the Second Affiliated Hospital&Yuying Children's Hospital of Wenzhou Medical University,Wenzhou,Zhejiang 325000,P.R.China)
【Objective】To investigate the risk factors of lymph node metastasis(LNM)of early gastric cancer (EGC)and to explore the feasibility of endoscopic resection(ER).【Methods】Seven clinicopathological features of the 417 patients who underwent a curative gastrectomy were analyzed,including sex,age,tumor size,depth of tumor invasion,tumor location,microscopic type,and histological type.These factors were assessed for their possible association with lymph node metastasis by using univariate and multivariate analysis.【Results】The incidence of lymph node metastasis of early gastric cancer was 13.9%(58/417),only 11(5.3%)intramucosal cancers compared with 47 (22.5%)invasive cancers were associated with LNM.By multivariate analysis,sex(P=0.050),tumor size(P= 0.047),depth of tumor invasion(P=0.000)and histological type(P=0.000)were independent risk factors for lymph node metastasis.In male patients with differentiated type and mucosal invasion,which were 2.0 cm or less in tumor diameter,no LNM was detected.【Conclusion】We propose male patients with differentiated type intramucosal EGC 2.0cm or less in size can be performed by EMR/ESD,but its accuracy remains to be verified by large sample analysis in the future.
early gastric cancer;lymph node metastasis;risk factors;endoscopic resection
R735.2
A
1007-1989(2015)10-1023-05
2015-03-02
薛战雄,E-mail:xuezhanxiong@126.com,Tel:0577-88002725