Pt/TiO2纳米纤维的制备及其对甲醇的电催化氧化活性
2015-08-15王诗贤赵万隆章能能郑颖平孙岳明东南大学化学化工学院南京211189
陈 红 王诗贤 赵万隆 章能能 郑颖平 孙岳明(东南大学化学化工学院,南京211189)
Pt/TiO2纳米纤维的制备及其对甲醇的电催化氧化活性
陈红王诗贤赵万隆章能能郑颖平*孙岳明*
(东南大学化学化工学院,南京211189)
采用静电纺丝技术结合还原浸渍法制备了Pt/TiO2纳米纤维电催化剂,通过X射线衍射(XRD)分析、扫描电镜(SEM)、透射电镜(TEM)和X射线能谱(EDS)等测试手段对样品的晶相、形貌、微结构和化学组成进行了表征.测试结果表明,TiO2纳米纤维为锐钛矿和金红石组成的混晶,Pt纳米颗粒均匀地分布于TiO2纳米纤维的表面,且Pt颗粒大小较均一,平均粒径为4.0 nm,Pt/TiO2纳米纤维中Pt的质量分数约为20%.采用三电极体系的循环伏安和计时电流电化学分析方法研究了样品在酸性溶液中对甲醇的电催化氧化活性,结果表明,与负载相同质量分数Pt的Pt/P25和商业Pt/C催化剂相比较,Pt/TiO2纳米纤维催化剂对甲醇呈现出较高的电催化氧化活性和更好的稳定性.
静电纺丝;二氧化钛纳米纤维;Pt纳米颗粒;甲醇;催化氧化
www.whxb.pku.edu.cn
1 引言
直接甲醇燃料电池(DMFCs)因具有能量密度高、来源丰富及成本低廉等优点,成为目前被广泛研究的燃料电池之一.但Pt基阳极催化剂的成本较高、催化效率低、易中毒以及稳定性较差等因素限制了DMFCs广泛的商业应用.1,2室温下,纯Pt催化氧化甲醇的效率很低,这是因为在催化氧化甲醇过程中会产生很多中间毒物,其中的CO会强烈吸附在Pt的活性表面,导致催化剂失效.3-6近年来,Pt基阳极催化剂的研究主要集中在以下几个方面,7(a)PtM合金纳米催化剂,7,8通过向Pt催化剂中添加其他非贵金属来减少Pt的用量,同时提高催化剂的稳定性;10(b)特殊结构Pt基纳米催化剂的合成,如核壳结构、11,12空心结构10,13以及纳米多孔结构,14,15结构上的特性不仅提高了电催化活性,而且减少了贵金属Pt的用量;16(c)高指数晶面Pt基纳米材料17,18的研究,即高指数晶面的催化活性要远高于常规晶面,一般采用化学方法或电化学方法来合成具有高指数晶面的Pt基纳米材料,从而进一步提高单位质量Pt的催化性能;19(d)选择理想的载体材料,载体材料的性质对催化剂的性能有较大的影响,研发具有好的导电性、大的比表面积、合理的孔隙结构和优异的抗腐蚀性能等特点的载体材料也是提高催化剂性能的有效途径之一.20目前常用的铂基催化剂为碳载Pt系列催化剂(Pt/C),该系列催化剂利用碳材料的高比表面积和良好的导电性来分散催化剂活性组分Pt,以实现其较高的催化活性.但Pt/C催化剂在电势高于0.9 V(vs RHE(可逆氢电极))时容易发生碳腐蚀,21影响了电池的催化效率及使用寿命.为了进一步提高催化剂的催化性能,研究者们开始将金属氧化物作为载体材料,如SnO2、22,23WO3、24,25CeO226-28和TiO229,30等.其中,TiO2因成本低廉、无毒及其在酸碱性及氧化还原条件下具备良好的稳定性4,5等独特优势备受研究者们的青睐.有研究表明,TiO2载体与贵金属之间存在强相互作用,Pt、Ag、Ir、Au、Ru和Pd等贵金属催化剂掺杂TiO2后,可使催化活性大大提高.33
本文通过静电纺丝技术制备了TiO2纳米纤维,以其为载体通过还原浸渍法负载Pt,制得Pt/TiO2纳米纤维催化剂.该催化剂在酸性条件下对甲醇具有较高的催化活性及稳定性,在燃料电池的研究中具有良好的应用前景.
2 实验部分
2.1试剂与仪器
Pt/C商业催化剂(20%(w),Johnson Matthey (Shanghai)Catalyst Co.,Ltd.),商业TiO2纳米粉体(P25 Degussa),钛酸异丙酯(TTIP,Mw=284.22)、聚乙烯吡咯烷酮(PVP,Mw=1300000)(Sigma Corporation of America),冰醋酸(CH3COOH,Mw=60.05,分析纯,上海申博化工有限公司),六水氯铂酸(H2PtCl6· 6H2O,Mw=517.92)、硼氢化钠(NaBH4,Mw=37.83,分析纯,国药集团化学试剂有限公司),实验中均采用二次去离子水.
样品的物相表征使用的是德国Bruker公司生产的D8 Advance型X射线衍射(XRD)仪,测试时采用Cu,Kα射线源(λ=0.1541 nm),扫描范围为10°-70°,扫速8(°)·min-1,步长为0.15°;样品微结构分析使用G2 T20(FEI),Tecnai型号的透射电镜(TEM),加速电压为200 kV;样品表面微观形貌分析使用FEI Inspect F50型号的扫描电镜(SEM);样品的化学组成分析采用X射线能量散射(EDS)谱.电化学测试所用的仪器为CHI760D电化学工作站(上海辰华有限公司).
2.220%(w)Pt/TiO2电催化剂的制备
TiO2纳米纤维采用溶胶-凝胶法结合静电纺丝技术进行制备.将适量PVP溶于无水乙醇,充分搅拌后,向溶液中加入一定量的CH3COOH及TTIP,并于室温下磁力搅拌,获得均一透明的纺丝液.其中金属盐的质量分数(w)为25.53%,PVP为3.2%(w).将纺丝溶液转移至安装有20 G金属针头的3 mL注射器,环境湿度<40%、温度25°C的条件下进行静电纺丝,溶液流速为0.3 mL·h-1,接收距离为15 cm,直流电压为16 kV,铝箔作为纺丝接收器.将收集的无纺布薄膜的聚合物/无机盐(PVP/TiO2)复合纳米纤维置于马弗炉中600°C煅烧3 h,得到载体TiO2纳米纤维材料.
采用浸渍法34制备20%(w)Pt/TiO2催化剂.首先按化学计量比将TiO2纳米纤维加入适量20 g·L-1的H2PtCl6·6H2O溶液中,混合液超声0.5 h,继续搅拌2 h.然后将上述混合液放入80°C水浴中加热并不断搅拌,加入配制好的0.4 mol·L-1的NaBH4溶液.反应结束后,将溶液过滤并用大量去离子水冲洗.最后置于真空干燥箱中110°C加热4 h,得到灰色样品Pt/TiO2纳米纤维催化剂.用同样的方法制备20%(w)Pt/P25催化剂.
2.3电化学测试
电化学测试在温度为30°C,常压三电极体系下测试.其中,涂覆催化剂浆料的玻碳电极为工作电极,Pt丝电极(Φ=0.5 mm)为辅助电极,饱和甘汞电极(SCE)作为参比电极.进行所有电化学测试之前都先向溶液中通氮气半小时,以除去溶液中氧气的干扰.电压范围为-0.242-0.958 V(vs SCE).电化学测试所用电解质溶液为0.5 mol·L-1H2SO4+1.0 mol· L-1CH3OH,其中,甲醇氧化测试以50 mV·s-1的扫描速率进行.计时电流测试在电势为0.4 V进行,测试时间为1 h.

图1 PVP/TiO2纳米纤维煅烧的SEM图Fig.1 SEM images of calcining PVP/TiO2nanofibers (a)before calcining;(b)after calcining;PVP:polyvinyl pyrrolidone
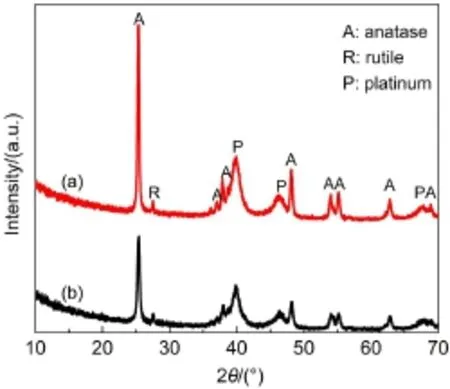
图2 各催化剂的XRD图Fig.2 XRD patterns of catalysts(a)Pt/TiO2nanofibers;(b)Pt/P25
3 结果与讨论
3.1催化剂的结构和形貌
图1是通过静电纺丝法制备的PVP/TiO2纳米纤维在空气气氛中600°C煅烧3 h前后的SEM图,由图1a可以看出,煅烧前纳米纤维材料的直径为100-300 nm,粗细较均匀且不存在蛛丝,这说明在实验条件下纺丝效果较为理想.图1b为煅烧后得到的TiO2纳米纤维,直径为50-200 nm,比煅烧前直径明显变小.这是因为在煅烧过程纳米纤维中的PVP被大量选择性烧除.
图2为负载相同质量分数的Pt纳米颗粒的Pt/ TiO2纳米纤维和Pt/P25催化剂的XRD图谱.其中2θ 为25.3°、37.8°、48.1°等处的衍射峰可归属为锐钛矿型TiO2(PDF No.21-1272)的特征衍射峰;2θ为27.4°和36.1°处衍射峰可归属为金红石型TiO2(PDF No.21-1276)的特征衍射峰.因此,静电纺丝所制备的载体TiO2纳米纤维及商业P25均是由锐钛矿和金红石型形成的混晶.图2中2θ为39.6°、46.1°及67.5°出现的衍射峰分别对应Pt(111)、Pt(200)和Pt (220)晶面特征峰,与标准卡片(PDF No.87-0642)相一致.结果表明,所制备的Pt纳米颗粒为多晶铂的面心立方结构.35由于XRD图谱中Pt(111)晶面特征峰不受载体干扰,由Pt(111)晶面的半峰宽利用Debye-Sherrer公式36可计算晶粒大小:

其中,θ为X射线的入射角,β为半峰宽,λ为X射线的波长,D为晶粒在垂直于(hkl)晶面方向的平均厚度,即是通常所说的晶粒大小,可计算出催化剂中Pt颗粒的平均粒径约为4.5 nm.
图3为高温煅烧后所得载体TiO2纳米纤维、Pt/ TiO2纳米纤维催化剂和Pt/P25催化剂的TEM图及相应的Pt纳米颗粒粒径分布图.由图3a可知,高温煅烧后所得TiO2纳米纤维由许多取向不一的晶粒组成且结晶良好;图3(b,d)中,TiO2纳米纤维表面均匀地负载Pt纳米颗粒,图中显示所负载的Pt纳米颗粒无团聚现象,平均粒径为4.0 nm,与XRD分析结果基本一致;图3(c,e)中,Pt颗粒均匀分散于TiO2粉体颗粒(P25)的表面,其中Pt纳米颗粒尺寸平均值为3.8 nm,商业TiO2纳米颗粒取向不一,粒径范围为20-30 nm.Pt/TiO2纳米纤维及Pt/P25催化剂经EDS测试,样品中均含有元素Ti、O及Pt元素,且Pt纳米颗粒的质量分数分别为20.35%和20.59%.
3.2电化学表征
图4为不同催化剂在0.5 mol·L-1H2SO4溶液中的循环伏安测试曲线.循环伏安曲线(a)表明,Pt/ TiO2纳米纤维催化剂中存在金属Pt,图中正向扫描电势范围0.7-0.9 V处发生Pt氧化,逆向扫描约0.4 V处为Pt表面氧化物还原峰.由图4看出,在电势范围-0.2-0.1 V区域,三种催化剂都有明显的氢吸附解吸峰,呈现出多晶铂特征.由氢吸附解吸区的峰大小结合以下公式34可以计算催化剂活性表面积(SPt):

其中,QH为氢吸附解吸区除去双电层的电量,0.21为光滑Pt表面吸附单层氢所需的电量(mC·cm-2),SPt值见表1.Pt/TiO2纳米纤维催化剂活性表面积明显大于Pt/P25,这可能归因于TiO2纳米纤维与Pt之间存在更强的协同作用.37图中商业Pt/C催化剂具有最大的双电层电容(电势范围为0.1-0.4 V).

图3 各样品的TEM图(a-e)及其Pt粒径分布图(f,g)Fig.3 TEM images(a-e)and Pt particle size distribution(f,g)of samples(a)TiO2nanofibers,(b,d,f)Pt/TiO2nanofibers,(c,e,g)Pt/P25
图5为Pt/TiO2纳米纤维、Pt/P25和商业Pt/C催化剂在0.5 mol·L-1H2SO4+1.0 mol·L-1CH3OH溶液中的循环伏安曲线.从图中可以看出,三种催化剂催化氧化甲醇的起始氧化峰电位在0.40 V左右,在0.6-0.65 V出现甲醇催化氧化峰,逆向扫描过程在约0.47 V出现另一氧化峰,该峰是由于甲醇催化氧化不完全而产生的中间产物氧化峰.
图5中纵坐标的电流密度(j)是由循环伏安测试所得电流(I)除以催化剂的活性表面积得到,即:j=I/SPt.一般而言,正扫峰电势越低,所对应电流密度越大则说明该催化剂吸附及催化甲醇的性能越好.38图5获得的各样品对甲醇电催化活性参数列于表1.根据表1数据得知,三种催化剂中Pt/TiO2纳米纤维催化剂的甲醇氧化峰起始电势Es最小,甲醇催化氧化峰电势Ep(0.638V)大于Pt/P25催化剂的值(0.608V)而小于商业Pt/C催化剂的值(0.656V),Pt/P25和商业Pt/C催化剂的甲醇催化氧化峰电流密度jp很接近,而Pt/TiO2纳米纤维催化剂则约为它们的1.7倍.综上所述,实验中三种催化剂对甲醇都具有一定的催化氧化活性,其中Pt/TiO2纳米纤维催化活性最好.对于反应中间毒物的催化氧化,由表1数据结合图5可知,Pt/TiO2纳米纤维催化剂的中间毒物氧化峰电势值Eb与Pt/P25催化剂接近而小于商业Pt/C催化剂(0.483V).Pt/TiO2纳米纤维催化剂和Pt/P25催化剂的峰电流密度比值jp/jb分别为1.01和1.32,大于商业Pt/C催化剂(0.68).因而,Pt/TiO2纳米纤维和Pt/P25催化剂催化氧化甲醇中间毒物的能力均强于商业Pt/C催化剂,其原因可能是当TiO2为载体时,其表面吸附的―OH物种能降低中间毒物的吸附能,从而促进了Pt纳米颗粒催化氧化中间毒物的能力.39就载体TiO2而言,其自身具有优越的表面效应和一定的催化活性,33当载体为P25时,其表面效应大于相同体积的TiO2纳米纤维,使得Pt/P25催化活性得到进一步提高,即Pt/P25催化剂的峰电流密度比值jp/jb(1.32)大于Pt/TiO2纳米纤维(1.01).Pt/TiO2纳米纤维对甲醇的催化氧化活性以及催化氧化甲醇中间毒物的能力接近文献报道的Pt/TiO2纳米管性能.34
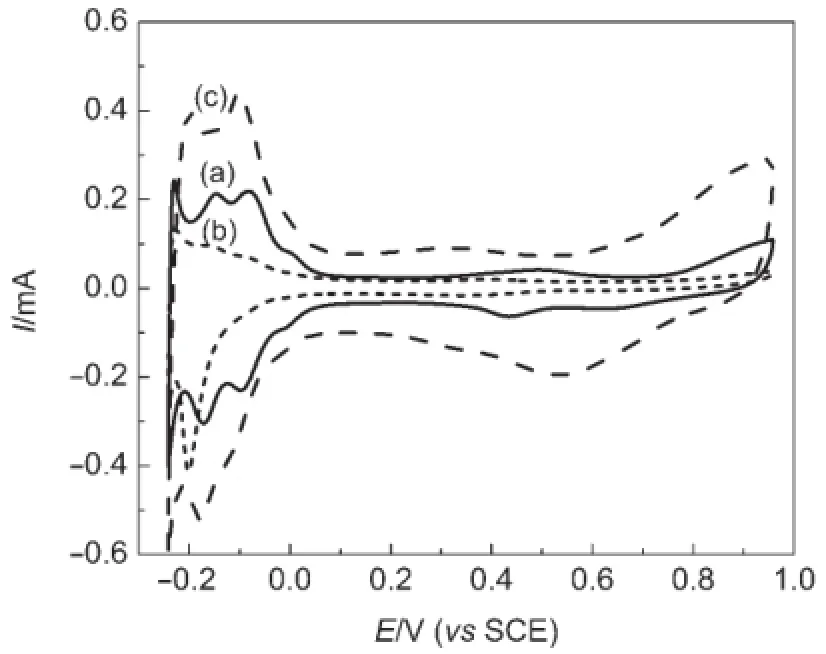
图4 不同催化剂在0.5 mol·L-1H2SO4溶液中的循环伏安曲线Fig.4 Cyclic voltammogram curves of different catalysts in 0.5 mol·L-1H2SO4solution(a)Pt/TiO2nanofibers,(b)Pt/P25,(c)Pt/C;30°C,50 mV·s-1

图5 甲醇氧化催化剂在0.5 mol·L-1H2SO4+1.0 mol·L-1CH3OH溶液中的循环伏安曲线Fig.5 Cyclic voltammogram curves of catalysts for methanol oxidation in 0.5 mol·L-1H2SO4+1.0 mol·L-1CH3OH solution(a)Pt/TiO2nanofibers,(b)Pt/P25,(c)Pt/C;30°C,50 mV·s-1

表1 样品对甲醇的电催化活性Table 1 Electrocatalytic activities of the samples for methanol
稳定的电极催化剂是燃料电池得以应用的关键因素之一.1图6为三种催化剂在0.5 mol·L-1H2SO4+ 1.0 mol·L-1CH3OH溶液中0.4 V时的计时电流曲线.随着反应的进行,三种催化剂上的甲醇氧化电流密度均呈现明显的下降趋势,这与反应过程中CO和类CO毒化中间物种在催化剂表面的累积以及SO2-在催化剂表面的吸附有关.40,41起始脉冲电流密
4度大小为:商业Pt/C催化剂(0.175 mA·cm-2)>Pt/ TiO2纳米纤维催化剂(0.137 mA·cm-2)>Pt/P25催化剂(0.073 mA·cm-2),电流密度随时间的推移迅速衰减,随后中间产物达到吸脱附平衡,其氧化电流最后趋于稳定.在反应进行1 h后,Pt/TiO2纳米纤维催化剂表现出较高的催化活性,衰减最大的为商业Pt/C催化剂.其原因可能是商业Pt/C催化剂在长时间催化氧化甲醇过程中载体碳材料易发生腐蚀,使得其在电解液中的电流密度不断减小,稳定性变差.而TiO2在酸性环境中有极好的稳定性,其表面吸附的―OH能增强Pt电极的抗中毒能力,42与图5获得的结论一致.综上所述,Pt/TiO2纳米纤维催化剂具有较高的抗中间毒物能力和更好的稳定性.
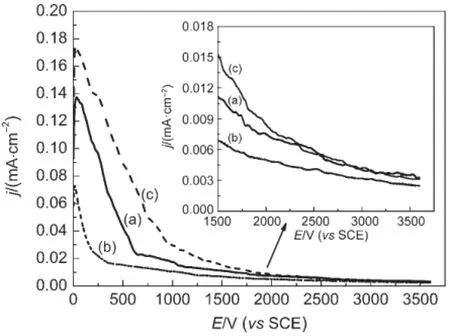
图6 不同甲醇氧化催化剂在0.5 mol·L-1H2SO4+1.0 mol· L-1CH3OH溶液中的计时电流曲线Fig.6 Chronoamperometry curves of the different catalysts for methanol oxidation in 0.5 mol·L-1H2SO4+1.0 mol·L-1CH3OH solution(a)Pt/TiO2nanofibers,(b)Pt/P25;(c)Pt/C;30°C
4 结论
采用静电纺丝技术并通过高温煅烧制备了TiO2纳米纤维,利用还原浸渍法将Pt纳米颗粒负载于其表面,得到Pt/TiO2纳米纤维电催化剂.与含相同质量分数Pt的Pt/P25和商业Pt/C催化剂相比,在相同实验条件下,Pt/TiO2纳米纤维电催化剂显示出最优的甲醇催化氧化活性,并且其抗中间毒物能力大于商业Pt/C催化剂.这是因为Pt纳米颗粒能均匀地分布于载体TiO2纳米纤维表面,并且存在较强的相互作用.计时电流测试表明,Pt/TiO2催化剂具有比Pt/ P25和商业Pt/C催化剂更好的稳定性.由于载体TiO2纳米纤维制备工艺简单,成本低廉,对Pt纳米颗粒有良好的分散性及对甲醇良好的催化氧化活性和稳定性等特点,对DMFCs电极材料的研究具有一定的指导意义.
References
(1)Wang,L.;Ma,J.H.Acta Phys.-Chim.Sin.2014,30(7),1267.[王丽,马俊红.物理化学学报,2014,30(7),1267.]doi:10.3866/PKU.WHXB201405052
(2)Seiler,T.;Savinova,E.R.;Friedrich,K.A.;Stimming,U. Electrochimica Acta 2004,49(22),3927.
(3)Léger,J.M.;Rousseau,S.;Coutanceau,C.;Hahn,F.;Lamy,C. Electrochimica Acta 2005,50(25),5118.
(4)Ávila-García,I.;Ramírez,C.;Hallen López,J.M.;Arce Estrada E.M.J.Alloy.Compd.2010,495,462.doi:10.1016/j. jallcom.2009.10.210
(5)Selvaraj,V.;Alagar,M.Electrochem.Commun.2007,9(5),1145.doi:10.1016/j.elecom.2007.01.011
(6) Gojković,S.L.J.Electroanal.Chem.2004,573(2),271.doi:10.1016/j.jelechem.2004.07.013
(7)Zhou,X.W.;Gan,Y.L.;Du,J.J.;Tian,D.N.;Zhang,R.H.;Yang,C.Y.;Dai,Z.X.J.Power Sources 2013,232,310.doi:10.1016/j.jpowsour.2013.01.062
(8)Wang,C.;Markovic,N.M.;Stamenkovic,V.R.ACS Catal. 2012,2,891.doi:10.1021/cs3000792
(9)Bing,Y.;Liu,H.;Zhang,L.;Ghosh,D.;Zhang,J.Chem.Soc. Rev.2010,39,2184.doi:10.1039/b912552c
(10)Zhou,X.W.;Gan,Y.L.;Sun,S.G.Acta Phys.-Chim.Sin.2012,28(9),2071.[周新文,甘亚利,孙世刚.物理化学学报,2012,28(9),2071.]doi:10.3866/PKU.WHXB201205031
(11)Ghosh,C.R.;Santanu,P.Chem.Rev.2012,112,2373.doi:10.1021/cr100449n
(12)Liu,B.;Liao,S.;Liang,Z.Prog.Chem.2011,23,852.
(13)Lai,X.;Halperta,J.E.;Wang,D.Energy Environ.Sci.2012,5,5604.doi:10.1039/c1ee02426d
(14)Menzel,N.;Ortel,E.;Kraehnert,R.;Strasser,P. ChemPhysChem 2012,13,1385.doi:10.1002/cphc.v13.6
(15)McCurry,D.A.;Kamundi,M.;Fayette,M.;Wafula,F.;Dimitrov,N.ACS Appl.Mater.Interfaces 2011,3,4459.doi:10.1021/am2011433
(16)Ataee-Esfahani,H.;Nemoto,Y.;Wang,L.;Yamauchi,Y.Chem. Commun.2011,47(13),3885.
(17)Deng,Y.J.;Tian,N.;Zhou,Z.Y.;Huang,R.;Liu,Z.L.;Xiao,J.;Sun,S.G.;Chem.Sci.2012,3,1157.doi:10.1039/ c2sc00723a
(18)Liu,H.X.;Tian,N.;Brandon,M.P.;Zhou,Z.Y.;Lin,J.L.;Hardacre,C.;Lin,W.F.;Sun,S.G.ACS Catal.2012,2,708.doi:10.1021/cs200686a
(19)Tian,N.;Zhou,Z.Y.;Yu,N.F.;Sun,S.G.J.Am.Chem.Soc. 2010,132,7580.doi:10.1021/ja102177r
(20)Luo,B.M.;Yan,X.B.;Xu,S.;Xue,Q.J.Electrochimica Acta 2012,59,429.
(21)Park,K.W.;Seol,K.S.Electrochem.Commun.2007,9(9),2256.doi:10.1016/j.elecom.2007.06.027
(22)Lou,X.W.;Deng,D.;Lee,J.Y.;Archer,L.A.J.Mater.Chem. 2008,20(20),6562.doi:10.1021/cm801607e
(23)Pang,H.L;Zhang,X.H.;Zhong,X.X.;Liu,B.;Wei,X.G.;Kuang,Y.F.;Chen,J.H.J.Colloid Interface Sci.2008,319(1),193.doi:10.1016/j.jcis.2007.10.046
(24)Jayaraman,S.;Jaramillo,T.F.;Baeck,S.H.;McFarland,E.W. J.Phys.Chem.B 2005,109(48),22958.doi:10.1021/ jp053053h
(25)Cui,Z.;Feng,L.;Liu,C.;Xing,W.J.Power Sources 2011,196 (5),2621.doi:10.1016/j.jpowsour.2010.08.118
(26)Campos,C.L.;Roldán,C.;Aponte,M.;Ishikawa,Y.;Cabrera,C.R.J.Electroanal.Chem.2005,581(2),206.doi:10.1016/j. jelechem.2005.04.002
(27)Gu,D.M.;Chu,Y.Y.;Wang,Z.B.;Jiang,Z.Z.;Yin,G.P.;Liu,Y.Appl.Catal.B 2011,102(1),9.
(28)Neto,A.O.;Farias,L.A.;Dias,R.R.;Brandalise,M.;Linardi,M.;Spinacé,E.V.Electrochem.Commun.2008,10(9),1315. doi:10.1016/j.elecom.2008.06.023
(29)Yoo,S.J.;Jeon,T.Y.;Lee,K.S.;Park,K.W.;Sung,Y.E. Chem.Commun.2010,46(5),794.doi:10.1039/b916335b
(30)Murdoch,M.;Waterhouse,G.I.N.;Nadeem,M.A.;Metson,J. B.;Keane,M.A.;Howe,R.F.;Llorca,J.;Idriss,H.Nature Chem.2011,3(6),489.
(31)Chen,M.S.;Goodman,D.W.Science 2004,306(5694),252. doi:10.1126/science.1102420
(33)Ma,C.A.;Yu,B.;Shi,M.Q.;Lang,X.L.Electrochemistry 2011,17(2),149.[马淳安,俞彬,施梅勤,郎小玲.电化学,2011,17(2),149.]
(34)Abida,B.;Chirchi,L.;Baranton,S.;Napporn,T.W.;Kochkar,H.;Léger,J.M.;Ghorbe,A.Appl.Catal.B 2011,106(3),609.
(35)Zhou,Y.;Chu,Y.Q.;Liu,W.M.;Ma,C.A.Acta Phys.-Chim. Sin.2013,29(2),287.[周阳,褚有群,刘委明,马淳安.物理化学学报,2013,29(2),287.]doi:10.3866/PKU. WHXB201211261
(36)Porter,J.F.;Li,Y.G.;Chan,C.K.J.Mater.Sci.1999,34(7),1523.doi:10.1023/A:1004560129347
(37)Liu,X.;Chen,J.;Liu,G.;Zhang,L.;Zhang,H.;Yi,B.J.Power Sources 2010,195(13),4098.doi:10.1016/j. jpowsour.2010.01.077
(38)Lin,M.C.Study on the Performance ofAnode Catalyst of Direct Methanol Fuel Cell.Ph.D.Dissertation,Shanghai Jiao Tong University,Shanghai,2008.[林茂财.直接甲醇燃料电池阳极催化剂的性能研究[D].上海:上海交通大学,2008.]
(39)Xing,L.;Jia,J.;Wang,Y.;Zhang,B.;Dong,S.J.Int.J.Hydrog. Energy 2010,35(22),12169.doi:10.1016/j. ijhydene.2010.07.162
(40)Hoster,H.;Iwasita,T.;Baumgärtner.H.;Vielstich,W.Phys. Chem.Chem.Phys.2001,3(3),337.doi:10.1039/b004895j
(41)Jiang,J.;Kucernak,A.J.Electroanal.Chem.2003,543(2),187.doi:10.1016/S0022-0728(03)00046-9
(42)Fan,Y.;Yang,Z.;Huang,P.;Zhang,X.;Liu,Y.M. Electrochimica Acta 2013,105,157.doi:10.1016/j. electacta.2013.04.158
Preparation of Pt/TiO2Nanofibers and Their Electrocatalytic Activity towards Methanol Oxidation
CHEN HongWANG Shi-XianZHAO Wan-LongZHANG Neng-Neng ZHENG Ying-Ping*SUN Yue-Ming*
(College of Chemistry and Chemical Engineering,Southeast University,Nanjing 211189,P.R.China)
A Pt/TiO2nanofiber catalyst has been prepared through the combination of an electrospinning technique with a reductive impregnation method.The compositions,morphologies and structures of the samples were characterized by X-ray diffraction(XRD),scanning electron microscopy(SEM),transmission electron microscopy(TEM),and energy dispersive spectroscopy(EDS).The results showed that the crystal phase of the TiO2nanofibers was composed of anatase and rutile TiO2.Pt nanoparticles were found to be uniformly distributed on the surface of the TiO2nanofibers with an average size of 4.0 nm.The mass fraction of Pt in the Pt/TiO2nanofiber catalyst was about 20%.The electrocatalytic activities of the samples towards the oxidation of methanol were measured by cyclic voltammetry and chronoamperometry using a three-electrode system in an acidic solution.Compared with Pt/P25 and commercial Pt/C catalysts containing the same quality percentage of Pt nanoparticles,the Pt/TiO2nanofiber catalyst exhibited higher catalytic activity towards the oxidation of methanol and better stability.
Electrospinning;TiO2nanofiber;Pt nanoparticle;Methanol;Catalytic oxidation
September 18,2014;Revised:December 3,2014;Published on Web:December 3,2014.
O646
10.3866/PKU.WHXB201412031
Tel:+86-25-52090619-6311,52090621.
The project was supported by the National Program on Key Basic Research Project,China(973)(2013CB932902),National Natural Science
Foundation of China(21173042),Scientific and TechnologicalAchievements Transformation Special Foundation of Jiangsu Province,China
(BA2014069),and Industrial Supporting Project Foundation of Jiangsu Province,China(BE20130118).
国家重点基础研究发展规划项目(973)(2013CB932902),国家自然科学基金(21173042),江苏省科技成果转化专项基金(BA2014069)及江苏省工业支撑项目(BE20130118)资助
©Editorial office ofActa Physico-Chimica Sinica
