帕金森病患者神经精神症状及其影响因素研究
2015-08-14武冬冬李淑华苏闻蔡晓杰金丽莹金莹崔艺耀赵鸿陈海波
武冬冬 李淑华 苏闻 蔡晓杰 金丽莹 金莹 崔艺耀 赵鸿 陈海波
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统变性疾病,运动系统症状为其主要临床表现,同时合并认知功能下降、自主神经系统症状及精神症状等多种非运动系统症状。国外报道PD患者精神症状的发生率为25%~50%[1],精神症状增加了对患者的护理负担,甚至超过运动症状成为影响PD患者生活质量和生存寿命的关键因素。简明精神病评定量表(brief psychiatric rating scale,BPRS)是全球精神科广泛应用的专业评定量表,其有效性和可靠性已得到普遍验证,国外学者常将其用于评估PD的精神症状,而目前国内相关报道较少。该研究应用BPRS对209例PD患者的神经精神症状展开调查,以期了解PD患者神经精神症状的发生率及分布情况,并对各神经精神症状间的相互关系和影响因素进行分析。
1 对象和方法
1.1 观察对象 连续收集2012-01-2015-01北京医院神经内科PD门诊就诊的PD患者209例,其中男100例,女109例,年龄30~87岁,平均(66.25±9.93)岁;病程为1~22年,中位数为6年,四分位数间距为6.5年;受教育时间为0~22年,中位数为12年,四分位数间距为7年。患者均符合英国PD协会脑库的诊断标准:缓慢起病,具有运动迟缓加上静止性震颤、强直2项中的1项,左旋多巴治疗试验有效,排除帕金森综合征和帕金森叠加综合征。无其他神经系统疾病,无精神分裂症等病史及服用抗精神病药物史。
1.2 方法
1.2.1 临床资料收集:收集患者一般临床资料,包括年龄、性别、病程、抗PD药物种类及左旋多巴等效剂量〔levodopa equivalent doses,LED;换算公式[2]:LED=左旋多巴标准片×l+左旋多巴控释片×0.75+甲磺酸培高利特片×100+甲磺酸溴隐亭片×10+(左旋多巴标准片×1+左旋多巴控释片×0.75)×0.25(同时服用恩他卡朋片)+甲磺酸-α-二氧麦角隐亭片×1.7+吡贝地尔缓释片×1+盐酸普拉克索片×100+盐酸司来吉兰片×10〕、受教育程度等。在此基础上应用统一帕金森病评定量表 (unified Parkinson disease rating scale,UPDRS)第三部分(UPDRSⅢ)、修订 Hoehn-Yahr(H-Y)分期对疾病运动严重程度进行评分;认知功能采用简易精神状态检查量表(minimum mental state examination,MMSE)进行评分;生活质量采用帕金森病生活质量问卷(the 39-item Parkinson disease questionnaire,PDQ-39)进行评分;睡眠质量采用帕金森病睡眠量表(Parkinson disease sleep scale,PDSS)进行评分;情绪方面采用汉密尔顿抑郁量表(the Hamilton rating scale for depression,HAMD)和汉密尔顿焦虑量表(the Hamilton rating scale for anxiety,HAMA)进行评分。入组患者H-Y分期在0~1.5期共61例(29.19%),2~2.5期97例(46.41%),3~5.0期51例(24.40%);UPDRS Ⅲ平均分数(27.49±13.20)分;MMSE 平均分数(26.49±5.39)分;PDQ-39得分中位数为24分,四分位数间距为25.5分;PDSS得分中位数为118分,四分位数间距为33分;HAMD得分中位数为8分,四分位数间距为7分;HAMA得分中位数为9分,四分位数间距为8分。服用左旋多巴类药物的患者共168例(80.38%),服用多巴胺激动剂者共123例(58.85%),服用单胺氧化酶B型抑制剂者共34例(16.27%),服用儿茶酚-氧位-甲基转移酶抑制剂者共35例(16.75%),服用金刚烷胺者共57例(27.27%),服用安坦者共20 例(9.57%)。LED中位数为450mg,四分位数间距为512.5mg。
1.2.2 神经精神症状调查:采用BPRS进行评定,包括20个项目,每项目按7级评分(1:无症状,2:很轻,3:轻度,4:中度,5:偏重,6:重度,7:极重),并把前18项归纳为5个分量表(包括焦虑抑郁、缺乏活力、思维障碍、激活性、敌对猜疑),计算出各个分量表得分及20项的总分。以上所有问卷及量表均由经过专门培训的神经科医师完成评分,对于有症状波动的患者,选择在“开”期进行。此外,数据的采集、核对和录入均由专职人员进行严格的质量控制。
1.3 统计学处理 采用SPSS 19进行统计学分析。符合正态分布的计量资料以均数±标准差表示,两均数间比较采用独立样本t检验;非正态分布的计量资料以中位数和四分位数间距表示,采用Mann-Whitney U 检验;计数资料以率表示,采用卡方检验;各神经精神症状与各临床特征的相关性、各神经精神症状之间的相关性采用Pearson相关分析;采用线性逐步多元回归分析探讨神经精神症状的影响因素,假定该回归模型的数据符合线性、正态性、方差齐,引入变量P值定为0.05,剔除变量P值定为0.10。统计学显著性标准取α=0.05。
2 结果
2.1 各神经精神症状发生率及分布情况 209例患者在BPRS评定的20项症状中发生率较高的前3位依次为动作迟缓(84.21%)、关心身体健康(66.51%)和焦虑(54.55%),而不合作、定向障碍和自知力障碍出现率较低,均为5.26%。从每项评分严重程度来看,平均分数较高的前3位分别为第13项动作迟缓(3.13±1.51)、第1项关心身体健康(2.62±1.61)和第2项焦虑(2.11±1.30),而第14项不合作、第17项兴奋和第19项自知力障碍评分较低(图1)。BPRS 5个分量表症状发生率从高到低依次为缺乏活力(84.69%)、焦虑抑郁(78.95%)、激活性(35.89%)、思维障碍(29.67%)、敌对猜疑(20.57%);评分严重程度从高到低依次为焦虑抑郁〔(8.15±4.71)分〕、缺乏活力〔(6.83±2.38)分〕、思维障碍〔(4.90±1.91)分〕、激活性〔(3.97±1.73)分〕和敌对猜疑〔(3.53±1.50)分〕。
2.2 各神经精神症状间相关性 BPRS 5个分量表两两之间均有明显相关性,其中思维障碍与敌对猜疑、缺乏活力与思维障碍、缺乏活力与敌对猜疑之间呈中度相关,相关系数分别为0.477、0.441、0.429(均P<0.01)。结果见表1。
2.3 神经精神症状与临床特征相关性研究BPRS总分与受教育时间、PDSS和MMSE呈负相关,与年龄、UPDRS Ⅲ、H-Y分期、HAMD、HAMA、PDQ-39呈正相关,而与病程和LED均无相关性。具体结果见表2。

表1 PD患者BPRS 5个分量表间Pearson相关性分析r值大小
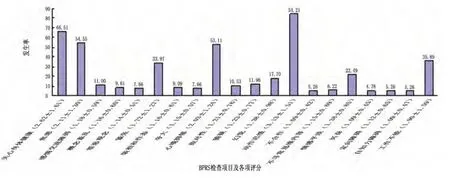
图1 209例PD患者BPRS 20个项目的发生率及评分
2.4 BPRS低分组和BPRS高分组临床特征比较将PD患者按BPRS总得分分为BPRS低分组(BPRS总分≤35)和BPRS高分组(BPRS总分>35)。高分组PD的年龄、起病年龄以及UPDRSⅢ、PDQ-39、HAMA和 HAMD评分均明显高于低分组,而MMSE评分明显低于低分组(均P<0.05);而两组在受教育时间、病程、H-Y 分期、PDSS评分和LED用量间比较无统计学差异(表3)。
2.5 神经精神症状的逐步多元线性回归 分别以BPRS总分和各分量表得分为因变量,各临床特征(包括年龄、受教育时间、病程、H-Y 分期、UPDRSⅢ、MMSE、PDSS、HAMA、HAMD、PDQ-39及 LED)为自变量。其中 MMSE 与BPRS总分呈负相关,HAMA与BPRS总分呈正相关。回归方程引入HAMA评分后,决定系数r2为0.196,表明HAMA可以预测BPRS总分的部分变化(19.6%);而当回归方程引入 MMSE评分后,r2值增至0.270,表明回归方程引入此变量可使BPRS总分中能够被预测的部分增至27%。就5个分量表评分而言,MMSE评分与缺乏活力、思维障碍、敌对猜疑密切相关;HAMA评分与焦虑抑郁、缺乏活力、思维障碍、激活性相关;H-Y分期与缺乏活力相关;年龄与思维障碍相关;LED与激活性相关。而病程、UPDRS Ⅲ、PDSS、PDQ-39、HAMD评分与BPRS总分和各分量表得分均无相关性。结果见表4。

表2 PD患者神经精神症状与临床特征Pearson相关性分析r值大小

表3 BPRS低分组PD与高分组PD患者临床特征比较

表4 PD患者神经精神症状的逐步多元线性回归分析
3 讨论
该研究结果显示,PD患者最常出现的精神症状排前3位的依次为动作迟缓、关心身体健康和焦虑,较低的症状为不合作、定向障碍和自知力障碍;按严重程度排名,排前3位依次为动作迟缓、关心身体健康和焦虑,程度最轻者为不合作、兴奋和自知力障碍。国外流行病学调查结果显示,PD患者中伴抑郁占40%~70%[3],焦虑占40%[4],幻觉占30%[5],淡漠占45%[6]。该组 209例 PD患者中,伴抑郁占53.11%,焦虑占54.55%,幻觉占17.70%,淡漠占22.49%。这与国外报道结果相近。2007年,美国国立神经病及中风研究所、国立精神卫生研究所(NINDS/NIMH)制定了临时的帕金森病精神障碍(PDPsy)的诊断标准[1],定义了错觉、错误的存在性感觉、幻觉、妄想4种症状为PD精神障碍。该研究发现,除上述4种精神症状外,PD患者还存在其他多种形式的神经精神症状,且发生率甚至高于上述4种。
多项研究发现,PD患者精神症状有聚发于同一患者的倾向,即一个患者可以出现多种精神症状,并相互影响,而且各项精神症状之间具有显著相关性[7]。本研究结果显示PD患者BPRS的5个分量表得分两两之间均有明显相关性,由此推测PD患者这些精神症状间可能有共同的神经生化基础。国外研究结果显示,精神症状的产生与5-羟色胺、去甲肾上腺素能系统功能失调有关,PD的黑质多巴胺能神经元减少会影响其投射到纹状体、额叶、扣带回的神经纤维功能,引起皮质-基底节-丘脑神经环路功能失调,同时去甲肾上腺素能神经元、5-羟色胺能神经元、胆碱能神经元也会出现不同程度的变性,从而导致运动功能、认知能力的下降以及精神症状的产生[8]。因此,神经变性可能是PD合并精神症状的主要原因。
本研究对PD患者神经精神症状与临床特征的相关性进行分析显示,患者的BPRS总分与受教育时间、MMSE和PDSS评分呈负相关,与UPDRSⅢ、H-Y分期、HAMD、HAMA及PDQ-39呈正相关,表明PD患者受教育时间越短、认知力越差、PD运动症状越重、抑郁及焦虑情绪障碍越重,其神经精神症状就越突出,而且直接影响其睡眠和生活质量。BPRS总分与病程和LED无相关性,表明其精神症状严重程度与病程长短及左旋多巴服用总量大小无关。目前研究结果显示PD精神症状的发生可能与病程[9]、运动障碍严重程度[10]、认知功能损害[11]、多巴胺受体激动剂[12]、抑郁[9-10]、睡眠障碍[11]和眼科疾病[10-11]有不同程度的相关性。上述研究所得出的影响PD精神症状的因素存在不一致,其原因可能与各研究对PD精神障碍的定义不同、调查方式、样本含量不同有关。
以BPRS总分35分为临床界限,将大于35分者定义为有精神疾病者。该组209例PD患者中,BPRS总分大于35分者共计45例,BPRS总分≤35者共164例,比较两组PD患者的临床特征,结果显示高分组PD的年龄、起病年龄以及UPDRSⅢ、PDQ-39、HAMA和 HAMD评分均明显高于低分组,而MMSE评分明显低于低分组,表明PD患者的年龄和起病年龄越大、运动症状越重、焦虑和抑郁程度越重、认知能力越差,出现的精神症状可能就会更严重;而两组在受教育时间、病程、H-Y分期、PDSS评分和LED用量间比较无统计学差异,提示精神症状的严重程度可能与受教育时间、PD病程、H-Y分期和服用左旋多巴药物总量无直接关系。
逐步多元线性回归分析结果显示,MMSE评分与缺乏活力、思维障碍、敌对猜疑密切相关;HAMA评分与焦虑抑郁、缺乏活力、思维障碍、激活性相关;H-Y分期与缺乏活力相关;年龄与思维障碍相关;LED与激活性相关;HAMA与BPRS总分呈正相关,MMSE与BPRS总分呈负相关,提示患者认知力越差、焦虑程度越重,BPRS总分就越高,PD神经精神症状越重。即可以根据患者认知水平、焦虑情况来预测PD患者神经精神症状发生的严重程度。可见,PD精神障碍的产生与多种因素有关。
综上所述,PD患者除存在幻觉、错觉、妄想外,还会出现如抑郁、淡漠、焦虑和不合作等其他精神症状,这些均为PD疾病的恶化因素,BPRS可以很好地评估PD的这些精神症状。但BPRS量表不包含对错觉和错误的存在性感觉症状的评定,对某些阴性症状的评价也可能会受到PD运动症状严重程度的影响[12]。迄今为止,国际上还未制定出一个可以准确描述PD相关的所有精神症状的量表,有关研究尚在探讨中。
[1]Ravina B,Marder K,Fernandez HH,et al.Diagnostic criteria for psychosis in Parkinson’s disease:report of an NINDS,NIMH work group[J].Mov Disord,2007,22(8):1061-1068.
[2]Minguez-Castellanos A,Escamilla-Sevilla F,Katati MJ,et al.Different patterns of medication change after subthalamic or pallidal stimulation for Parkinson’s disease:target related effect or selection bias?[J].J Neurol Neurosurg Psychiatry,2005,76(1):34-39.
[3]Lieberman A.Are dementia and depression in Parkinson’s disease related?[J].J Neurol Sci,2006,248(1-2):138-142.
[4]Richard IH.Anxiety disorders in Parkinson’s disease[J].Adv Neurol,2005,96:42-55.
[5]Diederich NJ,Goetz CG,Stebbins GT.Repeated visual hallucinations in Parkinson’s disease as disturbed external/internal perceptions:focused review and a new integrative model[J].Mov Disord,2005,20(2):130-140.
[6]Isella V,Melzi P,Grimaldi M,et al.Clinical,neuropsychological,and morphometric correlates of apathy in Parkinson’s disease[J].Mov Disord,2002,17(2):366-371.
[7]Shulman LM,Taback RL,Bean J,et a1.Comorbidity of the non-motor symptoms of Parkinson’s disease[J].Mov Disord,2001,16(3):507-510.
[8]Aarsland D, Karlsen K. Neuropsychiatric aspects of Parkinson’s disease[J].Curr Psychiatry Rep,1999,1(1):61-68.
[9]Fenelon G,Mahieux F,Huon R,et a1.Hallucinations in Parkinson’s disease:prevalence,phenomenology and risk factors[J].Brain,2000,123(Pt 4):733-745.
[10]Holroyd S,Currie L,Wooten GF.Prospective study of hallucinations and delusions in Parkinson’s disease[J].J Neurol Neurosurg Psychiatry,2001,70(6):734-738.
[11]de Maindreville AD,Fenelon G,Mahieux F.Hallucinations in Parkinson’s disease:a follow-up study[J].Mov Disord,2005,20(2):212-217.
[12]Bugalho P,da Silva JA,Cargaleiro I,et al.Psychiatric symptoms screening in the early stages of Parkinson’s disease[J].J Neurol,2012,259(1):124-131.
