人卵泡液抑制素B的分离与鉴定
2015-08-10杜江辛玲郭颖周芳于和鸣
杜江,辛玲,郭颖,周芳*,于和鸣*
(1.北京协和医学院研究生院,北京 100730;2.国家卫生计生委科学技术研究所,北京 100081)
据世界卫生组织报道,21世纪男性不育将会是危害人类健康的最严重疾病之一,男性不育因素占不孕不育的40%,且影响男性生育力的危险因素仍在增加[1]。抑制素B(INH-B)的检测在男性不育症的诊治中已逐渐得到广泛的应用[2]。研究表明,INH-B是一类糖蛋白激素,因可抑制卵泡刺激素(FSH)分泌而得名。男性体内INH 的重要生理活性形式为INH-B,其组装过程大部分在生精细胞内完成,然后释放到循环系统和精液中[3-4]。女性卵泡液中INH-B的含量为几十ng/ml至几百ng/ml,比血液及精液中的含量高约103倍[5-6]。而对于人卵泡液及精液中INH-B的相关研究屈指可数[7],并且对于其存在形式和理化性质并没有确切的研究结果。究其原因主要是由于卵泡液及精液中蛋白种类繁多,不容易从中纯化出INH-B,并且收集大量样品有一定的困难。本实验拟通过对女性卵泡液中INH-B的分离纯化方法及其在卵泡液中分子存在形式的研究,为进一步研究INH-B在临床诊断中的作用打下一定基础。
材料与方法
一、研究对象
1.卵泡液样本:取自北京市家圆医院正常女性卵泡液,共25例,均为育龄期女性成熟卵泡。所有样本均经家圆医院伦理委员会批准,征得志愿者和患者知情同意。
2.主要试剂:两性电解质(Sigma,美国),考马斯亮蓝R-250(Sigma,美国),牛血清白蛋白(BSA)(Sigma,美国),Inhibin B Gen II ELISA kit(Beckman,美国),聚乙二醇-20 000(PEG-20 000)(西胧化工),乙腈、丙酮、乙醇(北京试剂厂)。
3.主要仪器:聚丙酰胺凝胶电泳仪、电转仪、Rotofor System(BIO-RAD,美国),凝胶成像扫描分析仪(北京君意东方电泳设备),二乙基氨乙基(DEAE)阴离子交换柱(Pharmacia,美国),紫外分光光度计(Thermo Fisher,美国)。
二、研究方法
1.Bradford法测总蛋白质浓度:将标准BSA 配制成1mg/ml,分别取0、2、4、6、8、10、12、14 和16 μl加入到96孔酶标板中,每个浓度重复2次,并以去离子水补至终体积20μl,再加入280μl Bradford工作液,充分混匀,在570nm 紫外波长处测定OD值,利用Excel软件计算OD 平均值并绘制出标准曲线。当相关系数R2≥0.98时认为两者间存在线性关系。将待测样品1μl加入酶标板中,去离子水补至终体积20μl,加入280μl Bradford工作液,同一样品重复3次。测OD570nm 值,取3次平均值后根据标准曲线计算样品蛋白浓度。
2.去除卵泡液中的高丰度蛋白[8]:解冻-20℃保存的卵泡液,4℃12 000r/min 离心15min,分别取上清10 ml,分别与1.2 倍体积的乙腈、丙酮、乙醇混合,立即震荡混匀5 min,然后3 000r/min 离心15min,取上清,弃沉淀。将上清置于风扇下,挥发至体积10ml。再向各管中加入4倍体积的冷丙酮,-20℃静置1h,至蛋白沉淀完全,3 000r/min离心15 min,弃上清,留沉淀。室温放置至丙酮完全挥发,用2ml双蒸水(ddH2O)溶解沉淀。
3.聚丙烯酰胺凝胶电泳:取样品20μl,加入上样缓冲液,沸水浴5 min 使蛋白变性。电泳条件:60V恒压,样品至浓缩胶与分离胶界限,约30min,150V 恒压至溴芬兰到达凝胶底部,约1h。
4.凝胶染色和脱色:使用新配制的考马斯亮蓝R-250染色,室温1h。再用新配的脱色液脱色完全,用ddH2O 漂洗,并用ddH2O 浸泡保存。
5.DEAE-Sephadex A-50 柱 层 析 纯 化 方 法[9]:DEAE-Sephadex A-50经预处理、装柱、平衡、上样、洗脱后收集样品,再用紫外分光光度计分别测定每管OD280nm 值,并以OD280nm 为纵座标,以试管编号为横座标,绘制洗脱曲线。合并、浓缩:将洗脱峰的上坡段与下坡段各管收集液分别进行合并,以PEG-20000洗缩至适当体积,于4℃保存备用。
6.蛋白质等电点分离法(Rotofor System):取上述纯化的样品20ml,加入2ml两性电解质混匀,再补水稀释至50 ml,并全部注入Rotofor System样品槽中,加水补齐至样品槽中无气泡。恒功率12 W(电压为400~500V,电流20~30mA),启动后4.5h共收集20样品。
用pH 计分别测上述收集的20 管样品的pH值,酸性样品用0.1 mol/L pH 9.5的Tris-HCl调pH 至中性;碱性样品用稀释10倍的HCl调pH 至中性。
7.INH-B蛋白含量测定:按照Inhibin B Gen II ELISA kit的操作说明,完成测定。将待测样品与酶标孔表面的抗体起反应,用洗涤的方法使酶标孔上形成抗原抗体复合物并与样品中其他物质分开。再分别加入一抗和酶标记的二抗,通过抗原抗体反应结合在酶标孔上。加入酶反应底物后,生成有色产物,用酶标仪测450nm 吸光值。
8.蛋白样品的透析:将需要透析的样品装入截流分子量为14 000的透析袋中,袋两端用封口夹封闭后浸没于透析液(ddH2O 或上样缓冲液)中,磁力搅拌,每0.5h更换1次透析液,重复3次。
9.蛋白样品的浓缩:将透析处理后的样品连同透析袋包埋于PEG-20000中,浓缩样品至所需体积后回收样品。
结 果
一、Bradford法绘制BSA 标准曲线
根据标准的OD570值绘制出BSA 标准曲线,求得R2=0.985,公式为y=0.0772x+0.8493。BSA标 准 品 的OD570值 分 别 为:0.849、1.103、1.158、1.313、1.497、1.621、1.776、1.830μg/μl。
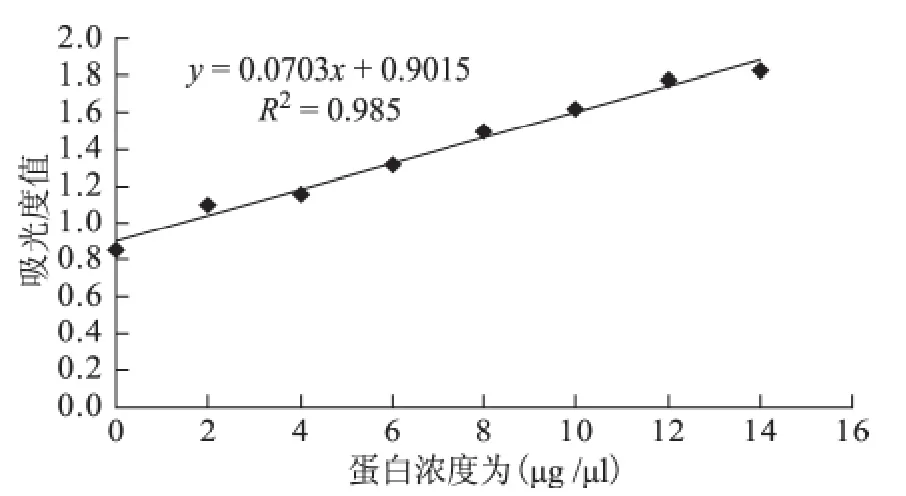
图1 Bradford法绘制BSA 标准曲线
二、3 种去除卵泡液中的高丰度蛋白方法的比较
按标准蛋白曲线回归方程计算出原样品的蛋白总量为37mg,经3种方法处理后样品的蛋白总量分别为22.5mg、17.1mg、32.8mg。结果表明,样品经丙酮、乙醇、乙腈处理后分别可清除60.9%、46.3%、88.7%的高丰度蛋白,即乙腈法处理卵泡原液去除高丰度蛋白是最优的方法。(图2)。
三、DEAE-Sephadex A-50柱层析纯化蛋白结果
DEAE-Sephadex A-50柱层析纯化蛋白共收集39管蛋白,从洗脱曲线可看出,洗脱峰出现在第14管和第15管(图3)。
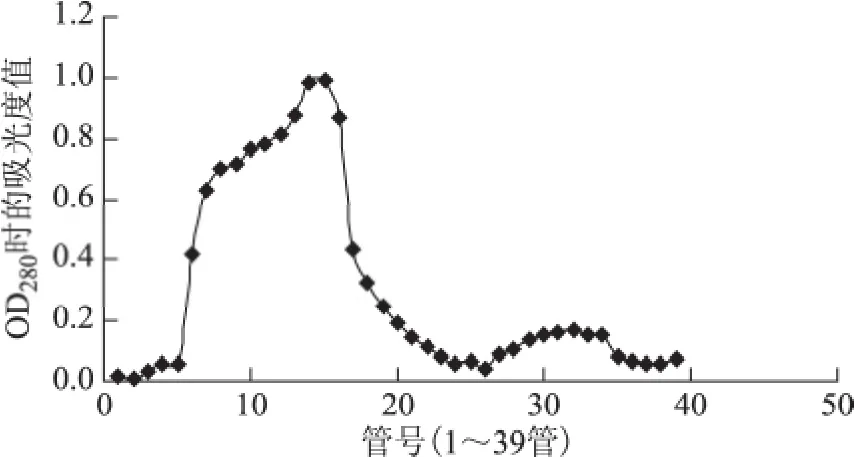
图3 DEAE-Sephadex A-50柱层析纯化蛋白洗脱曲线
四、Rotofor System 蛋 白 分 离 及 等 电 点 鉴 定结果
对Rotofor System 所收集的20管样品处理后用Inhibin B Gen II ELISA kit检测每管中INH-B的浓度,其中第3 和第4 管INH-B 的浓度分别为590pg/ml和750pg/ml,蛋白质等电点(isoelectric point,pI)分离法测得第3和第4管pI值分别为4.5和4.6。由此可推断出卵泡液中INH-B 的pI在4.55左右(表1)。
五、目的蛋白INH-B的回收率
采用Inhibn B Gen II ELISA kit试剂盒绘制INH-B浓度测定标准曲线,INH-B标准品的浓度分别为0、10、30、100、250、500、1 000pg/ml,其对应OD450值 依 次 为0、0.051、0.142、0.503、1.192、2.085、3.179。其 中R2=0.9718,公 式 为y=298.95x-35.445(图4)。
以100 ml原始卵泡液为初始样品,样品中总INH-B的含量为17.3μg。经乙腈、DEAE-Sephadex A-50柱层析、Rotofor System 蛋白分离3次处理,依次编号为1、2、3,各步样品中INH-B 的含量分别为10.7、8.9、6.7μg,经过3次纯化后回收率为38.70%(表2)。
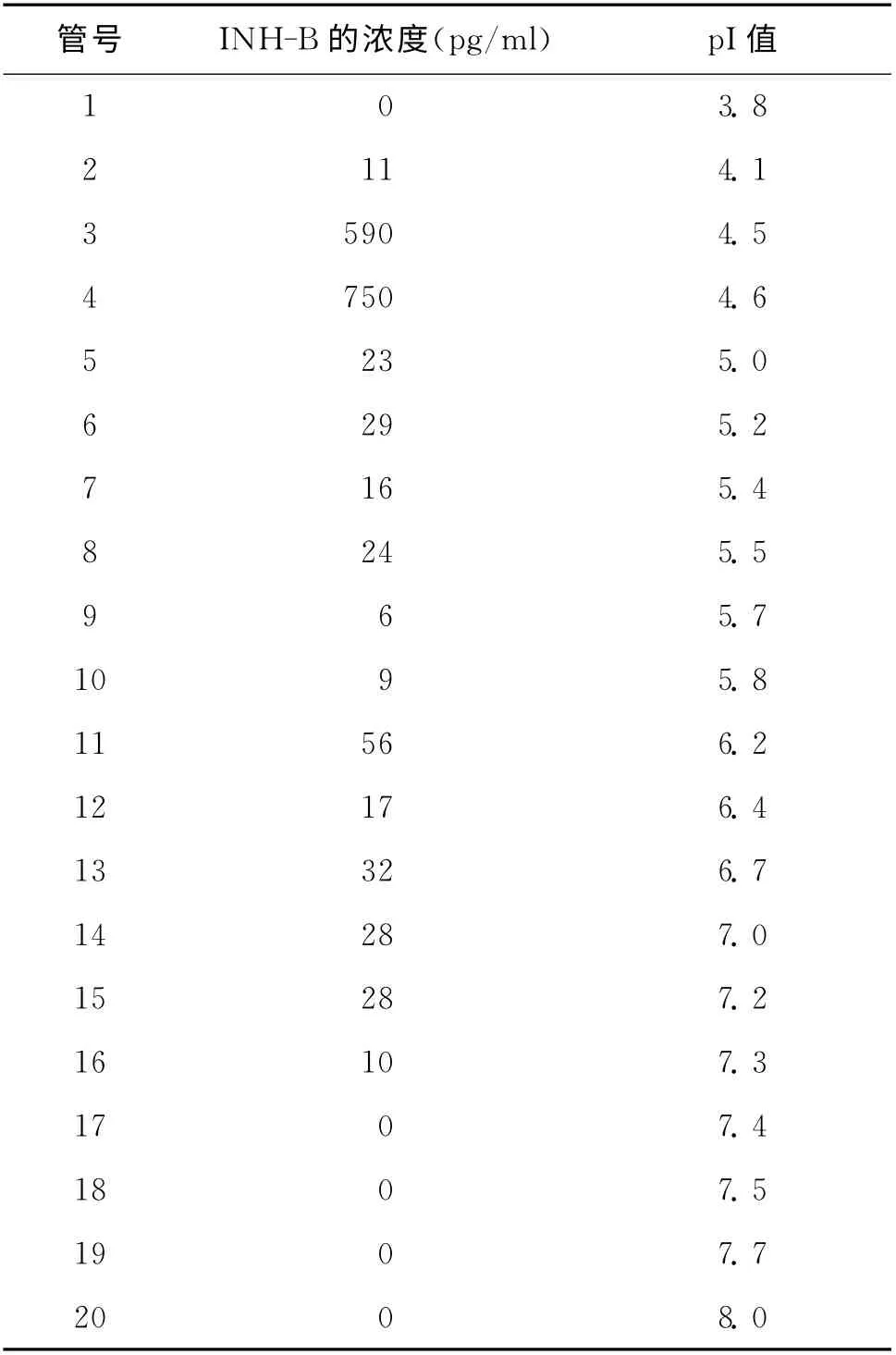
表1 测量20管样品INH-B的浓度和pI值
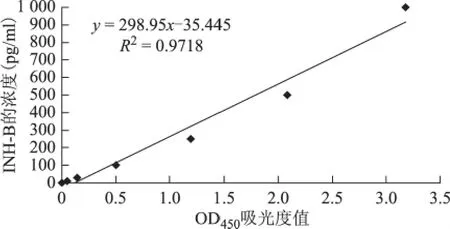
图4 INH-B浓度测定标准曲线

表2 目的蛋白INH-B的回收率
讨 论
女性体内INH-B由卵巢中、小窦卵泡颗粒细胞产生,具有反馈性抑制垂体FSH 分泌和调节生殖细胞发育的重要功能,可直接反映卵巢储备功能。INH-B的监测在女性生殖及辅助生殖技术中的应用有重要意义[10]。
男性体内INH-B 是直接由睾丸分泌的二聚体糖蛋白激素,对多种外源性激素起反应。血清INH-B水平受年龄、睾丸体积、青春期发生时间、标本采集时间、不同人群等多种因素影响。INH-B 能直接反映睾丸的精子发生,可作为临床评价男性生育力的重要指标[11-12]。睾丸穿刺活检是诊断无精子症的“金标准”,但血液中INH-B水平检测作为部分替代和补充,可作为睾丸生精障碍的间接诊断依据,但这一依据的准确性依然存在争议[13-14]。因此,随着生殖医学的发展,直接以精液为研究、检测材料的方法引起人们的兴趣。
现有的文献中,最新的对于血液中INH-B 存在形式的研究已经很完整[15],而对于男性精液和女性卵泡液中INH-B的存在形式及其理化特性的相关研究基本上是空白。由于受到材料的限制,以往对于INH-B纯化方法的研究,多取材于动物,如猪卵泡液[9]等。本实验则使用人卵泡液为实验材料,利用INH-B 本身的生化性质,通过乙腈富集、阴离子交换柱分离、等电点分离的“三步分离法”,初步纯化获得人体卵泡液中天然INH-B蛋白分子粗制品,纯化回收率达38.70%,并准确鉴定出其在人体中的等电点为4.55左右,为近一步研究人体INH-B的功能和结构特征打下基础,可能为临床诊断产品的开发提供了新的思路和理论依据。
[1] Povey AC,Stocks SJ.Epidemiology and trends in male subfertility[J].Hum Fertil(Camb),2010,13:182-188.
[2] Vänttinen T,Liu J,Hydén-Granskog C,et al.Regulation of immunoreactive inhibin A and B secretion in cultured human granulosa-luteal cells by gonadotropins,activin A and insulinlike growth factor type-1receptor[J].J Endocrinol,2000,167:289-294.
[3] Anderson RA,Irvine DS,Balfour C,et al.Inhibin B in seminal plasma:testicular origin and relationship to spermatogenesis[J].Hum Reprod,1998,13:920-926.
[4] 李培强.血清和精浆抑制素B在无精子症诊断中的应用研究[J].中华男科学杂志,2007,13:598-600
[5] Kaya A,Atabekoglu CS,Kohraman K,et al.Follicular fluid concentrations of IGF-I,IGF-II,IGFBP-3,VEGF,AMH,and inhibin-B in women undergoing controlled ovarian hyperstimulation using GnRH agonist or GnRH antagonist[J].Eur J Obstet Gynecol Biol,2012,164:167-171.
[6] Ludlow H,Muttukrishna S,Hyvönen M,et al.Development of a new antibody to the human inhibin/activin betaB subunit and its application to improved inhibin B ELISAs[J].J Immunol Methods,2008,329:102-111.
[7] 龚守良,刘树铮.抑制素(Inhibin)的研究.I.人精液抑制素的制备及其生物学特性[J].吉林大学学报(医学版),1986,12:279-283.
[8] 胡蝶飞,李国坚,吴继周,等.去除血清中高、中丰度蛋白方法的优化[J].广西医科大学学报,2011,28:250-252.
[9] Sugino K,Nakamura T,Takio K,et al.Purification and characterization of high molecular weight forms of inhibin from bovine follicular fluid[J].Endorinology,1992,130:789-796.
[10] 李蕾,章晓梅.抑制素B在女性生殖与辅助生殖技术中的意义[J].中国现代医生,2010,48:45-46.
[11] Anawalt BD,Bebb RA,Matsumoto AM,et al.Serum inhibin B levels reflect Sertoli cell function in normal men and men with testicular dysfunction[J].J Clin Endocrinol Metab,1996,81:3341-3345.
[12] Medraš M,Trzmiel A,Grabowski M,et al.Inhibin B--a marker of the function of male gonad[J].Ginekol Pol,2005,76:484-490.
[13] Huang X,Bai Q,Yan LY,et al.Combination of serum inhibin B and follicle-stimulating hormone levels can not improve the diagnostic accuracy on testicular sperm extraction outcomes in Chinese non-obstructive azoospermic men[J].Chin Med J(Engl),2012,125:2885-2889.
[14] Toulis KA,Iliadou PK,Venetis CA,et al.Inhibin B and anti-Müllerian hormone as markers of persistent spermatogenesis in men with non-obstructive azoospermia:a meta-analysis of diagnostic accuracy studies[J].Hum Reprod Update,2010,16:713-724.
[15] Walton KL,Chan KL,Pruysers E,et al.Use of detergentbased buffers allows detection of precursor inhibin forms in an immunoassay format[J].Mol Cell Endocrinol,2013,381:106-114.
