γ-氨基丁酸及其A 型受体α5亚单位在小鼠不同成熟度卵母细胞周围的卵丘颗粒细胞中的表达
2015-08-10戴皇冠郝翠芳黄鑫刘振腾连花瑜刘畅
戴皇冠,郝翠芳,黄鑫,刘振腾,连花瑜,刘畅
(1.山东青岛大学,青岛 266071;2.山东省烟台市毓璜顶医院生殖医学科,烟台 264000;3.山东大学,济南 250000)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种天然存在的功能性氨基酸,是谷氨酸在谷氨酸脱羧酶的作用下脱羧而成,是哺乳动物中枢神经系统中主要的抑制性神经递质。GABA 主要通过与其受体结合发挥生物学效应。GABA 受体根据其不同的药理学特征区分为GABAA、GABAB、GABAC三种亚型,其中GABAA受体及GABAC受体属配体门控型离子通道,目前所识别出的组成GABAA受体亚基种类有7 个亚基族16 种单体(α1-6、β1-3、γ1-3、δ、ε、θ、π)[1]。GABAB受体为G 蛋白偶联受体。GABAA受体及GABAB受体广泛分布于中枢神经系统,GABAC受体主要存在于视网膜和视觉通路中。有研究发现,GABA 及其A 型受体也广泛存在于外周神经组织及非神经组织中,如:脑垂体、胰腺、肾上腺、睾丸、卵巢、子宫和胎盘等[2]。有关GABA及其A 型受体在生殖系统中的作用,已有研究表明GABA 信号在女性生殖过程中发挥着特异性作用,既参与调节卵泡发育过程中雌孕激素的分泌,也参与卵泡发育和成熟。早期研究发现,大鼠发情周期不同阶段的生殖器官中存在GABA[3-4]。ErdÖ等[5]将[3H]muscimol(蝇 覃 醇,GABAA受 体 激 动剂)作为放射性配体,发现在大鼠卵巢上存在GABAA结合位点,尤其是在颗粒细胞上富含高亲和力的、特异的GABAA结合位点。人的卵巢上也存在GABA 及A 型受体结合位点[5]。
上述研究提示,GABA 及其A 型受体可能与生殖内分泌之间有着密切联系。近年来,通过基因微阵列技术研究人卵丘颗粒细胞,发现其A 型受体α5亚单位的基因表达水平与卵母细胞核成熟有关[6-7]。本文研究了GABA 及其A 型受体α5亚单位在小鼠卵巢卵丘颗粒细胞中的表达情况,旨在探讨其与卵泡发育及卵母细胞成熟的相关性,以期为研究卵母细胞成熟和卵泡发育的分子生物学机制提供新的认识。
材料与方法
一、实验材料
孕马血清促性腺激素(PMSG,Prospec-tany,以色列);人绒毛膜促性腺激素(HCG,丽珠制药);RNA 提取采用Qiagen Rneasy Mini Kit(Qiagen,Hilden,德国);实时荧光定量聚合酶链反应试剂盒(TaKaRa,日本);兔源性抗GABRA5 多克隆抗体(Abcam,英国);荧光(IgG-Cy3)标记二抗和兔源性抗GABA 多克隆抗体(武汉博士德公司);辣根酶标记山羊抗兔IgG、SP免疫组化试剂盒及二氨基联苯胺(DAB)显色试剂盒(北京中杉金桥生物技术公司);Western blotting相关试剂(碧云天公司)。
二、研究方法
1.卵丘颗粒细胞提取:(1)生发泡期(GV)卵丘颗粒细胞的收集:将20~21 日龄,体质量约13~15g的性成熟前雌性昆明小鼠饲养于光照(6:00~18:00)及温度(25 ℃)条件下,动物正常进食及自由饮水。小鼠经腹腔注射PMSG(10 U/只),48h后断颈处死小鼠,无菌操作下取出小鼠双侧卵巢,在解剖显微镜下,去除周围脂肪组织,培养液洗净卵巢上血污,置于培养液中,用无菌4号半针头针刺卵巢让其释放出GV 期卵泡,然后用吸管反复机械吹打卵泡,使卵丘颗粒细胞与卵母细胞分离,收集GV 期卵母细胞周围的卵丘颗粒细胞,1 000r/min 离心5min,弃上清,备用。在培养液中加入200μmol/L的异丁基甲基黄嘌岭(IBMX,Cayman,美国)防止GV 期卵泡自发成熟。
2.MⅡ卵丘颗粒细胞的收集:小鼠经腹腔注射PMSG(10U/只),48h后注射HCG(10U/只),注射HCG 后12~13h挑破输卵管膨大的壶腹部,将释出的MⅡ期卵泡移入含有0.1%的透明质酸酶的培养液中,室温放置10 min,用吸管反复机械吹打卵泡使卵母细胞和卵丘颗粒细胞充分分离,收集卵丘颗粒细胞,1 000r/min离心5min,弃上清,备用。
3.实时荧光定量聚合酶链反应(qRT-PCR)检测:(1)RNA 提取和逆转录反应:分别将收集的300个GV 期及MⅡ期卵母细胞周围的卵丘颗粒细胞置于含裂解液的离心管中,总RNA 抽提方法按照Rneasy Mini Kit(Qiagen,德国)说明书描述进行。逆 转 录 反 应 参 照PrimeScriptTMRT reagent Kit(TaKaRa,日本)操作说明书进行,对照实验用DEPC水取代逆转录酶,以排除DNA 污染。(2)根据Genebank 进行引物设计和合成(表1)。(3)qRT-PCR:依照SYBR Premix Ex Taq 实时荧光定量试剂盒(TaKaRa,日本)说明书进行,使用Rotor Gene 3000型实时荧光定量聚合酶反应仪(Corbett Research,澳大利亚)测定。循环参数:95 ℃30s,95 ℃5s45个循环,60 ℃60s。每次反应结束均进行熔解曲线分析,并计算GABRA5与β-actin的相对关系。运算分析最终所得2-ΔΔCT值[8]。
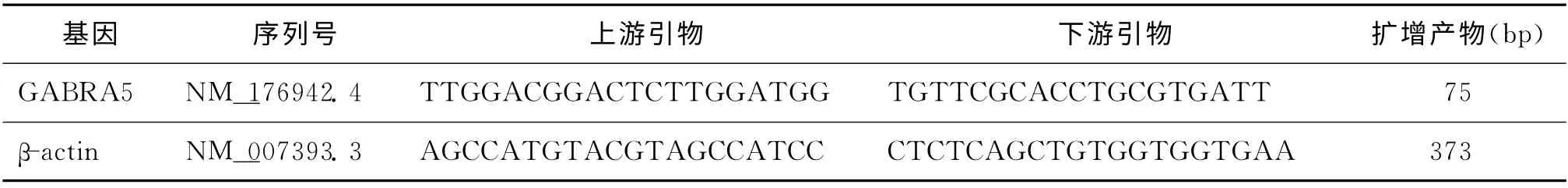
表1 qRT-PCR引物序列
4.Western blotting检测:实验简述如下:用蛋白裂解液裂解收集的300个GV 期和MⅡ期卵母细胞周围的卵丘颗粒细胞,冰上静置30min后在4 ℃下离心5 min。用BCA 法测蛋白浓度。每孔上样100μg,进行SDS-PAGE 电泳,转膜,7%TBST 脱脂奶粉室温封闭2h,一抗(兔源性抗GABRA5多克隆抗体)4 ℃孵育过夜,加入羊抗兔二抗,室温孵育1h,化学发光液显色。以GAPDH 为内参,采用Bio-Rad图像分析仪(伯乐,美国)分析。
5.免疫组织荧光检测:获取GV 期卵巢和MⅡ期输卵管组织,4%多聚甲醛4℃固定过夜,常规石蜡包埋,切成4μm 切片。按组织免疫荧光常规步骤操作。一抗1∶100稀释,阴性对照采用正常兔血清IgG 代替一抗。激光共聚焦显微镜扫描成像。
6.免疫组织化学检测:免疫组化方法简述如下,石蜡切片常规脱水,柠檬酸缓冲液微波抗原修复,H2O2去离子水孵育,山羊血清室温封闭,加入兔源性抗GABA 多克隆抗体(1∶100),4℃孵育过夜,滴加辣根过氧化物酶标记的羊抗兔二抗室温孵育。DAB显色,充分冲洗后苏木素复染、酒精逆浓度脱水、二甲苯透明、干燥后中性树胶封片,光学显微镜下观察。结果判定:细胞质内含棕黄色颗粒者为阳性细胞,用PBS代替一抗作为阴性对照,其余步骤与上述相同。
三、统计学处理
采用SPSS 17.0软件进行统计分析,计量资料采用Student’s t-检验。P<0.05为差异有统计学意义。
结 果
一、qRT-PCR 检测GABRA5mRNA 在GV 期和MⅡ期卵丘颗粒细胞中表达
GV 期和MⅡ期卵母细胞周围的卵丘颗粒细胞中均有GABRA5 mRNA 的表达,相对于GV 期的表达水平,GABRA5 mRNA 在MⅡ期卵母细胞周围卵丘颗粒细胞的表达是上调的,GV 组∶MⅡ组为(1.00±0.00)vs.(2.32±0.30),即MⅡ期表达量约是GV 期的2.32倍,有统计学差异(P<0.05)(图1)。
二、Western blotting 检 测GABRA5 蛋 白 在GV 期和MⅡ期卵丘颗粒细胞中表达
GABRA5蛋白在GV 期和MⅡ期卵母细胞周围的卵丘颗粒细胞中均有表达,其表达量随卵母细胞成熟而呈上升趋势,差异有统计学意义(P <0.05)(图2、3)。
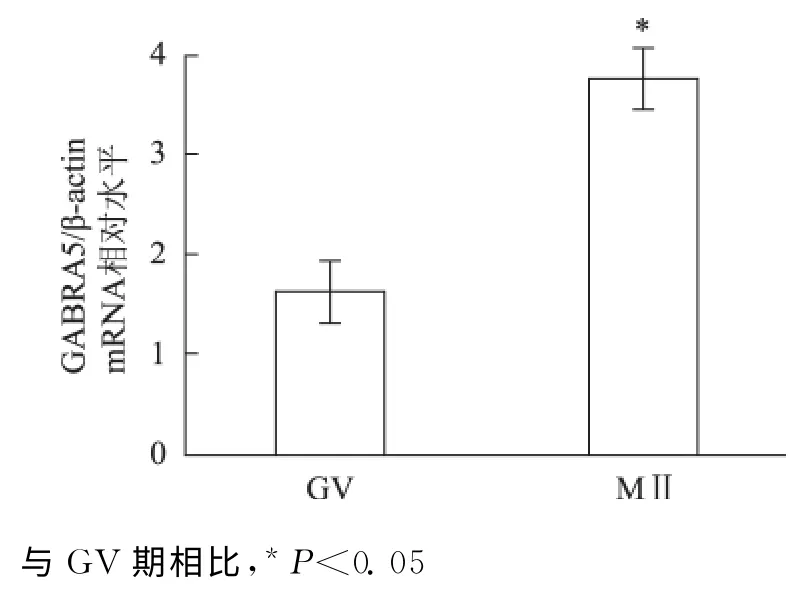
图1 GABRA5mRNA 在GV 期和MⅡ期卵丘颗粒细胞中的表达

图2 Western blotting检测GV 期和MⅡ期卵丘颗粒细胞中GABRA5蛋白的表达
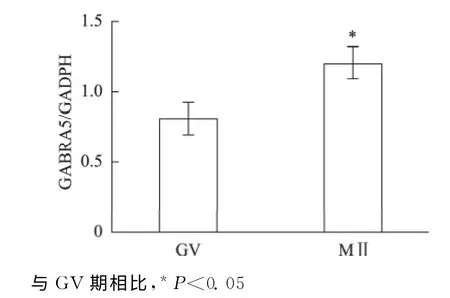
图3 GV 期和MⅡ期卵丘颗粒细胞中GABRA5蛋白相对表达量的比较
三、组织免疫荧光技术检测GABRA5 蛋白在GV 期和MⅡ期卵丘颗粒细胞中表达
激光共聚焦结果显示,GABRA5 蛋白表达于GV 期和MⅡ期卵母细胞周围卵丘颗粒细胞的细胞膜、细胞质,激发出红色荧光,蓝色为PI染核;阴性对照未见阳性表达(图4)。
四、免疫组织化学定性检测GABA 在GV 期和MⅡ期卵丘颗粒细胞中表达
免疫组化显示,GABA 均定位于GV 期和MⅡ期卵母细胞周围卵丘颗粒细胞的胞质中(图5)。
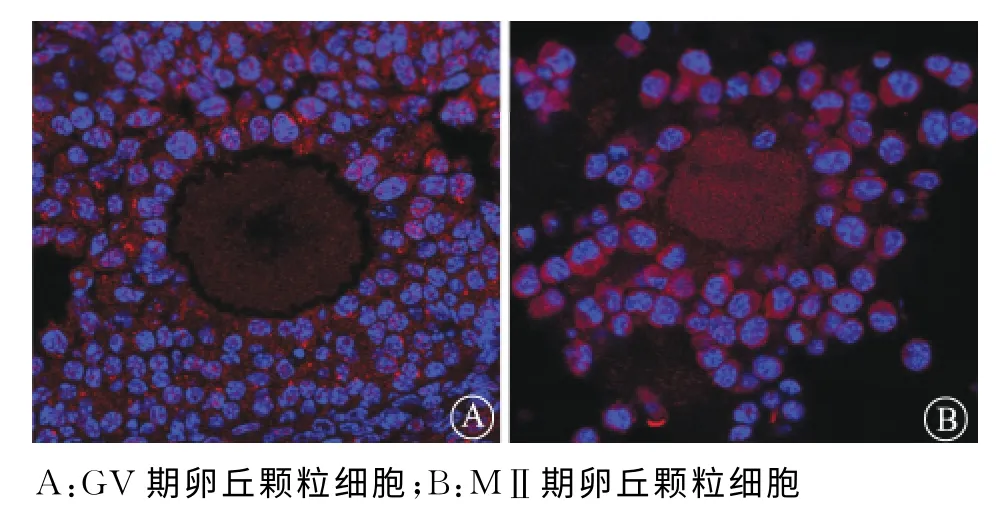
图4 GABRA5在GV 期和MⅡ期卵丘颗粒细胞中表达情况。免疫荧光染色法×400
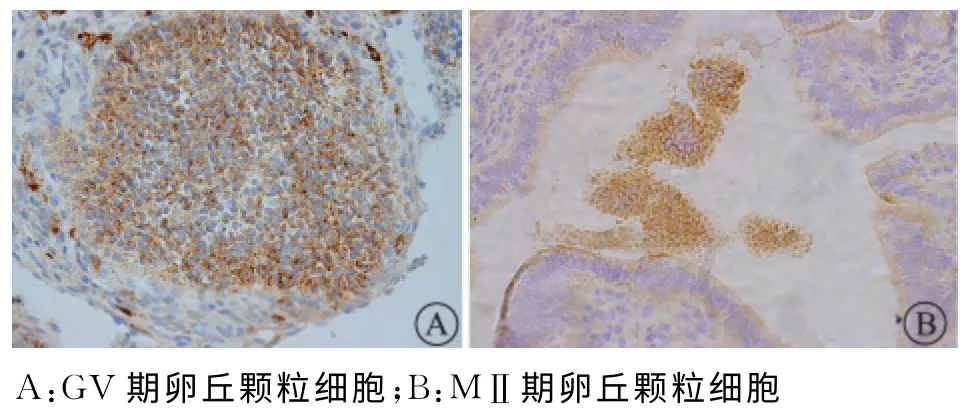
图5 GABA 在GV 期和MⅡ期卵丘颗粒细胞中表达情况。免疫组化染色法×400
讨 论
卵母细胞和卵丘颗粒细胞之间存在双向交流。卵母细胞在卵丘颗粒细胞的分化和发育过程中起着重要的调节作用,同时卵丘颗粒细胞在卵母细胞发育和成熟过程中起着重要的营养作用及信号传导作用,因而卵丘颗粒细胞的基因表达和功能状态在一定程度上可以反映卵母细胞的发育能力[9-10]。研究卵母细胞周围的卵丘颗粒细胞基因表达改变,为分析卵母细胞的质量提供有价值的信息,也可用于评估卵母细胞发育的状态和微环境[11]。
本研究对性成熟前小鼠给予外源性激素人工诱导卵泡发育及卵母细胞成熟,利用qRT-PCR 检测GV 期和MⅡ期卵母细胞周围的卵丘颗粒细胞中GABRA5 mRNA 的表达情况,发现GABRA5 mRNA表达水平存在上调趋势,其与卵母细胞成熟度呈正相关,表明卵母细胞成熟与GABRA5 基因的表达量升高有关。但Devjak等[7]通过基因微阵列技术研究人卵丘颗粒细胞,发现GABRA5 基因在卵丘颗粒细胞中的表达量与卵母细胞成熟度呈负相关,即其在MⅠ期卵母细胞周围的卵丘颗粒细胞的表达量高于其在MⅡ期卵母细胞时卵丘颗粒细胞 中 表 达 量。另 外,Huang 等[6]对GABRA5 基 因在多囊卵巢综合征患者卵母细胞成熟过程中的表达进行了研究,GABRA5基因在GV 期和MⅠ期卵母细胞时卵丘颗粒细胞的表达水平高于其在MⅡ期卵母细胞周围卵丘颗粒细胞中的表达水平,即在人卵母细胞成熟过程中表达量逐渐减少。两位学者的研究结果表明人卵母细胞成熟与GABRA5基因的表达量下降有关。本实验结果与上述研究结论不一致,推测其原因,可能是研究对象的种属差异所致。
根据Western blotting和组织免疫荧光研究结果显示,GABRA5蛋白在GV 期和MⅡ期卵母细胞周围卵丘颗粒细胞上均存在表达,且受体表达量随卵母细胞成熟而增高,进一步推测GABRA5 可能在卵泡发育成熟过程中发挥调控作用。Amenta等[12]利用组 织 放 射 自 显 影 技 术,将[3H]muscimol作为放射性配体,发现在猪的卵泡上A 型受体有可逆、可饱和、高亲和力的特性,并且A 型受体在卵泡发育过程中是逐渐减少的。由于A 型受体亚基较多,并且A 型受体各亚基之间可有不同的组合方式,但不是所有的亚基都能彼此间有效地组装成功能性受体[13]。到目前为止,A 型受体参与卵泡发育和卵母细胞成熟方面的分子机制仍然不清,所以尚需进一步的研究和证实。
本实验利用免疫组织化学技术检测GABA 在小鼠卵巢卵丘颗粒细胞上的表达情况,显示GABA在GV 期和MⅡ期卵母细胞周围卵丘颗粒细胞的胞质中均存在表达。Louzan等[3]也发现在鼠发情周期的不同阶段中,卵巢中可检测到GABA 的存在。此外,Batta[14]观察到外源性的GABA 能增加大鼠排卵释放的卵母细胞数目,并能影响这些释放的卵母细胞的质量。同时,有学者通过电生理技术研究人和小鼠的卵母细胞胞膜,发现GABA 能增加GV 和MⅡ卵母细胞胞膜的传导性和敏感性,且Bicuculline(GABAA受体拮抗剂)能降低胞膜对GABA 的 反应性[15]。刘 晓 艳 等[16]用 放 射 免 疫 测 定方法证实了人卵泡液中存在GABA,并且成熟卵泡液中的浓度高于未成熟卵泡液中的浓度。这些研究结果进一步提示GABA 有可能通过与其受体结合参与卵泡发育和成熟的过程。
此外,GABA 及其受体也在精子顶体反应和获能中起着重要调节作用[17]。体内多种递质如GABA、孕酮、透明带(ZP)作用于GABA 受体产生生理效应。而目前关于GABA 及其受体报道较多的是在肿瘤发生发展方面的研究,如乳腺癌[18],前列腺 癌[19]等。Sengupta等[20]报 道GABRA5 参 与神经系统肿瘤的发生,认为GABRA5 通过诱导细胞周期S期和G2期细胞凋亡而参与神经系统肿瘤的发生发展过程。但关于GABA 信号参与卵泡发育和成熟的分子机制及信号通路的报道甚少,其潜在价值仍待进一步研究。
总之,GABA 及其受体在生殖活动和生殖疾病中的影响正日益受到重视。GABA 及其受体在中枢神经系统和生殖内分泌系统发挥重要作用,推测GABA 也可能通过与其A 型受体结合参与小鼠卵泡发育和卵母细胞成熟过程。希望通过本实验,为研究神经递质及相关受体在生殖内分泌系统中的作用提供新的数据。
[1] Maemura K,Shiraishi N,Sakagami K,et al.Proliferative effects of gamma-aminobutyric acid on the gastric cancer cell line are associated with extracellular signal-regulated kinase 1/2 activation[J].J Gastroenterol Hepatol,2009,24:688-696.
[2] Watanabe M,Maemura K,Kanbara K,et al.GABA and GABA receptors in the central nervous system and other organs[J].Int Rev Cytol,2002,213:1-47.
[3] Louzan P, Gallardo MG, Tramezzani JH . Gammaaminobutyric acid in the genital tract of the rat during the oestrous cycle[J].J Reprod Fertil,1986,77:499-504.
[4] Schaeffer JM, Hsueh AJ.Identification of gammaaminobutyric acid and its binding sites in the rat ovary[J].Life Sci,1982,30:1599-1604.
[5] ErdöSL,László A.High specific gamma-aminobutyric acid binding to membranes of the human ovary[J].J Neurochem,1984,42:1464-1467.
[6] Huang X,Hao C,Shen X,et al.Differences in the transcriptional profiles of human cumulus cells isolated from MI and MII oocytes of patients with polycystic ovary syndrome[J].Reproduction,2013,145:597-608.
[7] Devjak R,Fon Tacer K,Juvan P,et al.Cumulus cells gene expression profiling in terms of oocyte maturity in controlled ovarian hyperstimulation using GnRH agonist or GnRH antagonist[J/OL].PloS One,2012,7:e47106.
[8] Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nat Protoc,2008,3:1101-1108.
[9] 钱易,孟艳,崔毓桂,等.卵丘细胞在卵母细胞发育过程中的作用[J].生殖医学杂志,2013,05:375-378.
[10] Huang Z,Wells D.The human oocyte and cumulus cells relationship:new insights from the cumulus cell transcriptome[J].Mol Hum Reprod,2010,16:715-725.
[11] Feuerstein P,Puard V,Chevalier C,et al.Genomic assessment of human cumulus cell marker genes as predictors of oocyte developmental competence:impact of various experimental factors[J/OL].PLoS One,2012,7:e40449.
[12] Amenta F,Erdo S L,Mione MC,et al.3H-muscimol binding sites within guinea pig ovary:a histoautoradiographic study[J].Pharmacology,1986,32:202-207.
[13] Feng H,Jounaidi Y,Haburcak M,et al.Etomidate produces similar allosteric modulation inα1β3δandα1β3γ2L GABA[J].Br J Pharmacol,2014,171:789-798.
[14] Batta SK.Effect of histamine,phencyclidine,phenoxybenzamine and gamma-aminobutyric acid on ovulation and quality of ova in rats[J].Reproduccion,1980,4:99-107.
[15] Dolci S,Eusebi F,Siracusa G.Gamma-aminobutyric-N-acid sensitivity of mouse and human oocytes[J].Dev Biol,1985,109:242-246.
[16] 刘晓艳.卵泡发育过程中γ-氨基丁酸作用的初步探讨[D].广州:南方医科大学妇产科学(生殖医学),2008.
[17] Kon H,Takei GL,Fujinoki M,et al.Suppression of progesterone-enhanced hyperactivation in hamster spermatozoa by gamma-aminobutyric acid[J].J Reprod Dev,2014,60:202-209.
[18] Zhang D,Li X,Yao Z,et al.GABAergic signaling facilitates breast cancer metastasis by promoting ERK1/2-dependent phosphorylation[J].Cancer Letters,2014,348:100-108.
[19] Wu W,Yang Q,Fung KM,et al.Linkingγ-aminobutyric acid A receptor to epidermal growth factor receptor pathways activation in human prostate cancer[J].Mol Cell Endocrinol,2014,383:69-79.
[20] Sengupta S,Weeraratne SD,Sun H,et al.α5-GABAA receptors negatively regulate MYC-amplified medulloblastoma growth[J].Acta Neuropathol,2014,127:593-603.
